Se presenta nuestra experiencia en neuritis óptica (ON) y se elabora un protocolo diagnóstico-terapéutico, que contempla descartar otras causas, principalmente infecciosas y se elabora una hoja informativa para padres.
Material y métodoEstudio descriptivo retrospectivo de los pacientes con ON en 27 años (1990-2017). Revisión de evidencia científica para elaboración del protocolo y hoja informativa.
ResultadosEn nuestra sección de neuropediatría se valoraron 20.744 niños en 27 años, 14 con ON: 8 ON aisladas, una esclerosis múltiple (EM), un episodio clínicamente aislado (CIS), 3 encefalomielitis agudas diseminadas y un paciente con ON aislada que el año anterior había sufrido una encefalomielitis aguda diseminada. Edades entre 4-13 años, 50% varones. Mayores de 10 años, 8 pacientes: 7 ON aisladas y un EM. Bilaterales 9, retrobulbares 3. Resonancia magnética cerebral normal en 7, solo afectación del nervio óptico en 2 y con desmielinización del SNC en 5 casos. Recibieron corticoterapia 13/14. Un caso vacunado de meningococo-C el mes anterior. Todos evolucionaron favorablemente, salvo la EM. Se presentan el protocolo y la hoja de información.
ConclusionesHabitual curso favorable. En niños a partir de 10 años, con factores de riesgo de desarrollar EM o neuromielitis óptica (presencia de hiperseñales en RM cerebral, bandas oligoclonales, anti-NMO, recurrencia de ON), se consensúa con Neurología el inicio de tratamiento inmunomodulador. Utilidad del protocolo para la toma de decisiones diagnósticas, de seguimiento y tratamiento, de una patología poco frecuente pero con posibles repercusiones importantes. Importancia de la protocolización y hojas informativas.
In this article, we present our experience on optic neuritis (ON) and provide a diagnostic/therapeutic protocol, intended to rule out other aetiologies (particularly infection), and a fact sheet for parents.
Material and methodsWe conducted a descriptive, retrospective study of patients with ON over a 27-year period (1990-2017). A review of the available scientific evidence was performed in order to draft the protocol and fact sheet.
ResultsOur neuropaediatrics department has assessed 20,744 patients in the last 27 years, of whom 14 were diagnosed with ON: 8 had isolated ON, 1 had multiple sclerosis (MS), 1 had clinically isolated syndrome (CIS), 3 had acute disseminated encephalomyelitis, and 1 had isolated ON and a history of acute disseminated encephalomyelitis one year previously. Patients’ age range was 4-13 years; 50% were boys. Eight patients were aged over 10: 7 had isolated ON and 1 had MS. Nine patients had bilateral ON, and 3 had retrobulbar ON. MRI results were normal in 7 patients and showed involvement of the optic nerve only in 2 patients and optic nerve involvement + central nervous system demyelination in 5. Thirteen patients received corticosteroids. One patient had been vaccinated against meningococcus-C the previous month. Progression was favourable, except in the patient with MS. A management protocol and fact sheet are provided.
ConclusionsON usually has a favourable clinical course. In children aged older than 10 years with risk factors for MS or optic neuromyelitis (hyperintensity on brain MRI, oligoclonal bands, anti-NMO antibody positivity, ON recurrence), the initiation of immunomodulatory treatment should be agreed with the neurology department. The protocol is useful for diagnostic decision-making, follow-up, and treatment of this rare disease with potentially major repercussions. The use of protocols and fact sheets is important.
La neuritis óptica (ON) es una enfermedad inflamatoria desmielinizante, generalmente monocular, que causa una pérdida de agudeza visual aguda, dolor con los movimientos oculares y capacidad reducida para la percepción del color.
La ON puede ocurrir como un episodio aislado, como episodios repetidos de pérdida visual (ON recurrente), como un componente más de desmielinización polisintomática en el contexto de una encefalomielitis aguda diseminada (EMAD), acompañando a una mielitis transversa en los pacientes con neuromielitis óptica (NMO), o puede ser la primera manifestación clínica de una esclerosis múltiple (EM)1.
La mayor parte de los casos ocurren en mujeres (2/3) en edades comprendidas entre los 20-40 años2,3. La incidencia de ON en población pediátrica es desconocida, aunque se cree que es considerablemente menor que en adultos.
Se analiza la experiencia de nuestra sección de neuropediatría en sus 27 años de funcionamiento y se elabora un protocolo de manejo y hoja de información para padres.
Material y métodosSe realiza un estudio descriptivo retrospectivo de los pacientes con diagnóstico de ON que constan en la base de datos de nuestra sección de neuropediatría del Hospital Infantil Universitario Miguel Servet de Zaragoza en sus 27 años de funcionamiento (mayo 1990 – agosto 2017)4,5. El Hospital Infantil Universitario Miguel Servet es un hospital de III nivel con 170 camas exclusivas para la atención pediátrica y nuestra sección es de referencia para el área de Aragón, La Rioja y Soria. La base de datos recoge todos los pacientes valorados por neuropediatría ya sea de forma ambulatoria o durante el ingreso hospitalario. El diagnóstico de ON se basó en la sintomatología clínica y en la exploración física y oftalmológica compatibles.
Se han revisado las historias clínicas de estos pacientes recogiendo el año de diagnóstico, edad, sexo, sintomatología clínica, exploración oftalmológica, exámenes complementarios realizados, diagnósticos diferenciales planteados, posibles factores desencadenantes, duración del ingreso, tratamiento recibido y evolución. En agosto de 2017 se contactó telefónicamente con los pacientes que ya no eran controlados en nuestra consulta para conocer si habían presentado alguna otra incidencia neurológica u oftalmológica posterior.
Se elabora y pone en marcha un protocolo de manejo diagnóstico y tratamiento en nuestro centro en base a las evidencias científicas actuales y consensuado con todos los profesionales implicados en el manejo: neuropediatras, oftalmólogos infantiles, neurorradiólogos y neurólogos.
Como complemento al protocolo también se redacta una hoja de información para los padres en las que se explica en qué consiste la enfermedad, pruebas que van a realizarse, opciones de tratamiento y evolución de la misma.
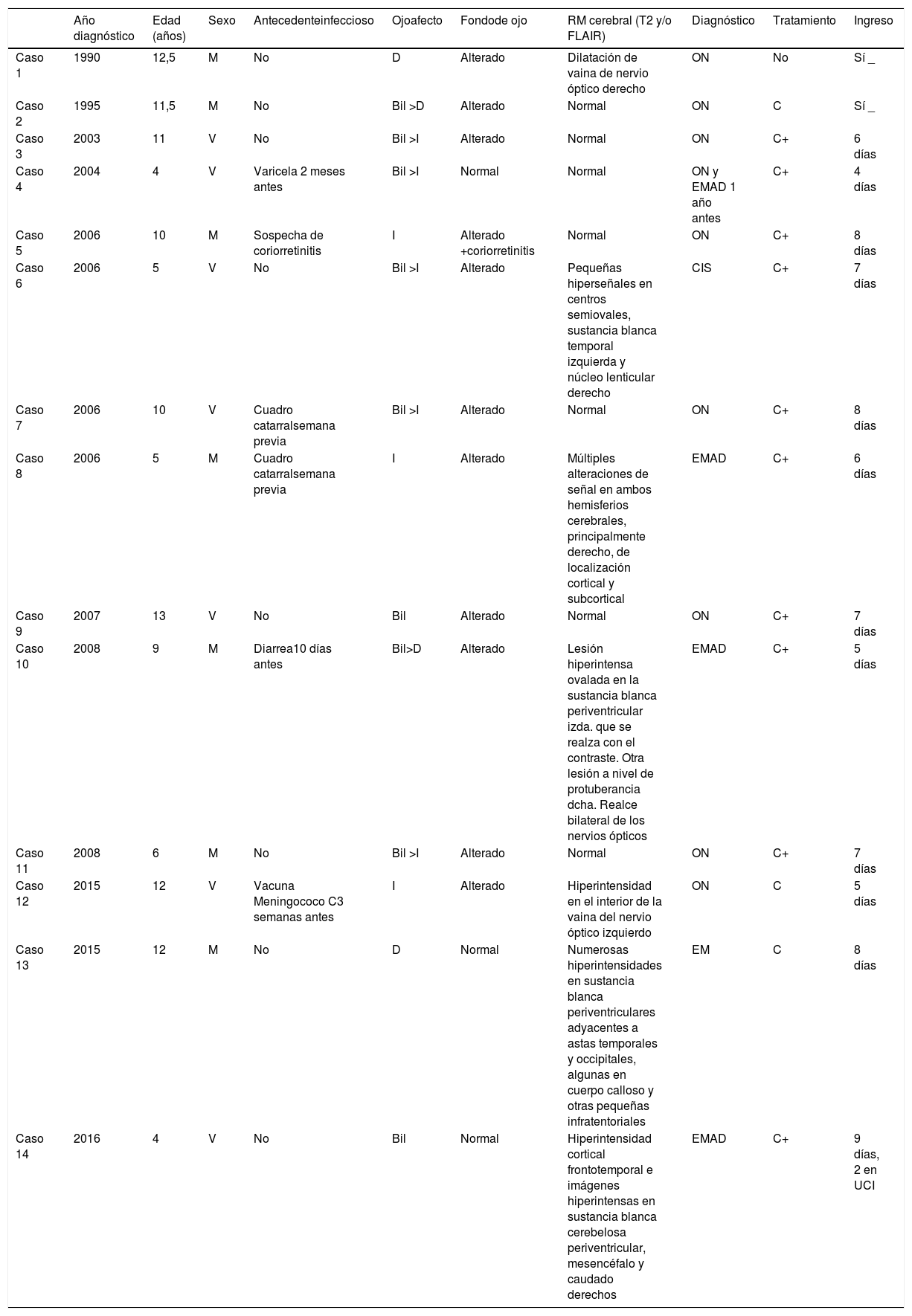
ResultadosEn nuestra sección de neuropediatría se han valorado 20.744 niños en los últimos 27 años, desde mayo de 1990 hasta agosto de 2017, de los cuales 14 presentaron ON: 8 ON aisladas, uno EM, un episodio clínicamente aislado (CIS), 3 EMAD y un paciente con ON aislada que el año anterior había sufrido una EMAD. El rango de edad al diagnóstico de estos pacientes es de 4 a 13 años, 50% varones. Mayores de 10 años, 8 pacientes: 7 con ON aisladas y uno con EM. La afectación del nervio óptico fue bilateral en 9, retrobulbar en 3. La resonancia magnética (RM) cerebral fue normal en 7 casos, solo con afectación del nervio óptico en 2 casos y con desmielinización del sistema nervioso central en 5 casos. Recibieron corticoterapia 13/14 con diferentes pautas. Todos los pacientes permanecieron ingresados de 4 a 8 días. Todos evolucionaron favorablemente, sin recurrencias ni secuelas, salvo la joven con EM (caso 13). Mediante contacto telefónico con los pacientes en agosto de 2017 se confirmó que ninguno había presentado recurrencias ni complicaciones posteriores hasta el momento. El tiempo medio de seguimiento de los pacientes desde su diagnóstico hasta agosto de 2017ha sido de 9,7 años, con un rango de 17 meses a 16,9 años y una DS de 4,8 años. El resumen de los pacientes y las principales características clínicas se recogen en la tabla 1.
Resumen de los pacientes y las principales características
| Año diagnóstico | Edad (años) | Sexo | Antecedenteinfeccioso | Ojoafecto | Fondode ojo | RM cerebral (T2 y/o FLAIR) | Diagnóstico | Tratamiento | Ingreso | |
|---|---|---|---|---|---|---|---|---|---|---|
| Caso 1 | 1990 | 12,5 | M | No | D | Alterado | Dilatación de vaina de nervio óptico derecho | ON | No | Sí _ |
| Caso 2 | 1995 | 11,5 | M | No | Bil >D | Alterado | Normal | ON | C | Sí _ |
| Caso 3 | 2003 | 11 | V | No | Bil >I | Alterado | Normal | ON | C+ | 6 días |
| Caso 4 | 2004 | 4 | V | Varicela 2 meses antes | Bil >I | Normal | Normal | ON y EMAD 1 año antes | C+ | 4 días |
| Caso 5 | 2006 | 10 | M | Sospecha de coriorretinitis | I | Alterado +coriorretinitis | Normal | ON | C+ | 8 días |
| Caso 6 | 2006 | 5 | V | No | Bil >I | Alterado | Pequeñas hiperseñales en centros semiovales, sustancia blanca temporal izquierda y núcleo lenticular derecho | CIS | C+ | 7 días |
| Caso 7 | 2006 | 10 | V | Cuadro catarralsemana previa | Bil >I | Alterado | Normal | ON | C+ | 8 días |
| Caso 8 | 2006 | 5 | M | Cuadro catarralsemana previa | I | Alterado | Múltiples alteraciones de señal en ambos hemisferios cerebrales, principalmente derecho, de localización cortical y subcortical | EMAD | C+ | 6 días |
| Caso 9 | 2007 | 13 | V | No | Bil | Alterado | Normal | ON | C+ | 7 días |
| Caso 10 | 2008 | 9 | M | Diarrea10 días antes | Bil>D | Alterado | Lesión hiperintensa ovalada en la sustancia blanca periventricular izda. que se realza con el contraste. Otra lesión a nivel de protuberancia dcha. Realce bilateral de los nervios ópticos | EMAD | C+ | 5 días |
| Caso 11 | 2008 | 6 | M | No | Bil >I | Alterado | Normal | ON | C+ | 7 días |
| Caso 12 | 2015 | 12 | V | Vacuna Meningococo C3 semanas antes | I | Alterado | Hiperintensidad en el interior de la vaina del nervio óptico izquierdo | ON | C | 5 días |
| Caso 13 | 2015 | 12 | M | No | D | Normal | Numerosas hiperintensidades en sustancia blanca periventriculares adyacentes a astas temporales y occipitales, algunas en cuerpo calloso y otras pequeñas infratentoriales | EM | C | 8 días |
| Caso 14 | 2016 | 4 | V | No | Bil | Normal | Hiperintensidad cortical frontotemporal e imágenes hiperintensas en sustancia blanca cerebelosa periventricular, mesencéfalo y caudado derechos | EMAD | C+ | 9 días, 2 en UCI |
Bil: bilateral; C: metilpredinosolona IV; C+: metilprednisola IV y posterior pauta oral con prednisona; D: derecho; I: izquierdo; M: mujer; ON: neuritis óptica aislada; V: varón.
Se realizó a todos los pacientes RM cerebral, valoración por oftalmología infantil, estudio citoquímico y microbiológico en líquido cefalorraquídeo (LCR) y serologías en sangre.
La agudeza visual en el momento del diagnóstico estaba reducida en todos los pacientes. En todos ellos, excepto en dos, la recuperación visual fue completa a lo largo de las primeras semanas de evolución. Independientemente de la presencia al inicio de edema o no en la capa de fibras nerviosas de la retina objetivado mediante tomografía de coherencia óptica (OCT), todos los pacientes presentaron disminución de su espesor a lo largo del seguimiento. En el campo visual al diagnóstico se observó disminución difusa de la sensibilidad en un caso, escotoma centrocecal en dos casos, reducción concéntrica en un caso y aumento de la mancha ciega en un caso. Se practicaron potenciales evocados visuales a 8 pacientes (casos 4, 6, 8, 9, 10, 11, 12 y 13) al diagnóstico, en todos alterado.
Se ha realizado estudio de autoinmunidad en LCR y bandas oligoclonales en los dos casos más recientes, caso 13 y caso 14. El caso 14 es un varón de 4 años con EMAD y anticuerpos contra la glicoproteína de la mielina de los oligodendrocitos (anti-MOG) positivos en LCR, siendo el resto negativo incluidos los anti-NMO (autoanticuerpos específicos contra aquoporina-4, anti-AQP4).
El caso 13 se trata de una niña de 12 años que inicia cuadro de visión borrosa inicialmente de ambos ojos acentuándose en ojo derecho junto con cefalea y sensación de mareo. Posterior aparición de estrabismo en ojo derecho. El fondo de ojo es normal pero la campimetría del ojo derecho está abolida. En la RM se visualizan numerosas lesiones hiperintensas en sustancia blanca predominantemente periventriculares sobre todo adyacentes a astas temporales y occipitales, algunas en cuerpo calloso y otras de pequeño tamaño infratentoriales. Existencia de bandas oligoclonales en LCR. Los anticuerpos anti-NMO en sangre fueron negativos. Se inició tratamiento con interferón beta-1a 30 mcg semanales vía intramuscular, a pesar de lo cual presenta 2 nuevos brotes, al mes y a los 5 meses, que se tratan con metilprednisolona intravenosa (IV) durante 5 días. En estos brotes la paciente presentaba clínica vertiginosa y paresia de VI, sin presentar episodios recurrentes de ON. Posteriormente se suspende interferón beta-1a y se inicia tratamiento con fingolimod 0,5mg diarios por vía oral. En la actualidad se mantiene estable, en la última RM hace 4 meses existe disminución del tamaño de las lesiones ya conocidas, sin aparición de otras nuevas.
Destacar el caso 4, niño de 4 años que presenta ON retrobulbar con RM normal, que había pasado la varicela hacía 2 meses, y que hacía un año había estado ingresado en nuestro centro por una encefalomielitis aguda diseminada de la que se había recuperado sin secuelas y en cuya RM presentaba múltiples lesiones diseminadas de hiperseñal en T2 situadas a nivel pedúnculo-protuberancial, periacueductal, región lenticular derecha, capsular interna, pálido izquierdo y sustancia blanca subcortical paraventricular bilateral.
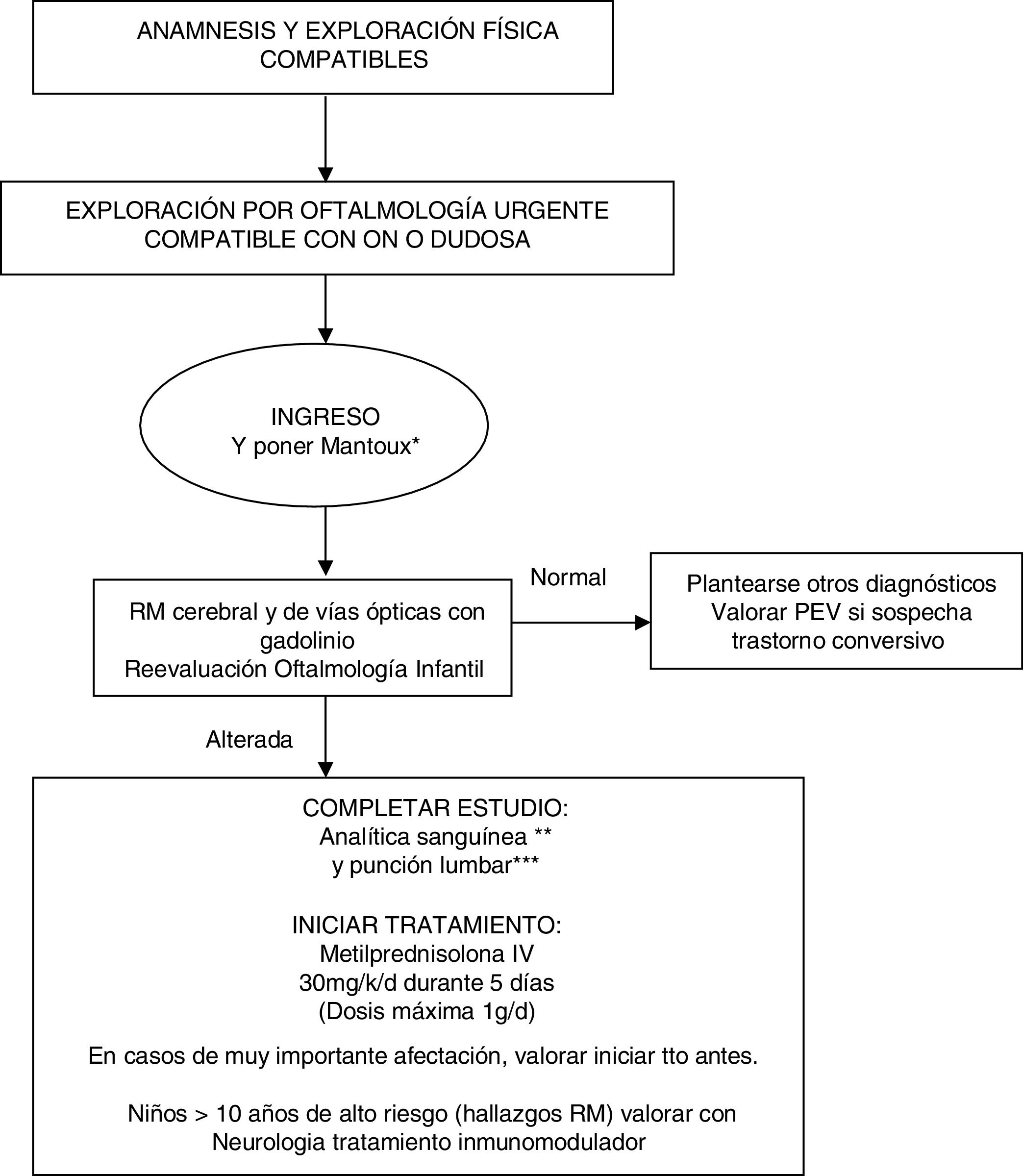
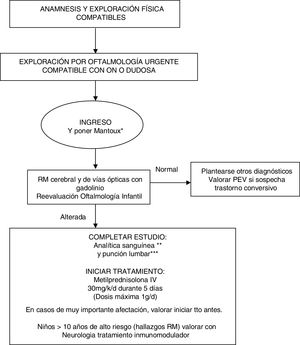
El algoritmo de manejo elaborado a partir de evidencia científica actual y la hoja informativa para padres se recogen en las figuras 1 y 2, respectivamente.
Algoritmo de actuación ante niño con sospecha de neuritis óptica.
* Mantoux de rutina ante la posibilidad de tener que poner tratamiento con altas dosis de corticoide.
** Analítica sanguínea incluye: hemograma, PCR, VSG, bioquímica, iones, creatinina, perfil hepático, albúmina, proteinograma, inmunoglobulinas, hormonas tiroideas, ECA, vitamina B12, ácido fólico y vitamina D. Estudio de autoinmundad (ANA, etc.), BOC y anti-NMO. Estudios serológicos en sangre: virus neurotrópos (CMV, VEB, herpes, enterovirus), micoplasma, Borrellia, Brucella, Chlamydia, sífilis, VIH.
*** En LCR: recuento celular, bioquímica, ADA, proteinograma e inmunoglobulinas, BOC en LCR. Estudio Gram y cultivo de virus y bacterias.
Las características clínicas de la ON en adultos fueron caracterizadas sistemáticamente en el «Optic Neuritis Treatment Trial», que enroló a 457 pacientes, con edades comprendidas entre los 18 y 46 años, con neuritis óptica aguda unilateral3. El cuadro clínico típico es la pérdida visual que se suele desarrollar en un periodo de horas a días, con un máximo dentro de las primeras 2 semanas, junto con dolor que empeora con los movimientos oculares. También puede haber fotopsias precipitadas con los movimientos oculares. La pérdida de visión de colores desproporcionada a la pérdida de agudeza visual es específica de patología del nervio óptico y el defecto del campo visual típico se caracteriza por un escotoma central.
En niños es un cuadro poco frecuente y difiere en varios aspectos a la ON del adulto6. En los niños suele existir un antecedente de infección viral previa en el 39-60%, aunque rara vez se identifica el patógeno. Existen casos descritos dentro de los 30 días siguientes a una vacunación, como ocurre en nuestro caso 12 vacunado de meningococo C, aunque esto ocurriría en menos del 5% de los pacientes pediátricos con ON7. En contraposición con los pacientes adultos, es más frecuente la afectación bilateral8 y que presenten papilitis, como se refleja en nuestra serie con 9/14 bilaterales y una gran frecuencia (11/14) con papilitis9,10.
El diagnóstico es clínico, basándose en la historia clínica y la exploración. El examen oftalmológico es esencial en la valoración ya que los hallazgos en el fondo de ojo, junto con la clínica, pueden ayudar a diferenciar casos típicos de atípicos. Para la valoración del daño a nivel de la vía visual se recomienda basarse tanto en técnicas de diagnóstico estructural, como es la OCT, y en técnicas de diagnóstico funcional, como son los potenciales evocados visuales y el campo visual11. Durante la última década, el estudio de la retina, especialmente de la capa de fibras nerviosas de la retina y la capa de células ganglionares, mediante OCT ha formado parte del protocolo clínico oftalmológico de todos los pacientes con ON. La realización de potenciales evocados visuales no suele ayudar en el diagnóstico del episodio agudo, por lo que en nuestro protocolo hemos establecido su utilización en casos dudosos o en los que haya sospecha de un trastorno conversivo, y no se realizan de forma rutinaria.
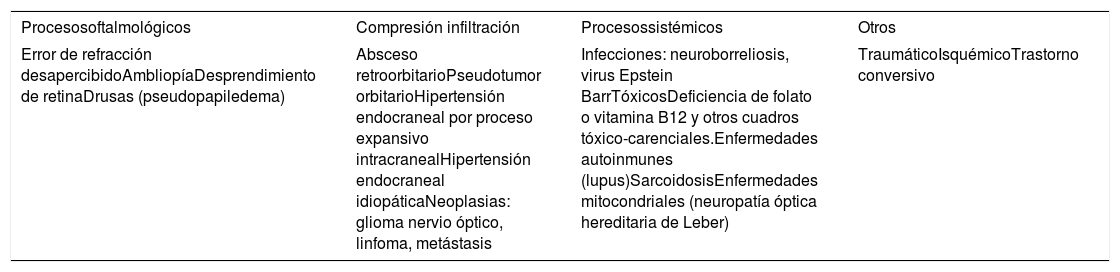
En el diagnóstico diferencial en niños, se deben tener en cuenta diversos procesos resumidos en la tabla 2.
Diagnóstico diferencial de neuritis óptica
| Procesosoftalmológicos | Compresión infiltración | Procesossistémicos | Otros |
|---|---|---|---|
| Error de refracción desapercibidoAmbliopíaDesprendimiento de retinaDrusas (pseudopapiledema) | Absceso retroorbitarioPseudotumor orbitarioHipertensión endocraneal por proceso expansivo intracranealHipertensión endocraneal idiopáticaNeoplasias: glioma nervio óptico, linfoma, metástasis | Infecciones: neuroborreliosis, virus Epstein BarrTóxicosDeficiencia de folato o vitamina B12 y otros cuadros tóxico-carenciales.Enfermedades autoinmunes (lupus)SarcoidosisEnfermedades mitocondriales (neuropatía óptica hereditaria de Leber) | TraumáticoIsquémicoTrastorno conversivo |
La RM cerebral y de vías ópticas con gadolinio confirma el diagnóstico en la mayoría de los casos, aunque en nuestra casuística el 50% de las RM fueron normales, lo que probablemente se debe a la antigüedad de algunos de los casos y la mejora de las técnicas de imagen. La RM también puede establecer el riesgo de una subsecuente esclerosis múltiple, si identifica alteraciones en la sustancia blanca características (ovoideas, periventriculares y mayores de 3mm). La prevalencia de alteraciones en sustancia blanca varía sustancialmente en adultos con ON, entre el 23 y 75%12. Los pacientes con alteraciones en sustancia blanca presentan un mayor riesgo de desarrollar EM, y los datos en niños también parecen apoyar este hecho13,14.
La analítica de sangre y LCR permite descartar otras causas, principalmente infecciosas, y permite completar estudio de anticuerpos que también nos pueden proporcionar información pronóstica y ayudar a la toma de decisiones terapéuticas. La presencia de bandas oligoclonales en LCR implica un riesgo aumentado de desarrollar EM; aunque también se han asociado con lesiones en sustancia blanca en la RM cerebral, por lo que su presencia no es claramente de importancia pronóstica independiente15. La positividad en suero de autoanticuerpos específicos contra aquoporina-4 (anti-AQP4 o anti-NMO) se asocia a mayor riesgo de presentar NMO, particularmente en pacientes con RM cerebral normal y aquellos con episodios de neuritis óptica en rápida sucesión o con una presentación de pérdida visual grave16–18, por lo que hemos establecido en nuestro protocolo su determinación de forma rutinaria a todos los pacientes con ON. No tenemos establecido en nuestro protocolo la realización de los anticuerpos anti-MOG en suero, en el caso 14 se pudieron determinar como parte de un proyecto de investigación al que se pudo mandar muestra del paciente. Existe evidencia de que los anticuerpos anti-MOG pueden aparecer de forma transitoria en casi el 50% de los niños con EMAD, aunque pueden estar presentes en otros procesos desmielinizantes y su determinación no está disponible en la mayoría de los centros19.
Todos los ensayos clínicos de tratamiento se limitan a población adulta, en los que recomiendan usar metilprednisolona IV en pacientes con ON con importante afectación visual y/o si tiene afectación visual bilateral, ya que puede acelerar la recuperación visual. También sería recomendable el tratamiento en pacientes con alteraciones de señal en la RM cerebral, ya que el tratamiento parece que retrasa el posible desarrollo de una EM20. No se recomienda el uso de prednisona oral en el tratamiento de la ON ya que se ha observado un riesgo aumentado de ON recurrente; aunque el riesgo asociado al tratamiento con prednisona oral solo se observó en un ensayo21, fue inesperado, y su base patológica no es conocida.
Los niños parece que tienen menor riesgo de recurrencias y de desarrollar posteriormente una EM22,23. No hay ensayos clínicos en niños que puedan servir como guía de tratamiento en niños con ON. La metilprednisolona IV, al igual que en adultos, parece acelerar la recuperación visual24–26 en la ON y las series de casos sugieren que el pronóstico visual final no se altera; aunque determinar la historia natural sin tratamiento de la ON en niños es complicado ya que en la práctica clínica habitual la corticoterapia se inicia de forma precoz.
Los episodios leves que no limitan la actividad o la asistencia al colegio no requieren corticoterapia. Las pautas que se usan en las series de niños son1: metilprednisolona IV 20-30mg/kg dosis (con un máximo de 1g por dosis) en infusión durante 3-5 días. Si la recuperación visual se completa después del tratamiento IV, no es preciso terapia oral. Si el paciente mejora, pero no se resuelve por completo, se sugiere que se continúe con prednisona oral 1-2mg/kg/día, reduciendo la dosis en 5mg cada 3-5 días durante 14-21 días. El riesgo de supresión adrenal es mínimo. Otros tratamientos usados en enfermedades neuroinmunológicas son las inmunoglobulinas intravenosas (IgIV) y la plasmaféresis. No está establecida su eficacia en ON. En niños en los que no hay respuesta al tratamiento corticoideo podrían responder a las IgIV, aunque la mayor parte de los datos recogidos sobre su uso en niños con pérdida visual es en contexto de desmielinización polisintomática o EMAD27–30. Las series de casos publicadas utilizan dosis de 2g/kg en total, divididas en 2-5 días.
En nuestro centro, ante recientes experiencias de algunos casos atípicos de tuberculosis emergente, hemos decidido poner un Mantoux de rutina al ingreso del paciente ante la posibilidad de tener que administrar tratamiento con altas dosis de corticoide31. Las pautas utilizadas a lo largo de estos años en los pacientes con ON en nuestro hospital han sido metilprednisolona IV seguida o no de pauta de prednisona oral, la continuación de tratamiento oral no se correlacionó con falta de resolución del cuadro tras el tratamiento IV y fue arbitraria ante la falta de una pauta previa establecida. Este hecho también se refleja en la heterogeneidad de los exámenes complementarios solicitados.
Una importante decisión clínica en adultos con ON es si comenzar o no tratamiento inmunomodulador crónico para prevenir, retrasar o aminorar una subsecuente EM. Los resultados de 3 estudios randomizados (Controlled High-Risk Avonex MS Prevention Study, Early Treatment of Multiple Sclerosis Study y PreCISe study trial)32–34 apoyan el uso de tratamiento con beta interferón o con acetato de glatiramero en pacientes de alto riesgo, definidos por los hallazgos en la RM.
En general, el tratamiento inmunomodulador con interferón no se usa en niños pequeños, ya que existe menor riesgo en población pediátrica de desarrollar una esclerosis múltiple, aunque en niños mayores, a partir de los 12 años, se siguen las mismas guías que en adultos35.
Los porcentajes descritos de diagnóstico de EM en niños tras un episodio de ON son muy variables: 13% a los 10 años de seguimiento de 79 casos22, 36% de 36 casos a los 2 años (de los que el 68% tenían al menos una lesión fuera del nervio óptico en la RM cerebral obtenida durante el episodio de ON)9, 32% de 41 casos (4 de ellos no tuvieron datos que sugirieran otra afectación neurológica a parte del nervio óptico en su comienzo)7.
En una cohorte de Francia que siguió a 296 niños durante una media de 2,9 años tras un único evento desmielinizante agudo del sistema nervioso central, el diagnóstico de esclerosis múltiple se confirmó en el 57% de los niños al final del estudio36. Los factores presentes en el brote inicial que se asociaron a un riesgo aumentado de presentar un segundo evento desmielinizante fueron: tener más de 10 años, presentar lesiones en el nervio óptico y tener un patrón de RM típico de EM (lesiones múltiples bien delimitadas periventriculares o subcorticales). Los factores presentes al inicio que se asociaron con menor riesgo de un nuevo evento fueron: lesiones en la médula espinal y cambios agudos en el estado mental.
En nuestro protocolo hemos establecido que en niños a partir de 10 años, con factores de riesgo de desarrollar EM o neuromielitis óptica (presencia de hiperseñales en RM cerebral, bandas oligoclonales, anti-NMO, recurrencia de ON), se consensuará con el servicio de neurología el inicio de tratamiento inmunomodulador.
La protocolización de nuestra actividad asistencial nos permite minimizar la variabilidad de nuestras actuaciones y facilita la toma de decisiones diagnósticas, de seguimiento y tratamiento, de una patología poco frecuente pero con posibles repercusiones importantes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado en la XL Reunión Anual de la Sociedad Española de Neurología Pediátrica.