La esclerosis múltiple (EM) es una enfermedad crónica desmielinizante autoinmune del sistema nervioso central (SNC) que produce neuroinflamación; un modelo es la encefalitis autoinmune experimental (EAE). La EM ha sido tratada con interferón beta (IFN-β) y acetato de glatirámero (AG). Se ha descrito que la melatonina (MLT) modula la respuesta del sistema inmune. El objetivo de este estudio fue observar el efecto de la administración de MLT contra los tratamientos de primera línea utilizados en la EM (IFN-β y AG).
MétodosSe indujo EAE a ratas macho Sprague Dawley y se les administró IFN-β, AG o MLT. Se colectó líquido cefalorraquídeo (LCR) y se midieron citocinas proinflamatorias por multiplex, además del registro de la evaluación neurológica de la EAE.
ResultadosTodos los animales inmunizados establecieron la EAE. Se evaluó el primer ciclo de recaída-remisión, observando que IFN-β y AG tienen mejores resultados que MLT en la evaluación clínica. La concentración en el LCR tanto de IL-1β como de IL-12p70 no se vio modificada por el modelo o por los tratamientos administrados. EL TNF-α se vio disminuido en el LCR por el IFN-β y la MLT bajo el modelo de EM.
ConclusionesEs necesario realizar estudios posteriores para evaluar los mecanismos moleculares involucrados en el comportamiento de la MLT en la EAE, así como la cuantificación de otras citocinas en diferentes matrices biológicas para poder considerar la MLT como un agente antiinflamatorio regulador de la EM.
Multiple sclerosis (MS) is a chronic, demyelinating, autoimmune disease of the central nervous system causing neuroinflammation. Experimental autoimmune encephalitis (EAE) is a model of the disease. MS is classically treated with interferon beta (IFN-β) and glatiramer acetate (GA). Melatonin (MLT) has been reported to modulate immune system responses. The aim of the present study is to analyse the effects of MLT administration in comparison with the first-line treatments for MS (IFN-β and GA).
MethodsEAE was induced in male Sprague-Dawley rats; the animals subsequently received either IFN-β, GA, or MLT. Cerebrospinal fluid (CSF) samples were analysed by multiplex assay to determine the levels of proinflammatory cytokines. The neurological evaluation of EAE was also recorded.
ResultsAll immunised animals developed EAE. We evaluated the first relapse-remission cycle, observing that IFN-β and GA had better results than MLT in the clinical evaluation. Neither EAE nor any of the treatments administered modified CSF IL-1β and IL-12p70 concentrations. However, IFN-β and MLT did decrease CSF TNF-α concentrations.
ConclusionsFurther studies are needed to evaluate the molecular mechanisms involved in the behaviour of MLT in EAE, and to quantify other cytokines in different biological media in order for MLT to be considered an anti-inflammatory agent capable of regulating MS.
La esclerosis múltiple (EM) es una enfermedad crónica desmielinizante autoinmune del sistema nervioso central (SNC), caracterizada por desmielinización, daño axonal y pérdida neuronal1-4. La EM representa la principal causa de discapacidad neurobiológica en adultos jóvenes y tiene consecuencias psicológicas, económicas, sociales y en la salud3. En México se estima que la prevalencia de esta enfermedad es de 15:100.000 habitantes y se presenta con mayor frecuencia en mujeres5.
Diferentes estudios establecen la encefalitis autoinmune experimental (EAE) como un modelo adecuado para estudiar muchos aspectos de la EM. Se trata de un trastorno autoinmune del SNC inducido experimentalmente6, caracterizado por la disrupción de la barrera hematoencefálica (BHE), por infiltración perivascular de linfocitos dentro del SNC, activación de la microglía y parálisis de miembros inferiores6-8. Las moléculas proinflamatorias secretadas por los macrófagos infiltrados, células T y células de la glía activadas interactúan con el SNC para determinar el proceso inflamatorio que conduce a la destrucción de la mielina y de los oligodendrocitos6. El curso clínico de la EAE se caracteriza por pérdida de peso, parálisis ascendente y recuperación espontánea8.
El tratamiento de primera línea de la EM incluye al interferón beta (IFN-β) y al acetato de glatirámero (AG)9. El IFN-β es una citocina con actividad antiviral y potentes efectos antiinflamatorios10,11. Se ha demostrado que es efectivo en la esclerosis múltiple de recaída-remisión (EM-RR), ya que puede reducir la tasa de recaídas, la severidad de la enfermedad y el desarrollo de lesiones cerebrales, así como retardar la progresión de la enfermedad12. El AG es un copolímero sintético aleatorio basado en la composición de la proteína básica de mielina (MBP)13-15, que también reduce la tasa de recaídas de la EM-RR16; su mecanismo de acción es aún desconocido17.
Por otro lado, la melatonina (MLT), o N-acetil-5-metoxitriptamina, es un neuromodulador sintetizado en la glándula pineal. Se ha reportado que los receptores de MLT se expresan sobre la membrana de las células T CD4+, células T CD8+, células B y monocitos18,19. Los mecanismos moleculares responsables por los efectos pleiotrópicos de la MLT involucran la unión de alta afinidad de los receptores acoplados a proteínas G a nivel membranal, y/ o la interacción con blancos intracelulares que modulan las señales de transducción de las vías de señalización, los procesos redox, o el barrido de radicales libres20.
La MLT ha sido asociada con la supresión de enfermedades autoinmunes, incluida la EAE8, por lo que su utilización puede proporcionar una solución alternativa en el tratamiento de la EM previniendo el desarrollo de la fisiopatología de la EM y de su modelo, la EAE. Hasta la fecha, no se han realizado estudios comparativos entre los tratamientos inmunomoduladores (IFN-β y AG) para tratar la EM y la MLT en el modelo de EAE en función de su curso clínico. Por ello, el objetivo de este estudio fue observar el efecto de la administración de MLT contra los tratamientos de primera línea utilizados en la EM (IFN-β y AG), en el desarrollo de la EAE.
Material y métodosTodos los experimentos fueron llevados a cabo en el Centro de Investigación Biomédica de Occidente del Instituto Mexicano del Seguro Social.
AnimalesSe utilizaron un total de 128 ratas adultas macho de la cepa Sprague Dawley, de 60 días de edad posnatal, obtenidas de Harlam Laboratories SA de CV (México), las cuales se mantuvieron bajo condiciones de bioterio, con ciclos de luz-oscuridad de 12 por 12h, con comida y agua a libre demanda.
Todos los cuidados de los animales, así como los experimentos, fueron llevados a cabo bajo lo que dicta la Norma Oficial Mexicana NOM-062-ZOO-1999. El proyecto de investigación fue aprobado por el Comité Local de Investigación y Ética de la Investigación en Salud del Instituto Mexicano del Seguro Social con número de registro 2013-1305-3.
Inducción de la encefalitis autoinmune experimentalLa EAE fue inducida por la administración de 150μL del homogenado de inducción, el cual fue conformado por 25μL de homogenado de médula espinal de cerdo, 25μL de homogenado de cerebro de cerdo y 100μL de adyuvante completo de Freund (Sigma & Aldrich). La administración del homogenado de inducción se realizó por vía subcutánea en uno de los miembros posteriores de la rata. El tejido para realizar los homogenados de médula espinal y cerebro de cerdo fue obtenido de animales sanos y sin ninguna intervención previa; la homogeneización se realizó en buffer de fosfatos (100mM de fosfato dibásico de sodio (JT Baker), 50mM de sacarosa (JT Baker) y 0,5mM de EDTA (JT Baker), pH 7.4, de la siguiente manera: se coloca 1g de tejido cerebral en 1mL de buffer de fosfatos, se pasa por el homogeneizador hasta desintegrar por completo el tejido, se centrifuga a 1.000g por 15min, se recupera el sobrenadante para volver a centrifugarlo a 14.000rpm durante 20min, se recupera el sobrenadante para guardarlo en congelación hasta su uso; a este último sobrenadante recuperado se le llama homogenado de cerebro. Para elaborar el homogenado de médula espinal lo que se hace es en red fría pesar el tejido y homogeneizar con buffer de fosfatos en una relación 1:10 tejido:buffer, se homogeniza hasta conseguir la desintegración total del tejido, posteriormente se centrifuga a 1.000g durante 5min, se recupera el sobrenadante y se conserva en congelación; al sobrenadante recuperado se le llama homogenado de médula espinal.
Evaluación neurológica de la encefalitis autoinmune experimentalLa severidad de la enfermedad fue evaluada desde el día 0 hasta el día 12 postinducción a través de la escala clínica descrita por Fang et al.7, según la cual grado 0=rata normal, grado 1=pérdida parcial de la tonicidad de la cola, grado 2=pérdida de la tonicidad de la cola, grado 3=marcha inestable y parálisis leve, grado 4=parálisis de miembros posteriores, y grado 5=estado moribundo o muerte. El modelo de EAE se considera exitoso cuando la evaluación neurológica supera el grado 2.
Grupos experimentales y tratamientosEl total de animales fue distribuido en 8 grupos de 16 animales cada uno; los grupos son los siguientes: 1) grupo control (CTRL), sin tratamiento ni manipulación; 2) grupo EAE, sin tratamiento con EAE; 3) grupo IFN-β, con tratamiento de IFN-β 1b (dosis de 8.000U, cada tercer día, vía intramuscular), sin EAE; 4) grupo AG, con tratamiento de AG (dosis de 0,50mg/kg/día, vía subcutánea) sin EAE; 5) grupo MLT, con tratamiento de MLT (dosis de 10mg/kg/día, vía intraperitoneal), sin EAE; 6) grupo EAE-IFNβ, con tratamiento de IFN-β1b (dosis de 8.000U, vía intramuscular, cada tercer día), con EAE; 7) grupo EAE-AG, con tratamiento de AG (dosis de 0,50mg/kg/día, vía subcutánea), con EAE; y 8) grupo EAE-MLT, con tratamiento de MLT (dosis de 10mg/kg/día, vía intraperitoneal), con EAE.
El IFN-β 1b (Uriβeta®) fue reconstituido con solución salina fisiológica al 0,9%. El AG (Copaxone®) fue administrado directamente de su presentación farmacéutica comercial. La MLT (Sigma) fue disuelta, con condiciones de aislamiento de luz, en alcohol absoluto para después completar con solución salina al 0,9%. Todos los tratamientos fueron administrados desde el día de inducción (día 0) hasta el día 12 postinducción.
Recolección de líquido cefalorraquídeoAl día 12 postinducción se realiza la recolección de las muestras de LCR. Se anestesia la rata mediante administración de 50μg/kg de peso de dexmedetomidina por vía intramuscular y 80mg/kg de peso de ketamina vía intramuscular. Una vez anestesiada, se depila la parte superior del cuello y la nuca. Posteriormente, se inmoviliza al animal en el aparato estereotáxico para roedores donde se fija la cabeza a 90° ventralmente, de tal manera que quedan separadas las primeras vértebras cervicales. Se procede a realizar antisepsia con solución de yodo. Posteriormente, se administran 100μL de articaína-epinefrina (1:100.000) vía subcutánea en la zona de punción.
Por otro lado, se marca 1cm a partir de la punta del bisel de la aguja calibre 22G, de tal manera que se cuente con una referencia visual. Se palpa la cresta occipital y la parte craneal del atlas; en la parte media de estas estructuras se introduce una aguja marcada calibre 22G con el bisel hacia arriba en un ángulo de 30° del plano horizontal unos 3 a 4mm para luego corregir a un ángulo de 0° y continuar introduciendo la aguja otros 3 a 4mm de profundidad. El LCR comienza a fluir por presión positiva.
Para recuperar el LCR se emplea una jeringa de 1mL con aguja calibre 25G con la que se aspira el LCR contenido en el cono de la aguja que ha puncionado a la rata, la cual permanece en su sitio hasta aspirar todo el LCR que ha fluido desde la cisterna magna. El LCR recuperado (50μL) se transfiere a un tubo Eppendorf inmediatamente después de su extracción y se congela a −80̊ hasta su uso.
Cuantificación de citocinasPara la determinación de las citocinas IL-1β, IL-12p70 y TNF-α en el LCR se utilizó el kit de Milliplex map (cat. RECYTMAG-65K, Merck, EE.UU.), y se siguieron las especificaciones del proveedor. Se añade el buffer de ensayo a cada pozo para acondicionar la placa y se desecha este buffer. Después, se agrega el estándar, el blanco, las muestras y las perlas a los pozos respectivos. Se deja incubando por 2h a temperatura ambiente. Se remueve el contenido y se realizan lavados, luego se añade el anticuerpo de detección y la estreptavidina-ficoeritrina. Finalmente, se remueve todo el contenido, se realizan lavados, y se agrega el fluido de lectura. Se utilizó el equipo Luminex 200 (Texas, EE.UU.) donde se registraron 50 eventos por perla. Las concentraciones de cada citocina en el LCR fueron determinadas a partir de curvas estándar preparadas en la placa. Los datos se adquirieron en el programa xPONENT (Luminex, EE.UU.), se analizaron en el software Millipex Analyst 5.1 y se reportan como pg/mL.
Análisis estadísticoEl análisis estadístico fue llevado a cabo con los programas IBM® SPSS® Statistics V21 (EE.UU.) y GraphPad Prism 5.0 (EE.UU.). Los datos fueron expresados como media + error estándar de la media (SEM). Se utilizó la prueba de Kruskal-Wallis y el post hoc U de Mann-Whitney para comparar entre grupos. Se consideró estadísticamente significativo un valor de p≤0,05.
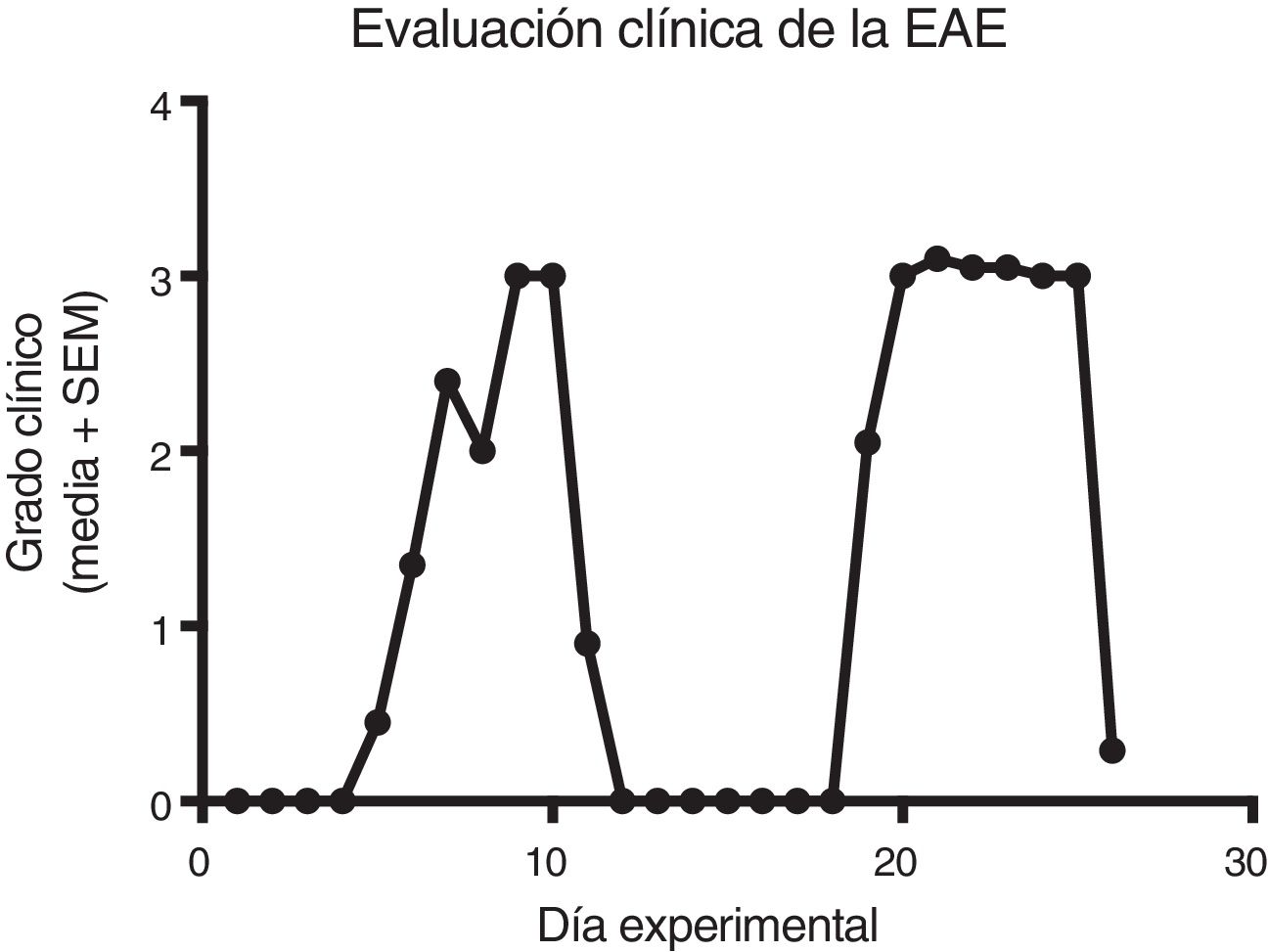
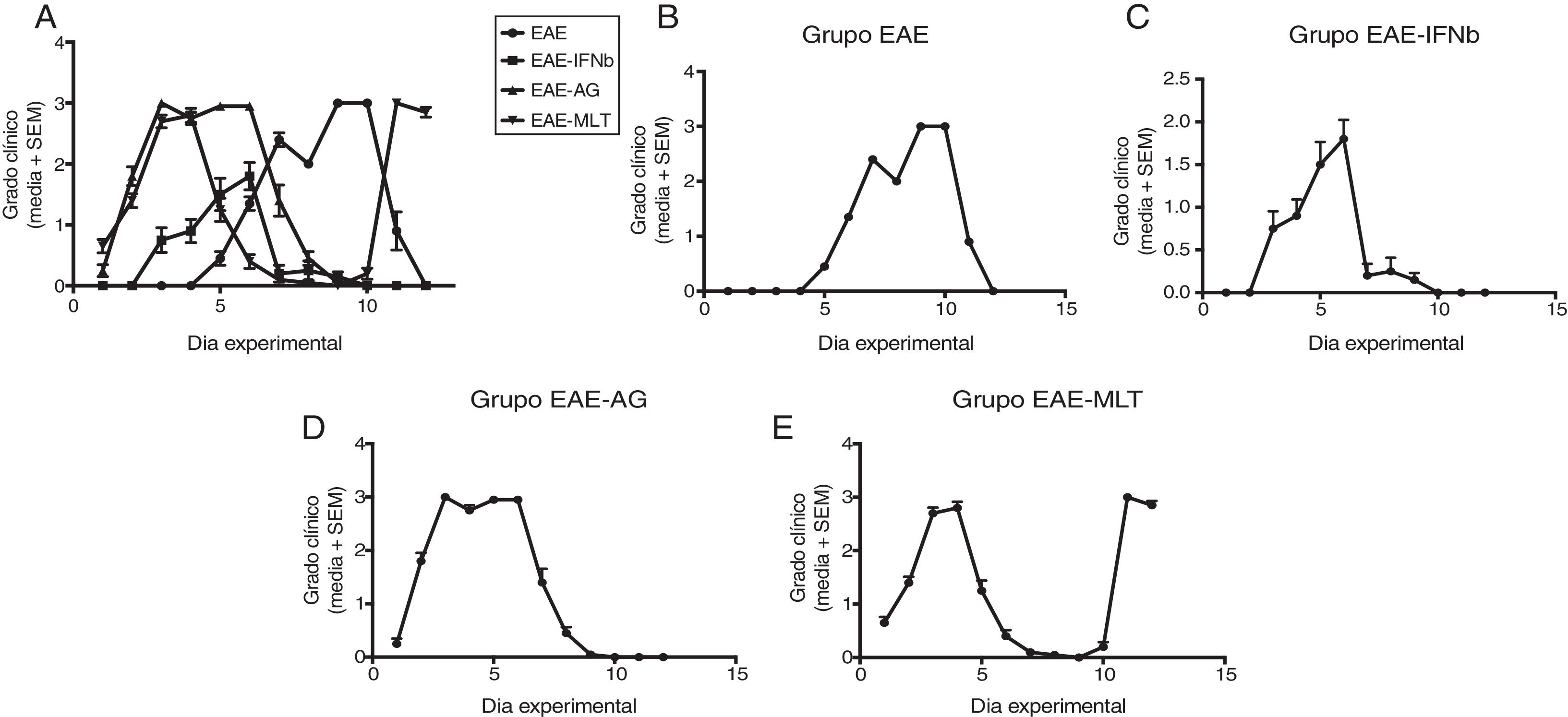
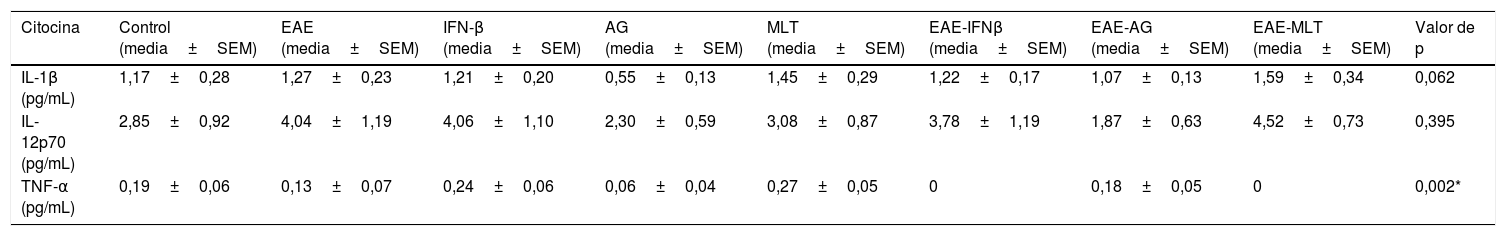
ResultadosEstablecimiento y evaluación clínica de la encefalitis autoinmune experimentalSe implementó y estandarizó el modelo de EAE de recaída-remisión, inmunizando ratas machos Sprague Dawley de 60 días de edad posnatal con el homogenado de inducción acompañado con adyuvante completo de Freund, alcanzando como máximo el grado 3 de la escala de evaluación clínica de la EAE. El modelo de EAE de recaída-remisión es el más adecuado para evaluar tratamientos ya que recrea la EM más común, la de recaída-remisión; además de que los tratamientos evaluados en este estudio son los utilizados para este tipo de EM (fig. 1). Se evaluó solo el primer ciclo de recaída-remisión el cual abarcó 12 días experimentales. El 100% de los animales inmunizados establecieron el modelo, alcanzando el grado 2 de la enfermedad, considerado como exitoso (fig. 2A-E).
Evaluación clínica de la EAE (media+SEM) de los grupos experimentales EAE, EAE-IFNβ, EAE-AG, EAE-MLT en 12 días experimentales. A) Comparación de la evaluación clínica de la EAE en los grupos experimentales. B) Evaluación clínica del grupo EAE. C) Evaluación clínica del grupo EAE-IFNβ, D) Evaluación clínica del grupo experimental EAE-AG. E) Evaluación clínica del grupo experimental EAE-MLT.
EAE: encefalitis autoinmune experimental; EAE-AG: encefalitis autoinmune experimental tratada con acetato de glatirámero; EAE-INFb: encefalitis autoinmune experimental tratada con interferón beta; EAE-MLT: encefalitis autoinmune experimental tratada con melatonina; IFNb: interferón beta; MLT: melatonina; SEM: error estándar de la media.
En los animales tratados con IFN-β, AG y MLT a los que se les indujo EAE, esta aparece de manera más temprana en comparación con el grupo sin tratamiento. Además, la administración con IFN-β aminora la severidad y la duración de los signos y síntomas clínicos, mientras que el tratamiento con AG establece una meseta en el grado clínico 3 durante varios días para después mostrar una recuperación de los animales inducidos con EAE. Por otro lado, el tratamiento con MLT actúa mejorando los síntomas de manera más rápida que el AG, logrando la recuperación total de los animales. Sin embargo, al final del periodo experimental sufren una recaída (fig. 2E).
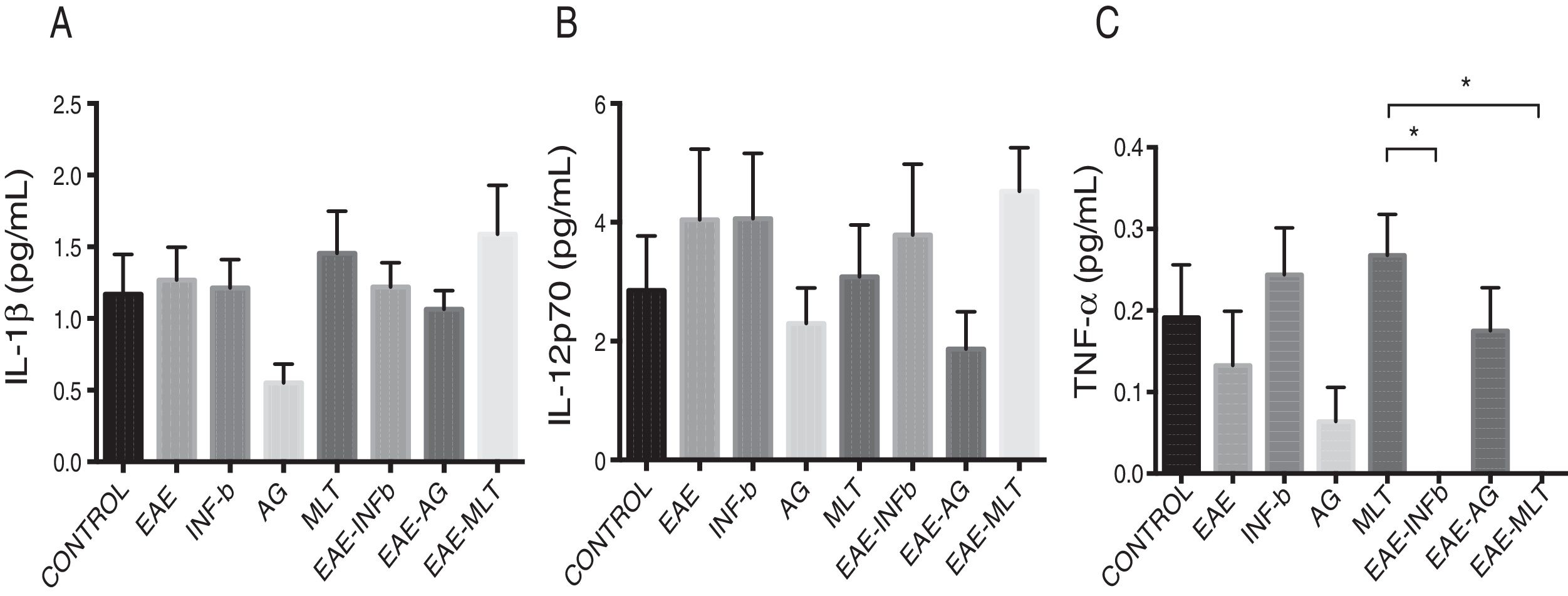
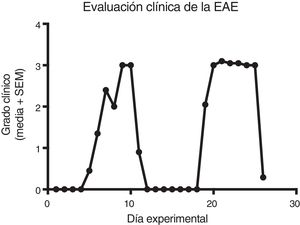
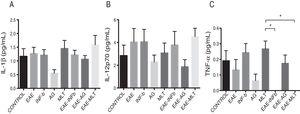
Cuantificación de citocinas proinflamatorias en el líquido cefalorraquídeoLa concentración de la IL-1β entre los grupos experimentales osciló entre 0,55±0,13 y 1,59±0,34pg/mL (media±SEM) en el LCR obtenido de ratas a las cuales se les indujo o no el modelo y en las que se administraron o no los tratamientos de IFN-β, AG y MLT, resultando estadísticamente no significativas las diferencias entre los grupos (p>0,0618, IC 95%). La concentración de la IL-12p70 para los grupos experimentales osciló entre 1,87±0,63 y 4,52±0,73pg/mL (media±SEM), sin embargo, estadísticamente no son significativas estas variaciones en la concentración de la citocina (p>0,3948, IC 95%). Por lo que la concentración en el LCR tanto para IL-1β como para IL-12p70 no se vio modificada por el modelo o por los tratamientos a los que fueron sometidos los animales. Por otro lado, la concentración del TNF-α entre los grupos registró valores entre 0,0±0,0 y 0,27±0,05pg/mL (media±SEM), siendo estadísticamente significativa con una p<0,0015, IC 95%, por lo que el TNF-α fue afectado por el modelo y por los tratamientos administrados en diferentes grados, incluso por debajo del límite inferior de detección del equipo, lo que supondría un importante efecto de los tratamientos de IFN-β y MLT en el modelo de EAE (tabla 1 y fig. 3A-C). Cabe resaltar que las concentraciones en el LCR de estas citocinas se encuentran por debajo de lo que otros estudios han reportado en suero.
Concentración media de las citocinas IL-1β, IL-12p70 y TNF-α en el LCR de ratas macho Sprague Dawley
| Citocina | Control (media±SEM) | EAE (media±SEM) | IFN-β (media±SEM) | AG (media±SEM) | MLT (media±SEM) | EAE-IFNβ (media±SEM) | EAE-AG (media±SEM) | EAE-MLT (media±SEM) | Valor de p |
|---|---|---|---|---|---|---|---|---|---|
| IL-1β (pg/mL) | 1,17±0,28 | 1,27±0,23 | 1,21±0,20 | 0,55±0,13 | 1,45±0,29 | 1,22±0,17 | 1,07±0,13 | 1,59±0,34 | 0,062 |
| IL-12p70 (pg/mL) | 2,85±0,92 | 4,04±1,19 | 4,06±1,10 | 2,30±0,59 | 3,08±0,87 | 3,78±1,19 | 1,87±0,63 | 4,52±0,73 | 0,395 |
| TNF-α (pg/mL) | 0,19±0,06 | 0,13±0,07 | 0,24±0,06 | 0,06±0,04 | 0,27±0,05 | 0 | 0,18±0,05 | 0 | 0,002* |
AG: acetato de glatirámero; EAE: encefalitis autoinmune experimental; EAE-AG: encefalitis autoinmune experimental tratada con acetato de glatirámero; EAE-IFNβ: encefalitis autoinmune experimental tratada con interferón beta; EAE-MLT: encefalitis autoinmune experimental tratada con melatonina; IFN-β: interferón beta; IL: interleucina; LCR: líquido cefalorraquídeo; MLT: melatonina; SEM: error estándar de la media; TNF-α: factor de necrosis tumoral alfa.
* Diferencia estadísticamente significativa entre los grupos experimentales con la prueba Kruskal-Wallis.
Concentración de IL-1β, IL-12p70 y TNF-α (media±SEM) en LCR de los grupos experimentales; control, EAE, IFN-β, AG, MLT, EAE-IFNβ, EAE-AG y EAE-MLT. A) Concentración de IL-1β en el LCR de los diferentes grupos. B) Concentración de IL-12p70 en el LCR de los diferentes grupos. C) Concentración de TNF-α en el LCR de los diferentes grupos.
AG: acetato de glatirámero; EAE: encefalitis autoinmune experimental; EAE-AG: encefalitis autoinmune experimental tratada con acetato de glatirámero; EAE-INFb: encefalitis autoinmune experimental tratada con interferón beta; EAE-MLT: encefalitis autoinmune experimental tratada con melatonina; IL: interleucina; INF-b: interferón beta; LCR: líquido cefalorraquídeo; MLT: melatonina; SEM: error estándar de la media; TNF-α: factor de necrosis tumoral alfa.
* Prueba Kruskal-Wallis con un post hoc de Dunn.
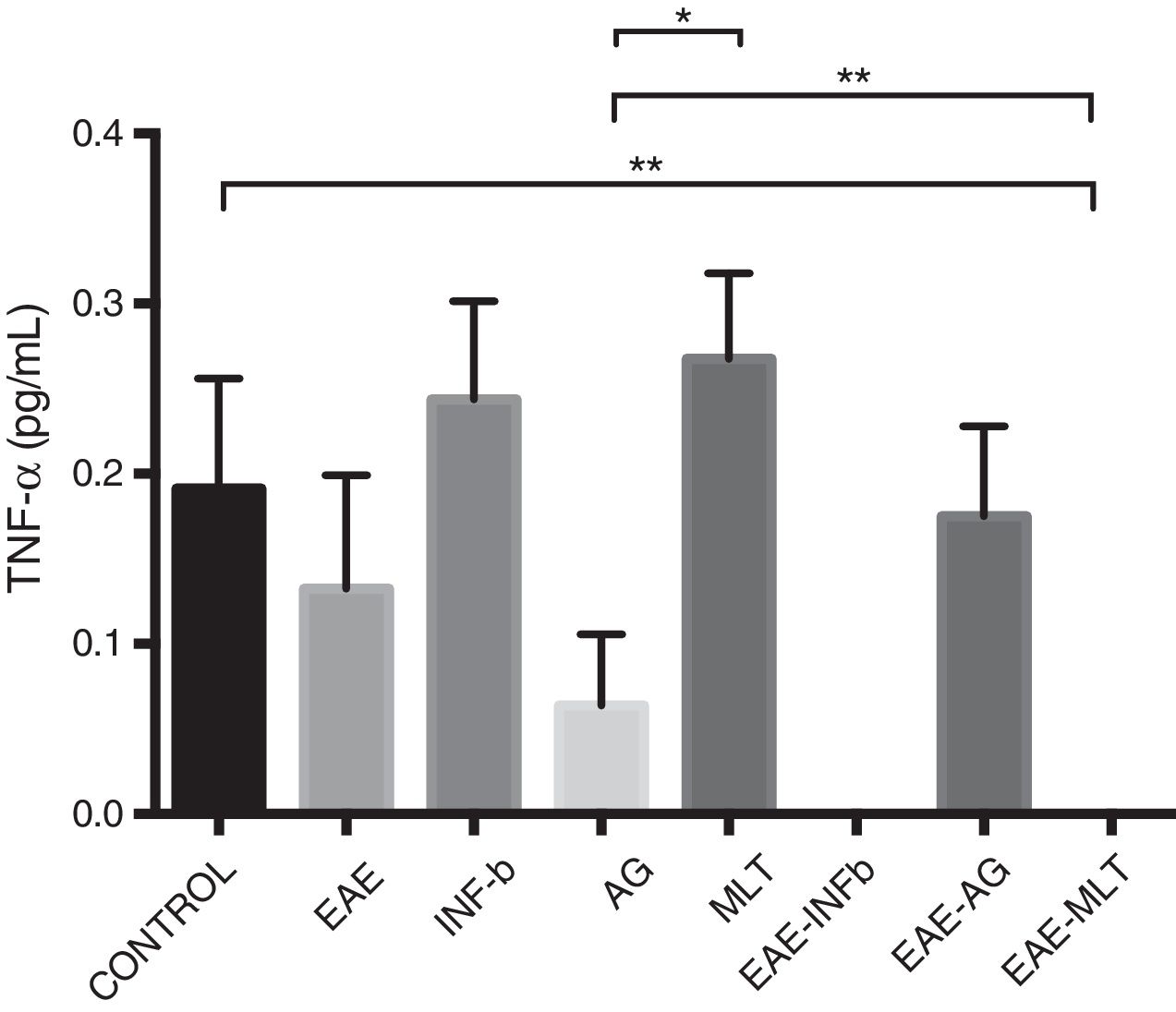
En relación con la concentración de TNF-α se observaron diferencias estadísticamente significativas entre los grupos control y EAE-IFNβ, control y EAE-MLT, IFN-β y AG, IFN-β y EAE-IFNβ, IFN-β y EAE-MLT, AG y MLT, MLT y EAE-IFNβ, MLT y EAE-MLT (p<0,030, IC 95%) (fig. 4).
Concentración de TNF-α en LCR obtenido de los grupos experimentales; control, EAE, INF-β, AG, MLT, EAE-INFβ, EAE-AG y EAE-MLT.
AG: acetato de glatirámero; EAE: encefalitis autoinmune experimental; EAE-AG: encefalitis autoinmune experimental tratada con acetato de glatirámero; EAE-INFb: encefalitis autoinmune experimental tratada con interferón beta; EAE-MLT: encefalitis autoinmune experimental tratada con melatonina; INF-b: interferón beta; LCR: líquido cefalorraquídeo; MLT: melatonina; TNF-α: factor de necrosis tumoral alfa.
*p≤0,030; **p<0,010, IC 95%. Prueba Kruskal-Wallis, con un post hoc de U de Mann-Whitney.
En el presente estudio se realizó una comparación del efecto entre los fármacos de primera línea utilizados en la clínica (IFN-β y AG) contra el uso de MLT en un modelo murino de EM, la EAE, el cual se ha reportado como el modelo más utilizado para la evaluación de fármacos potenciales para el tratamiento de la EM21, por lo que es el adecuado para llevar a cabo nuestro objetivo de comparar entre los fármacos IFN-β, AG y MLT. Nuestro modelo alcanza como máximo el grado 3 de la escala clínica establecida, así pues podemos considerarlo como un modelo no agresivo de la EAE, por lo menos en el primer ciclo de la enfermedad. Es probable que, si la enfermedad evoluciona, en cada ciclo se observará un aumento significativo hacia el grado clínico máximo, lo que se correspondería con la EM-RR, en la que el curso natural de las exacerbaciones es completado con un periodo de reparación, lo cual conduce a la remisión clínica. Sin embargo, el déficit residual después de una recaída pudiera persistir y contribuir al progreso escalonado de la discapacidad22.
El efecto del IFN-β sobre el AG y la MLT en la evaluación clínica de la EAE fue superior; de esta manera queda demostrado por qué es considerado como un estándar de oro en el tratamiento de la EM, ya que logra suprimir la EAE de manera más rápida y eficiente, debido a que impide que la severidad se incremente más allá del grado 2, que el resto de los tratamientos evaluados. El mecanismo de acción del IFN-β es complejo, involucra efectos a diferentes niveles de la función celular23. Los mecanismos de acción más relevantes incluyen la inhibición de citocinas proinflamatorias y la regulación de las citocinas Th2 por las células T de los pacientes tratados con IFN-β24. Sin embargo, ningún estudio había evaluado el efecto del IFN-β en el LCR. En nuestro estudio observamos que no existen diferencias estadísticamente significativas entre los grupos con respecto a la concentración de las citocinas IL-1β e IL-12p70, por lo que su concentración permanece estable al momento de la recolección del LCR. Esto no sucede en el caso del TNF-α, el cual se observa depletado o por debajo del límite de detección de la técnica metodológica. Lo anterior coincide con otros estudios en los cuales el IFN-β reduce la expresión de TNF-α en células T y macrófagos25,26; este efecto promovería la inhibición de su producción y por lo tanto su ausencia en la cuantificación en el LCR.
Por otro lado, en nuestro modelo, el AG, comparado con los otros tratamientos, no resultó tan eficaz ya que no disminuye la severidad de la enfermedad ni acelera el proceso de recuperación, pero sí logra una meseta por un periodo de 4 días en un grado elevado de severidad. En cuanto a la concentración de las citocinas en el LCR, se puede observar una tendencia a disminuir la IL-1β, IL-12p70 y el TNF-α en el grupo al que solo se le administró AG, lo que nos habla de la regulación del sistema inmune a pesar de no existir un proceso inflamatorio.
La MLT logra suprimir la EAE acortando el tiempo de la fase de recaída y promoviendo la fase de remisión en un menor tiempo, comparado con lo observado en el grupo de EAE. Sin embargo, durante el tiempo de evaluación, los animales sufrieron una segunda recaída. Al parecer la MLT promovió el proceso inflamatorio debido a que exhibe un papel dual, es decir, actúa de manera antiinflamatoria así como proinflamatoria dependiendo del contexto del microambiente celular; Franco y Markus describen este papel evaluando células cerebelares estimuladas con lipopolisacárido (LPS) y tratadas con MLT. Observaron que aquellas células estimuladas con LPS y tratadas con MLT resultan con un mayor grado de protección ante la citotoxicidad del LPS, mientras que en aquellas que no han sido estimuladas, pero sí tratadas con MLT, se promovía la muerte celular27. Otros grupos han descrito cómo actúa la MLT de manera antiinflamatoria; tal es el caso del ensayo publicado por Chen et al., en un modelo de EAE; se administran altas dosis de MLT, lo que promueve la inhibición de las células Th17 en el SNC, este efecto induce la reducción de la migración celular y la inhibición de la proliferación celular dentro del SNC28-30. Otros grupos de investigación han descrito diversos modelos y estirpes celulares en las que el efecto antiinflamatorio de MLT se presenta por la inhibición de la expresión y la activación de NFκB31, factor de transcripción involucrado en el desarrollo de la respuesta inmune y en procesos inflamatorios32. Por otra parte, se ha descrito que la MLT juega un papel proinflamatorio importante debido a la sobrerregulación de la expresión del MHC claseII33, además de que promueve la respuesta inmune tipo Th134,35. Se ha demostrado que el impacto negativo de la MLT exógena en la recuperación del modelo agudo de EAE se presenta por el incremento del IFN-γ en el suero y la activación de astrocitos e infiltración de células T al SNC36. Este comportamiento dual de la MLT ha sido denominado como «buffer del sistema inmune», actuando como un estimulante bajo condiciones basales o inmunosupresoras, o como un supresor antiinflamatorio en presencia de una respuesta inmune exacerbada como la inflamación aguda20. En este modelo de EAE fue posible observar que en un microambiente proinflamatorio ejerce un efecto benéfico, reduciendo la severidad de la EAE, mientras que en un ambiente controlado exhibe un efecto de tipo negativo, ya que promueve el proceso inflamatorio, exacerbando los síntomas de la EAE.
La inhibición de las citocinas proinflamatorias (TNF-α) por la MLT se debe a que suprime los mediadores inflamatorios por medio de la señalización de diferentes vías, tales como ERK/p38 MAPK, c/EBPb, NFκB y p30037. No fue posible observar diferencias significativas en la concentración de las citocinas IL-1β e IL-12p70 bajo ninguno de los tratamientos en este modelo debido a la matriz donde fueron medidas, ya que se ha reportado en otros modelos de EAE que la IL-1β se encuentra localizada en los infiltrados perivasculares de células MHC claseII, en los bordes de las lesiones desmielinizantes o en la microglía residente o macrófagos diferenciados, lo que sugiere que la expresión de IL-1β es inducida dentro del SNC38, mientras que la expresión de IL-12 ha sido identificada en secciones de tejido cerebral afectado por la EAE39. Por ello la concentración de las citocinas se mantiene constante en el LCR, sin la necesidad de realizar una estimulación desde sitios lejanos que aumente la concentración de estas en el LCR.
En conclusión, este modelo permite el estudio y la comparación de tratamientos alternativos para la EM. El IFN-β demuestra un mayor efecto inmunomodulador del proceso inflamatorio de la EAE. El AG no controla tan eficazmente la EAE, pero sí demuestra un efecto antiinflamatorio por medio de otros mecanismos no evaluados en este estudio. Se ha demostrado que la MLT presenta un efecto de tipo proinflamatorio así como antiinflamatorio, dependiendo del microambiente celular en el que se encuentre. Es necesario realizar estudios posteriores para evaluar los mecanismos moleculares involucrados en el comportamiento de la MLT en la EAE, así como la cuantificación de estas y otras citocinas en otras matrices biológicas para poder considerar la MLT como un agente antiinflamatorio eficaz en el tratamiento de la EM.
FinanciaciónEste trabajo fue financiado por el Fondo en Investigación en Salud del Instituto Mexicano del Seguro Social, con número de registro FIS/IMSS/PROT/G13/123.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.