La fatiga en la esclerosis múltiple (EM) se define como la falta de energía física y/o mental percibida por el individuo e interfiere en las actividades habituales. Es el síntoma más común en la EM, presente hasta en el 90% de las personas con EM. La fatiga junto con la discapacidad, la depresión, el deterioro cognitivo y el tratamiento modificador de la enfermedad (TME) condicionan la calidad de vida (CdV).
MétodoDiseñamos un estudio prospectivo observacional en pacientes con EM y con TME de moderada eficacia para valorar la asociación entre la fatiga y los aspectos epidemiológicos, clínicos y farmacológicos que influyen en la CdV. Analizamos variables relacionadas con los pacientes, la discapacidad, la fatiga (MFIS), la actividad clínica y radiológica, la depresión (BDI), el deterioro cognitivo (SDMT) y la CdV (EQ-5D).
ResultadosIncluimos 91 personas, el 65,9% mujeres, 43,9 años de edad media. Los TME han sido: ell 27,4% interferón-β, el 15,38% acetato de glatirámero, el 9,89% teriflunomida y el 47,25% dimetilfumarato. La mediana de la EDSS fue de 1,5 puntos. El 40,9% han presentado fatiga, el 36,3% deterioro cognitivo y el 30,7% de los pacientes depresión.
ConclusionesLos pacientes con fatiga tienen más edad, mayor discapacidad, mayor prevalencia de depresión y peor CdV. El tiempo de evolución, las recaídas, la carga lesional en RM y los TME no se asocian a la fatiga. La fatiga es un síntoma frecuente en pacientes con EM que influye en la CdV, de ahí la importancia de su diagnóstico y tratamiento.
Fatigue in multiple sclerosis (MS) is defined as the lack of physical and/or mental energy perceived by the individual that interferes with normal activities. It is the most common symptom in MS, present up to 90% of people with MS. Fatigue along with disability, depression, cognitive impairment, and disease-modifying therapy (DMT) affect quality of life (QoL).
MethodWe designed a prospective observational study in patients with MS and DMT of moderate efficacy to assess the association between fatigue and the epidemiological, clinical, and pharmacological aspects that influence in the QoL. We analyzed variables related to patients, disability, fatigue (MFIS), clinical and radiological activity, depression (BDI), cognitive impairment (SDMT), and QoL (EQ-5D).
ResultsWe included 91 people, 65.9% women, mean age 43.9 years. The DMT were: 27.4% interferon-β, 15.38% glatiramer acetate, 9.89% teriflunomide, and 47.25% dimethyl fumarate. The median of the EDSS was 1.5 points. 40.9% have presented fatigue, 36.3% cognitive deterioration and 30.7% of the patients depression.
ConclusionsPatients with fatigue are older, more disabled, have a higher prevalence of depression and worse QoL. Evolution time, relapses, MRI lesion load, and DMTs are not associated with fatigue. Fatigue is a frequent symptom in patients with MS that influences in the QoL, hence the importance of its diagnosis and treatment.
La esclerosis múltiple (EM) es una enfermedad crónica inflamatoria autoinmune del sistema nervioso central (SNC) que produce una desmielinización y una neurodegeneración axonal1. La etiología es desconocida, pero involucra una compleja interacción entre factores genéticos y ambientales2. La presentación y evolución más frecuente es la remitente-recidivante, apareciendo «recaídas» recurrentes que son expresión de la actividad inflamatoria de la enfermedad, a la que se va sumando la progresión de la discapacidad como consecuencia de la neurodegeneración axonal3. Existen múltiples tratamientos modificadores de la enfermedad (TME), actualmente clasificados en tratamientos de eficacia moderada y otros de alta eficacia, en base al perfil riesgo/beneficio demostrado en los ensayos clínicos pivotales4. Además, existen aspectos clínicos que determinan la calidad de vida (CdV) de las personas con EM y que suelen tener un tratamiento sintomático. La aparición de síntomas como la fatiga, la depresión, la espasticidad y el deterioro cognitivo son una constante y todo un reto a la hora de tratar a nuestros pacientes en la consulta.
Entre los fármacos empleados para tratar las formas de inicio con una actividad leve/moderada tenemos los TME inyectables (interferón beta, acetato de glatirámero), que fueron los primeros disponibles para tratar la EM y, por tanto, se dispone de una amplia experiencia clínica en su efectividad y seguridad. Otros TME orales (teriflunomida, dimetilfumarato) de moderada eficacia, son de aparición posterior, pero no tienen los efectos propios de la administración parenteral y la ausencia del síndrome seudogripal, tan prevalente en pacientes tratados con interferones beta. En un estudio de cohortes con un seguimiento de 18 años, la mediana hasta la discontinuación del primer TME inyectable fue de 8,6 años, siendo la razón principal la falta de eficacia (real o percibida) y los efectos secundarios como síntomas seudogripales, depresión, fatiga y reacción en el sitio de punción5.
La fatiga en la EM se define como la falta de energía física y/o mental percibida por el individuo que interfiere en las actividades habituales6. Es el síntoma más común de la enfermedad, afectando hasta en un 80-90% de los pacientes en cualquier momento de su evolución7,8. Dada la diversidad de los síntomas asociados a la fatiga y su complejidad a la hora de determinar el mecanismo fisiopatológico, se distingue entre: la «fatiga primaria», la que es atribuible directamente a la EM por la disregulación inmunológica con la aparición de desmielinización, pérdida axonal o alteración neuroendocrina9, y la «fatiga secundaria»: causada indirectamente por las consecuencias de la EM incluyendo trastornos del sueño, depresión, apatía, discapacidad y por los propios TME10. Existen 2 componentes relacionados con la fatiga en las personas con EM, la física y la cognitiva. La física se caracteriza por una disminución del rendimiento motor durante la actividad muscular sostenida. La fatiga cognitiva definida como una disminución en el rendimiento durante la actividad cognitiva con la falta de concentración, pérdida de memoria, inestabilidad emocional, estando presente de forma precoz en la EM con independencia de la discapacidad física11.
La fatiga en las personas con EM, es más grave e incapacitante con respecto a las personas sanas y otras enfermedades crónicas12. Aproximadamente tercios de las personas con EM describen la fatiga como su síntoma más incapacitante13. Aún con una alta prevalencia y el potencial impacto de la fatiga en la EM, la etiología es poco conocida y las opciones terapéuticas son limitadas14. Aunque no siempre con el beneficio esperado, podemos prescribir algunos fármacos en pacientes con EM y fatiga: la amantadina, el modafinilo, los estimulantes anfetamina-like (metilfenidato) o los ISRS, además de técnicas cognitivo/conductuales (relajación, ejercicio físico, entrenamiento de resistencia, mindfuldness, yoga, taichí). que pueden mejorar la fatiga15.
La depresión es frecuente en las personas con EM, diagnosticándose aproximadamente en el 50% de los casos de EM16, y es uno de los principales determinantes de la CdV en estas personas17. La depresión mayor es hasta el doble de frecuente en las personas con EM, con una hazard ratio (HR), ajustada a edad y sexo de 2,3, sin existir diferencias entre varones y mujeres, pero siendo más frecuentes en adultos jóvenes con menos de 45 años18. La depresión se asocia con frecuencia a la fatiga, incluso algunos autores postulan que el inicio de fatiga y ansiedad puede ser un marcador de riesgo para padecer depresión19. La fatiga en las personas con EM se asocia a la presencia de depresión, además de otras variables como la angustia emocional, la discapacidad20, el deterioro cognitivo21 y otras comorbilidades como trastornos del sueño, dolor, espasticidad, nicturia o síndrome de piernas inquietas.
Entre los determinantes de CdV en las personas con EM, se concluye que la depresión, la fatiga y el grado de discapacidad medido con la escala ampliada del estado de discapacidad (EDSS) son predictores independientes de la CdV. La presencia de fatiga determina una peor CdV22,23, con repercusión no solo en las actividades sociales o familiares, también en la actividad laboral24.
Algunos autores sugieren que el tratamiento con TME mejora la fatiga al reducir la respuesta inflamatoria, por lo que se podría relacionar la fatiga y la depresión con factores inmunológicos. Los efectos del TME en las personas con EM y depresión no aportan datos concluyentes. Se han obtenido un efecto beneficioso de los TME en la reducción de la fatiga25,26, mientras que otros indican que determinados TME aumentan la fatiga y el riesgo de depresión27,28.
Es necesario realizar cuestionarios como los patient-reported outcomes (PROs) o escalas de valoración clínica, para ver cómo se encuentran nuestros pacientes con EM, y poder establecer una estrategia terapéutica específica. Los TME pueden influir en aspectos relacionados no solo con las recaídas (brotes), la progresión de la discapacidad (EDSS), sino también en otras variables que determinan en gran medida la CdV. Además, existen aspectos que pueden pasar desapercibidos en la consulta si no se preguntan por ellos específicamente, refiriéndonos concretamente a: fatiga, depresión, deterioro cognitivo y CdV.
El objetivo de este trabajo es determinar la prevalencia de la fatiga en pacientes con EMRR, y su relación con aspectos dependientes del paciente, de aspectos clínicos y farmacológicos que influyen en la CdV, además de buscar diferencias en estas variables según el TME recibido.
Material y métodosEstudio prospectivo observacional abierto no aleatorizado, realizado en la unidad de enfermedades desmielinizantes del servicio de neurología. Se incluyeron pacientes con EM que acudían a revisiones programadas en la consulta, que cumpliendo los criterios de selección y aceptando participar. Fueron reclutados consecutivamente durante el año 2021. Los criterios de inclusión son personas de 18 a 60 años de edad, diagnosticados de esclerosis múltiple remitente-recurrente (EMRR) que recibían TME de moderada eficacia, del grupo inyectable: interferón β-1a (INF), acetato de glatirámero (AG), u orales: dimetilfumarato (DMF) o teriflunomida (Teri) al menos durante 6 meses, de acuerdo con la práctica clínica e indicados según ficha técnica. No se recogieron datos de pacientes tratados con fármacos de alta eficacia, para tener una muestra más homogénea y evitar sesgos con los fármacos de alta eficacia, que se aplican a formas clínicas más activas, más evolucionadas y con mayor EDSS. Se excluyeron pacientes con procesos concurrentes (anemia, hipotiroidismo no controlado) o que tomasen fármacos que pudieran ser causa secundaria de fatiga.
Se recogieron variables demográficas: edad, sexo, antecedentes familiares de EM, nivel de escolarización, tabaquismo, variables de evolución de la EM (edad de inicio, tiempo evolución, localización primer brote), variables relacionadas con la actividad de la enfermedad: la tasa anualizada de brotes (TAB), la discapacidad (EDSS), la destreza manual el Nine-Hole Peg test (9-HPT)29, la velocidad de la marcha con el test de los 25 foot walked test (25FWT)30. Otros datos recogidos estaban relacionados con la neuroimagen, de la última RM realizada (número de lesiones Gd+ y de lesiones en T2), el TME actual y los niveles de vitamina D.
Se realizó el cuestionario MFIS, una versión abreviada con 21 items para evaluar la fatiga según la percepción de los pacientes en las últimas 4 semanas, en su componente físico (9 ítems), cognitivo (10 ítems) y psicosocial (2 ítems). Cada ítem se puntúa de 0 (nunca) a 4 (casi siempre) para obtener una puntuación global de 84. Puntuaciones del componente físico (0 a 36), cognitivo de 0 a 40 y piscosocial de 0 a 8. A mayor puntuación indica mayor impacto de la fatiga en los pacientes con EM15. El punto de corte de 38 puntos, clasifica a los pacientes con fatiga y sin fatiga31. El inventario de depresión de Beck (BDI) para clasificar a los pacientes con síndrome depresivo y su grado32. El Symbol Modality Digit Test (SDMT)33 para valorar deterioro cognitivo y el EuroQoL-5D y EQ-VAS para medir la CdV. Se evaluó mediante el EQ-5D, que consta de 5 dominios: movilidad, autocuidado, actividades habituales, dolor/malestar y ansiedad/depresión que genera un estado de salud índice. El EuroQoL-5D, también recoge el estado de salud auto informado (EQ-5Dstatus) utilizando una escala analógica visual que oscila entre 0 (peor estado de salud imaginado) y 100 (estado de salud más alto)34.
Análisis estadísticoTodos los datos fueron analizados usando el programa de software (IBM SPSS® para Windows, versión 28.0.1.0; IBM Corp, Armonk, Nueva York, EE. UU.). El análisis de los datos descriptivos se realizó para variables numéricas con medias y desviaciones típicas o con porcentajes para variables categóricas. Se consideró estadísticamente significativo una p<0,05. Las comparaciones entre variables numéricos en los grupos con fatiga y sin fatiga se emplearon test no paramétrico de Mann-Whitney y para variables cualitativas el test de χ2 o el exacto de Fisher. Las variables que fueron significativamente diferentes entre los grupos se consideraron posibles factores de confusión, por lo que se realizó una regresión logística para cuantificar los efectos sobre otras variables y la fatiga.
ResultadosSe incluyeron 91 pacientes con EMRR definidos por criterios de McDonald 2017 que seguían revisiones programadas en el año 2021 y que estaban en tratamiento con TME considerados de moderada eficacia en el momento de la inclusión. De los 91 participantes 60 fueron mujeres (65,9%) y 31 varones (34,1%). La edad media al momento de inclusión en el estudio fue de 43,9±11,1 años. Un 10,9% presentaban antecedentes familiares de EM. Un 34% eran fumadores activos. La distribución del nivel de estudios fue de 19 (20,9%) primarios, 29 (31,9%) secundarios, 4 (4,3%) bachiller y 39 (42,9%) universitarios. Con respecto a las características clínicas, la edad media de inicio de la enfermedad fue de 32,23±10,4 años y el tiempo medio de evolución de 140 meses. El síndrome topográfico inicial más frecuente fue medular en el 30,7% de los casos, seguida de la neuritis óptica en un 24,2%. La media de TME previos fue 0,4889±0,74. La distribución de los TME fue de 25 (27,4%) tratados con interferón b, 14 (15,38%) con acetato de glatirámero, 9 (9,89%) con teriflunomida y 43 (47,25%) con dimetilfumarato.
Con respecto a los datos clínicos de discapacidad la mediana de la EDSS fue de: 1,5 (rango de 0 a 6). El número de brotes medio en los 6 meses previos a la inclusión fue de 0,04±0,2 y en los 2 últimos años fue 0,33±0,5. La carga lesional en T2 se distribuyó con menos de 9 lesiones en un 17,08% de los pacientes, entre 9 y 20 lesiones fueron un 41,46% y con más de 20 lesiones también un 41,46% de los pacientes. El número de lesiones que realzan gadolinio fue de 0,13±0,5.
Para los distintos test realizados, un 40,9% de los pacientes presentaban fatiga de acuerdo con las puntuaciones de la escala MFIS siendo la puntuación media de 15,42±9,8 en el componente de esfuerzo físico, un 15,04±10,27 en el componente cognitivo y un 3,21±2,54 en el componente psicosocial. La media obtenida en el SDMT fue de 43,13±13,30 respuestas correctas. Según estos resultados el 36,26% presentaban deterioro cognitivo. Para valorar la presencia de depresión se administró el BDI, con una puntuación media de 10,67±8,7. Un 30,7% presentaban algún grado de depresión, fundamentalmente depresión leve. Finalmente se llevó a cabo la valoración de la CdV mediante el EuroQoL-5D, obteniendo una puntuación media de 1,72±1,52 (0 máxima CdV y 5 la peor CdV). La evaluación de las distintas dimensiones mostró que no había problemas en; movilidad en un 70% de los pacientes, en autocuidado en un 93,33%, en actividades cotidianas en un 65,56% y en ansiedad y/o depresión en un 56,67% de los pacientes. La puntuación media obtenida en la escala visual analógica de CdV (0 a 100) fue de 70,57±21,42 puntos.
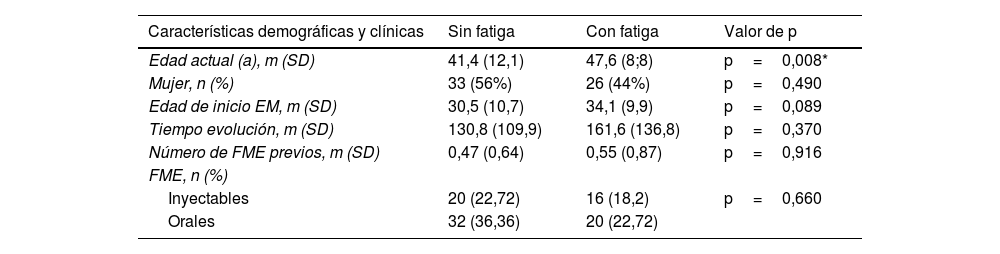
Para determinar los factores demográficos y clínicos que pueden asociarse a la fatiga, clasificamos a los pacientes en 2 grupos: con fatiga y sin fatiga, definidos por la puntuación en la escala MFIS. Analizamos las variables demográficas y clínicas en ambos grupos para ver si existían diferencias (tabla 1). No hay diferencias entre el grado de escolaridad (p=0,49), el hábito tabáquico (p=0,11) y los antecedentes familiares de EM (p=0,24) con la presencia de fatiga. La localización del primer brote (medular, neuritis óptica, sensitivo, troncoencéfalo) tampoco se relacionó con la presencia de fatiga (p=0,366).
Variables demografías y clínicas de los pacientes incluidos sin fatiga y con fatiga
| Características demográficas y clínicas | Sin fatiga | Con fatiga | Valor de p |
|---|---|---|---|
| Edad actual (a), m (SD) | 41,4 (12,1) | 47,6 (8;8) | p=0,008* |
| Mujer, n (%) | 33 (56%) | 26 (44%) | p=0,490 |
| Edad de inicio EM, m (SD) | 30,5 (10,7) | 34,1 (9,9) | p=0,089 |
| Tiempo evolución, m (SD) | 130,8 (109,9) | 161,6 (136,8) | p=0,370 |
| Número de FME previos, m (SD) | 0,47 (0,64) | 0,55 (0,87) | p=0,916 |
| FME, n (%) | |||
| Inyectables | 20 (22,72) | 16 (18,2) | p=0,660 |
| Orales | 32 (36,36) | 20 (22,72) |
EM: esclerosis múltiple; FME: fármacos modificadores de la enfermedad; SD: standard deviation.
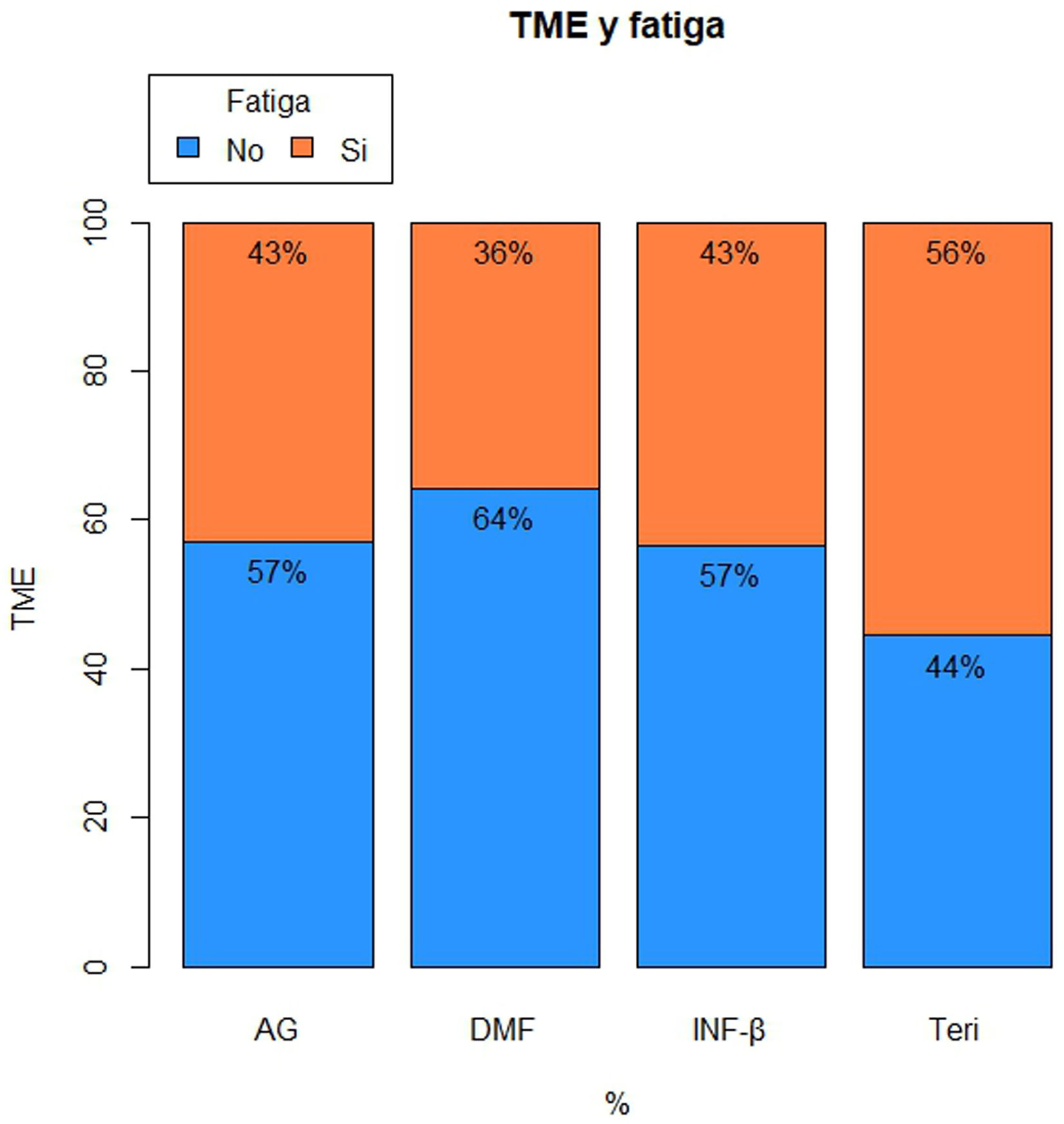
Se analizó los niveles de vitamina D en los pacientes sin fatiga con una media 25,66 vs. 22,50ng/ml en el grupo con fatiga, sin encontrar diferencias significativas p=0,319. Tampoco se obtuvieron diferencias estadísticamente significativas entre la fatiga y el empleo de los distintos TME p=0,7167 (fig. 1).
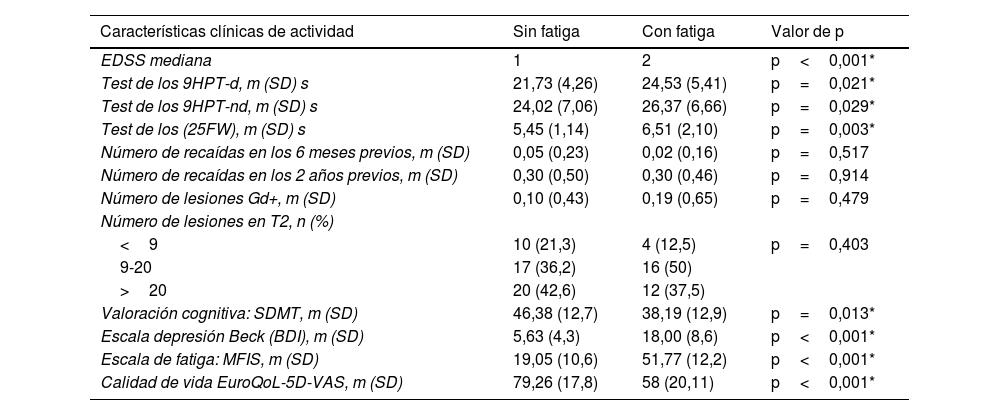
En la tabla 2 se recogen las características clínicas en relación con la discapacidad medida por EDSS, el test de los 9 HPT y de los 25FWT y las características radiológicas. En el grupo sin fatiga la prevalencia del deterioro cognitivo es menor 26 vs. 73% (p=0,0418). Los pacientes con fatiga presentan mayores puntuaciones en la escala de depresión. La depresión en el grupo sin fatiga es del 3,8 vs. un 69,4% (p<0,00001) de prevalencia en el grupo con fatiga. El grado de depresión en el grupo con fatiga es del 13,9% depresión grave, el 19,4% depresión moderada, el 36,1% depresión leve y 30,6% sin depresión. Los fármacos empleados para tratar la fatiga en nuestra serie han sido amantadina/modafinilo en 11 (12%) pacientes e ISRS en 9 (9,8%) pacientes.
Actividad clínica, discapacidad, cognición, estado anímico, fatiga, calidad de vida y características radiológicas en personas con EM con y sin fatiga
| Características clínicas de actividad | Sin fatiga | Con fatiga | Valor de p |
|---|---|---|---|
| EDSS mediana | 1 | 2 | p<0,001* |
| Test de los 9HPT-d, m (SD) s | 21,73 (4,26) | 24,53 (5,41) | p=0,021* |
| Test de los 9HPT-nd, m (SD) s | 24,02 (7,06) | 26,37 (6,66) | p=0,029* |
| Test de los (25FW), m (SD) s | 5,45 (1,14) | 6,51 (2,10) | p=0,003* |
| Número de recaídas en los 6 meses previos, m (SD) | 0,05 (0,23) | 0,02 (0,16) | p=0,517 |
| Número de recaídas en los 2 años previos, m (SD) | 0,30 (0,50) | 0,30 (0,46) | p=0,914 |
| Número de lesiones Gd+, m (SD) | 0,10 (0,43) | 0,19 (0,65) | p=0,479 |
| Número de lesiones en T2, n (%) | |||
| <9 | 10 (21,3) | 4 (12,5) | p=0,403 |
| 9-20 | 17 (36,2) | 16 (50) | |
| >20 | 20 (42,6) | 12 (37,5) | |
| Valoración cognitiva: SDMT, m (SD) | 46,38 (12,7) | 38,19 (12,9) | p=0,013* |
| Escala depresión Beck (BDI), m (SD) | 5,63 (4,3) | 18,00 (8,6) | p<0,001* |
| Escala de fatiga: MFIS, m (SD) | 19,05 (10,6) | 51,77 (12,2) | p<0,001* |
| Calidad de vida EuroQoL-5D-VAS, m (SD) | 79,26 (17,8) | 58 (20,11) | p<0,001* |
EDSS: escala ampliada del estado de discapacidad; MFIS: escala modificada de impacto de fatiga; s: segundos; SD: standard deviation; SDMT: symbol modality digit test; VAS: escala visual analógica.
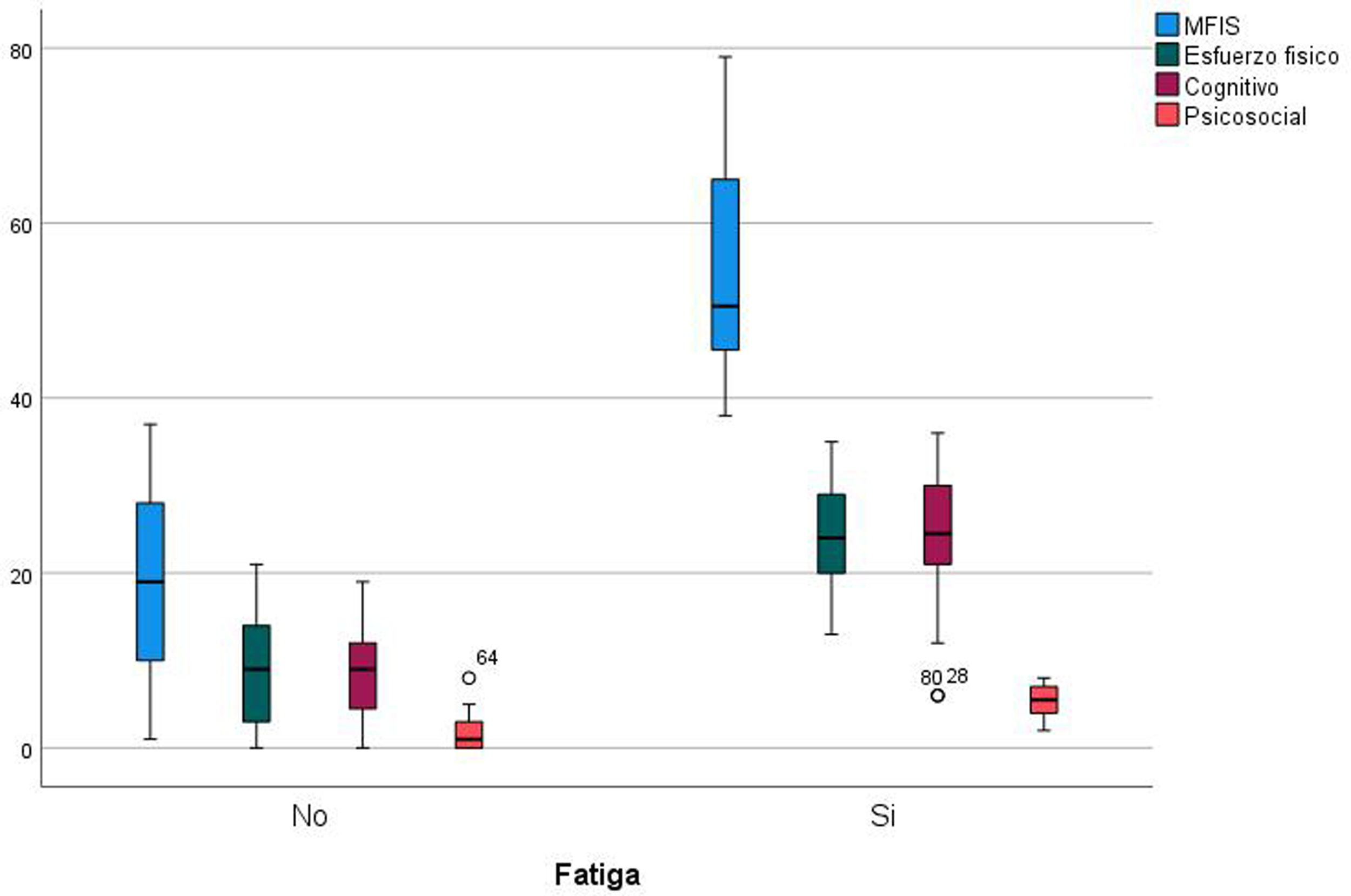
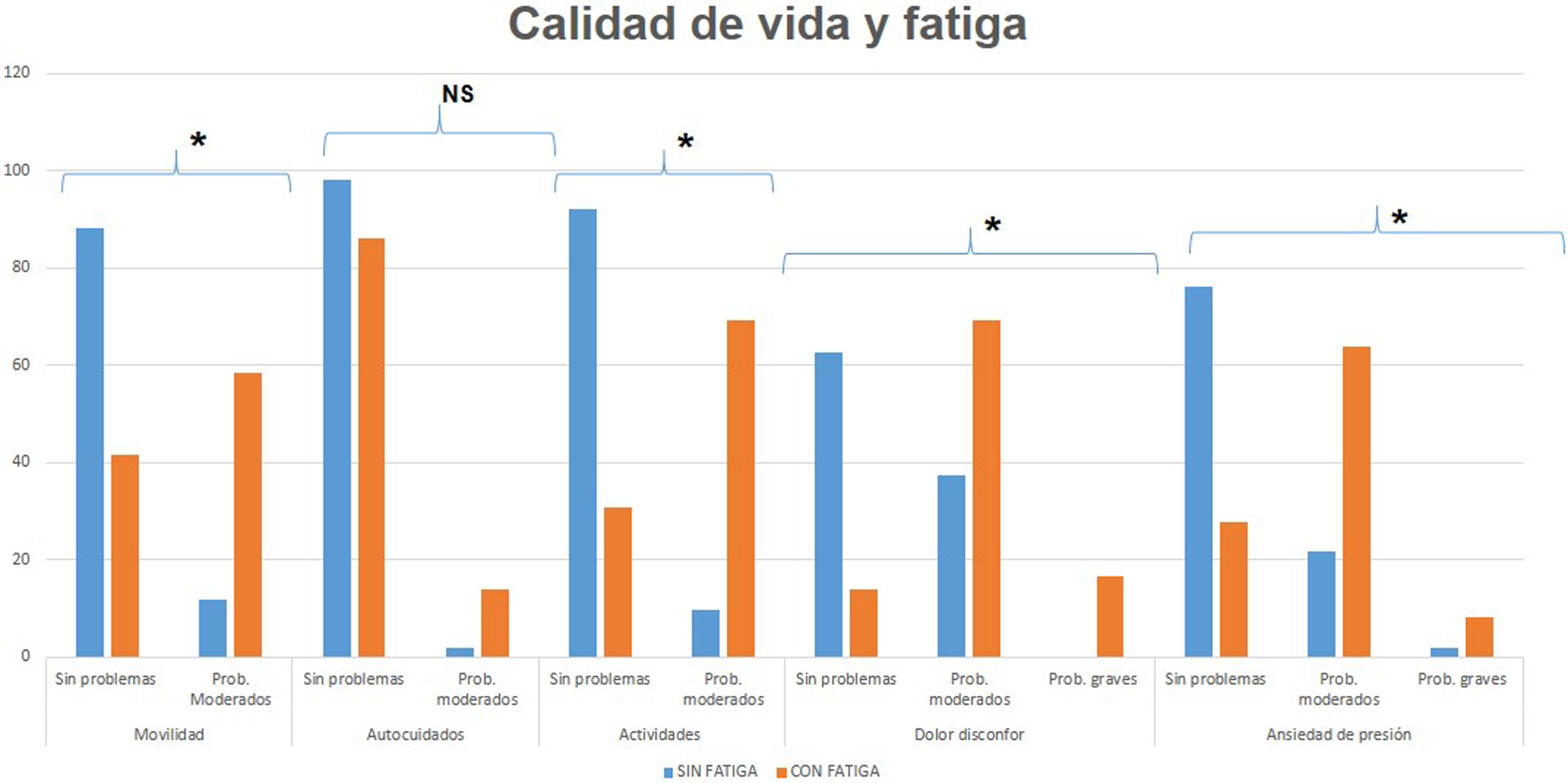
En la figura 2 se comparan las medias de las puntuaciones obtenidas en MFIS*, y sus dominios: esfuerzo físico*, cognitivo* y psicosocial*, existiendo diferencias estadísticamente significativas entre el grupo con fatiga y el grupo sin fatiga *p<0,001. La CdV EuroQoL-5D es menor en el grupo con fatiga con puntuaciones más altas. Existen diferencias en los componentes de movilidad, actividades diarias, dolor malestar, ansiedad y depresión, no así en el dominio de autocuidado (fig. 3).
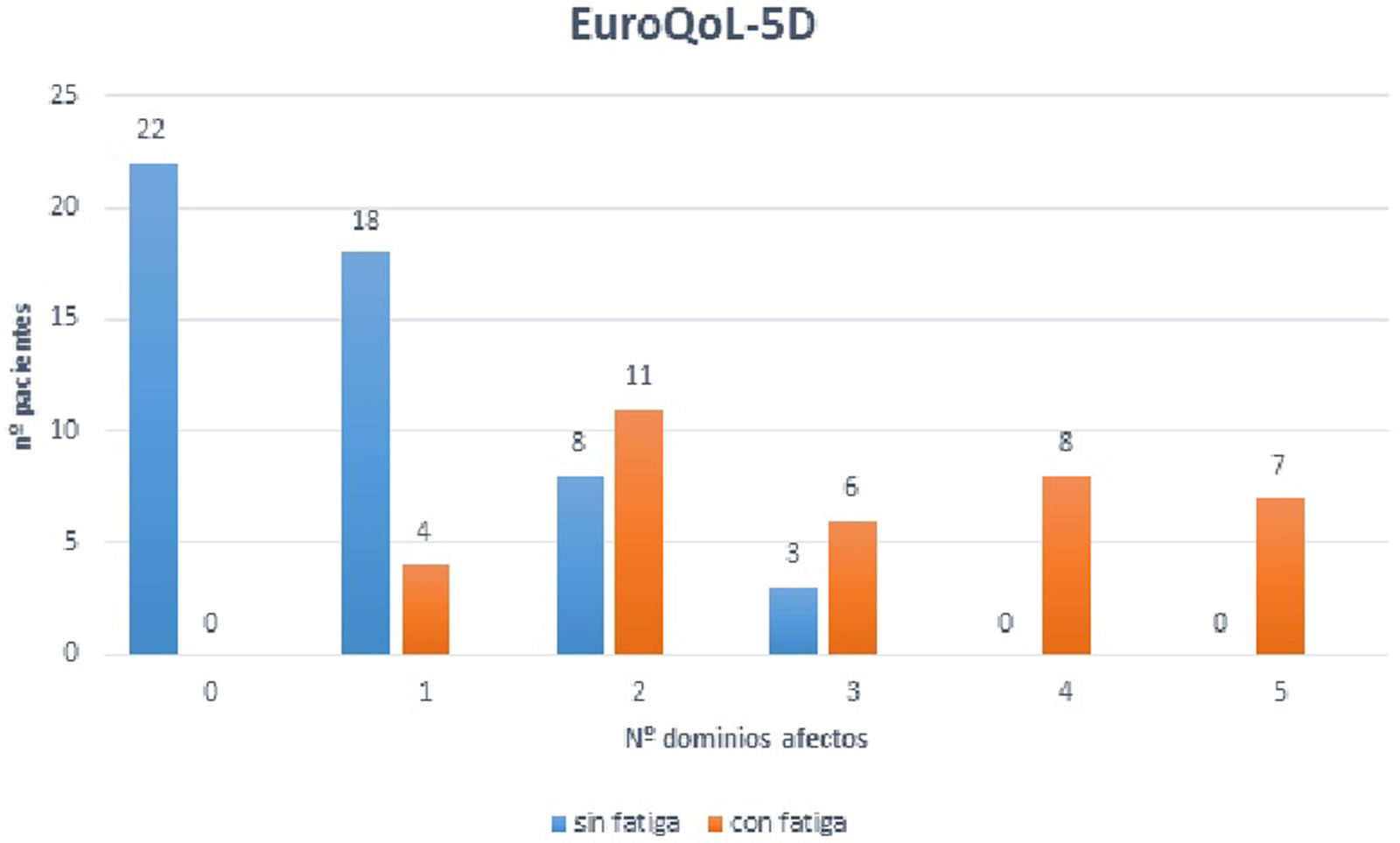
En pacientes con fatiga de un 80% tienen 2 o más dominios de la CdV del EuroQol-5D con problemas moderados o graves. En la figura 4 vemos la distribución del número de dominios afectados en la CdV en ambos grupos. Se obtienen menores puntuaciones en la escala visual analógica de CdV en el grupo con fatiga (58±20,1) vs. sin fatiga (79,2±17,8) p<0,001.
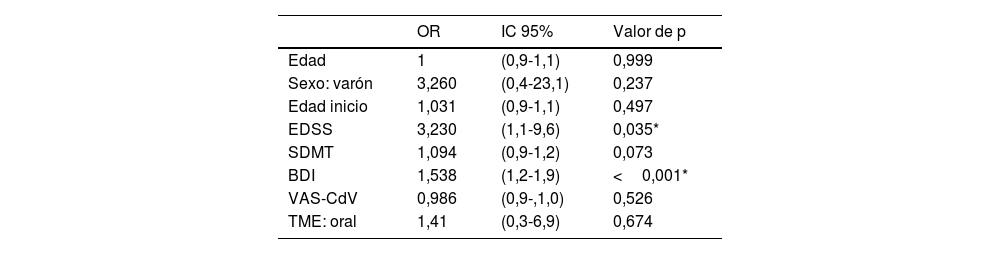
Se realizó análisis mediante regresión logística de las distintas variables que podrían influir en la en la presencia de la fatiga en las personas con EM, ajustando este modelo por edad y sexo, solo la EDSS (OR: 3,2) y la depresión medida por BDI (OR: 1,5) son factores de riesgo independientes para padecer fatiga35 (tabla 3).
Análisis de regresión logística ajustada a la edad y el sexo en la fatiga
| OR | IC 95% | Valor de p | |
|---|---|---|---|
| Edad | 1 | (0,9-1,1) | 0,999 |
| Sexo: varón | 3,260 | (0,4-23,1) | 0,237 |
| Edad inicio | 1,031 | (0,9-1,1) | 0,497 |
| EDSS | 3,230 | (1,1-9,6) | 0,035* |
| SDMT | 1,094 | (0,9-1,2) | 0,073 |
| BDI | 1,538 | (1,2-1,9) | <0,001* |
| VAS-CdV | 0,986 | (0,9-,1,0) | 0,526 |
| TME: oral | 1,41 | (0,3-6,9) | 0,674 |
BDI: inventario de depresión de Beck; EDSS: escala ampliada del estado de discapacidad; IC 95%: intervalo de confianza del 95%; OR: odds ratio; SDMT: symbol modality digit test; TME: tratamiento modificador de la enfermedad; VAS: escala visual analógica
La fatiga es uno de los síntomas más frecuentes en las personas con EM, con gran repercusión en su CdV. La prevalencia de la EM es mayor en mujeres, en nuestra serie suponen un 65,9% de las personas, similar a otros datos publicados36. La edad se ha propuesto como un factor de riesgo relacionado con la fatiga en estos pacientes37. La edad media de nuestra serie es de 47 años en el grupo con fatiga, sin diferir en el tiempo de evolución ni en la edad de inicio de la enfermedad entre ambos grupos. No hay consenso respecto a la presencia de fatiga en los pacientes con EM según la edad o el sexo en las distintas series9. En nuestros pacientes con EMRR, la fatiga no se relacionó con el nivel de estudios, pero otros autores encuentran mayor fatiga en aquellos individuos con una menor escolaridad, fundamentalmente en aquellos con mayor edad y en formas progresivas, no así en las formas recurrentes38. No se observó relación entre el hábito tabáquico con un mayor grado de fatiga, pero otros sí encuentran asociación entre el estilo de vida (tabaquismo, ingesta de alcohol y sedentarismo) con la fatiga, fundamentalmente entre esta y la actividad física en la escala psicosocial del MFIS39. No obtuvimos diferencia en los niveles de vitamina D independientemente del grado de fatiga, aunque si hay descrita esta asociación40.
La fatiga está presente entre el 35-97% de las personas con EM según las distintas publicaciones15,36,37. Aproximadamente el 40% de nuestros pacientes con EM presentan fatiga. La mayor prevalencia descrita por otros autores puede justificarse por una mayor edad media (54 vs. 44 años), un mayor tiempo de evolución (13 vs. 11 años) y, sobre todo, por una mayor EDSS (5 vs. 1,5 puntos). Téllez et al., con un 55% de los pacientes con fatiga medida por MFIS, encontró también con una prevalencia por encima de nuestra casuística, en parte porque se incluían un grupo de pacientes con formas progresivas de la enfermedad (EMSP), que lógicamente presentaban mayor edad y mayor tiempo de evolución41. Según los datos aportados en nuestro trabajo, la edad de inicio de la enfermedad y el tiempo de evolución, al igual que otros autores han descrito, no influyen en la aparición de la fatiga37. Tras analizar los 3 dominios que componen la escala MFIS, obtenemos resultados similares a los previos. La fatiga en la EM se manifiesta con una alteración en el dominio de resultado físico42,43, en el de resultado psicosocial44 y en el dominio cognitivo del MFIS45, lo que resalta el impacto multifactorial y debilitante de la fatiga en los pacientes con EM.
No hay muchas referencias publicadas que valoren la fatiga y su asociación con problemas en la movilidad, la depresión o la CdV. La discapacidad medida por la EDSS en nuestra serie aumenta con la edad. Los pacientes con fatiga presentan una EDSS mediana de 2 frente a EDSS de 1 en el grupo sin fatiga. Aunque no siempre se replican estos datos, pensamos que podría deberse a una EDSS más elevada en ambos grupos36. Parece un hecho frecuente que la fatiga se relaciona con una mayor discapacidad, no obstante, al controlar variables como la edad, la duración de la enfermedad u otros aspectos clínicos como la depresión, la correlación es más débil46,47. En el trabajo de Rooney et al. la presencia de la fatiga fue del 64%, que se relacionó con la CdV, la depresión, la cognición y la calidad del sueño, tanto en formas progresivas como no progresivas de la EM. En el grupo de EM no progresiva la gravedad de la fatiga se asoció con la discapacidad37. Los datos aportados en nuestro trabajo demuestran, no solo que los pacientes con fatiga tienen una mayor EDSS, sino también más discapacidad demostrada a la hora de realizar el test de los 9-HPT y el de los 25FWT. La presencia de actividad clínica (brotes en los últimos 6 meses o 2 años) o la actividad radiológica (lesiones Gd+) no se relaciona con la aparición de fatiga en nuestro trabajo. Además, la carga lesional en T2 no es diferente según tengan o no fatiga.
Es controvertido por los datos de la literatura consultada el efecto del INF y AG sobre la fatiga48. La influencia de los TME en la fatiga ha sido ampliamente valorada y no siempre con resultados concordantes. Putzki et al. estudiaron 320 pacientes, mostrando una prevalencia de fatiga del 50%. En el análisis de sus datos y teniendo presente el subtipo de EM, la duración de la enfermedad y la discapacidad, no se relacionó la aparición de la fatiga con tratar o no al paciente. El control de la actividad clínica de la enfermedad y la inflamación no parece tener un efecto significativo en la fatiga49.
Los resultados informados por los pacientes, Patient Reported Outcomes (PRO), cada vez se emplean más en la práctica clínica habitual, ya que permiten tener mejor conocimiento de los «síntomas invisibles» y personalizar el tratamiento según las necesidades de cada paciente. Un estudio con TME de moderada eficacia (INF, AG, DMF y Teri) demuestra que DMF y Teri (TME orales) tienen mejor grado de satisfacción al tratamiento medido mediante el treatment satisfaction questionnaire for medication (TSQM), aunque los efectos secundarios eran mayores. Los pacientes con Teri, tenían una peor CdV y mayor fatiga, pero presentaban mayor edad, discapacidad y depresión, con lo que estos resultados se deben evaluar con cautela50. Con DMF se han registrado mejores puntuaciones en la escala de CdV con respecto a pacientes sin tratamiento, y presentan mejores resultados en los test de fatiga y depresión25. Los TME no han demostrado persé que mejoren la fatiga en los pacientes con EM. Téllez et al.38 no encuentran diferencias entre los pacientes tratados o no con INF-b y la presencia de fatiga o depresión. La depresión puede aparecer o empeorar con el uso de interferones51. En nuestra serie la depresión aparece en el 30,7% de los pacientes y no se asocia específicamente con ningún TME. Este porcentaje es menor al 68% descrito en la literatura41 o del 50% en una reciente revisión15. Los pacientes con fatiga presentan mayores puntuaciones en BDI (18 vs. 5,63 puntos), datos similares a los aportados en otras investigaciones36,37.
No todos los estudios comparten la influencia de la depresión en la aparición de la fatiga52, pero cada vez más se piensa en favor de dicha asociación53,54. La depresión ha sido identificada como contribuyente a la fatiga y viceversa. Bakshi et al., determinaron que la fatiga relacionada con la EM se asocia a la depresión incluso después de controlar la variable discapacidad, apoyando la idea de que la depresión y la fatiga comparten mecanismos neuronales patogénicos46. Sin embargo, otros no hallaron correlaciones entre ambos, creemos que por limitaciones en la inclusión de pacientes con EDSS baja y una forma menos sensible de medir la fatiga55.
El deterioro en el procesamiento cognitivo es clínicamente relevante y sucede desde fases precoces de la EM. Empleamos el SDMT, que evalúa la concentración del paciente, la atención y la velocidad de procesamiento, para medir el deterioro cognitivo56. Los resultados en el SDMT indican un retraso en el procesamiento cognitivo en el 36,3% de nuestros pacientes, algo menor del 40% publicada en otras series. Otro aspecto importante a destacar de nuestro artículo es la menor puntuación en la escala cognitiva SDMT en los pacientes con fatiga (38 vs. 46), concordante otros autores57. Esto supone un porcentaje elevado de personas con EM que precisa un adecuado seguimiento clínico por la repercusión social, laboral y familiar58.
La fatiga es un factor predictor en la CdV de las personas con EM. Encontramos en nuestros pacientes con fatiga puntuaciones más bajas en la CdV medida por la EuroQol-5D, en todos los dominios excepto en el de autocuidado, así como una menor puntuación en la escala visual de CdV (79 puntos en pacientes sin fatiga vs. 58 puntos en el grupo con fatiga). Estudios previos confirman que la fatiga se asoció de forma independiente con la CdV23,36,59. Amato et al., postulan que la fatiga es un predictor independiente de la CdV, con puntuaciones más bajas medidas por el MSQOL-54 cuanto mayor es la fatiga22. Tal es la repercusión de la fatiga que es la causa más frecuente de desempleo en pacientes con EM60. La fatiga es claramente dominante en el modelo final que explica la varianza de la CdV. Por tanto, para promover una mejora en este aspecto se debe incluir a la fatiga como una de las dianas terapéuticas. Este acercamiento no es solo farmacológico, sino que también necesita la colaboración de otros profesionales (enfermería, rehabilitación, logopedia, terapia ocupacional y psicología), respaldando la creación de equipos multidisciplinares59.
Debemos reconocer algunas limitaciones: se trata de un estudio observacional transversal abierto no controlado, por lo que no es posible establecer causalidad, al no poder determinar la relación temporal entre las variables. Tampoco podemos evaluar el efecto de los fármacos para el tratamiento de la fatiga, y si el cambio de TME modifica los resultados. Todos los individuos incluidos son pacientes con EMRR, por lo que no podemos extrapolar los datos a las formas progresivas de la enfermedad. El deterioro cognitivo no ha sido valorado por baterías neuropsicológicas que definan mejor el perfil cognitivo, fueron evaluados por el SDMT ampliamente validado y aceptado para la valoración cognitiva en EM. Aunque nuestra muestra haya sido de 91 pacientes se han obtenidos datos relevantes para un mejor conocimiento de la fatiga en la EMRR.
ConclusionesLa fatiga es un síntoma multidimensional en el que diferentes aspectos pueden influir en su aparición. El estudio de la fatiga debe tenerse en cuenta cuando valoramos a nuestros pacientes con EM. Los resultados obtenidos muestran que la fatiga es un síntoma frecuente en pacientes con EMRR y se relaciona con la discapacidad, la depresión y el deterioro cognitivo, siendo independiente del TME. Su aparición repercute en otros aspectos como son: el estado anímico, la cognición y la CdV. Por tanto, debemos abordarlos de manera integral y con los diferentes escenarios terapéuticos posibles. La detección temprana de la fatiga y su tratamiento pueden mejorar la CdV de las personas con EM.
Consideraciones éticasTodos los participantes han cumplimentado el consentimiento informado por escrito para participar en este proyecto. La participación en el mismo ha sido voluntaria. Todos los registros han sido codificados garantizando el cumplimiento de la Ley Orgánica de Protección de Datos de Carácter Personal (Ley 15/1999). Los datos fueron recogidos por los responsables de la unidad durante las revisiones programadas según práctica clínica habitual. El proyecto fue aprobado por el Comité de Ética de la Investigación Biomédica del hospital.
El Comité Ético de Investigación (CEI) Provincial de Granada de la Red de Comités de Ética del SSPA aprobó la investigación. Este Comité ha ponderado y evaluado en sesión celebrada el 29/06/2020 y recogido en acta 6/2020 la propuesta del/de la promotor/a (no hay promotor/a asociado/a) para realizar el estudio de investigación titulado: DMF-ver-1.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Los resultados presentados en este artículo forman parte del proyecto de tesis doctoral de R.P.M., de la Universidad de Granada.