Más de 100 millones de personas han sido infectadas en el mundo por el virus SARS-CoV-2, responsable de una enfermedad aguda denominada COVID-19. Múltiples estudios han mostrado cómo diversos síntomas en estos enfermos pueden persistir durante varios meses tras la resolución del proceso agudo, denominándose síndrome post-COVID. La clínica neurológica es variada, pero con presentación constante de fatiga.
ObjetivoAnalizar la fatiga post-COVID.
MétodosPresentamos un estudio unicéntrico, prospectivo, de casos y controles comparando pacientes con fatiga en el contexto de un síndrome post-COVID con pacientes que hayan pasado la COVID-19 sin fatiga post-COVID. Se realizó un registro basal (abril 2021) y a los 6meses. Se registran variables clínicas, cuestionarios de fatiga, problemas de sueño, depresión, ansiedad, afectación cognitiva y calidad de vida. Se recogen analíticas básicas de las dos visitas. Además, se realiza un subestudio de citoquinas inflamatorias (IL-6, IL-1β, TNF-α) y antiinflamatorias (IL-10).
ResultadosLa fatiga de los pacientes medida por Chadler es de intensidad moderada y mixta (física y psicológica). A los 6meses mejora la fatiga física, pero no la psicológica. Se encuentran diferencias significativas en mejoría de la somnolencia, la ansiedad, el deterioro cognitivo y la calidad de vida. Se evidencian alteraciones significativas en cuanto a los valores de TNF-α, no en el resto de citoquinas.
ConclusionesLos pacientes con fatiga tienen peor calidad de vida, observándose una mejoría en el control a los 6meses, lo que sugiere un curso que podría autolimitarse, pero habrá que confírmalo con estudios más prolongados.
More than 100 million people have been infected worldwide by the SARS-CoV-2 virus, which is responsible for an acute disease called COVID-19. Multiple studies have shown how various symptoms in these patients can persist for several months after resolution of the acute process, known as post-COVID syndrome. The neurological clinic is varied, but with constant presentation of fatigue.
ObjectiveAnalyze post-COVID fatigue.
MethodsWe present a single-center, prospective, case-control study comparing patients with fatigue in the context of a post-COVID syndrome with patients who have passed COVID-19 without post-COVID fatigue. A baseline record (April 2021) and a control record at 6months were made. Clinical variables, fatigue questionnaires, sleep disorders, depression, anxiety, cognitive impairment and quality of life are recorded. Basic analyzes of the two visits are collected. In addition, a substudy of inflammatory (IL-6, IL-1β, TNF-α) and anti-inflammatory (IL-10) cytokines is performed.
ResultsThe fatigue of the patients measured by Chadler is of moderate and mixed intensity (physical and psychological). At 6months, physical fatigue improves, but psychological fatigue does not. Significant differences were found in sleepiness, cognitive deterioration, anxiety and quality of life. Significant alterations are evident of TNF-α values, but not in the rest of the cytokines.
ConclusionsPatients with fatigue have a poorer quality of life, with improvement in control being observed at 6months, which suggests a course that could be self-limiting, but this will have to be confirmed with longer studies.
El SARS-COV-2 es un virus de la familia de los coronavirus capaz de desarrollar una enfermedad que se ha denominado COVID-19. Fue descrito por primera vez en China en 2019. Desde entonces ha sido responsable de una de las mayores pandemias a nivel mundial1.
El cuadro más característico de la COVID-19 es una neumonía grave, pero el espectro clínico es muy variable, desde pacientes asintomáticos hasta, en los casos más graves, distrés respiratorio y fallo multiorgánico. Las manifestaciones clínicas iniciales estaban en relación con la invasión del virus al organismo y las complicaciones parecían debidas a la tormenta de citoquinas que se desencadena por la respuesta inmune del sujeto afecto2. Independientemente de la presentación clínica inicial, hay pacientes que, a pesar del paso de las semanas y de la negativización de la PCR del SARS-CoV-2, siguen presentando diferentes síntomas, y es lo que se denomina «síndrome post-COVID»3. Se define como una nueva condición que ocurre en individuos que han padecido COVID-19 y en los que los síntomas persisten a pesar del tiempo4, concretamente al menos 3meses5. Entre estos síntomas, aparecen con gran frecuencia manifestaciones neurológicas, como fatiga, cefalea, trastorno de atención y quejas de memoria. Por otro lado, es importante tener en cuenta que los síntomas aparecen de un modo independiente de la presentación clínica inicial y de la gravedad del estado del paciente6. Esta entidad parece que aqueja a un amplio porcentaje de las personas afectas. Las cifras varían, según los estudios internacionales, desde el 10 al 80%7.
La disregulación inmune crónica tras procesos infecciosos, conocida como estados de inflamación-inmunosupresión y catabolismo persistente, ya ha sido descrita con otros virus8. El SARS-COV-2 provocaría una respuesta inmune desmedida que llevaría a la liberación de una tormenta de citoquinas. Los órganos dañados continúan generando moléculas inflamatorias, perpetuando la situación de infamación crónica sistémica9-11. Se cree que esta podría ser una de las bases fisiopatológicas del síndrome post-COVID12.
Hoy en día parece haber suficiente literatura como para justificar el hecho de que el virus, tanto directa como indirectamente, pueda provocar una disfunción del tronco cerebral, y esta pueda ser responsable de muchas de las manifestaciones neurológicas del síndrome post-COVID13,14. Entre ellas se encuentran la fatiga, las mialgias, el insomnio, las cefaleas, la depresión, la ansiedad, alteraciones del gusto y del olfato y disfunciones cognitivas15. La fatiga es probablemente el síntoma más común en la presentación post-COVID16, tal y como describen autores como Islam et al.17 o Ceban et al.16, donde el 32% de los pacientes lo presentan. Este síntoma también se había descrito previamente con otros virus y otros coronavirus18. Los pacientes pueden englobar en este término de fatiga sensaciones como debilidad, disnea, dificultades de concentración, falta de ánimo o somnolencia19. De ahí, tal y como proponen Sandler et al.19, la importancia de medir objetivamente la fatiga con cuestionarios, como pueden ser el Chadler, e integrar en la valoración aspectos como el sueño o el ánimo. Rudroff et al.20 proponen una definición de fatiga neurológica asociada al síndrome post-COVID como la disminución en la actividad física y mental como resultado de cambios en el sistema nervioso central (SNC), psicológicos o periféricos provocados por la COVID-1920. Estos autores postulan que el virus pueda invadir el SNC provocando fatiga, al igual que ocurre en otras enfermedades neurológicas, como la esclerosis múltiple20. Así mismo, hablan de factores psicológicos, como aquellos que se relacionaron con la situación de miedo, aislamiento, restricciones sociales o fallecimientos de familiares, que pueden contribuir a esa percepción20. Por último, hablan de factores periféricos, refiriéndose a la capacidad del virus para atacar a diferentes tejidos, y en concreto al sistema musculoesquelético. Ceban et al.16 refieren factores de riesgo de fatiga post-COVID: el sexo femenino, edad adulta (en niños y adolescentes no se presenta tanto) y la preexistencia de comorbilidades. Mazza et al.21 realizan un estudio en el que evalúan la fatiga a lo largo del tiempo y comprueban cómo esta se mantiene en el tiempo e incluso empeora en intensidad a lo largo del primer año. El único factor que encuentran como factor de riesgo es la depresión después de la COVID-19 como predictor de presencia de fatiga a los 6 y 12meses del inicio de la clínica, que a su vez podrían retroalimentarse y podrían tener una base fisiopatológica común como es la neuroinflamación21.
Dada la elevada prevalencia del síndrome post-COVID y sus implicaciones sociosanitarias, se hace preciso llevar a cabo estudios que permitan conocer su etiopatogenia, las posibles intervenciones terapéuticas y las implicaciones pronósticas. El objetivo de este estudio es, por un lado, evaluar la fatiga y la comorbilidad con afectación cognitiva, depresión y/o ansiedad y ver su impacto en la calidad de vida. Y por otro lado, valorar la relación de este síndrome post-COVID con biomarcadores de inflamación y calidad del sueño.
Nuestra hipótesis es que los pacientes con fatiga puedan tener mayores tasas de depresión, ansiedad y afectación cognitiva, tal y como se han descrito en series previas19,21. Y la hipótesis etiológica de la fatiga es que sea debida a una baja inflamación continua por un lado y por otro, secundaria a la disfunción del tronco cerebral producida por el virus. La afectación del tronco cerebral también podría justificar las alteraciones del sueño que describen los pacientes, que a su vez favorecerían la liberación de citoquinas, lo que perpetuaría el cuadro22. Se analizan citoquinas inflamatorias y antiinflamatorias en ambos grupos, así como cuestionarios de sueño para valorarlo. La hipótesis es que en el grupo de fatiga haya elevación de citoquinas inflamatorias y mayores problemas de sueño que en el grupo control, en el que se espera que haya más citoquinas antiinflamatorias.
Material y métodosDiseño del estudioSe trata de un estudio unicéntrico, prospectivo observacional de casos y control durante 24semanas.
Criterios de inclusión y exclusiónLos criterios de inclusión fueron ser mayor de 18años, haber sido diagnosticado de COVID-19 (confirmado por PCR positiva) y que llevase al menos 12semanas desde el inicio de los síntomas. De estos, se incluyeron como casos aquellos que presentaban síntomas de fatiga persistente relacionados con la infección previa, y como controles, aquellos que habiendo pasado la COVID-19, no tuvieran fatiga. La presencia o ausencia de fatiga se estableció en base a la escala de fatiga Chalder.
Los criterios de exclusión fueron: pacientes que hubieran padecido COVID-19 pero que requirieron ingreso en la unidad de medicina intensiva; pacientes con fatiga prolongada atribuida a otras causas diferentes a la infección por SARS-CoV-2 (patología tiroidea, tumores, insuficiencia cardíaca) o previa a la infección por SARS-CoV-2; la no aceptación de participar en el estudio y/o que no cumplimentasen los documentos de consentimiento informado, y pacientes con trastornos cognitivos previas a la COVID-19.
La fatiga se define como una abrumadora sensación de cansancio en reposo, agotamiento con la actividad y/o falta de energía que impide llevar a cabo las tareas diarias23. La fatiga se evaluó mediante la Escala de Fatiga de Chalder (CFQ-11)24, y las respuestas fueron medidas mediante la escala Likert (0-3)25. Esta escala se ha utilizado en estudios previos. Las puntuaciones de la escala se pueden valorar de dos formas: presencia de fatiga (4 o más puntos) o ausencia (3 o menos), y por otro lado la intensidad de esta (0-33, donde a menor puntuación, menor fatiga). La escala valora diferentes dimensiones (física y psicológica: ítems del 1-7 y del 8 al 11, respectivamente).
Procedimiento del estudio y selección de participantesEl estudio se desarrolló de manera prospectiva en dos visitas, una basal (entre abril y junio de 2021) y otra a las 24semanas (entre octubre y diciembre de 2021). Los pacientes fueron seleccionados de manera consecutiva según su aceptación de participar en el estudio. En base a los criterios de la escala CFQ-11 (4 o más puntos vs 3 o menos), los participantes fueron cribados consecutivamente de manera telefónica (con la escala Chalder) y clasificados en dos grupos: casos con fatiga y controles o sin fatiga. La primera visita comenzó con la firma del consentimiento informado y con un cuestionario con las variables seleccionadas: variables sociodemográficas, comorbilidades previas, presentación clínica del proceso, situación actual y variables antropométricas.
Las variables elegidas fueron: sociodemográficas, comorbilidades previas al diagnóstico de la COVID-19, antropométricas, relacionadas con infección por SARS-CoV-2, cuidados en fase aguda, sintomatología actual.
Los índices evaluados son:
- a)
Calidad del sueño: escala de Pittsburg26.
- b)
Escala de somnolencia: escala de Epworth27.
- c)
Escala de fatiga (CFQ-11): comentada ya en la definición de fatiga.
- d)
Escala de ansiedad (Hamilton)28.
- e)
Escala de depresión (inventario de Beck)29.
- f)
Escala de deterioro cognitivo (Montreal Cognitive Assessment [MOCA])30.
- g)
Escala de calidad de vida (EQ-5D-5L)31.
En esa misma visita se les facilitaron unos cuestionarios para cuantificar y confirmar los síntomas previamente comentados con extracción de sangre. Las determinaciones analíticas seleccionadas fueron: además del perfil hematimétrico y bioquímico, se evaluaron citoquinas proinflamatorias y antiinflamatorias mediante la técnica ELISA/CBA: IL-1, IL-6, IL-10, TNF-α. El análisis se hizo siguiendo las recomendaciones de la casa comercial.
Análisis estadísticoEl tamaño del estudio se calculó para maximizar la muestra y que esta sea significativa y válida científicamente; se utilizó una potencia del 80% como poder estadístico, que equivale al 20% del error tipoII (beta), prefijando el resto de parámetros propuestos, donde el error tipoI (alpha) se fijó al 5% (que equivale al nivel de confianza del 95%) y la diferencia entre ambos grupos se estableció en al menos el 25% (esto es, un excedente de reclutamiento aproximado de 9 pacientes más) para suplir el 10% (que son la equivalencia a 4 pacientes) de los abandonos al seguimiento, proporcionando justo el tamaño muestral alcanzado (40 pacientes por grupo).
El análisis estadístico describe las variables cuantitativas utilizando media y desviación típica o mediana e intervalo intercuartílico, dependiendo de si la variable asume distribución normal. La normalidad de todos los datos se comprobó mediante los test de Shapiro-Wilk y Kolmogorof-Smirnov. Las variables cualitativas se describen mediante su distribución de frecuencias.
Para comparar las variables entre grupos se utilizó el contraste t de Student o ANOVA de un factor en el caso de comparar dos grupos o más, si la variable cuantitativa asume distribución normal. En caso contrario, se usaron sus análogos no paramétricos: el test U de Mann-Whitney o H de Kruskal-Wallis, respectivamente. La asociación entre variables cuantitativas se llevó a cabo mediante correlaciones, concretamente mediante el coeficiente de correlación paramétrico de Pearson o no paramétrico de Spearman. Para terminar, en caso de variables cualitativas se utilizó el test chi-cuadrado o test de Fisher, según correspondiera. En este estudio se ha utilizado el análisis de medidas repetidas o emparejadas, mediante una ANOVA, con el fin de medir el cambio de evolución entre dos tiempos diferentes (tiempo2 respecto al tiempo1), dentro de cada grupo por separado y/o con respecto a ambos grupos, detectando la existencia de posibles diferencias significativas en la evolución de ambos grupos, tanto en conjunto (grupo caso frente grupo control) como por separado (grupo caso y grupo control). Para la realización de todos los análisis estadísticos se han utilizado los programa SPSS 26.0, STATA/SE v16.0 y R v4.2.2, considerando significativos aquellos valores de p por debajo del 5%.
Este estudio respeta todas las recomendaciones y consideraciones éticas. Ha sido aprobado por el Comité de Ética de Investigación con Medicamento de nuestro centro hospitalario.
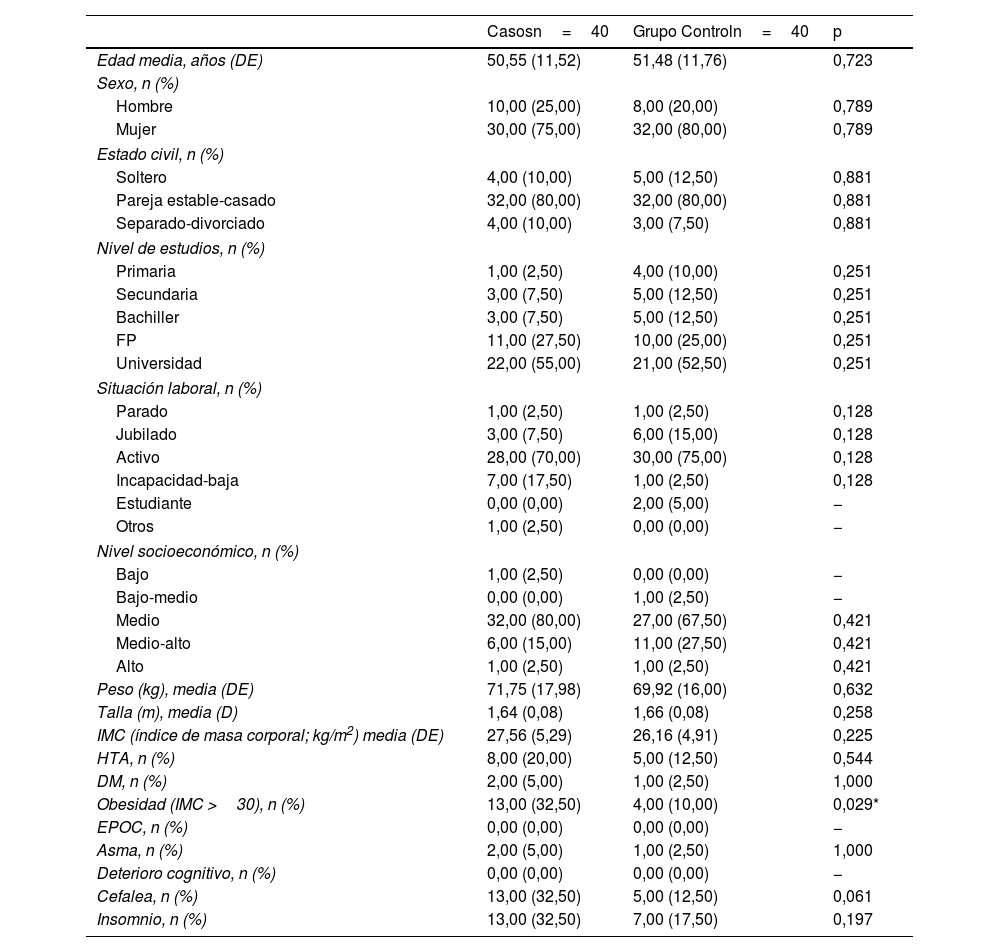
ResultadosLos resultados sociodemográficos, antropométricos y de comorbilidades previas al diagnóstico de COVID-19 se recogen en la tabla 1. Únicamente destacar como estadísticamente significativa (p=0,029) la obesidad en el grupo de pacientes con fatiga, como comorbilidad previa.
Variables sociodemográficas, antropométricas y comorbilidades previas a la COVID-19
| Casosn=40 | Grupo Controln=40 | p | |
|---|---|---|---|
| Edad media, años (DE) | 50,55 (11,52) | 51,48 (11,76) | 0,723 |
| Sexo, n (%) | |||
| Hombre | 10,00 (25,00) | 8,00 (20,00) | 0,789 |
| Mujer | 30,00 (75,00) | 32,00 (80,00) | 0,789 |
| Estado civil, n (%) | |||
| Soltero | 4,00 (10,00) | 5,00 (12,50) | 0,881 |
| Pareja estable-casado | 32,00 (80,00) | 32,00 (80,00) | 0,881 |
| Separado-divorciado | 4,00 (10,00) | 3,00 (7,50) | 0,881 |
| Nivel de estudios, n (%) | |||
| Primaria | 1,00 (2,50) | 4,00 (10,00) | 0,251 |
| Secundaria | 3,00 (7,50) | 5,00 (12,50) | 0,251 |
| Bachiller | 3,00 (7,50) | 5,00 (12,50) | 0,251 |
| FP | 11,00 (27,50) | 10,00 (25,00) | 0,251 |
| Universidad | 22,00 (55,00) | 21,00 (52,50) | 0,251 |
| Situación laboral, n (%) | |||
| Parado | 1,00 (2,50) | 1,00 (2,50) | 0,128 |
| Jubilado | 3,00 (7,50) | 6,00 (15,00) | 0,128 |
| Activo | 28,00 (70,00) | 30,00 (75,00) | 0,128 |
| Incapacidad-baja | 7,00 (17,50) | 1,00 (2,50) | 0,128 |
| Estudiante | 0,00 (0,00) | 2,00 (5,00) | − |
| Otros | 1,00 (2,50) | 0,00 (0,00) | − |
| Nivel socioeconómico, n (%) | |||
| Bajo | 1,00 (2,50) | 0,00 (0,00) | − |
| Bajo-medio | 0,00 (0,00) | 1,00 (2,50) | − |
| Medio | 32,00 (80,00) | 27,00 (67,50) | 0,421 |
| Medio-alto | 6,00 (15,00) | 11,00 (27,50) | 0,421 |
| Alto | 1,00 (2,50) | 1,00 (2,50) | 0,421 |
| Peso (kg), media (DE) | 71,75 (17,98) | 69,92 (16,00) | 0,632 |
| Talla (m), media (D) | 1,64 (0,08) | 1,66 (0,08) | 0,258 |
| IMC (índice de masa corporal; kg/m2) media (DE) | 27,56 (5,29) | 26,16 (4,91) | 0,225 |
| HTA, n (%) | 8,00 (20,00) | 5,00 (12,50) | 0,544 |
| DM, n (%) | 2,00 (5,00) | 1,00 (2,50) | 1,000 |
| Obesidad (IMC >30), n (%) | 13,00 (32,50) | 4,00 (10,00) | 0,029* |
| EPOC, n (%) | 0,00 (0,00) | 0,00 (0,00) | − |
| Asma, n (%) | 2,00 (5,00) | 1,00 (2,50) | 1,000 |
| Deterioro cognitivo, n (%) | 0,00 (0,00) | 0,00 (0,00) | − |
| Cefalea, n (%) | 13,00 (32,50) | 5,00 (12,50) | 0,061 |
| Insomnio, n (%) | 13,00 (32,50) | 7,00 (17,50) | 0,197 |
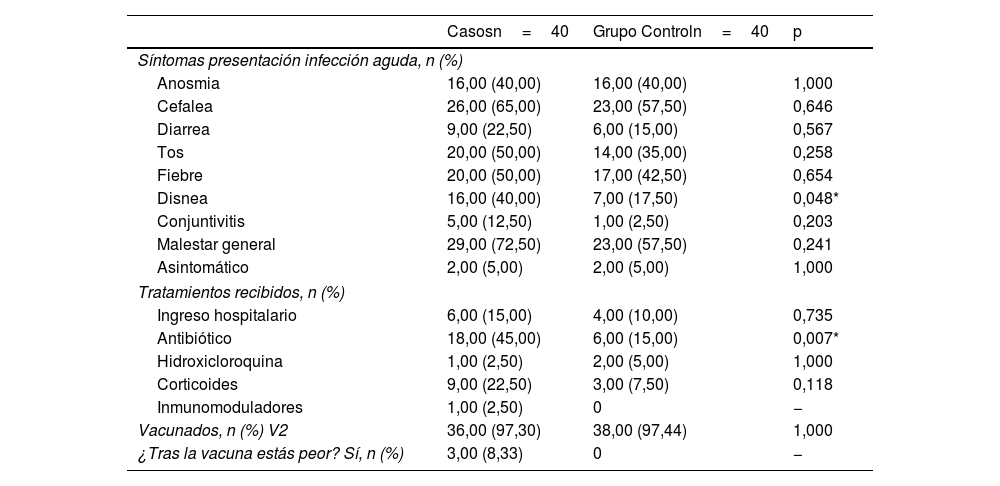
La sintomatología presentada en el momento de la infección aguda, los tratamientos recibidos y la vacunación se presentan en la tabla 2. Destacar como estadísticamente significativo entre ambos grupos la presentación de disnea (16casos vs 7controles; p=0,048). En cuanto a los tratamientos, el uso de antibiótico (18casos vs 6controles; p=0,007).
Sintomatología en infección aguda, tratamientos recibidos y vacunación
| Casosn=40 | Grupo Controln=40 | p | |
|---|---|---|---|
| Síntomas presentación infección aguda, n (%) | |||
| Anosmia | 16,00 (40,00) | 16,00 (40,00) | 1,000 |
| Cefalea | 26,00 (65,00) | 23,00 (57,50) | 0,646 |
| Diarrea | 9,00 (22,50) | 6,00 (15,00) | 0,567 |
| Tos | 20,00 (50,00) | 14,00 (35,00) | 0,258 |
| Fiebre | 20,00 (50,00) | 17,00 (42,50) | 0,654 |
| Disnea | 16,00 (40,00) | 7,00 (17,50) | 0,048* |
| Conjuntivitis | 5,00 (12,50) | 1,00 (2,50) | 0,203 |
| Malestar general | 29,00 (72,50) | 23,00 (57,50) | 0,241 |
| Asintomático | 2,00 (5,00) | 2,00 (5,00) | 1,000 |
| Tratamientos recibidos, n (%) | |||
| Ingreso hospitalario | 6,00 (15,00) | 4,00 (10,00) | 0,735 |
| Antibiótico | 18,00 (45,00) | 6,00 (15,00) | 0,007* |
| Hidroxicloroquina | 1,00 (2,50) | 2,00 (5,00) | 1,000 |
| Corticoides | 9,00 (22,50) | 3,00 (7,50) | 0,118 |
| Inmunomoduladores | 1,00 (2,50) | 0 | − |
| Vacunados, n (%) V2 | 36,00 (97,30) | 38,00 (97,44) | 1,000 |
| ¿Tras la vacuna estás peor? Sí, n (%) | 3,00 (8,33) | 0 | − |
V2: visita 2.
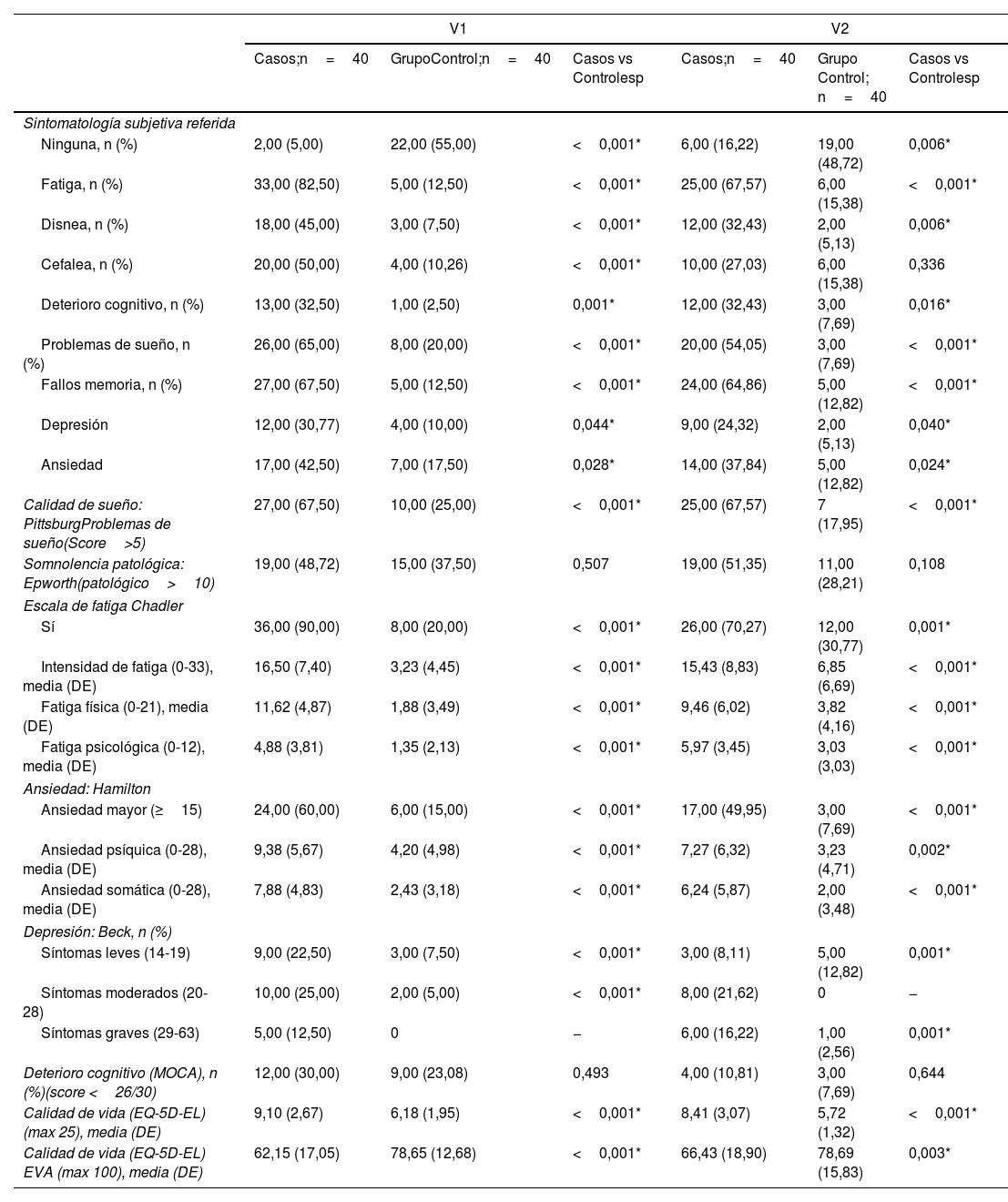
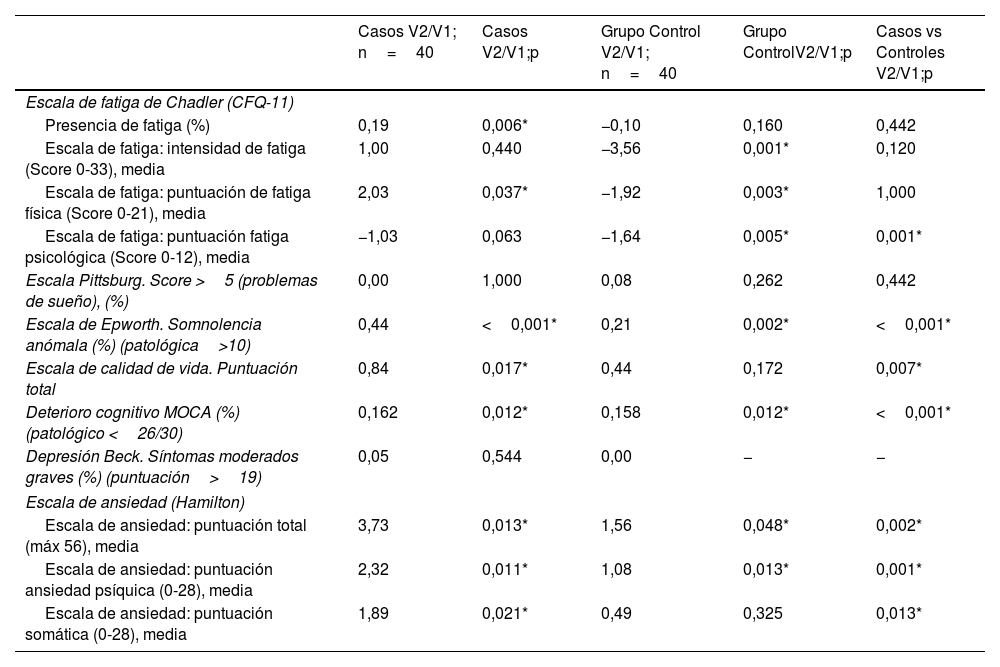
En la tabla 3 se describen las principales manifestaciones neurológicas referidas por los pacientes de manera subjetiva, destacando en prevalencia, más allá de la fatiga, la disnea y la cefalea, los fallos cognitivos y de memoria, los trastornos de sueño y las mialgias, siendo en todos estos casos estadísticamente significativas con respecto al grupo sin fatiga. Los cuestionarios muestran diferencias entre ambos grupos en cuanto a fatiga, problemas de sueño, ansiedad, depresión y calidad de vida, siendo mayores en el grupo de fatiga. En la tabla 3 se exponen los datos tanto de primera como de segunda visita, donde se observa que, con el paso del tiempo, en el grupo de casos, la clínica (fatiga en general, ansiedad, depresión, trastornos de sueño y calidad de vida en general) va mejorando. En la tabla 4 se presentan los datos sobre las diferencias entre ambas visitas por grupos, destacando una mejoría a los 6meses en fatiga en general y en el apartado de fatiga física, somnolencia, calidad de vida, deterioro cognitivo y ansiedad estadísticamente significativa en el grupo de pacientes con fatiga. En los pacientes del grupo que no tenían fatiga, destacar mejoría estadísticamente significativas en el tiempo en las puntuaciones de somnolencia, deterioro cognitivo y ansiedad. Así mismo, destacar en este punto el empeoramiento estadísticamente significativo tanto de la fatiga en puntuación global, como por subapartados. Si se mira el análisis entre grupos a lo largo del tiempo, destacar como mejoría estadísticamente significativa la somnolencia, la calidad de vida, el deterioro cognitivo y la ansiedad. Así mismo, destacar en este análisis el resultado estadísticamente significativo, pero por empeoramiento, en las puntuaciones de la fatiga psicológica.
Sintomatología actual y resultados de cuestionarios
| V1 | V2 | |||||
|---|---|---|---|---|---|---|
| Casos;n=40 | GrupoControl;n=40 | Casos vs Controlesp | Casos;n=40 | Grupo Control; n=40 | Casos vs Controlesp | |
| Sintomatología subjetiva referida | ||||||
| Ninguna, n (%) | 2,00 (5,00) | 22,00 (55,00) | <0,001* | 6,00 (16,22) | 19,00 (48,72) | 0,006* |
| Fatiga, n (%) | 33,00 (82,50) | 5,00 (12,50) | <0,001* | 25,00 (67,57) | 6,00 (15,38) | <0,001* |
| Disnea, n (%) | 18,00 (45,00) | 3,00 (7,50) | <0,001* | 12,00 (32,43) | 2,00 (5,13) | 0,006* |
| Cefalea, n (%) | 20,00 (50,00) | 4,00 (10,26) | <0,001* | 10,00 (27,03) | 6,00 (15,38) | 0,336 |
| Deterioro cognitivo, n (%) | 13,00 (32,50) | 1,00 (2,50) | 0,001* | 12,00 (32,43) | 3,00 (7,69) | 0,016* |
| Problemas de sueño, n (%) | 26,00 (65,00) | 8,00 (20,00) | <0,001* | 20,00 (54,05) | 3,00 (7,69) | <0,001* |
| Fallos memoria, n (%) | 27,00 (67,50) | 5,00 (12,50) | <0,001* | 24,00 (64,86) | 5,00 (12,82) | <0,001* |
| Depresión | 12,00 (30,77) | 4,00 (10,00) | 0,044* | 9,00 (24,32) | 2,00 (5,13) | 0,040* |
| Ansiedad | 17,00 (42,50) | 7,00 (17,50) | 0,028* | 14,00 (37,84) | 5,00 (12,82) | 0,024* |
| Calidad de sueño: PittsburgProblemas de sueño(Score>5) | 27,00 (67,50) | 10,00 (25,00) | <0,001* | 25,00 (67,57) | 7 (17,95) | <0,001* |
| Somnolencia patológica: Epworth(patológico>10) | 19,00 (48,72) | 15,00 (37,50) | 0,507 | 19,00 (51,35) | 11,00 (28,21) | 0,108 |
| Escala de fatiga Chadler | ||||||
| Sí | 36,00 (90,00) | 8,00 (20,00) | <0,001* | 26,00 (70,27) | 12,00 (30,77) | 0,001* |
| Intensidad de fatiga (0-33), media (DE) | 16,50 (7,40) | 3,23 (4,45) | <0,001* | 15,43 (8,83) | 6,85 (6,69) | <0,001* |
| Fatiga física (0-21), media (DE) | 11,62 (4,87) | 1,88 (3,49) | <0,001* | 9,46 (6,02) | 3,82 (4,16) | <0,001* |
| Fatiga psicológica (0-12), media (DE) | 4,88 (3,81) | 1,35 (2,13) | <0,001* | 5,97 (3,45) | 3,03 (3,03) | <0,001* |
| Ansiedad: Hamilton | ||||||
| Ansiedad mayor (≥15) | 24,00 (60,00) | 6,00 (15,00) | <0,001* | 17,00 (49,95) | 3,00 (7,69) | <0,001* |
| Ansiedad psíquica (0-28), media (DE) | 9,38 (5,67) | 4,20 (4,98) | <0,001* | 7,27 (6,32) | 3,23 (4,71) | 0,002* |
| Ansiedad somática (0-28), media (DE) | 7,88 (4,83) | 2,43 (3,18) | <0,001* | 6,24 (5,87) | 2,00 (3,48) | <0,001* |
| Depresión: Beck, n (%) | ||||||
| Síntomas leves (14-19) | 9,00 (22,50) | 3,00 (7,50) | <0,001* | 3,00 (8,11) | 5,00 (12,82) | 0,001* |
| Síntomas moderados (20-28) | 10,00 (25,00) | 2,00 (5,00) | <0,001* | 8,00 (21,62) | 0 | − |
| Síntomas graves (29-63) | 5,00 (12,50) | 0 | − | 6,00 (16,22) | 1,00 (2,56) | 0,001* |
| Deterioro cognitivo (MOCA), n (%)(score <26/30) | 12,00 (30,00) | 9,00 (23,08) | 0,493 | 4,00 (10,81) | 3,00 (7,69) | 0,644 |
| Calidad de vida (EQ-5D-EL) (max 25), media (DE) | 9,10 (2,67) | 6,18 (1,95) | <0,001* | 8,41 (3,07) | 5,72 (1,32) | <0,001* |
| Calidad de vida (EQ-5D-EL) EVA (max 100), media (DE) | 62,15 (17,05) | 78,65 (12,68) | <0,001* | 66,43 (18,90) | 78,69 (15,83) | 0,003* |
EVA: escala analógica visual; max: máximo; V1: visita 1; V2: visita 2.
Comparativa por grupos entre las visitas (V2/V1) por muestra apareadas (casos controles)
| Casos V2/V1; n=40 | Casos V2/V1;p | Grupo Control V2/V1; n=40 | Grupo ControlV2/V1;p | Casos vs Controles V2/V1;p | |
|---|---|---|---|---|---|
| Escala de fatiga de Chadler (CFQ-11) | |||||
| Presencia de fatiga (%) | 0,19 | 0,006* | −0,10 | 0,160 | 0,442 |
| Escala de fatiga: intensidad de fatiga (Score 0-33), media | 1,00 | 0,440 | −3,56 | 0,001* | 0,120 |
| Escala de fatiga: puntuación de fatiga física (Score 0-21), media | 2,03 | 0,037* | −1,92 | 0,003* | 1,000 |
| Escala de fatiga: puntuación fatiga psicológica (Score 0-12), media | −1,03 | 0,063 | −1,64 | 0,005* | 0,001* |
| Escala Pittsburg. Score >5 (problemas de sueño), (%) | 0,00 | 1,000 | 0,08 | 0,262 | 0,442 |
| Escala de Epworth. Somnolencia anómala (%) (patológica>10) | 0,44 | <0,001* | 0,21 | 0,002* | <0,001* |
| Escala de calidad de vida. Puntuación total | 0,84 | 0,017* | 0,44 | 0,172 | 0,007* |
| Deterioro cognitivo MOCA (%) (patológico <26/30) | 0,162 | 0,012* | 0,158 | 0,012* | <0,001* |
| Depresión Beck. Síntomas moderados graves (%) (puntuación>19) | 0,05 | 0,544 | 0,00 | − | − |
| Escala de ansiedad (Hamilton) | |||||
| Escala de ansiedad: puntuación total (máx 56), media | 3,73 | 0,013* | 1,56 | 0,048* | 0,002* |
| Escala de ansiedad: puntuación ansiedad psíquica (0-28), media | 2,32 | 0,011* | 1,08 | 0,013* | 0,001* |
| Escala de ansiedad: puntuación somática (0-28), media | 1,89 | 0,021* | 0,49 | 0,325 | 0,013* |
V2: visita 2; V1: visita 1.
Los números absolutos son la diferencia de puntos entre visitas, siendo el signo positivo una mejoría a lo largo del tiempo y el signo negativo un empeoramiento.
Se realiza un análisis de correlación entre fatiga y deterioro cognitivo medido por MOCA con un valor cor de −0,10 y una p=0,391, por lo que no se encuentra correlación entre ambas variables. En cuanto a la correlación de fatiga y ansiedad medida por escalas, se encuentra un cor de 0,55, con una p<0,001, y al mirar la correlación con depresión según escalas, el cor es de 0,6, con una p<0,001, lo que orienta hacia una posible correlación entre ambos síntomas y la fatiga. Así mismo, se realiza un análisis de correlación entre calidad de sueño y citoquina inflamatoria IL-6 en la visita1, con un coeficiente de cor de −0,07 y una p=0,530, y en la visita2 con un cor de −0,14 y una p=0,244. A la vista de los resultados, se puede apreciar que la presencia de problemas de sueño no guarda relación significativa con la variable inflamatoria IL-6, pero posiblemente pueda ser por la escasez de la muestra, por lo que no se puede concluir con seguridad dicha evidencia.
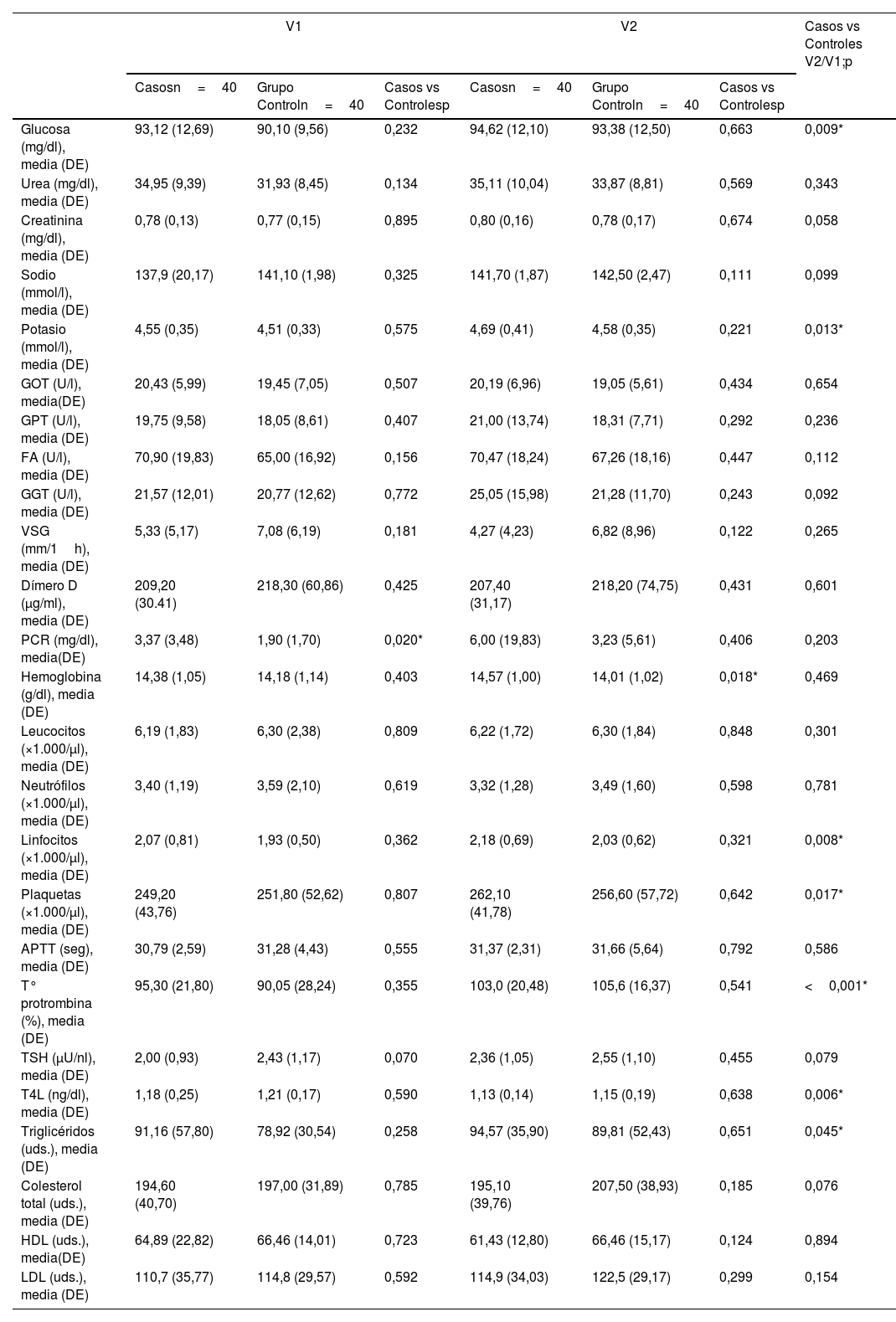
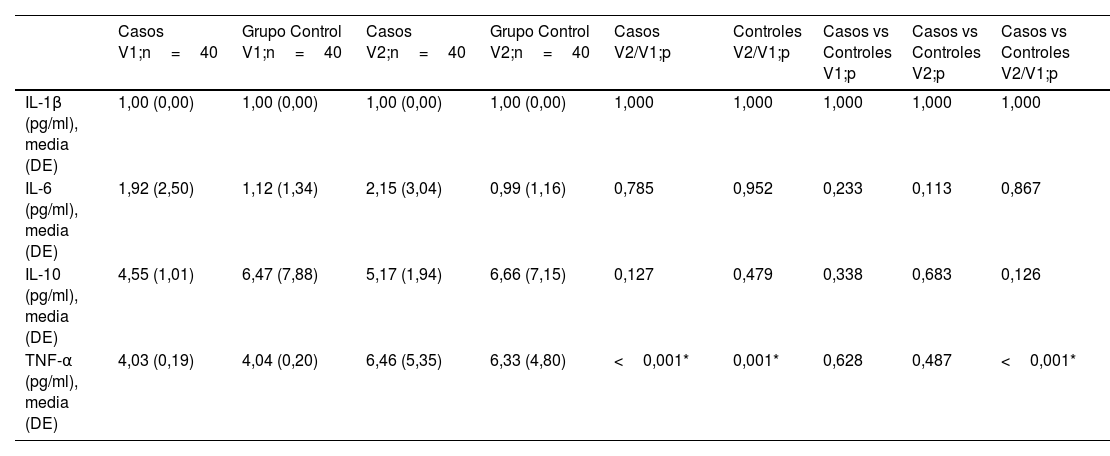
Con respecto a las determinaciones, no hay alteraciones relevantes clínicamente, y destacar que estadísticamente hay diferencias entre ambos grupos en los valores de PCR en la primera visita y de hemoglobina en la segunda visita, pero clínicamente no son relevantes (tabla 5). Así mismo, al realizar el análisis de la diferencia entre grupos a lo largo del tiempo son estadísticamente significativos los cambios en glucosa, potasio, linfocitos, plaquetas, tiempo de protrombina, hormona tiroidea T4 libre y triglicéridos, no siendo clínicamente relevantes. En el estudio de las citoquinas hay diferencias estadísticamente significativas en cuanto a los valores de TNF-α (tabla 6). En el resto de citoquinas no se encuentran diferencias estadísticamente significativas, pero sí se observa una tendencia en los valores de IL-10, citoquina antiinflamatoria, más elevadas en el grupo sin fatiga, pero sin llegar a ser estadísticamente significativas.
Comparación entre grupos en las visitas (por muestras apareadas e independientes) para los resultados de las analíticas
| V1 | V2 | Casos vs Controles V2/V1;p | |||||
|---|---|---|---|---|---|---|---|
| Casosn=40 | Grupo Controln=40 | Casos vs Controlesp | Casosn=40 | Grupo Controln=40 | Casos vs Controlesp | ||
| Glucosa (mg/dl), media (DE) | 93,12 (12,69) | 90,10 (9,56) | 0,232 | 94,62 (12,10) | 93,38 (12,50) | 0,663 | 0,009* |
| Urea (mg/dl), media (DE) | 34,95 (9,39) | 31,93 (8,45) | 0,134 | 35,11 (10,04) | 33,87 (8,81) | 0,569 | 0,343 |
| Creatinina (mg/dl), media (DE) | 0,78 (0,13) | 0,77 (0,15) | 0,895 | 0,80 (0,16) | 0,78 (0,17) | 0,674 | 0,058 |
| Sodio (mmol/l), media (DE) | 137,9 (20,17) | 141,10 (1,98) | 0,325 | 141,70 (1,87) | 142,50 (2,47) | 0,111 | 0,099 |
| Potasio (mmol/l), media (DE) | 4,55 (0,35) | 4,51 (0,33) | 0,575 | 4,69 (0,41) | 4,58 (0,35) | 0,221 | 0,013* |
| GOT (U/l), media(DE) | 20,43 (5,99) | 19,45 (7,05) | 0,507 | 20,19 (6,96) | 19,05 (5,61) | 0,434 | 0,654 |
| GPT (U/l), media (DE) | 19,75 (9,58) | 18,05 (8,61) | 0,407 | 21,00 (13,74) | 18,31 (7,71) | 0,292 | 0,236 |
| FA (U/l), media (DE) | 70,90 (19,83) | 65,00 (16,92) | 0,156 | 70,47 (18,24) | 67,26 (18,16) | 0,447 | 0,112 |
| GGT (U/l), media (DE) | 21,57 (12,01) | 20,77 (12,62) | 0,772 | 25,05 (15,98) | 21,28 (11,70) | 0,243 | 0,092 |
| VSG (mm/1h), media (DE) | 5,33 (5,17) | 7,08 (6,19) | 0,181 | 4,27 (4,23) | 6,82 (8,96) | 0,122 | 0,265 |
| Dímero D (μg/ml), media (DE) | 209,20 (30.41) | 218,30 (60,86) | 0,425 | 207,40 (31,17) | 218,20 (74,75) | 0,431 | 0,601 |
| PCR (mg/dl), media(DE) | 3,37 (3,48) | 1,90 (1,70) | 0,020* | 6,00 (19,83) | 3,23 (5,61) | 0,406 | 0,203 |
| Hemoglobina (g/dl), media (DE) | 14,38 (1,05) | 14,18 (1,14) | 0,403 | 14,57 (1,00) | 14,01 (1,02) | 0,018* | 0,469 |
| Leucocitos (×1.000/μl), media (DE) | 6,19 (1,83) | 6,30 (2,38) | 0,809 | 6,22 (1,72) | 6,30 (1,84) | 0,848 | 0,301 |
| Neutrófilos (×1.000/μl), media (DE) | 3,40 (1,19) | 3,59 (2,10) | 0,619 | 3,32 (1,28) | 3,49 (1,60) | 0,598 | 0,781 |
| Linfocitos (×1.000/μl), media (DE) | 2,07 (0,81) | 1,93 (0,50) | 0,362 | 2,18 (0,69) | 2,03 (0,62) | 0,321 | 0,008* |
| Plaquetas (×1.000/μl), media (DE) | 249,20 (43,76) | 251,80 (52,62) | 0,807 | 262,10 (41,78) | 256,60 (57,72) | 0,642 | 0,017* |
| APTT (seg), media (DE) | 30,79 (2,59) | 31,28 (4,43) | 0,555 | 31,37 (2,31) | 31,66 (5,64) | 0,792 | 0,586 |
| T° protrombina (%), media (DE) | 95,30 (21,80) | 90,05 (28,24) | 0,355 | 103,0 (20,48) | 105,6 (16,37) | 0,541 | <0,001* |
| TSH (μU/nl), media (DE) | 2,00 (0,93) | 2,43 (1,17) | 0,070 | 2,36 (1,05) | 2,55 (1,10) | 0,455 | 0,079 |
| T4L (ng/dl), media (DE) | 1,18 (0,25) | 1,21 (0,17) | 0,590 | 1,13 (0,14) | 1,15 (0,19) | 0,638 | 0,006* |
| Triglicéridos (uds.), media (DE) | 91,16 (57,80) | 78,92 (30,54) | 0,258 | 94,57 (35,90) | 89,81 (52,43) | 0,651 | 0,045* |
| Colesterol total (uds.), media (DE) | 194,60 (40,70) | 197,00 (31,89) | 0,785 | 195,10 (39,76) | 207,50 (38,93) | 0,185 | 0,076 |
| HDL (uds.), media(DE) | 64,89 (22,82) | 66,46 (14,01) | 0,723 | 61,43 (12,80) | 66,46 (15,17) | 0,124 | 0,894 |
| LDL (uds.), media (DE) | 110,7 (35,77) | 114,8 (29,57) | 0,592 | 114,9 (34,03) | 122,5 (29,17) | 0,299 | 0,154 |
V1: visita 1; V2: visita 2.
Resultados de citoquinas
| Casos V1;n=40 | Grupo Control V1;n=40 | Casos V2;n=40 | Grupo Control V2;n=40 | Casos V2/V1;p | Controles V2/V1;p | Casos vs Controles V1;p | Casos vs Controles V2;p | Casos vs Controles V2/V1;p | |
|---|---|---|---|---|---|---|---|---|---|
| IL-1β (pg/ml), media (DE) | 1,00 (0,00) | 1,00 (0,00) | 1,00 (0,00) | 1,00 (0,00) | 1,000 | 1,000 | 1,000 | 1,000 | 1,000 |
| IL-6 (pg/ml), media (DE) | 1,92 (2,50) | 1,12 (1,34) | 2,15 (3,04) | 0,99 (1,16) | 0,785 | 0,952 | 0,233 | 0,113 | 0,867 |
| IL-10 (pg/ml), media (DE) | 4,55 (1,01) | 6,47 (7,88) | 5,17 (1,94) | 6,66 (7,15) | 0,127 | 0,479 | 0,338 | 0,683 | 0,126 |
| TNF-α (pg/ml), media (DE) | 4,03 (0,19) | 4,04 (0,20) | 6,46 (5,35) | 6,33 (4,80) | <0,001* | 0,001* | 0,628 | 0,487 | <0,001* |
V1: visita 1; V2: visita 2.
El síndrome post-COVID, y dentro de este la fatiga, es una nueva entidad con gran relevancia por su incidencia y la discapacidad que asocia. Además, su fisiopatología aún no está dilucidada, lo que hace necesario investigar para profundizar en su conocimiento y posibles alternativas terapéuticas. En este contexto se enmarca este trabajo. Nuestros resultados muestran que ambos grupos (casos con fatiga y controles o pacientes sin fatiga) son similares en cuanto a presentación, sexo y edad, con un predominio de mujeres y una edad media de 50años, tal y como se describen en otras series32. La mayoría de los pacientes estudiados tienen al menos estudios secundarios, el 70% se encuentran en situación activa y la gran mayoría presentan un nivel socioeconómico medio o incluso alto, sin haber diferencias entre ambos grupos.
En cuanto a los síntomas de presentación de la infección aguda, destacar que los pacientes con fatiga tienen una sintomatología similar a los del grupo sin fatiga, salvo una tendencia sin significación estadística en la tos y significativa en la disnea, no encontrándose presentaciones que permitan definir un mayor riesgo de fatiga. Estos resultados están en línea con lo previamente publicado y con la hipótesis de que los síntomas iniciales no predicen ni influyen en la aparición de fatiga ni otros síntomas propios del síndrome post-COVID33. Entre las comorbilidades previas, destacar como estadísticamente significativa la presencia de obesidad. Es conocido el papel de la obesidad como factor predisponente para el desarrollo de una COVID de mayor gravedad34. No hay datos publicados sobre post-COVID y obesidad previa. En base a la hipótesis de que la fisiopatología del síndrome post-COVID pudiera deberse a una inflamación crónica mantenida35, y dado que las personas con obesidad tienen mayor actividad inflamatoria crónica36, podría ser un factor predisponente para el desarrollo del síndrome.
Los síntomas neurológicos más frecuentemente descritos por los pacientes sobre su sintomatología en el momento de la entrevista fueron: fatiga, cefalea, disnea, problemas de sueño, somnolencia, fallos de memoria, depresión, ansiedad y mialgias, habiendo diferencias estadísticamente significativas entre fatiga, disnea y cefalea en el grupo de casos con fatiga frente al grupo de pacientes sin fatiga, similar a lo que describen otras series32.
El estudio se realiza por primera vez en abril de 2021, justo al inicio de la vacunación en población general. En la primera visita, solo el 40% de los pacientes estaban vacunados, en parte por haber pasado recientemente la COVID. A los 6meses, con un 97% de vacunación en ambos grupos, no refieren haber notado empeoramiento de los síntomas tras la misma, lo que, a falta de otros estudios que confirmen este hallazgo, apunta a que la vacunación no empeora el cuadro.
Centrándonos en la fatiga, destacar que la prevalencia de la fatiga disminuye al alejarse temporalmente del proceso agudo, a diferencia de su intensidad, que persiste moderada tanto al inicio como en visita y control. Otro dato a destacar es que, a pesar de ser de predominio mixto, a los 6meses se observa en el grupo de casos una leve mejoría de la fatiga física, estadísticamente significativa, y una tendencia a empeorar la psicológica, estadísticamente significativa. En el grupo control se objetiva un empeoramiento global en las puntuaciones de fatiga. Clínicamente esto podría justificarse por el hecho de que las puntuaciones en la escala de fatiga, para ser control, debían puntuar muy bajo: un pequeño cambio en la escala, que clínicamente no sería significativo, en la traducción estadística podría ser significativo, demostrando así la gran sensibilidad de la escala. En esta misma línea, al comparar ambos grupos en el tiempo llama la atención que los resultados son estadísticamente significativos por empeoramiento en la fatiga psicológica, no habiéndose encontrado razones que puedan justificar estos hallazgos, lo que puede abrir una vía a estudiar el mecanismo que subyace bajo esta fatiga.
Así mismo, se objetiva en nuestro estudio que los pacientes del grupo de fatiga tienen diferencias estadísticamente significativas en cuanto a las puntuaciones sobre problemas de sueño, somnolencia, ansiedad y depresión. Esta sintomatología se presenta con mayor frecuencia que en el grupo control de pacientes sin fatiga. Tanto la ansiedad como la somnolencia y la calidad de vida mejoran, de manera estadísticamente significativa, a los 6meses, y estas diferencias se encuentran también en el análisis de diferencias entre grupos a lo largo del tiempo.
Sin embargo, en el deterioro cognitivo no hay diferencias entre grupos si se analizan las diferencias por visitas. Este hecho se podría justificar por el elevado número de sujetos, tanto entre los casos como entre los controles (30 vs 23%), que en la visita basal muestran afectación cognitiva en los test realizados. Pero cuando se mira la evolución en el tiempo, a los 6meses, tanto entre grupos por separado como la diferencia encontrada entre ambos, sí que se objetivan diferencias estadísticamente significativas, lo que muestra que, al igual que ocurría con la fatiga, el deterioro cognitivo mejora con el paso del tiempo.
Se hizo análisis de correlación, en el que no hay significación estadística, por lo que se concluye que en nuestra serie no se muestra una asociación entre la fatiga y el deterioro cognitivo, mostrándose como síntomas independientes y con una mejoría evolutiva en la cognición, que también es independiente de la fatiga. En cuanto a la independencia entre la cognición y la fatiga, nuestros resultados confirman lo apuntado previamente en un estudio reciente37, probablemente porque los mecanismos fisiopatológicos que subyacen bajo la fatiga y el deterioro cognitivo en pacientes con síndrome post-COVID puedan estar en relación con diferentes áreas cognitivas menos exploradas y estudiadas en los test utilizados, o bien impliquen diferentes regiones y redes cerebrales, por lo que harían falta estudios más exhaustivos con neuroimagen para localizarlas. Recientemente Díez-Cirarda et al.38 han publicado un artículo donde presentan 86 pacientes con síndrome post-COVID y los comparan con 36 voluntarios sanos. Los autores encuentran menor conectividad entre las áreas parahipocampales izquierda y derecha, orbitofrontal y cerebelosa que la encontrado en los controles.
Normalmente la fatiga se asocia con afectación a nivel del tronco cerebral39, mientras que la afectación cognitiva sería más en la zona frontal y frontoparietal40, pero hay variabilidad, como así demuestran los diferentes estudios llevados a cabo sobre el tema. Delorme et al.41 realizaron un estudio con tomografía por emisión de positrones con fluorodesoxiglucosa (PET-FDG) para valorar el metabolismo de la glucosa en pacientes con COVID-19 y fatiga. Encontraron un hipometabolismo frontal y un hipermetabolismo cerebeloso, que podrían estar implicados en la fatiga. Guedj et al.42, en 35 pacientes, también encontraron hipometabolismo cerebral que afecta a giro recto/orbitario, del lóbulo temporal derecho con extensión al tálamo ipsilateral, de la protuberancia y del cerebelo, relacionando esta última área con las quejas cognitivas. Finalmente, Rudroff et al.43 presenta otro estudio revisando varios artículos sobre PET y afectación en post-COVID en el que sus conclusiones son que la zona principalmente afectada es la zona frontal, o al menos la zona frontal de las redes corticosubcorticales.
Así mismo, destacar que en el grupo control (sin fatiga) el porcentaje encontrado de pacientes con afectación cognitiva objetivada en test neuropsicológicos de cribado (23%) es llamativamente superior (2,5%) al manifestado subjetivamente por los pacientes. Concuerda con lo publicado en un artículo en el que los autores, como subanálisis, estudiaban si había más afectación cognitiva en pacientes con quejas cognitivas o no; y los resultados eran negativos, es decir, al igual que en nuestro estudio, encontraron pacientes con alteraciones cognitivas en los test, y los pacientes no eran conscientes de ello44. Esta minimización subjetiva del deterioro cognitivo frente a otras sintomatologías más relacionadas con la afectividad ya ha sido previamente descrita recientemente por Delgado-Alonso et al.45, que describen una personalidad relacionada con el síndrome post-COVID que se caracteriza por enfatizar la depresión y la ansiedad, pero no así el deterioro cognitivo.
Como ya hemos adelantado, nuestros resultados muestran que los pacientes con fatiga obtienen puntuaciones significativamente más elevadas en las escalas de síntomas depresivos y ansiedad que los del grupo sin fatiga, lo que podría hacernos pensar en una relación etiológica entre estos síntomas y la sensación de fatiga. Sin embargo, habría que realizar estudios más dirigidos para demostrar esta causalidad, puesto que la afectación del estado de ánimo puede ser una consecuencia del propio síndrome post-COVID o de la propia fatiga. De hecho, se observa una mejora significativa en la ansiedad a lo largo del tiempo, y no así en la fatiga. Así mismo destacar que las puntuaciones de depresión se mantienen estables a lo largo del tiempo, a diferencia de la ansiedad, que mejora, al igual que encuentra el grupo de Mazza el al.46. Los autores lo relacionan con el estado inflamatorio persistente y las características individuales (sexo e historia previa psiquiátrica) de los pacientes incluidos. ¿Podría haber relación entre los síntomas depresivos con una fatiga más psicológica y la ansiedad con una fatiga más física? De ser así, podrían relacionarse con los resultados encontrados en nuestro estudio, pero lo cierto es que no hemos hallado evidencias que confirmen estos resultados. Pero en otro estudio de Mazza el al.21 se evalúa la fatiga a lo largo del tiempo, y se comprueba que esta se mantiene en el tiempo e incluso empeora en intensidad a lo largo del primer año. La depresión después de la COVID-19 es el único factor que encuentran como predictor de presencia de fatiga a los 6 y 12meses del inicio de la clínica. Los autores postulan que a su vez podrían retroalimentarse y podrían tener una base fisiopatológica común como es la neuroinflamación21.
En cuanto al sueño, se sabe que es fundamental para la homeostasis del organismo y la capacidad cognitiva. El sueño está regulado, entre otros, por el hipotálamo y el sistema nervioso autónomo47. Está descrito que los trastornos del sueño pueden generar problemas cardiovasculares, cognitivos, y provocar un estado de baja inflamación continuo48. Así mismo, se sabe que el virus, tanto directa como indirectamente, puede provocar una disfunción del tronco cerebral14. En pacientes con síndrome de fatiga crónica (SFC), que presentan clínica similar en algunos aspectos a la de los pacientes con síndrome post-COVID, se han encontrado correlaciones entre la severidad de los síntomas de SFC y la disfunción del tronco cerebral, en concreto del sistema reticular ascendente49. Estos hallazgos, de afectación del tronco, podrían justificar los trastornos del sueño, que, a su vez, podrían generan un estado crónico de inflamación que perpetuaría el cuadro22. El hecho de que haya mayor afectación de sueño en el grupo de los pacientes con fatiga podría correlacionarse con la hipótesis que sostenemos de que el síndrome es consecuencia de un estado de inflamación de bajo grado50. En nuestro estudio se realizó un análisis de correlación entre citoquinas inflamatorias y alteraciones del sueño, no pudiendo llegar a confirmarse esta hipótesis, ya que no se encontraron diferencias significativas, quizá debido al escaso tamaño muestral.
Recientemente se ha publicado un artículo de revisión sobre la fisiopatología de la fatiga del síndrome post-COVID12. Los autores postulan que podría deberse a una neuroinflamación del cerebro secundaria a la infección del SARS-CoV-2 o a una inflamación sistémica secundaria activación el sistema inmune innato cerebral a través de señales humorales o vías retrógradas (nervio vago), de tal manera que la respuesta inmune frente al SARS-CoV-2 generaría citoquinas proinflamatorias que serían la causa de múltiples síntomas del síndrome post-COVID. En el estudio de citoquinas de perfil inflamatorio y antiinflamatorio que hemos llevado a cabo únicamente se encuentran diferencias estadísticamente significativas en los valores de TNF-α en el análisis entre grupos a lo largo del tiempo. Sí que se observa una tendencia, de modo que los niveles de IL-6 (citoquina inflamatoria) están más elevados en el grupo de fatiga, y los de IL-10 (citoquina antiinflamatoria) lo están en el grupo que no presenta fatiga (control); diferencias que se mantienen en la visita de control a los 6meses. Estas tendencias son congruentes con la hipótesis proinflamatoria que habría de ser confirmada en estudios con mayor número de pacientes o cambio de diseño (comparación con voluntarios sanos). Mazza et al.46 analizaron síntomas neurocognitivos y depresión tres meses después de haber pasado la COVID-19 junto con un estudio de parámetros inflamatorios (PCR, ratio neutrófilos/linfocitos, ratio monocitos/linfocitos) y el índice inmuno-inflamatorio (plaquetas ×neutrófilos/linfocitos). Los resultados muestran mayores elevaciones de estos parámetros en pacientes que presentan síntomas 3meses después. En un metaanálisis16 que valora la fatiga y el deterioro cognitivo en pacientes con síndrome post-COVID se encuentran elevaciones de marcadores periféricos, como pueden ser elevación de proteínaC reactiva o dímeroD, y elevación de citoquinas inflamatorias, como pueden ser las IL-17A, IL-1β, IL-6, en el grupo de pacientes, refiriendo los autores una asociación entre la elevación de los parámetros inflamatorios y la sintomatología post-COVID. La principal diferencia con nuestro estudio es que los comparan con voluntarios sanos y no se muestran resultados de la evolución en el tiempo.
En cuanto a la calidad de vida, los pacientes con fatiga presentan peor calidad de vida que los controles, si bien se observa una mejoría a los 6meses, haciendo falta estudios más prolongados para confirmar que esta diferencia es limitada en el tiempo.
Limitaciones del estudioSe trata de un estudio observacional y con un número limitado de pacientes. Así mismo, no hay representación de los pacientes que requirieron ingreso en la unidad de medicina intensiva, si bien esto hubiese incluido en el síndrome múltiples distractores al ingreso en unidades críticas que habrían podido interferir en la validez de los resultados.
ConclusionesSegún los datos de nuestro estudio, podemos concluir que los pacientes con fatiga post-COVID presentan una fatiga moderada que afecta a su calidad de vida, pero se observa una mejoría evolutiva a los 6meses. La única comorbilidad previa asociada a la fatiga de manera estadísticamente significativa ha sido la obesidad. El cuadro neurológico de los pacientes con fatiga se acompaña de problemas de sueño, mayores puntuaciones en cuestionarios de depresión, ansiedad, y a los 6meses mejoran varios de ellos: calidad de vida, ansiedad, somnolencia y la afectación cognitiva. Se objetivan alteraciones significativas en TNF-α y cierta tendencia hacia la proinflamación en los pacientes con fatiga, sin llegar a ser estadísticamente significativos.
FinanciaciónLa presente investigación ha recibido ayudas provenientes de fondos propios del Servicio de Neurología, Hospital San Pedro.
Conflicto de interesesNo se declaran conflictos de intereses.
A José Ramón Blanco, M. Eugenia Marzo, M. Jesús Chinchetru, María Barrios y Lourdes Romero. Y a todos los pacientes que han participado.