El síndrome de pseudotumor cerebri (SPTC) en pacientes prepuberales presenta características que lo diferencian respecto a su presentación en la etapa pospuberal. Nuestro objetivo es describir las características de los pacientes diagnosticados de SPTC pediátrico en nuestro centro y compararlas en función de su estado puberal.
Pacientes y métodosSe incluyeron a los pacientes diagnosticados de SPTC en un hospital de tercer nivel entre los años 2006 y 2019 con edades comprendidas entre uno y 18 años que cumplieran los criterios diagnósticos actualizados del SPTC. Se clasificaron en función de su estado puberal y peso corporal. Posteriormente, se analizaron los datos de las punciones lumbares, estudios de neuroimagen, valoraciones oftalmológicas, así como el régimen terapéutico recibido a lo largo de su seguimiento.
ResultadosSe recogieron 28 pacientes, 22 prepuberales y seis pospuberales, con edad media de 9,04 ± 2,86 años. El 83,3% de los pacientes pospuberales eran varones presentando sobrepeso/obesidad en el 66,7%. Eran varones el 27% de los pacientes prepuberales, de ellos asociaban sobrepeso el 31,8%. La sintomatología más frecuente fue cefalea (89,9%) y visión borrosa (42,9%). Todos los pacientes presentaron papiledema; un 21,4% de los casos presentaron parálisis del VI par. Se identificó un posible desencadenante en un 28,6%. El 19% presentaron recurrencia clínica, siendo todos ellos prepuberales. La resolución clínica completa se produjo en el 55,6% de los pacientes.
ConclusiónPacientes con SPTC presentan menor prevalencia de obesidad en la etapa prepuberal, junto con un mayor porcentaje de etiologías secundarias y tasa de recurrencia que los pacientes pospuberales.
Pseudotumor cerebri (PC) in prepubertal patients displays certain characteristics that differentiate it from its presentation at the postpubertal stage. The aim of this study is to describe the characteristics of paediatric patients diagnosed with PC at our centre and to compare them according to their pubertal status.
Patients and methodsWe included patients aged between 1 and 18 years who were diagnosed with PC in a tertiary-level hospital between 2006 and 2019 and who met the updated diagnostic criteria for PC. They were classified according to body weight and pubertal status. Subsequently, we analysed results from lumbar punctures, neuroimaging studies, ophthalmological assessments, and treatments received during follow-up.
ResultsWe included 28 patients, of whom 22 were of prepubertal age and 6 were of postpubertal age. The mean age (standard deviation) was 9.04 (2.86) years. Among the postpubertal patients, 83.3% were boys, 66.7% of whom presented overweight/obesity. In the group of prepubertal patients, 27% were boys, 31.8% of whom were overweight. The most frequent symptoms were headache (89.9%) and blurred vision (42.9%). All patients presented papilloedema, and 21.4% manifested sixth nerve palsy. Possible triggers were identified in 28.6% of cases. Nineteen percent of patients presented clinical recurrence, all of whom were prepubertal patients. Complete clinical resolution was achieved in 55.6% of patients.
ConclusionPrepubertal patients with PC show lower prevalence of obesity, higher prevalence of secondary aetiologies, and higher recurrence rates than postpubertal patients.
El cuadro clínico del síndrome de pseudotumor cerebri (SPTC) en la población pediátrica ha mostrado tener características diferenciales respecto a su presentación en la vida adulta1.
Este síndrome se define como el conjunto de síntomas (cefalea, disminución de visión) y signos (papiledema, parálisis del VI par), derivados de un aumento de la presión intracraneal en ausencia de lesión estructural en neuroimagen y normalidad en la composición del líquido cefalorraquídeo (LCR). Según se encuentre o no un factor desencadenante del cuadro, se cataloga como primario (hipertensión intracraneal idiopática) o secundario2.
Su patogenia se cree que es debida a una alteración en la circulación del LCR, bien por un aumento de su producción o disminución de su absorción3; siendo la disfunción del sistema glinfático recientemente involucrado en su desarrollo4,5.
Aunque su presentación en la vida adulta suele asociarse con obesidad y a un claro predominio del sexo femenino6,7; esta predilección ha sido descrita en la población pediátrica únicamente en su etapa pospuberal8,9. Otras características diferenciadoras del SPTC pediátrico son el mayor porcentaje de casos secundarios, así como la mayor frecuencia de pacientes asintomáticos como forma de presentación10, siendo el hallazgo incidental de papiledema en estos pacientes el motivo inicial de estudio.
Sin embargo, estas características diferenciadoras no han sido descritas de forma homogénea en las distintas series de SPTC pediátrico. Recientemente, Mosquera et al.11 mostraron un 41% de casos secundarios, sin presentar ninguno de sus pacientes obesidad. Datos que contrastan con el 20% de adolescentes obesos descrito por Bhalla et al.12, en cuya serie únicamente encontró un 16% de SPTC pediátrico secundario.
Dada la presencia de resultados discordantes en la literatura, consideramos necesario seguir profundizando en el estudio del SPTC pediátrico. El objetivo de este estudio es analizar las características epidemiológicas, clínicas y pronósticas de los pacientes pediátricos diagnosticados de SPTC en nuestro centro y compararlas en función de su estado puberal.
Pacientes y métodosSe trata de un estudio longitudinal retrospectivo descriptivo, donde se revisaron los pacientes diagnosticados de SPTC pediátrico por la Unidad de Neurología Pediátrica de un hospital de tercer nivel entre febrero de 2006 y noviembre de 2019.
Los criterios de inclusión fueron pacientes con edades comprendidas entre uno y 18 años en el momento del diagnóstico, que cumpliesen los criterios diagnósticos del SPTC de la última actualización realizada por Friedman et al.2 Se exigía una presión de apertura (PA) mayor de 25 cm H2O (28 cm H2O, en caso de sedación u obesidad), para el diagnóstico definitivo y una PA mayor de 20 cm H2O, sin alcanzar umbral para el diagnóstico probable. Se excluyeron aquellos pacientes de los que no se dispusiera de registro de PA de LCR, así como a los pacientes diagnosticados de pseudopapiledema sin otra clínica sugestiva de hipertensión intracraneal.
La valoración inicial de los pacientes incluía una anamnesis, exploración física y estudio oftalmológico con fundoscopia y medición de la agudeza visual (AV). Tras descartar lesiones ocupantes de espacio en la tomografía axial computarizada (TAC) craneal, se llevaba a cabo un estudio con resonancia magnética (RM) craneal, con y sin contraste, y en la mayoría de los pacientes una angio-RM en fase venosa. La punción lumbar se efectuaba bajo sedación en posición de decúbito lateral y rodillas en extensión para la medición de la PA. Se realizaba estudio con bioquímica, hemograma, serologías, autoinmunidad, así como estudio hormonal para descartar causas secundarias. Un estudio con campimetría de Humphrey y tomografía de coherencia óptica (OCT) papilar Spectralis se realizaba en pacientes colaboradores.
Una vez alcanzado el diagnóstico, se iniciaba tratamiento con acetazolamida (ACZ) en dosis de 15-25 mg/kg, subiéndose progresivamente según respuesta. En el seguimiento de los pacientes se monitorizaba la presencia de cefalea, así como la función visual a través de fundoscopia, AV, OCT, campimetría y en algunos pacientes PEV (potenciales evocados visuales) y ecografía de nervio óptico. En aquellos con ausencia de respuesta al tratamiento se asociaban otros fármacos como: furosemida, prednisona, espironolactona, topiramato o tratamiento quirúrgico (derivación ventrículo peritoneal [DVP] o derivación lumboperitoneal [DLP]) en caso de compromiso visual severo.
Las variables estudiadas fueron: edad, sexo, presentación clínica, exploración física (AV, fundoscopia, parálisis del VI par craneal), comorbilidad, hallazgos en pruebas de laboratorio, neuroimagen, punción lumbar con PA, campimetría y OCT, modalidad de tratamiento/efectos secundarios, tiempo de seguimiento, resolución clínica y presencia o no de recurrencia.
Los pacientes fueron categorizados en función del percentil (p) de índice de masa corporal ajustado por edad en: normopeso (p ≥ 5° y ˂ 85°), sobrepeso (p ≥ 85° y ˂ 95°) u obesidad (p 95°). La variable grupo de peso se recodificó a dicotómica: peso normal (normopeso) o peso aumentado (sobrepeso más obesidad).
Adicionalmente, se clasificaron con base en su edad en tres grupos: 1-5 años, 6-11 años y 12-18 años. Basándonos en estudios previos, los pacientes se agruparon en prepuberales, menores de 12 años y pospuberales, igual o mayores de 12 años9,13. Se llevó a cabo un estudio descriptivo de frecuencias absolutas y relativas para las variables cualitativas; utilizando la media y la desviación típica para representar las cuantitativas
El contraste de hipótesis se realizó de forma bilateral, empleando el test exacto de Fisher para la comparación de porcentajes entre los diferentes subgrupos, considerándose estadísticamente significativo si p < 0,05. La información fue registrada, procesada y analizada utilizando el programa estadístico SPSS Statistics v. 25 (IBM Corp., Armonk, NY, EE. UU.).
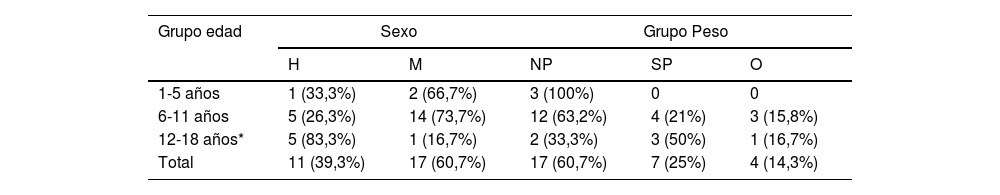
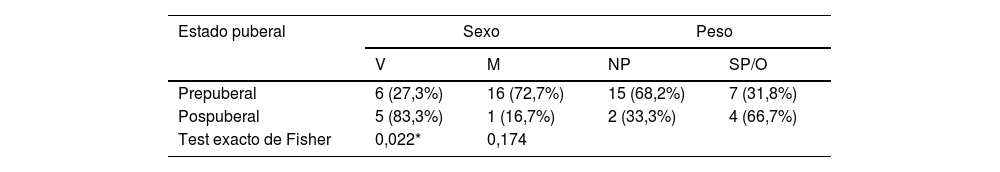
ResultadosCaracterísticas clínicasSe identificaron un total de 31 pacientes con diagnóstico de SPTC, tres de ellos fueron excluidos al no cumplir criterios diagnósticos, quedando finalmente 28. Del total de sujetos, 17 (60,3%) eran mujeres, siendo los 11 restantes (39,7%) varones. La edad media ± desviación típica fue de 9,04 ± 2,86 años. La distribución del sexo y categoría de peso en función de la edad aparece representada en la tabla 1. Se analizó la distribución del sexo y de la presencia o no de aumento de peso, según el estado puberal (tabla 2).
Distribución del sexo y grupo de peso en función de la edad
| Grupo edad | Sexo | Grupo Peso | |||
|---|---|---|---|---|---|
| H | M | NP | SP | O | |
| 1-5 años | 1 (33,3%) | 2 (66,7%) | 3 (100%) | 0 | 0 |
| 6-11 años | 5 (26,3%) | 14 (73,7%) | 12 (63,2%) | 4 (21%) | 3 (15,8%) |
| 12-18 años* | 5 (83,3%) | 1 (16,7%) | 2 (33,3%) | 3 (50%) | 1 (16,7%) |
| Total | 11 (39,3%) | 17 (60,7%) | 17 (60,7%) | 7 (25%) | 4 (14,3%) |
H: hombre; M: mujer; NP: normopeso; O: obesidad; SP: sobrepeso.
Distribución de peso y sexo, según estado puberal
| Estado puberal | Sexo | Peso | ||
|---|---|---|---|---|
| V | M | NP | SP/O | |
| Prepuberal | 6 (27,3%) | 16 (72,7%) | 15 (68,2%) | 7 (31,8%) |
| Pospuberal | 5 (83,3%) | 1 (16,7%) | 2 (33,3%) | 4 (66,7%) |
| Test exacto de Fisher | 0,022* | 0,174 | ||
M: mujer; NP: normopeso; O: obesidad; SP: sobrepeso; V: varón.
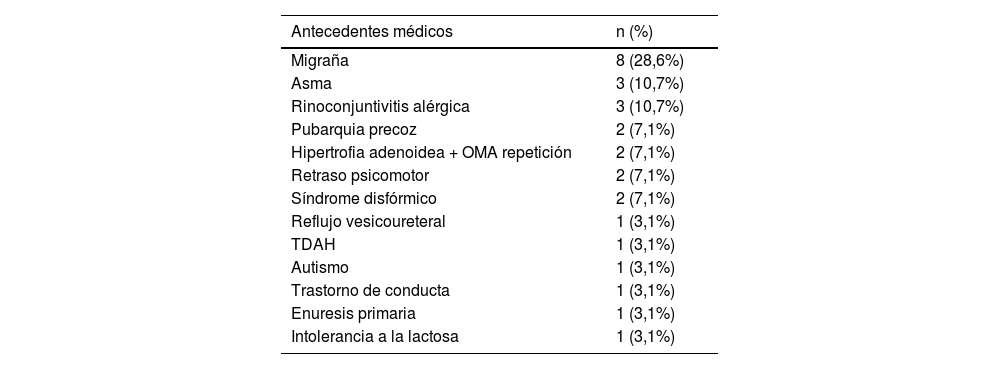
En la presentación clínica de los pacientes seleccionados no se halló ningún paciente asintomático, el conjunto de síntomas con el que debutaron se expresan en la tabla 3. En el 53,6% de los pacientes se identificó al menos un antecedente médico, cuya frecuencia se representa en la tabla 4.
Síntomas en la presentación del SPTC pediátrico
| Sintomatología | n (%) |
|---|---|
| Cefalea | 25 (89,3%) |
| Visión borrosa | 12 (42,9%) |
| Náuseas/Vómitos | 11 (39,3%) |
| Diplopía | 9 (32,1%) |
| Fotofobia | 7 (25%) |
| Sonofobia | 7 (25%) |
| Mareo | 1 (3,1%) |
| Dolor ocular | 4 (14,3%) |
| Fosfenos | 4 (14,3%) |
| Apagones | 3 (10,7%) |
| Tinnitus | 3 (10,7%) |
| Cervicalgia | 3 (10,7%) |
| Lumbalgia | 2 (7,1%) |
SPTC: síndrome de pseudotumor cerebri.
Antecedentes médicos pacientes SPTC pediátrico
| Antecedentes médicos | n (%) |
|---|---|
| Migraña | 8 (28,6%) |
| Asma | 3 (10,7%) |
| Rinoconjuntivitis alérgica | 3 (10,7%) |
| Pubarquia precoz | 2 (7,1%) |
| Hipertrofia adenoidea + OMA repetición | 2 (7,1%) |
| Retraso psicomotor | 2 (7,1%) |
| Síndrome disfórmico | 2 (7,1%) |
| Reflujo vesicoureteral | 1 (3,1%) |
| TDAH | 1 (3,1%) |
| Autismo | 1 (3,1%) |
| Trastorno de conducta | 1 (3,1%) |
| Enuresis primaria | 1 (3,1%) |
| Intolerancia a la lactosa | 1 (3,1%) |
SPTC: síndrome de pseudotumor cerebri; OMA: otitis media aguda; TDAH: trastorno por déficit de atención e hiperactividad.
En la exploración neurológica, seis pacientes (21,4%) presentaron una oftalmoparesia del VI par craneal, siendo esta en el 50% de los casos, bilateral; en dos pacientes se detectó una exotropía alternante. Se recogió una AV menor de 1 en ocho pacientes (30,8%), de ellos únicamente tres presentaron una AV inferior a 0,5. En 23 pacientes (82,1%) se describió papiledema bilateral, en uno (3,6%) unilateral y en cuatro (14,3%) se planteó el diagnóstico diferencial con pseudopapiledema. La presencia de hemorragias en astillas se detectó en seis pacientes (21,4%) de forma unilateral.
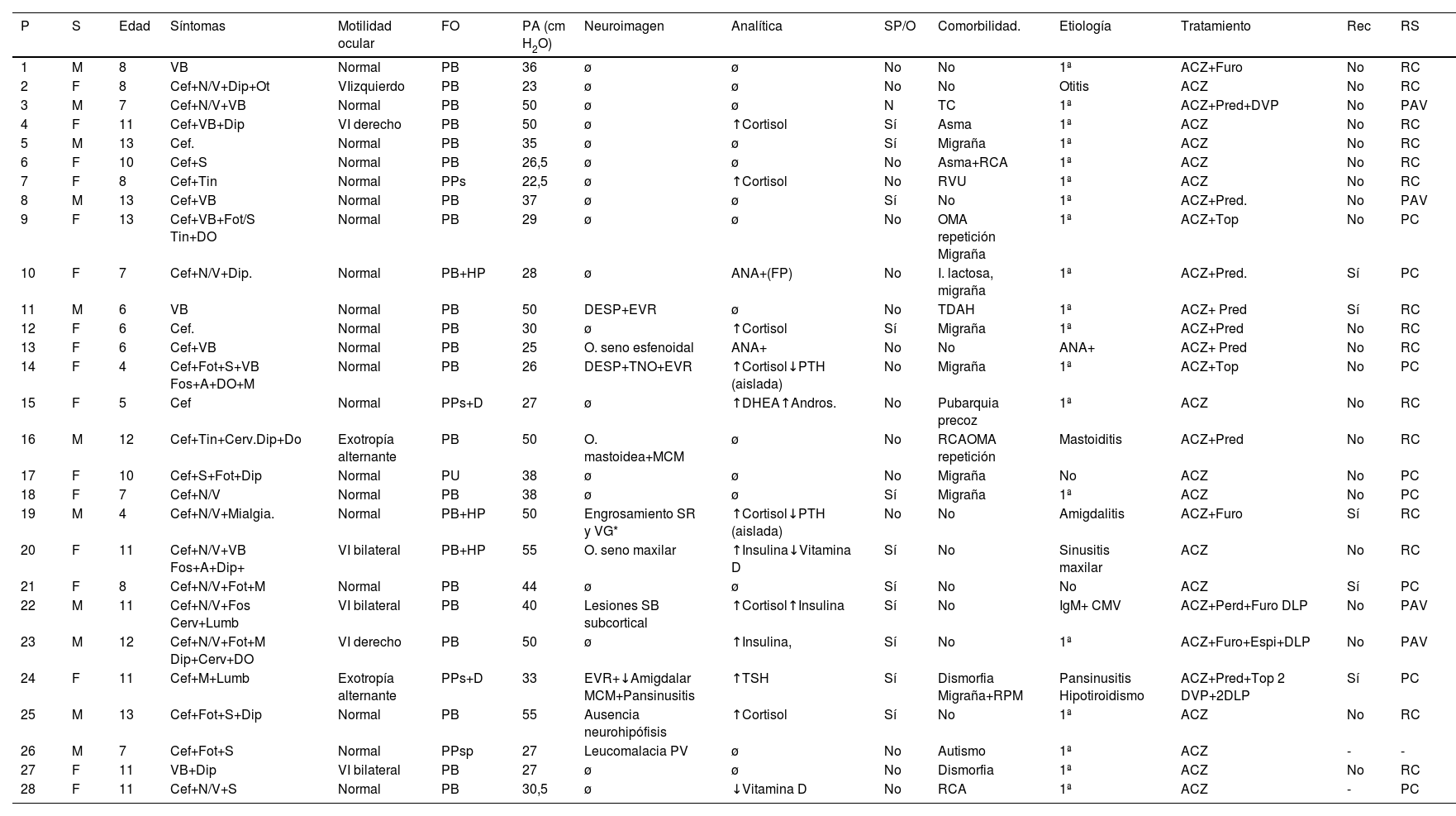
Pruebas complementariasEn todos los pacientes se llevó a cabo una RM craneal que se completó con angio-RM venosa en el 88,5% de los casos. En cuatro pacientes (14,3%) se describió una distensión del espacio subaracnoideo perióptico (DESP), añadiendo tortuosidad del nervio óptico (TNO) en uno de ellos. Ninguno presentó aplanamiento de globo ocular (AGO), estenosis de senos transversos (EST) o silla turca vacía (STV). Otros hallazgos de neuroimagen fueron: sinusopatía cuatro (13,4%), dilatación de los espacios de Virchow-Robin (EVR) tres (10,7%), megacisterna magna dos (7,1%), alteraciones de la señal de intensidad inespecíficas subcorticales dos (7,1%), descenso amigdalar uno (3,6%), ocupación mastoidea uno (3,6%) o ausencia de neurohipófisis uno (3,6%). Otros resultados se recogen en la tabla 5, junto con otras características de los pacientes.
Características de pacientes con síndrome de pseudotumor cerebri
| P | S | Edad | Síntomas | Motilidad ocular | FO | PA (cm H2O) | Neuroimagen | Analítica | SP/O | Comorbilidad. | Etiología | Tratamiento | Rec | RS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 8 | VB | Normal | PB | 36 | ø | ø | No | No | 1ª | ACZ+Furo | No | RC |
| 2 | F | 8 | Cef+N/V+Dip+Ot | VIizquierdo | PB | 23 | ø | ø | No | No | Otitis | ACZ | No | RC |
| 3 | M | 7 | Cef+N/V+VB | Normal | PB | 50 | ø | ø | N | TC | 1ª | ACZ+Pred+DVP | No | PAV |
| 4 | F | 11 | Cef+VB+Dip | VI derecho | PB | 50 | ø | ↑Cortisol | Sí | Asma | 1ª | ACZ | No | RC |
| 5 | M | 13 | Cef. | Normal | PB | 35 | ø | ø | Sí | Migraña | 1ª | ACZ | No | RC |
| 6 | F | 10 | Cef+S | Normal | PB | 26,5 | ø | ø | No | Asma+RCA | 1ª | ACZ | No | RC |
| 7 | F | 8 | Cef+Tin | Normal | PPs | 22,5 | ø | ↑Cortisol | No | RVU | 1ª | ACZ | No | RC |
| 8 | M | 13 | Cef+VB | Normal | PB | 37 | ø | ø | Sí | No | 1ª | ACZ+Pred. | No | PAV |
| 9 | F | 13 | Cef+VB+Fot/S Tin+DO | Normal | PB | 29 | ø | ø | No | OMA repetición Migraña | 1ª | ACZ+Top | No | PC |
| 10 | F | 7 | Cef+N/V+Dip. | Normal | PB+HP | 28 | ø | ANA+(FP) | No | I. lactosa, migraña | 1ª | ACZ+Pred. | Sí | PC |
| 11 | M | 6 | VB | Normal | PB | 50 | DESP+EVR | ø | No | TDAH | 1ª | ACZ+ Pred | Sí | RC |
| 12 | F | 6 | Cef. | Normal | PB | 30 | ø | ↑Cortisol | Sí | Migraña | 1ª | ACZ+Pred | No | RC |
| 13 | F | 6 | Cef+VB | Normal | PB | 25 | O. seno esfenoidal | ANA+ | No | No | ANA+ | ACZ+ Pred | No | RC |
| 14 | F | 4 | Cef+Fot+S+VB Fos+A+DO+M | Normal | PB | 26 | DESP+TNO+EVR | ↑Cortisol↓PTH (aislada) | No | Migraña | 1ª | ACZ+Top | No | PC |
| 15 | F | 5 | Cef | Normal | PPs+D | 27 | ø | ↑DHEA↑Andros. | No | Pubarquia precoz | 1ª | ACZ | No | RC |
| 16 | M | 12 | Cef+Tin+Cerv.Dip+Do | Exotropía alternante | PB | 50 | O. mastoidea+MCM | ø | No | RCAOMA repetición | Mastoiditis | ACZ+Pred | No | RC |
| 17 | F | 10 | Cef+S+Fot+Dip | Normal | PU | 38 | ø | ø | No | Migraña | No | ACZ | No | PC |
| 18 | F | 7 | Cef+N/V | Normal | PB | 38 | ø | ø | Sí | Migraña | 1ª | ACZ | No | PC |
| 19 | M | 4 | Cef+N/V+Mialgia. | Normal | PB+HP | 50 | Engrosamiento SR y VG* | ↑Cortisol↓PTH (aislada) | No | No | Amigdalitis | ACZ+Furo | Sí | RC |
| 20 | F | 11 | Cef+N/V+VB Fos+A+Dip+ | VI bilateral | PB+HP | 55 | O. seno maxilar | ↑Insulina↓Vitamina D | Sí | No | Sinusitis maxilar | ACZ | No | RC |
| 21 | F | 8 | Cef+N/V+Fot+M | Normal | PB | 44 | ø | ø | Sí | No | No | ACZ | Sí | PC |
| 22 | M | 11 | Cef+N/V+Fos Cerv+Lumb | VI bilateral | PB | 40 | Lesiones SB subcortical | ↑Cortisol↑Insulina | Sí | No | IgM+ CMV | ACZ+Perd+Furo DLP | No | PAV |
| 23 | M | 12 | Cef+N/V+Fot+M Dip+Cerv+DO | VI derecho | PB | 50 | ø | ↑Insulina, | Sí | No | 1ª | ACZ+Furo+Espi+DLP | No | PAV |
| 24 | F | 11 | Cef+M+Lumb | Exotropía alternante | PPs+D | 33 | EVR+↓Amigdalar MCM+Pansinusitis | ↑TSH | Sí | Dismorfia Migraña+RPM | Pansinusitis Hipotiroidismo | ACZ+Pred+Top 2 DVP+2DLP | Sí | PC |
| 25 | M | 13 | Cef+Fot+S+Dip | Normal | PB | 55 | Ausencia neurohipófisis | ↑Cortisol | Sí | No | 1ª | ACZ | No | RC |
| 26 | M | 7 | Cef+Fot+S | Normal | PPsp | 27 | Leucomalacia PV | ø | No | Autismo | 1ª | ACZ | - | - |
| 27 | F | 11 | VB+Dip | VI bilateral | PB | 27 | ø | ø | No | Dismorfia | 1ª | ACZ | No | RC |
| 28 | F | 11 | Cef+N/V+S | Normal | PB | 30,5 | ø | ↓Vitamina D | No | RCA | 1ª | ACZ | - | PC |
A: apagones visuales; ACZ: acetazolamida; ANA: anticuerpos antinucleares; Andros: androstenediona; Cef: cefalea; Cerv: cervicalgia; D: drusas peripapilares; DESP: distensión del espacio subaracnoideo perióptico; DHEA: deshidroepiandrosterona; Dip: diplopía; DLP: derivación lumboperitoneal; DO: dolor ocular; DVP: derivación ventrículo peritoneal; EVR: espacios de Virchow-Robin; Espi: espironolactona; F: femenino; FO: fondo de ojo; Fos: fosfenos; Fot: fotofobia; FP: falso positivo; Furo: furosemida; HP: hemorragia peripapilar; Lumb: lumbalgia; M: mareo; M: masculino; MCM: megacisterna magna; N/V: náuseas o vómitos; O: ocupación; OMA: otitis media aguda; Ot: otalgia; P: paciente; PA: presión de apertura; PAV: persistencia de alteración visual; PB: papiledema bilateral; PC: persistencia de cefaleas; PPs: posible pseudopapiledema; Pred: prednisona; PTH: paratohormona; PU: papiledema unilateral; PV: periventricular; Rec.: recurrencia; RC: resolución completa; RCA: rinoconjuntivitis alérgica; RPM: retraso psicomotor; RS: resolución síntomas; RVU: reflujo vesiculoureteral; S: sexo; S: sonofobia; SB: sustancia blanca; SP/O: sobrepeso/obesidad; SR: seno recto; TC: trastorno de conducta; TDAH: trastorno por déficit de atención e hiperactividad; Tin: tinnitus; TNO: tortuosidad del nervio óptico; Top: topiramato; VB: visión borrosa; VG: vena de Galeno; ø: normal; -: datos no registrados.
La media de PA del LCR y su desviación típica fue de 35,05 ± 11,52 cm de H2O. El 32,1% de los pacientes (nueve) fueron clasificados como SPTC probable por presentar PA entre 20 y 28 cm H2O.
En las pruebas de laboratorio se detectó: elevación de cortisol sérico en siete pacientes (25%), hiperinsulinemia en tres pacientes (10,7%), déficit de vitamina D en dos pacientes (7,1%), elevación de deshidroepiandrosterona (DHEA) y androstenediona en un paciente (3,6%), IgM + para CMV en un paciente (3,6%), ANA + en dos pacientes (7,1%), negativizándose en uno de ellos durante el seguimiento. En dos pacientes se detectaron niveles bajos de paratohormona (PTH) de forma aislada y sin repercusión en el metabolismo fosfocálcico.
En ocho de los pacientes (28,6%) se identificó un posible factor desencadenante del cuadro. En seis de ellos una infección de las vías aéreas superiores (uno otitis, uno mastoiditis, uno amigdalitis, dos sinusitis, uno pansinusitis + hipotiroidismo); un paciente con IgM + para CMV asociada con alteraciones de la intensidad de señal inespecíficas en RM y otro paciente con ANA +. No se encontraron diferencias en cuanto a la distribución del sexo y presencia de sobrepeso/obesidad, según se clasificara como primario o secundario. En pacientes con SPTC primario, el 75% eran prepuberales aumentando hasta el 87,7% en el caso de SPTC secundario. No se encontraron diferencias estadísticamente significativas en el porcentaje de pacientes prepuberales, según la etiología del SPTC al aplicar el test exacto de Fisher p = 0,640.
En 21 pacientes (75%) se realizó una OCT papilar, que se informó como normal en cinco pacientes (23,8%), aumento generalizado del grosor de la capa de fibras nerviosas peripapilares (RNFLp) en 12 (57,1%) y aumento sectorial de RNFLp en cuatro (19%). El estudio campimétrico se realizó en 26 pacientes (92,9%), fue informado como no valorable en 10 pacientes (38,5%), normal en cuatro (15,4%) y alterada en 12 (46,15%). Dentro de este grupo: nueve pacientes (75%) presentaron un defecto leve, uno (8,3%) moderado y dos (16,7%) severo. El tipo de defecto campimétrico más frecuente fue aumento de la mancha ciega en cuatro (15,8%), defecto arciforme parcial en cuatro (15,8%) y constricción en dos (7,7%). El estudio con PEV se realizó únicamente en cuatro pacientes (14,3%) siendo normal en todos ellos.
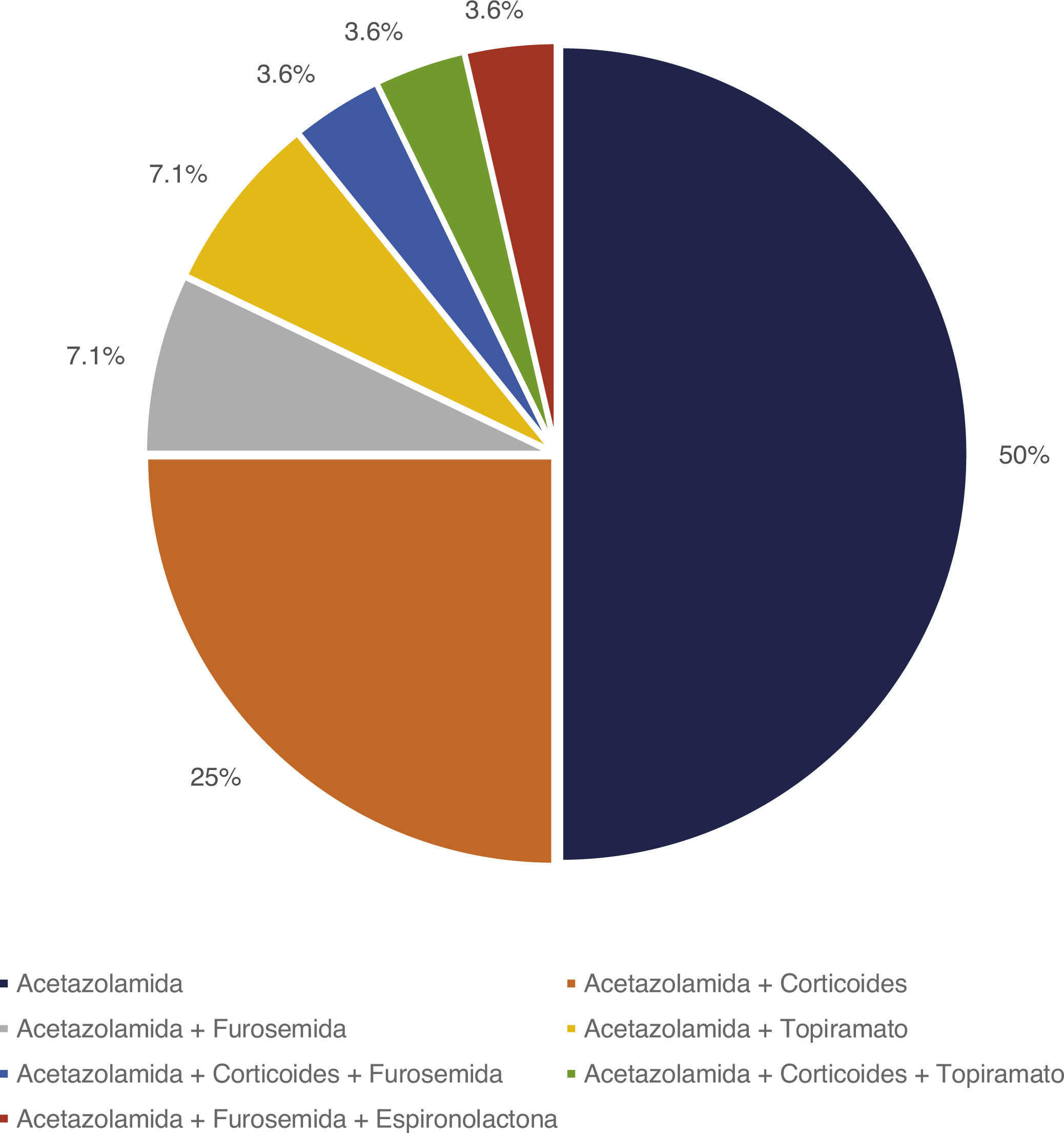
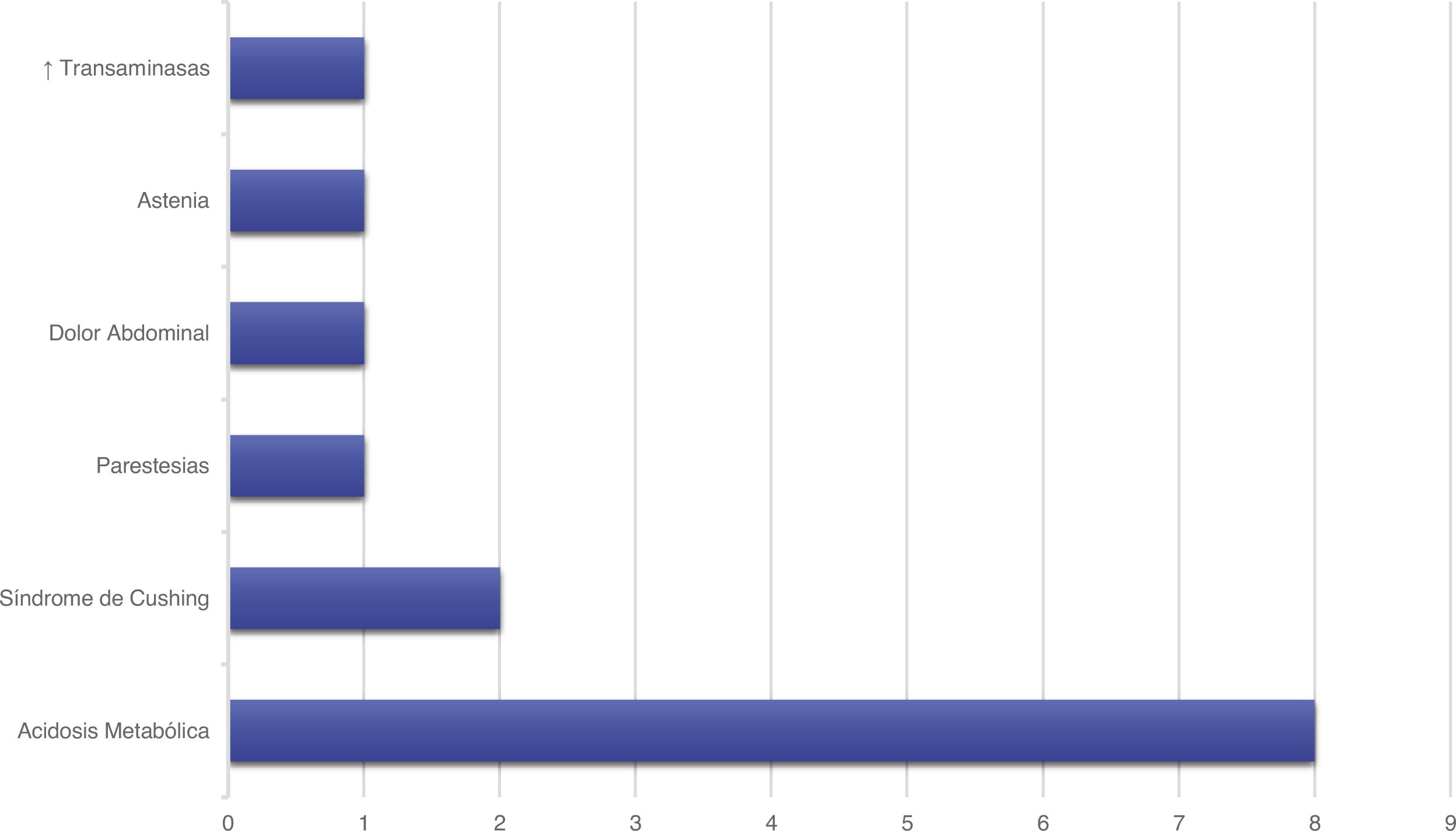
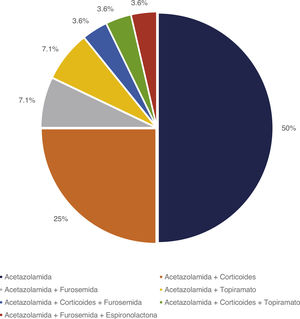
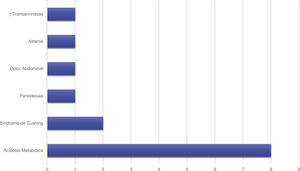
Tratamiento y evoluciónEn todos los pacientes se inició tratamiento con ACZ, añadiéndose otros fármacos en función del grado de respuesta. En la figura 1 se representan los tratamientos farmacológicos administrados. En 12 pacientes (42,9%) aparecieron efectos secundarios representados en la figura 2, en ninguno de ellos condicionó la suspensión del tratamiento médico. Este fue complementado con medidas dietéticas en 10 pacientes (35,7%). La duración media de tratamiento y su desviación típica fue de 39,51 ± 36,48 meses.
En cuatro pacientes (14,3%) se requirió tratamiento quirúrgico por refractariedad del tratamiento médico: DLP en dos pacientes y DVP en un paciente. Un paciente fue sometido a laminectomía C1 (por malformación de Chiari asociada) y DLP que precisó tres reintervenciones: una DLP y dos DVP por disfunción valvular secundaria a infección/obstrucción. Tras una de las intervenciones para DVP presentó un hematoma en tálamo-caudado.
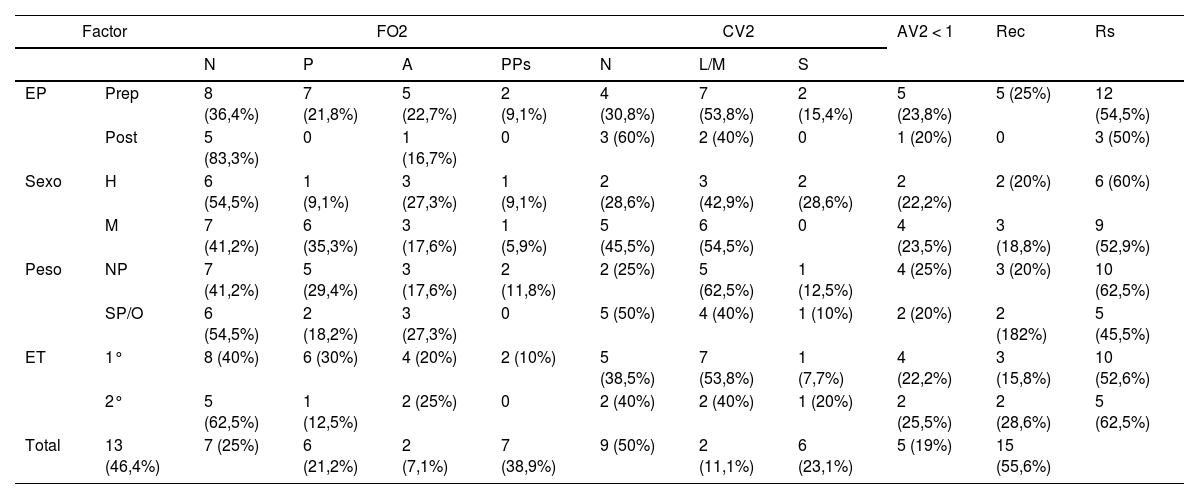
La duración media de seguimiento de los pacientes fue de 18,48 ± 19,31 meses. La fundoscopia, AV, campimetría en la última valoración, así como datos de recurrencia y resolución clínica se representan en la tabla 6. De los 22 pacientes con AV registrada, únicamente en un paciente fue inferior a 0,8. La campimetría se realizó en 21 pacientes, siendo en tres pacientes no valorable.
Pronóstico en función del estado puberal, sexo, peso y etiología del SPTC
| Factor | FO2 | CV2 | AV2 < 1 | Rec | Rs | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N | P | A | PPs | N | L/M | S | |||||
| EP | Prep | 8 (36,4%) | 7 (21,8%) | 5 (22,7%) | 2 (9,1%) | 4 (30,8%) | 7 (53,8%) | 2 (15,4%) | 5 (23,8%) | 5 (25%) | 12 (54,5%) |
| Post | 5 (83,3%) | 0 | 1 (16,7%) | 0 | 3 (60%) | 2 (40%) | 0 | 1 (20%) | 0 | 3 (50%) | |
| Sexo | H | 6 (54,5%) | 1 (9,1%) | 3 (27,3%) | 1 (9,1%) | 2 (28,6%) | 3 (42,9%) | 2 (28,6%) | 2 (22,2%) | 2 (20%) | 6 (60%) |
| M | 7 (41,2%) | 6 (35,3%) | 3 (17,6%) | 1 (5,9%) | 5 (45,5%) | 6 (54,5%) | 0 | 4 (23,5%) | 3 (18,8%) | 9 (52,9%) | |
| Peso | NP | 7 (41,2%) | 5 (29,4%) | 3 (17,6%) | 2 (11,8%) | 2 (25%) | 5 (62,5%) | 1 (12,5%) | 4 (25%) | 3 (20%) | 10 (62,5%) |
| SP/O | 6 (54,5%) | 2 (18,2%) | 3 (27,3%) | 0 | 5 (50%) | 4 (40%) | 1 (10%) | 2 (20%) | 2 (182%) | 5 (45,5%) | |
| ET | 1° | 8 (40%) | 6 (30%) | 4 (20%) | 2 (10%) | 5 (38,5%) | 7 (53,8%) | 1 (7,7%) | 4 (22,2%) | 3 (15,8%) | 10 (52,6%) |
| 2° | 5 (62,5%) | 1 (12,5%) | 2 (25%) | 0 | 2 (40%) | 2 (40%) | 1 (20%) | 2 (25,5%) | 2 (28,6%) | 5 (62,5%) | |
| Total | 13 (46,4%) | 7 (25%) | 6 (21,2%) | 2 (7,1%) | 7 (38,9%) | 9 (50%) | 2 (11,1%) | 6 (23,1%) | 5 (19%) | 15 (55,6%) | |
A: atrofia/palidez papilar; AV2: agudeza visual última revisión; CV2: campimetría última revisión; EP: estadio puberal; ET: etiología; FO2: fundoscopia última revisión; H: hombre; M: mujer; N: normal; L/M: defecto campimétrico leve/moderado; NP: normopeso; O: obesidad; P: papiledema; PPs: probable pseudopapiledema por presencia de drusas peripapilares; Prep: prepuberal; Post: pospuberal; Rec: recurrencia; Rs: resolución sintomatología; S: defecto campimétrico severo; SP: sobrepeso; SPTC: síndrome de pseudotumor cerebri.
En cuanto a la remisión de la sintomatología inicial, 15 de los pacientes (55,6%) refirieron resolución completa de la misma, cuatro (14,8%) de ellos persistencia de alteración visual con mejoría parcial en dos de ellos y finalmente ocho pacientes (29,6%) manifestaron persistencia de cefalea, siendo seis de ellos pacientes con diagnóstico de migraña.
La recurrencia fue definida como la reaparición de síntomas y signos de hipertensión intracraneal, una vez remitido el cuadro inicial. Cinco pacientes presentaron recurrencia clínica (19%). La edad media fue de 7,20 ± 2,58 años, siendo el tiempo medio desde la resolución clínica a la recurrencia de 14,20 ± 16,58 meses. En un paciente se reinició tratamiento con ACZ, tres pacientes en monoterapia con ACZ precisaron aumentar la dosis, añadiendo prednisona o furosemida en dos de ellos. En un paciente con pauta de ACZ y prednisona se incrementó dosis de ACZ, suspendiéndose tras ineficacia e iniciando topiramato. En tres pacientes se obtuvo la resolución de la sintomatología con AV de 1, una paciente mantuvo cefalea esporádica con AV preservada y finalmente paciente persistió con cefalea refractaria AV 0,7/1, requiriendo varias intervenciones neuroquirúrgicas por refractariedad al tratamiento y complicaciones.
El 100% de los pacientes con recurrencia eran prepuberales, siendo el 71,4% en el grupo de no recurrencia. El análisis del estado puberal en función de la presencia o no de recurrencia no mostró diferencias estadísticamente significativas en el test exacto de Fisher p = 0,298.
DiscusiónEn el análisis de la distribución del sexo en nuestra serie de 28 pacientes, se apreció una mayor prevalencia para el sexo femenino en menores de 12 años, que se invertía en favor del sexo masculino en el grupo de 12 o más años de edad. Este hecho contrasta con estudios realizados previamente, en los que describen una ratio similar de sexo en edades prepuberales, apareciendo predominancia femenina a partir de los 11-12 años14. Posiblemente sea debido al bajo número de pacientes en este subgrupo (cinco) y a la poca diferencia de edad entre ambos (edad máxima 13 años), hecho que dificulta la separación de las características en los subgrupos.
Se observó un aumento progresivo del porcentaje de pacientes con sobrepeso u obesidad conforme aumentaba la edad de los sujetos, sin poder demostrar diferencias estadísticamente significativas. Esta tendencia es consistente con la mayoría de los estudios realizados con anterioridad, que mostraron un aumento de la prevalencia de obesidad en paciente con SPTC en su etapa pospuberal8,9,14.
A diferencia de otras series, en las que entre el 15-22% de los pacientes se encuentran asintomáticos al diagnóstico10,11,15, en nuestra serie ningún paciente fue catalogado como asintomático. La oscilación de este porcentaje puede estar en relación con la mayor dificultad para expresar sintomatología en este grupo de edad.
La comorbilidad más frecuente en nuestros pacientes fue obesidad/sobrepeso (39,3%), migraña (28,6%) y asma (10,7%), consistente con lo descrito en estudios anteriores12. En ellos, se postula la obesidad como factor generador de inflamación sistémica que pudiera explicar su asociación con el asma e influir en el desarrollo de SPTC12,16.
Todos los pacientes presentaron edema de papila, salvo cuatro en los que se planteó duda con pseudopapiledema, en ellos, la detección de drusas no elimina la posibilidad diagnóstica de un SPTC. Muestra de ello son series como la de Gospe et al., donde se describe hasta un 48% de pacientes con SPTC y drusas papilares de forma concomitante17. En otros estudios retrospectivos recientes se ha descrito en torno al 9% de pacientes con SPTC sin papiledema12,18. La ausencia en nuestra serie de pacientes sin papiledema, además de por su baja frecuencia, puede estar en relación con criterios diagnósticos más estrictos vigentes desde 2013, en los que se exige la presencia de una oftalmoparesia del VI par craneal para realizar el diagnóstico y en su ausencia únicamente puede sugerirse su diagnóstico si presenta tres de cuatro signos en RM craneal (STV, DESP, AGO o EST)2.
Hay mucha variabilidad en la literatura respecto a la frecuencia con la que se describen signos de hipertensión intracraneal en RM craneal. Desde estudios como el de Görkem et al.19, en el que se describió: DESP (88%), AGO (56%) o disminución del tamaño hipofisario (64%); a series de casos sin signos en neuroimagen11,15. Una explicación puede ser el mecanismo de reabsorción del LCR que predomina en cada paciente, cuando este es el sistema linfático aparecen signos como DESP, TNO o AGO, que son menos prevalentes cuando el sistema venoso prevalece20. Esto es debido a que el sistema linfático cerebral que acompaña a los senos venosos durales drena en las vainas de nervios craneales como el nervio óptico y su hiperaflujo desencadena los signos en RM descritos. Por otra parte, se ha visto que la preferencia de uno u otro sistema está influenciada por la edad, siendo la absorción vía sistema venoso más frecuente en la etapa prepuberal21. Este hecho podría explicar la menor prevalencia de signos radiológicos en nuestra serie.
El aumento en tamaño y número de EVR, o espacios perivasculares, presentes en tres de nuestros pacientes podría estar en relación con la reciente adopción de la disfunción del sistema glinfático en la patogenia del SPTC4,5. Lenck postula que la congestión del sistema glinfático en el SPTC se traduce en un aumento de volumen de LCR a nivel del espacio subaracnoideo, del intersticio del parénquima cerebral, así como de los espacios perivasculares20. Según esta teoría sería lógico pensar en la presencia de EVR ensanchados como un signo de SPTC en la RM craneal, sin embargo, en las diferentes revisiones de signos radiológicos sobre SPTC no ha sido descrito22.
Al igual que en nuestra serie, la presencia de sinusitis precediendo o concomitante a la instauración del SPTC ha sido descrita por otros autores hasta en el 26,3% de los casos15. El mecanismo por el cual esta induce el SPTC es desconocido, pudiendo o no asociarse con trombosis venosa cerebral, sin embargo, en los criterios diagnósticos de SPTC secundario, únicamente se contempla como causa si se asocia con una anormalidad venosa cerebral2. En otras series de casos describen una etiología secundaria hasta en el 77% de los pacientes23. Esta variabilidad en cuanto a la prevalencia del SPTC secundario en la población pediátrica puede estar en relación con una aplicación diferente de los criterios diagnósticos defendidos por Friedman et al.2 En ellos, ni el déficit de vitamina D ni los procesos infecciosos sin repercusión en el drenaje venoso se postulan como causas secundarias, sin embargo, sí que se exponen como posibles desencadenantes en varias series15.
El porcentaje de pacientes con SPTC secundario en nuestra serie es un 15% mayor en pacientes prepuberales (31,8%) que en pospuberales (16,7%); aunque los resultados no son estadísticamente significativos parece recomendable realizar un estudio más dirigido a descartar factores desencadenantes en este grupo de edad.
El estudio con OCT puede ayudar en la detección de drusas peripapilares, así como para detectar papiledema. La normalidad en el 23,8% de nuestros pacientes puede explicarse por su realización posterior al inicio de tratamiento médico. Por otra parte, el empleo de la campimetría en este grupo de edad, aunque útil para la monitorización visual, está limitado por la baja colaboración, al mostrar un resultado no fiable en el 38% de los casos.
En nuestra serie el 32,2% de los pacientes asoció tratamiento corticoideo, en todos ellos, salvo en uno, el diagnóstico se había llevado a cabo previo a 2014. Aunque su administración disminuye la producción de LCR inhibiendo a la enzima 11β-HSD116, actualmente su empleo no está indicado debido a la frecuente reaparición del cuadro tras su suspensión, así como la alta prevalencia de efectos secundarios24.
Ante la progresión del deterioro en la función visual refractario a tratamiento médico, se recomienda tratamiento quirúrgico bien con válvulas de derivación de LCR, fenestración de la vaina del nervio óptico o stent de los senos venosos, la recomendación se realiza dependiendo de las características del paciente y la experiencia de cada centro. En nuestra serie en cuatro pacientes, se llevó a cabo la derivación de LCR, mostrando complicaciones únicamente en uno de ellos.
En pacientes con SPTC con persistencia de cefalea después de haber iniciado el tratamiento médico, es importante diferenciar si la cefalea es debido a una presión intracraneal aumentada o a una cefalea crónica secundaria a una hipertensión craneal resuelta en pacientes con comorbilidad de cefaleas primarias25,26. Para ello, la clasificación de la International Headache Society (IHS) tiene un apartado con criterios para el diagnóstico de cefalea atribuible a hipertensión intracraneal idiopática (HII), donde resalta el empeoramiento de una cefalea previa y la asociación de papiledema o tinnitus pulsátil27. En ausencia de un deterioro de la función visual sin empeoramiento del papiledema no estaría indicado potenciar el tratamiento hipotensor. En ese caso, se recomienda descartar el abuso de analgésicos, la comorbilidad psiquiátrica, así como considerar la adicción de fármacos como topiramato o zonisamida, útiles en la profilaxis de migraña crónica, y que a su vez disminuyen el peso y la producción de LCR24–26.
El pronóstico visual en los pacientes de nuestras serie en cuanto a la presencia de defectos campimétricos (61% de los 18 pacientes con campimetría), alteración de la agudeza visual (23%) y presencia de palidez/atrofia óptica (21%) o papiledema crónico (25%) son comparativamente peores respecto a series previas, en las cuales llegan hasta el 20% en defectos campimétricos o alteración de la AV y al 13% de atrofia del nervio óptico13,17. Sin embargo, a pesar de la alta prevalencia de alteraciones visuales, en la mayoría de nuestros casos los defectos fueron leves con únicamente un paciente con AV menor a 0,8 y tres pacientes con defecto campimétrico moderado-severo. La distinción subjetiva entre estudio normal y un defecto campimétrico leve o la pequeña fluctuación de AV entre 0,9-1 pueden variar estos resultados, posiblemente aproximándolos a estudios previos.
La tasa de recurrencia de nuestros pacientes fue del 19,2%, similar a la descrita en otras cohortes6,12,28. Todos los pacientes que presentaron una recurrencia se encontraban dentro del grupo prepuberal y fue un 13% más frecuente en aquellos en los que se había identificado una posible causa del síndrome, estas diferencias no fueron estadísticamente significativas.
El tratamiento de las recurrencias está determinado por su severidad, factores desencadenantes, tratamiento basal de los sujetos, así como la tolerancia al mismo. Nuestro manejo consiste en reiniciar o intensificar terapia con ACZ, añadiendo fármacos complementarios como topiramato o furosemida en función de la tolerancia. Ante refractariedad o progresión con compromiso visual consideramos tratamiento quirúrgico con válvulas de derivación de LCR.
Pueden objetarse varias limitaciones en nuestro estudio, entre ellos remarcar su naturaleza retrospectiva. Por otra parte, la distinción de los sujetos en puberales y pospuberales se realizó acorde con la edad, sin emplear la escala de Tanner para la detección de caracteres sexuales secundarios. Este hecho, unido al bajo tamaño muestral en el grupo pospuberal, hace que debamos interpretar con prudencia las comparaciones entre estos subgrupos.
El SPTC incluye un espectro de enfermedades que se manifiestan por una anomalía en la circulación del LCR, los factores que inducen esta alteración parecen ser diferentes en pacientes pediátricos prepuberales respecto a pospuberales o adultos. En aquellos, la mayor prevalencia de etiologías secundarias, así como un menor porcentaje de sobrepeso evidencian una etiopatogenia diferente, probablemente originada por la modificación en el ambiente hormonal.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.