Evaluar y comparar la utilidad diagnóstica (UD) para el cribado de deterioro cognitivo (DC) de los test cognitivos breves (TCB) recomendados por la Guía de práctica clínica sobre la atención integral a las personas con enfermedad de Alzheimer y otras demencias.
Material y métodosEstudio de fase iii de evaluación de pruebas diagnósticas en el que se ha incluido en Atención Primaria a sujetos con sospecha de DC. A todos se les ha aplicado Mini-Mental State Examination (Mini-Mental), Mini Examen Cognoscitivo (MEC), Short Portable Mental Status Questionnaire (SPMSQ), Memory Impairment Screen (MIS), test del reloj (TdR), Eurotest, Fototest y test de alteración de memoria (T@M). El diagnóstico de DC se ha realizado de forma independiente y cegada con respecto a los resultados de los TCB. La UD se ha evaluado mediante el área bajo la curva ROC (aROC).
ResultadosSe ha incluido a 141 sujetos (86 con DC). El Eurotest y el T@M (0,91 ± 0,02 [aROC ± EE] y 0,90 ± 0,02, respectivamente), los instrumentos que requieren más tiempo (7,1 ± 1,8 [media ± DE] y 6,8 ± 2,2 min, respectivamente) tienen una UD significativamente superior a la del Mini-Mental, MEC, SPMSQ y TdR, pero no a la del MIS y Fototest (0,87 ± 0,03 ambas), requiriendo este último menos de la mitad del tiempo (2,8 ± 0,8 min). T@M y MIS solo evalúan memoria y el último no es aplicable a analfabetos.
ConclusionesLos instrumentos más recomendables para el cribado de DC en Atención Primaria son Eurotest, T@M y Fototest, siendo el último más eficiente por requerir la mitad de tiempo.
This study aims to assess and compare the diagnostic performance of brief cognitive tests for cognitive impairment (CI) screening recommended by the Spanish guidelines for the integral care of people with Alzheimer's disease and other dementias.
Material and methodsWe performed a phase iii study into the accuracy of diagnostic tests, including patients with suspected CI in a primary care setting. All patients completed the Mini–Mental State Examination (MMSE), the Mini Examen Cognoscitivo (MEC), the Short Portable Mental Status Questionnaire (SPMSQ), the Memory Impairment Screen (MIS), the Clock Drawing Test (CDT), the Eurotest, the Fototest, and the Memory Alteration Test (M@T). CI was diagnosed independently by researchers blinded to scores on these tests. Diagnostic performance was evaluated by calculating the area under the receiver operating characteristic curve (AUC).
ResultsThe study included 141 individuals (86 with CI). The Eurotest and M@T (AUC ± SE: 0.91 ± 0.02 and 0.90 ± 0.02, respectively) took longer to administer (mean [SD]: 7.1 [1.8] and 6.8 [2.2] min, respectively) and have significantly better diagnostic performance compared to the MMSE, MEC, SPMSQ, and CDT, but not compared to MIS or Fototest (both with an AUC of 0.87 ± 0.03), with the latter taking less than half as long to administer (2.8 [0.8] min). The M@T and MIS only evaluate memory, and the latter cannot be administered to illiterate people.
ConclusionThe most advisable tests for CI screening in primary care are the Eurotest, M@T, and Fototest, with the latter being the most efficient as it takes half as long to administer.
El deterioro cognitivo (DC) en general y la enfermedad de Alzheimer en particular son uno de los más importantes desafíos sociosanitarios a los que se enfrenta la sociedad, tanto por su frecuencia como por su relevancia y coste1. En nuestro país, la prevalencia de DC en la población se sitúa entre el 14,5 y el 19% en mayores de 65 años2-4, aunque muchos de estos pacientes no están identificados (más de la mitad en el reciente estudio Gómez de Caso4); a pesar de ello, existe un amplio consenso en considerar que en la actualidad no se dan las circunstancias mínimas requeridas para recomendar la realización de un despistaje (screening) de DC en sujetos asintomáticos5-9. No obstante, la mayoría de las guías de práctica clínica coinciden en señalar la conveniencia de mantener en Atención Primaria una adecuada actitud de alerta y realizar un cribado con test cognitivos breves (TCB) en los sujetos en los que se plantee la sospecha de DC7,8, sea por la existencia de quejas subjetivas, quejas por parte del cuidador o allegados o por sospecha generada en los propios profesionales.
En España, la Guía de práctica clínica sobre la atención integral a las personas con enfermedad de Alzheimer y otras demencias del Sistema Nacional de Salud (G-SNS)10 promovida por el Ministerio de Sanidad, Política Social e Igualdad, se hace eco de estas recomendaciones y aconseja el uso de TCB en sujetos con sospecha de DC. En concreto, recomienda el uso de la versión española normalizada del Mini-Mental State Examination (Mini-Mental)11 o del Mini Examen Cognoscitivo (MEC)12 (recomendación A); en segundo término (recomendación B), considera el uso de otros instrumentos como el test de Pfeiffer (Short Portable Mental State Questionnaire [SPMSQ])13, Memory Impairment Screen (MIS)14, test de los 7 min (T7M)15, test del reloj (TdR)16, Eurotest17, Fototest18 o el test de alteración de memoria (T@M)19. La G-SNS no establece recomendaciones concretas sobre puntos de corte o correcciones a realizar y recomienda que la elección entre instrumentos debe realizarse en función del tiempo disponible, de la experiencia clínica, de la disponibilidad de datos normativos y de estudios de validación en la lengua y en el medio en el que se aplicarán (criterio de buena práctica clínica). Existen también otras características a las que no hace alusión la G-SNS, que también pueden ser relevantes a la hora de la selección, como puede ser el que se pueda aplicar a analfabetos, el que evalúe uno o más dominios cognitivos o el coste que pueda tener asociado su uso (tabla 1)20.
Características de los test cognitivos breves recomendados en la Guía de práctica clínica sobre la atención integral a las personas con enfermedad de Alzheimer y otras demencias del Sistema Nacional de Salud
| Tiempo | Test | Aplicablesanalfabetos | Multidominio | Estudios enAP | ValidaciónDC | Datosnormativos | Costeasociado |
|---|---|---|---|---|---|---|---|
| <5 min | TdR | No | Sí | Sí | Sí | No | No |
| SPMSQ | Sí | Sí | Sí | No | No | No | |
| Fototest | Sí | Sí | Sí | Sí | Sí | No | |
| MIS | No | No | Sí | Sí | No | No | |
| > 5 min | MMSE/MEC | No | Sí | Sí | Sí | Sí | Sí |
| T@M | Sí | No | Sí | Sí | No | No | |
| Eurotest | Sí | Sí | Sí | Sí | Sí | No | |
| > 10 min | T7M | No | Sí | No | No | Sí | Sí |
MEC: Mini Examen Cognoscitivo; MIS: Memory Impairment Screen; MMSE: Mini-Mental State Examination; SPMSQ: Short Portable Mental State Questionnaire; TdR: test del reloj; T7M: test de los 7 min; T@M: test de alteración de memoria;
Pocos estudios han evaluado y comparado entre sí estos instrumentos en nuestro país21-24 y por el momento no existe ningún estudio que haya comparado la utilidad diagnóstica (UD) y la efectividad de los distintos TCB recomendados por la G-SNS en condiciones de práctica clínica habitual en la misma muestra de sujetos. Nuestro objetivo es evaluar y comparar la UD y efectividad de las distintas estrategias de cribado recomendadas por la G-SNS utilizando para ello una cohorte prospectiva de sujetos atendidos en Atención Primaria con verificación diagnóstica completa e independiente.
Material y métodosDiseño. Estudio de fase iii de evaluación de pruebas diagnósticas25, con un diseño pareado (a todos los sujetos se les aplican todos los TCB) y con verificación completa (todos los sujetos, independientemente de los resultados en los TCB, son tratados mediante el procedimiento diagnóstico completo descrito en Procedimientos).
ÿmbito. La selección se realizó en 4 Centros de Salud del Distrito Metropolitano del ÿrea Granada Norte (Almanjáyar, Casería de Montijo, Cartuja y Salvador Caballero). El estudio diagnóstico se llevó a cabo en la Unidad de Neurología Cognitivo-Conductual del Servicio de Neurología del Hospital Universitario Virgen de las Nieves.
Población de estudio. Sujetos atendidos en los Centros de Salud en los que se plantea la sospecha de DC.
Criterios de inclusión y exclusión. Se ha incluido de forma consecutiva y sistemática durante el periodo de un año a todos los sujetos atendidos en los que se planteó la sospecha de DC por parte de su médico de Atención Primaria; esta sospecha podía estar basada en la presencia de quejas subjetivas de pérdida de memoria o alteración cognitiva, quejas similares planteadas por un familiar o informador, o bien apreciación, por parte del profesional, de signos o síntomas que sugerían esta sospecha. Se excluyó del estudio a aquellos sujetos que no prestaron consentimiento, que habían participado previamente en el estudio o tenían un DC previo; ni la edad, ni la existencia de déficits sensoriales, motores o cualquier otra condición previa, incluidas las enfermedades neurológicas, han sido motivo de exclusión.
Procedimiento. A todos los sujetos seleccionados se les aplicó de forma balanceada todos los TCB recomendados por la G-SNS excepto el T7M (Mini-Mental, MEC, SPMSQ, MIS, TdR, Eurotest, Fototest y T@M). La orientación temporal y espacial fue evaluada tan solo una vez y se aplicaron los resultados correspondientes a los distintos instrumentos que la contienen (Mini-Mental, MEC, SPMSQ, T@M). La puntuación del MEC fue derivada; para ello, tras la aplicación del Mini-Mental, se aplicaron los ítems específicos del MEC y se recalcularon los resultados correspondientes a las formas con 30 y 35 ítems (MEC-30 y MEC-35, respectivamente). Para la corrección del TdR se utilizó el sistema utilizado en el T7M15. Se controló el tiempo de aplicación de Eurotest, Fototest, TdR, T@M y Mini-Mental, en los 2últimos sin incluir los ítems de orientación.
Independientemente de los resultados en los TCB, todos los sujetos fueron remitidos a la consulta de Neurología, donde se llevó a cabo una evaluación conductual (adaptación española del NPI26), funcional (índice Barthel27, escala de Lawton-Brody28 y FAQ de Pfeffer29) y neuropsicológica detallada (orientación, atención/función ejecutiva (span dígitos, semejanzas, fluidez verbal semántica30), memoria verbal (lista de palabras del CERAD31), lenguaje (test de denominación de Boston abreviado32, fluidez verbal semántica30 y comprensión órdenes), praxias motoras33 y visuoconstructivas (copia de dibujos del CERAD31); esta evaluación se realizó por profesionales independientes de los que habían aplicado los TCB y que desconocían los resultados de los mismos; ninguno de los TCB aplicados formó parte de la evaluación neuropsicológica formal. El tiempo máximo transcurrido entre la aplicación de los TCB y la evaluación en la consulta de Neurología fue de 2semanas.
Diagnóstico de referencia. El diagnóstico gold standard lo realizaron de forma independiente 2neurólogos experimentados en Neurología cognitivo-conductual que, con base en una evaluación clínica detallada y en los resultados de la evaluación cognitiva, conductual y funcional, clasificaron a los sujetos como: no DC (NoDC), DC ligero (DCL) y demencia (DEM). Se usaron los criterios del Grupo de Estudio de Neurología y Conducta y Demencias de la Sociedad Española de Neurología34 para DCL y DEM, incluidos también en la G-SNS. Estos profesionales estaban cegados con respecto a los resultados de los TCB. Las discrepancias se resolvieron por consenso.
Análisis de datos. La UD se ha evaluado mediante el área bajo la curva ROC (aROC) para cada uno de los TCB; la comparación entre aROC se ha realizado mediante el método deLong de comparación de aROC procedentes de la misma muestra35; el nivel de significación se estableció en p ≤ 0,05. La efectividad se ha calculado para DC (DCL y DEM) vs. NoDC. Se han calculado la sensibilidad (S) y la especificidad (E) para el mejor punto de corte de cada instrumento (aquel que maximiza la proporción de aciertos diagnósticos; en caso de igualdad entre varios puntos, se optó por aquel entre ellos que maximizaba el índice de Jouden36), así como para aquellos otros que maximizan la E teniendo una S ≥ 0,80. El análisis estadístico se ha llevado a cabo con el programa SPSS (SPSS Inc., Chicago, IL, EE. UU.) y MedCalc 18.937.
Aspectos formales. El estudio fue aprobado por el Comité de Ética e Investigación del Hospital Universitario Virgen de las Nieves y se obtuvo el consentimiento informado de todos los participantes. El diseño del estudio y la redacción del informe se ajustan a las recomendaciones STARD de estudios de pruebas diagnósticas38 y a las recomendaciones para describir resultados de estudios diagnósticos de la Food and Drug Administration36.
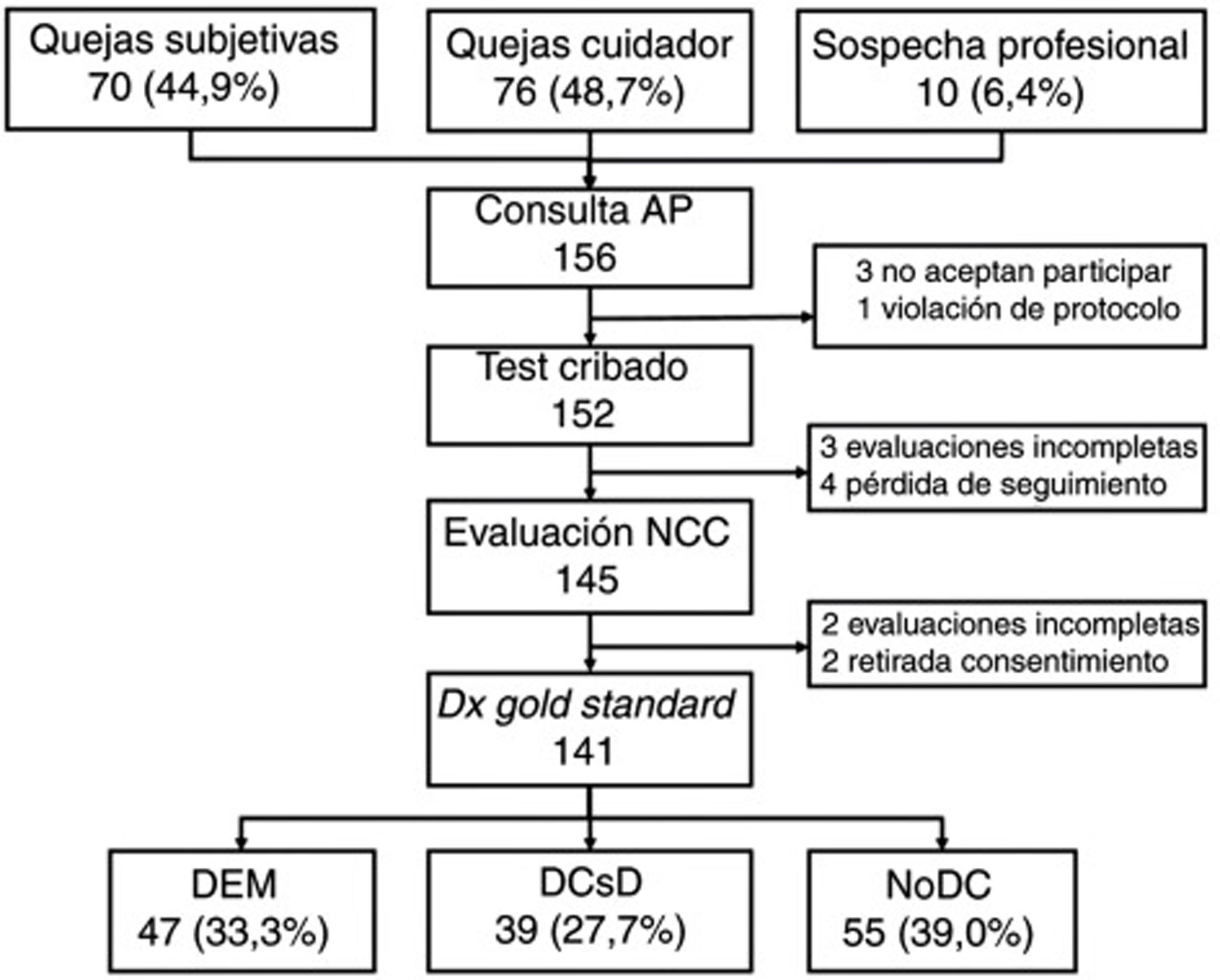
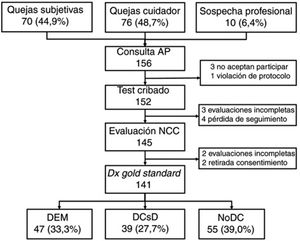
ResultadosSe seleccionó a un total de 156 sujetos (70 [44,9%] por quejas cognitivas subjetivas, 76 [48,7%] por quejas del cuidador y 10 [6,4%] por sospecha directa del profesional), de los cuales 3 no consintieron participar en el estudio y uno fue excluido por violación de protocolo (tenía un diagnóstico previo de DC); 4 no acudieron a la consulta de Neurología, 2 retiraron el consentimiento a lo largo del estudio, 3 no pudieron ser evaluados por déficits sensoriales y secuelas de ictus previos, y 2 no colaboraron en la evaluación por alteraciones conductuales (fig. 1).
En la tabla 2 se muestran las características sociodemográficas de la muestra final formada por 141 sujetos (55 [39,0%] NoDC, 39 [27,7%] DCL y 47 [33,3%] DEM), con una edad de 72,0 ± 11,5 (31-90) años (media ± DE [rango]), con claro predominio de mujeres (73,0%) y bajo nivel educativo (14,2% analfabetos y solo la mitad [49,6%] con estudios primarios o superiores), así como los resultados de los distintos TCB y el tiempo empleado en su aplicación, estratificados por el diagnóstico cognitivo. Los resultados muestran, en todos los casos y como era de esperar, una diferencia muy significativa entre grupos en el sentido de una peor puntuación y un mayor tiempo en los sujetos con DC.
Características sociodemográficas y resultados en los test cognitivos breves por grupos diagnósticos
| Total | DC (DCL+DEM) | NoDC | DCL | DEM | |
|---|---|---|---|---|---|
| N.° sujetos | 141 | 86 | 55 | 39 | 47 |
| Sexo (mujeres) | 103 (73,0) | 59 (68,6) | 44 (80,0) | 23 (59,0) | 36 (76,6) |
| Edad (años) | 72,0 ± 11,5 | 77,1 ± 7,5 | 64,6 ± 12,2 | 74,3 ± 7,3 | 68,4 ± 11,6 |
| Nivel educativo | |||||
| Analfabetos | 20 (14,2) | 19 (22,1) | 1 (1,8) | 5 (12,8) | 14 (29,8) |
| Estudios primarios incompletos | 51 (36,2) | 35 (40,7) | 16 (29,1) | 16 (41,0) | 19 (40,4) |
| Estudios primarios completos | 69 (49,6) | 32 (37,2) | 38 (69,1) | 18 (50,0) | 14 (29,8) |
| MMSE (141) | 19,9 ± 5,7 | 17,3 ± 5,3 | 24,1 ± 3,2 | 21,5 ± 3,7 | 13,7 ± 3,7 |
| Tiempo (min)a | 5,5 ± 1,6 | 5,9 ± 1,5 | 4,8 ± 1,4 | 5,8 ± 1,7 | 6,0 ± 1,4 |
| MEC (141) | 25,4 ± 7,2 | 22,1 ± 7,2 | 30,6 ± 2,9 | 27,4 ± 4,8 | 17,8 ± 5,9 |
| Eurotest (140) | 20,2 ± 10,3 | 14,7 ± 9,2 | 28,6 ± 4,4 | 22,3 ± 6,0 | 8,3 ± 6,1 |
| Tiempo (min) | 7,1 ± 1,8 | 7,7 ± 1,5 | 6,2 ± 1,9 | 7,7 ± 1,7 | 7,8 ± 1,3 |
| T@M (139) | 29,0 ± 12,5 | 22,3 ± 11,0 | 39,3 ± 6,0 | 30,9 ± 8,3 | 15,2 ± 7,2 |
| Tiempo (min)a | 6,8 ± 2,2 | 7,6 ± 2,0 | 5,6 ± 1,9 | 6,7 ± 1,9 | 8,4 ± 1,9 |
| Fototest (139) | 29,1 ± 7,7 | 25,4 ± 6,8 | 34,7 ± 5,0 | 30,0 ± 4,6 | 21,4 ± 5,8 |
| Tiempo (min) | 2,8 ± 0,8 | 2,9 ± 0,8 | 2,5 ± 0,7 | 2,5 ± 0,5 | 3,3 ± 0,9 |
| TdR (126) | 4,4 ± 2,6 | 3,1 ± 2,6 | 6,2 ± 1,4 | 4,7 ± 2,2 | 1,6 ± 2,0 |
| Tiempo (min) | 1,3 ± 0,7 | 1,5 ± 0,7 | 1,0 ± 0,6 | 1,3 ± 0,6 | 1,6 ± 0,8 |
| SPMSQ (140) | 2,6 ± 2,6 | 3,8 ± 2,7 | 0,6 ± 0,9 | 1,8 ± 1,6 | 5,6 ± 2,1 |
| MIS (119) | 4,2 ± 2,9 | 2,6 ± 2,5 | 6,3 ± 1,8 | 4,0 ± 2,5 | 1,0 ± 1,4 |
Las cifras son número de sujetos (porcentaje) o media ± DE.
DC: deterioro cognitivo (DCL y DEM); DCL: deterioro cognitivo ligero; DEM: demencia; MEC: Mini Examen Cognoscitivo; MIS: Memory Impairment Screen; MMSE: Mini-Mental State Examination; NoDC: no deterioro cognitivo; SPMSQ: Short Portable Mental State Questionnaire; TdR: test del reloj; T@M: test de alteración de memoria.
Todos los pacientes (141) completaron el Mini-Mental y el MEC; 140 completaron el Eurotest y el SPMSQ, y 139 el Fototest y el T@M. El MIS no pudo ser realizado por 22 sujetos (20 de ellos analfabetos); el TdR solo fue completado por 126 sujetos ya que 15 analfabetos se negaron a hacerlo.
En la tabla 3 se resumen los resultados de los distintos instrumentos con indicación del número de sujetos en los que se aplicó, el tiempo que precisó su administración, la UD expresada como aROC, los parámetros diagnósticos (S, E) y la proporción de aciertos diagnósticos correspondiente a los puntos de corte seleccionados.
Utilidad diagnóstica y efectividad de los test cognitivos breves
| Test | N.° | Tiempo (min) | aROC | Mejor punto de corte | Punto de corte con S ≥ 0,80 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| PdC | S | E | PAD | PdC | S | E | PAD | ||||
| MMSE | 141 | 5,5 ± 1,6a | 0,85 ± 0,03 | 20/21 | 0,71 | 0,87 | 0,77 | 22/23 | 0,80 | 0,65 | 0,75 |
| MEC-35 | 141 | > 5,5 ± 1,6 | 0,85 ± 0,03 | 27/28 | 0,70 | 0,87 | 0,77 | 30/31 | 0,85 | 0,62 | 0,76 |
| MEC-30 | 141 | > 5,5 ± 1,6 | 0,85 ± 0,03 | 25/26 | 0,81 | 0,78 | 0,79 | 25/26 | 0,81 | 0,78 | 0,79 |
| Eurotest | 140 | 7,1 ± 1,8 | 0,91 ± 0,02 | 24/25 | 0,82 | 0,89 | 0,84 | 24/25 | 0,82 | 0,89 | 0,84 |
| T@M | 139 | 6,8 ± 2,2a | 0,90 ± 0,02 | 32/33 | 0,81 | 0,89 | 0,84 | 32/33 | 0,81 | 0,89 | 0,84 |
| SPMSQ | 140 | – | 0,86 ± 0,03 | 1/2 | 0,74 | 0,85 | 0,78 | 0/1 | 0,88 | 0,54 | 0,75 |
| Fototest | 139 | 2,8 ± 0,8 | 0,87 ± 0,03 | 30/31 | 0,76 | 0,80 | 0,78 | 32/33 | 0,84 | 0,69 | 0,77 |
| TdR | 126 | 1,3 ± 0,7 | 0,83 ± 0,03 | 4/5 | 0,64 | 0,91 | 0,76 | 6/7 | 0,86 | 0,59 | 0,75 |
| MIS | 119 | – | 0,87 ± 0,03 | 5/6 | 0,82 | 0,81 | 0,81 | 5/6 | 0,82 | 0,81 | 0,81 |
aROC: área bajo la curva ROC; E: especificidad; MEC: Mini Examen Cognoscitivo; MIS: Memory Impairment Screen; MMSE: Mini-Mental State Examination; N.°: número de sujetos; PAD: proporción de aciertos diagnósticos; PdC: punto de corte; S: sensibilidad; SPMSQ: Short Portable Mental State Questionnaire; TdR: test del reloj; T@M: test de alteración de memoria.
La comparación de la UD entre los distintos TCB (tabla 4) se ha llevado a cabo de 2en 2en las respectivas submuestras de sujetos que completaron ambos TCB. Los resultados muestran que no hay diferencia significativa entre la UD del Eurotest y el T@M, pero ambos tienen una UD significativamente superior a las del Mini-Mental, MEC-30, MEC-35 y SPMSQ; esta diferencia también es significativa en el caso del TdR y T@M, y está en el límite de la significación cuando se compara TdR y Eurotest (p=0,08). No hay diferencia significativa, en cambio, entre la UD del Eurotest y T@M con la del Fototest y MIS.
Comparación utilidad diagnóstica de los test cognitivos breves
| TdR | MEC-35 | MEC-30 | MMSE | SPMSQ | Fototest | MIS | T@M | Eurotest | |
|---|---|---|---|---|---|---|---|---|---|
| TdR | – | ns (126) | ns (126) | ns (126) | ns (126) | ns (126) | ns (117) | 0,03 (125) | 0,08 (126) |
| MEC-35 | – | ns (141) | ns (141) | ns (140) | ns (139) | ns (119) | 0,02 (139) | 0,02 (140) | |
| MEC-30 | – | ns (141) | ns (140) | ns (139) | ns (119) | 0,03 (139) | 0,04 (140) | ||
| MMSE | – | ns (140) | ns (139) | ns (119) | 0,03 (139) | 0,03 (140) | |||
| SPMSQ | – | ns (139) | ns (119) | 0,05 (139) | 0,05 (139) | ||||
| Fototest | – | ns (119) | ns (138) | ns (138) | |||||
| MIS | – | ns (118) | ns (118) | ||||||
| T@M | – | ns (138) | |||||||
| Eurotest | – |
MEC: Mini Examen Cognoscitivo; MIS: Memory Impairment Screen; MMSE: Mini-Mental State Examination; ns: no significativo; SPMSQ: Short Portable Mental State Questionnaire; TdR: test del reloj; T@M: test de alteración de memoria.
Los resultados indican el valor de p en el test de deLong y entre paréntesis el número de sujetos en el que se lleva a cabo la comparación.
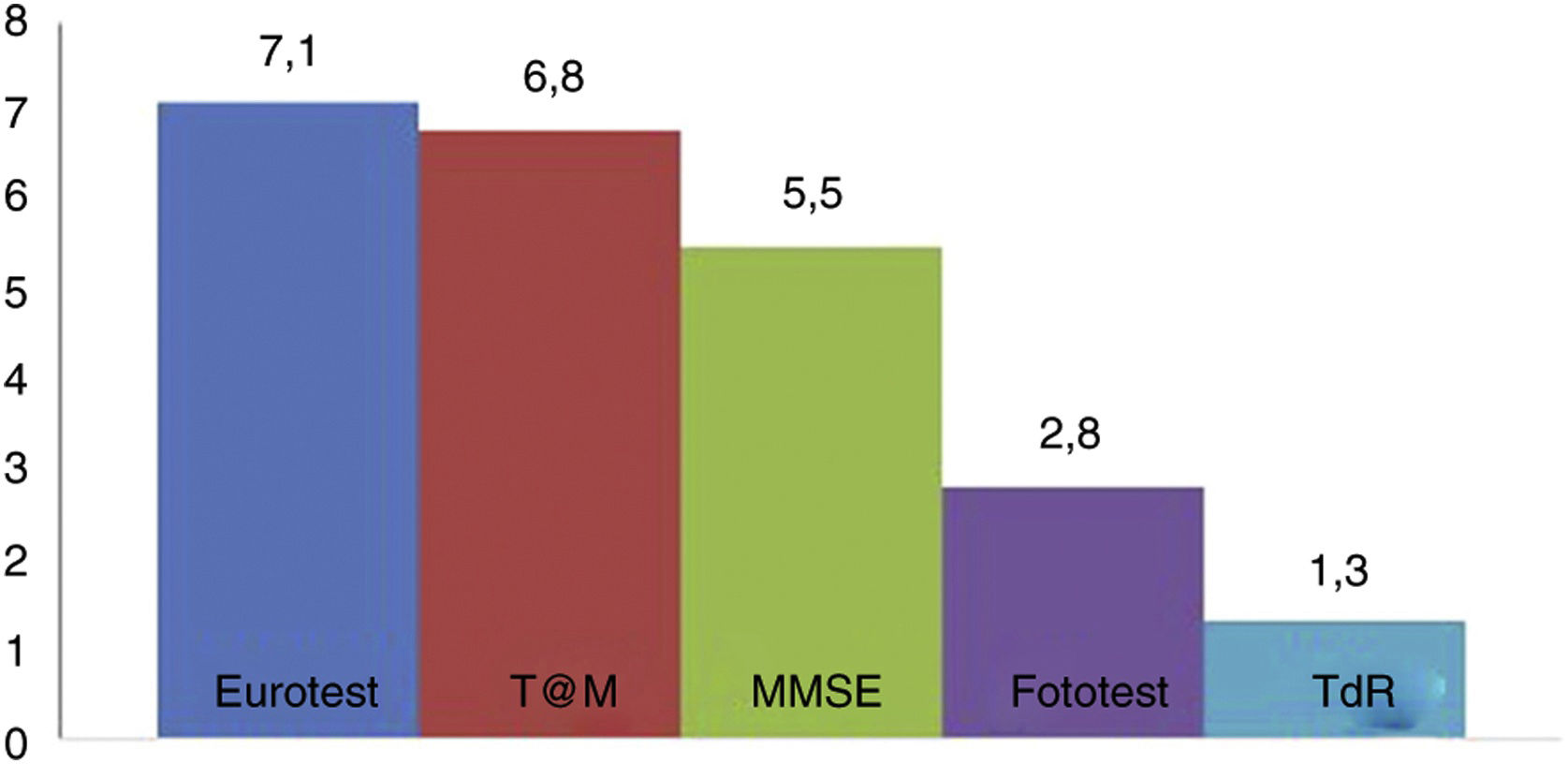
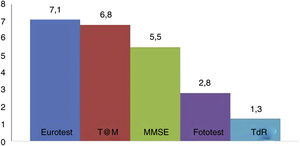
En la figura 2 se representan los tiempos necesarios para la aplicación de los TCB utilizados (excepto SPMSQ y MIS que no se han controlado). No hay diferencia significativa entre el tiempo de aplicación del Eurotest y T@M (7,1 ± 1,8 vs. 6,8 ± 2,2min, respectivamente), que son claramente superiores al tiempo exigido por el Fototest (2,8 ± 0,8min) y el TdR (1,3 ± 0,7min). El tiempo requerido por el Mini-Mental (5,5 ± 1,6min) está infraestimado porque en él no se incluyen los ítems correspondientes a la orientación temporal y espacial, a pesar de lo cual es un tiempo significativamente superior al del Fototest y el TdR, y sobrepasa claramente los 5 min. El tiempo de aplicación del MEC, al incluir más ítems que el Mini-Mental, debe ser superior al de este.
DiscusiónLos resultados de este estudio de fase iii de evaluación de pruebas diagnósticas (prospectivo, pareado y con verificación completa) muestran que el Eurotest (0,91 ± 0,02) y el T@M (0,90 ± 0,02), los TCB que requieren más tiempo de aplicación (7,1 ± 1,8 y 6,8 ± 2,2 min, respectivamente), cuentan con la mayor UD sin que exista diferencia significativa entre ellas y ambos clasifican correctamente el 84% de la muestra. Ambos instrumentos han sido desarrollados y validados en nuestro país, son aplicables a analfabetos y de uso libre17,19; el T@M tiene los inconvenientes, en cambio, de que no cuenta con un estudio normativo formal y que solo evalúa memoria, por lo que sería insensible al DC que afecte a otros dominios cognitivos con preservación de la memoria. La UD del T@M es muy similar a la mostrada por este instrumento en un reciente estudio realizado en sujetos con quejas de memoria reclutados en Atención Primaria (aROC 0,91), si bien los resultados globales en nuestra muestra son inferiores probablemente por el menor nivel educativo39.
La UD de Mini-Mental, MEC-30 y MEC-35, los instrumentos más utilizados y la recomendación preferente de la G-SNS, que también requieren más de 5min para ser aplicados (al menos 5,5 ± 1,6 min), es significativamente inferior a la de T@M y Eurotest. El bajo rendimiento diagnóstico para DC de estos instrumentos de uso tan universal y generalizado es la norma más que la excepción y viene a sumarse a múltiples estudios de fuera40,41 y dentro de nuestro país42. Nuestros resultados actuales, en línea con estudios previos de nuestro grupo, también muestran que el punto de corte más efectivo (22/23) es inferior al que habitualmente se utiliza42. La baja UD, el tiempo exigido para su aplicación, sumado a otros inconvenientes (influencia nivel educativo, etc.) y, sobre todo, al hecho de que se trata de un TCB cuya aplicación no es gratuita justifica que muchos lo hayan dejado de considerar como instrumento de uso preferente43 y otros ni tan siquiera lo incluyen ya entre sus recomendaciones44.
También es significativamente inferior la UD del SPMSQ, un instrumento que, sin embargo, requiere mucho menos tiempo de aplicación (no cuantificado en este estudio). El SPMSQ se usa ampliamente en nuestro país para demencia13, pero no se había evaluado hasta ahora su UD para DC. Nuestros resultados muestran un marcado fenómeno «suelo», ya que incluso una puntuación de 0 puntos tiene una S 0,88, lo que implica que el 12% de los sujetos con DC tienen una ejecución perfecta (0 errores) y, por tanto, no podrían nunca ser detectados por este instrumento. El SMSPQ tiene además el inconveniente de que la corrección de 3 de sus 10 ítems (número de teléfono, fecha nacimiento y apellido de la madre) exige información previa que muchas veces es difícil de tener o de verificar, en especial en sujetos mayores que pueden acudir solos a consulta.
El TdR, el TCB más breve (1,3 ± 0,7 min), cuenta con la menor UD (0,83 ± 0,03), que también es significativamente inferior, cuenta además con el inconveniente añadido de que exige cierta destreza grafomotora de la que carecen los sujetos analfabetos y con bajo nivel educativo, lo que justifica que 15 sujetos (10,6%), la mayor parte de los analfabetos, rechazara su ejecución. Estos resultados confirman las recomendaciones previas de que no es un TCB adecuado para sujetos que no dispongan de un nivel educativo mínimo45.
No hay diferencia significativa, en cambio, entre la UD de T@M y Eurotest y las de Fototest y MIS (0,87 ± 0,02 ambos), 2instrumentos que precisan mucho menos tiempo para su aplicación (2,8 ± 0,8min en el caso del Fototest). Estos resultados confirman los de estudios previos22,23 y apuntan a que estos instrumentos, al tener similar UD y requerir menos de la mitad de tiempo, son más eficientes. El MIS tiene, en cambio, los inconvenientes de no contar con estudio normativo, evaluar solo memoria y, sobre todo, no ser aplicable a analfabetos, por lo que no podría ser aplicado a una respetable proporción de las personas mayores de nuestro país (14,2% de nuestra muestra).
Hemos elegido la aROC como medida de la UD porque es un parámetro que evalúa la capacidad discriminativa global de una prueba diagnóstica a lo largo de todos sus posibles resultados y permite comparar las UD de los distintos instrumentos en una misma muestra46,47, independientemente de la prevalencia de la condición diagnóstica y de las características sociodemográficas (edad, educación, etc.) de la misma, y por tanto, de su representatividad. También hemos optado por evaluar la UD para DC y no para DEM porque entendemos que es lo más pragmático desde el punto de vista clínico. El interés diagnóstico del profesional en general y del de Atención Primaria en particular ha de ser el DC pues la orientación a DEM impediría detectar casos de DC sin repercusión funcional en los que cabría aplicar medidas preventivas, correctoras o paliativas, que en muchos casos corrigieran esta situación, retrasando o incluso impidiendo su progresión a DEM20.
La principal limitación de este estudio es el hecho de que los TCB se han aplicado de forma seriada, lo que pudiera haber determinado un sesgo debido al cansancio o fatiga del sujeto a pesar de tratarse de instrumentos breves; para contrarrestrar en parte este efecto, la aplicación se hizo de forma balanceada según 3ordenaciones distintas y se ha comprobado que los resultados de los distintos TCB no están asociados a la posición serial de estos (datos no mostrados). Otra limitación es no haber incluido en la evaluación el T7M también recomendado por la G-SNS; no obstante, el T7M48 es un instrumento complejo, tanto en su aplicación como corrección, que requiere, a pesar de su nombre, más de 10 min para su aplicación, que no puede ser aplicado a analfabetos y que también tiene asociado un coste; en conjunto pues, se trata de un instrumento que no creemos indicado para el ámbito de la Atención Primaria20.
La principal fortaleza de este estudio es su diseño. Por un lado, el carácter prospectivo, consecutivo y sistemático del reclutamiento, el hecho de que el periodo de inclusión se haya prolongado un año, la práctica ausencia de criterios de exclusión y el bajo índice de pérdidas en el estudio hacen que nuestra muestra sea un fiel reflejo del problema diagnóstico que se plantea en condiciones de práctica clínica habitual en este entorno asistencial, dotando al estudio de un carácter naturalístico y pragmático. Por otro lado, la evaluación de todos los sujetos con todos los TCB, el hecho de someter a todos los sujetos al protocolo de estudio y diagnóstico gold standard independientemente de sus resultados en los TCB, y la evaluación ciega e independiente de los instrumentos evaluados y del gold standard aseguran el control de los principales sesgos de los estudios de evaluación de pruebas diagnósticas25,49.
En conclusión, no existe un TCB perfecto e ideal para aplicar en Atención Primaria; los profesionales debieran conocer y manejar varios instrumentos y la elección en un caso determinado debiera realizarse en función de las circunstancias asistenciales (tiempo disponible), las características del sujeto (nivel educativo, déficits sensoriales, etc.), los datos disponibles (datos normativos, validación específica para DC) y las preferencias y experiencia del profesional20. Con base en los resultados de este estudio y a las características deseables resumidas en la tabla 1, nuestra recomendación sería utilizar en Atención Primaria el Eurotest, el T@M o el Fototest, siendo el último más eficiente por requerir menos de la mitad de tiempo.
FinanciaciónAgencia de Evaluación de Tecnologías Sanitarias, Instituto de Salud Carlos III, España (Expediente. PI06/90034).
Conflicto de interesesC. Carnero Pardo es el creador del Fototest y Eurotest; ha recibido honorarios por actividades académicas y de asesoría de Nutricia, Schwabe Farma Ibérica, Biogen, Piramal, Janssen Cilag, Pfizer, Eisai, Esteve, Novartis, Lundbeck, Grunenthal y Biogen.
El test de las Fotos o Fototest y el Eurotest están bajo licencia Creative Commons BY-NC-ND; pueden ser usados y difundidos sin fines comerciales, siempre y cuando no sean modificados y se haga reconocimiento expreso de su autoría.
Profesionales que han colaborado en el estudio
Hospital Universitario Virgen de las Nieves: C. Sáez Zea, M. Espinosa García, B. Espejo Martínez, L. Montiel Navarro, S. López Alcalde, E. Mora Gavilán.
C.S. Salvador Caballero: F. Padilla Ruiz, P. Concha López, J.A. Henares Civantos, I. Valenzuela López, J.L. Martín Manzano, A. Esteva Rodríguez, M.A. Jurado Duce.
C. S. Almanjáyar: M. Melguizo Jiménez, I. Rodrigo Bravo, B. Martínez Romero, D. Sánchez Mariscal, E. Fernández Román, J.A. Castro Gómez.
C. S. Cartuja: S. Cárdenas Viedma, A.M. de los Ríos ÿlvarez, J.A. López de Hierro Ruiz.
C. S. Casería de Montijo: F. Romo Serral, M.J. Rodríguez Romero, F. Suárez Pinilla, F. Rodríguez Espinosa, R. Moya Mingorance, V. Molina García, A.M. Zamora Rodrigo, M. Jiménez de la Cruz, C. Romero Molina, A. Cano Carrera, F. Dorador Atienza, J. López Ríos, Y. García Iglesias, C. Pérez Lucena, A. Zambrano Murillo, H. Mahmoud El Awad.