En algunos informes de casos se ha documentado el compromiso del nervio vestibulococlear en el síndrome de Guillain-Barré, pero su frecuencia aún no está clara. Este estudio tiene como objetivo describir la posible afectación del nervio vestibulococlear en pacientes con síndrome de Guillain-Barré, considerando la hipoacusia como posible desenlace.
MétodosEn este estudio observacional, descriptivo y prospectivo, realizamos potenciales evocados auditivos en una muestra de pacientes con síndrome de Guillain Barré ingresados en un hospital universitario de Bogotá (Colombia), entre julio de 2019 y marzo de 2021.
ResultadosEl estudio seleccionó a 20 pacientes, 15 (75%) de ellos varones, entre 19 y 79 años de edad (media 52); 8 (40%) tenían antecedentes de infecciones previas. En 14 pacientes (70%), los potenciales evocados auditivos fueron anormales, con cambios en el intervalo de conducción central I-V y retrasos de onda I-onda III, indicativos de compromiso periférico del nervio vestibulococlear.
ConclusionesLos resultados de este estudio indican que la afectación del nervio vestibulococlear es frecuente en el síndrome de Guillain-Barré. Sin embargo, nuestro tamaño de la muestra es pequeño y se necesitan estudios más grandes para permitir el análisis de correlación.
Case reports have documented vestibulocochlear nerve involvement in Guillain-Barré syndrome, but its frequency is still unclear. This study aims to describe possible involvement of the vestibulocochlear nerve in patients with Guillain-Barré syndrome, with hearing loss a potential outcome.
MethodsIn this observational, descriptive, prospective study we performed auditory evoked potentials in a sample of consecutive patients with Guillain-Barré syndrome admitted to a university hospital in Bogotá, Colombia, between July 2019 and March 2021.
ResultsThe study recruited 20 patients, 15 (75%) of them male, ages 19-79 years (mean 52); 8 (40%) had a history of previous infections. In 14 patients (70%), the auditory evoked potentials were abnormal. They had changes in the central conduction interval I-V with wave I to wave III delays, indicative of peripheral involvement of the vestibulocochlear nerve.
ConclusionsResults in this study suggest that vestibulocochlear nerve involvement is frequent in Guillain-Barré syndrome. The sample size is small, however, and larger studies are needed to enable correlation analysis.
El síndrome de Guillain-Barré (SGB) es una enfermedad relativamente infrecuente1,2 con una incidencia anual estimada a nivel mundial de entre 1 y 3 casos por 100.000 habitantes, ligeramente mayor en hombres que en mujeres3. La incidencia anual en Colombia se ha estimado en 3 casos por 100.0004. El SGB es la causa más común y grave de parálisis flácida neuromuscular aguda. Tiene presentaciones clínicas heterogéneas con diferentes variantes y con frecuencia se presenta con debilidad de las extremidades acompañada de disestesia1. En casos graves, el síndrome produce una degeneración axonal generalizada intensa con mala recuperación5,6.
El SGB es frecuentemente precedido por un desencadenante, que en un tercio de los casos, es una infección respiratoria o gastrointestinal. Entre los agentes etiológicos predomina Campylobacter jejuni, aunque también se ha encontrado el síndrome tras infecciones por citomegalovirus, virus de Epstein-Barr, virus de la influenza A, Mycoplasma pneumoniae, Haemophilus influenzae, zika, chikungunya1 y el coronavirus SARS-CoV-27. Se han descrito casos posinmunización tras vacunas contra la gripe, la rabia, el sarampión1 y, más recientemente, contra el SARS-CoV-28. Se presume que algunos factores genéticos y ambientales afectan la susceptibilidad individual, dado que menos del 1% de las personas infectadas desarrollarán el síndrome9.
El SGB afecta con frecuencia a los nervios craneales, generalmente con debilidad facial, faríngea u oculomotora y anomalías en la deglución. La afectación de los nervios craneales inferiores necesaria para la integridad de las vías respiratorias puede requerir soporte ventilatorio hasta en el 30% de los casos3. La afectación de los nervios craneales se ha asociado con la gravedad de la enfermedad2. El período de recuperación varía de meses a años, ya que la respuesta del sistema inmunitario disminuye y los nervios se someten a un proceso de reparación endógena1,10,11.
Algunos informes de casos han documentado la afectación del nervio vestibulococlear en el SGB12-18, pero, hasta donde sabemos, solo 2estudios clínicos lo han evaluado mediante potenciales evocados auditivos19,20. Este estudio caracteriza la relación entre el SGB y la afectación vestibulococlear y sus posibles implicaciones clínicas.
MétodosEste estudio observacional, descriptivo y prospectivo recolectó datos de pacientes de 16 años o más con SGB en la etapa aguda (primeras 4 semanas desde el inicio de los síntomas) ingresados en un hospital universitario en Bogotá (Colombia), entre julio de 2019 y marzo de 2021. El diagnóstico de SGB se estableció con base en los criterios de Brighton: la presencia de síndrome de debilidad aguda o síntomas sensitivos asociada a un estudio electrofisiológico confirmatorio de neuroconducciones que mostró afectación axonal o desmielinizante y onda F y reflejo H anormales indicativos de enfermedad radiculoneuropática, y disociación albuminocitológica en el líquido cefalorraquídeo (presencia de más de 45mg/dL de proteínas con menos de 5 células/mm3). Se excluyó a los pacientes con deficiencia auditiva previa y a los que se negaron a participar en el estudio.
A los pacientes se les hizo la prueba de los potenciales evocados auditivos para documentar la afectación del nervio vestibulococlear, aunque no se realizó estudio de audiometría. El mismo electrofisiólogo realizó los estudios con un instrumento de medida estandarizado, un Nicolet Viking Quest (Natus) de 4 canales. Para los potenciales evocados se utilizó un estímulo tipo clic por rarefacción a 90dB con enmascaramiento contralateral a 60dB. Los electrodos activos fueron A1 y A2, y el electrodo de referencia se colocó en Cz.
La técnica utilizada para los potenciales evocados auditivos fue un estudio de rarefacción. Se administraron un total de 2.000 estímulos recurrentes en cada oído. El estímulo de 90dB es el máximo que proporciona el equipo y es un estímulo suficientemente efectivo como para evocar respuestas auditivas sin producir un traumatismo acústico. Adicionalmente, se realizó un estudio de umbrales auditivos ubicando la onda V. El estímulo más alto fue de 90dB y la intensidad del estímulo se fue disminuyendo de forma progresiva de 10 en 10dB hasta llegar a 20dB.
Antes de la toma del estudio, se verificó la integridad y permeabilidad del conducto auditivo mediante otoscopia. El grado de hipoacusia se definió teniendo en cuenta los umbrales auditivos. Así, hipoacusia profunda: percepción de estímulos auditivos mayores a 85dB; hipoacusia grave: de 65 a 80dB; hipoacusia moderada: de 45 a 60dB e hipoacusia superficial: de 35 a 40dB. La audición normal se definió como la percepción del umbral auditivo entre 20 y 30dB. Los potenciales evocados auditivos fueron realizados por un técnico con formación en electrofisiología y fueron interpretados por un neurólogo electrofisiólogo clínico.
Se consideraron potenciales evocados auditivos anormales si hubo una prolongación en la latencia de las ondas, definida para la onda I por encima de 2ms; para la onda II, por encima de 3ms; para la onda III, por encima de 4ms; para la onda IV, por encima de 5ms y para la onda V, por encima de 6ms. Los valores de referencia de ondas y latencias corresponden a los propuestos por el laboratorio y representan los valores anormales de la población tomada por el laboratorio.
El estudio también evaluó variables como el subtipo de SGB, la funcionalidad del paciente según el sistema de puntuación de Hughes al ingreso y el alta hospitalaria, la duración de la estancia hospitalaria, la necesidad de monitorización en la unidad de cuidados intensivos (UCI) y la necesidad de soporte ventilatorio.
Los datos de cada paciente fueron registrados en una base de datos de Excel por un individuo externo al estudio. El análisis estadístico utilizó frecuencias, RR y χ2 para enfoques univariados y bivariados.
El estudio siguió criterios éticos nacionales e internacionales. Cada paciente proporcionó su consentimiento informado y el protocolo de estudio fue aprobado por el Comité de Ética y la Junta de Revisión Institucional.
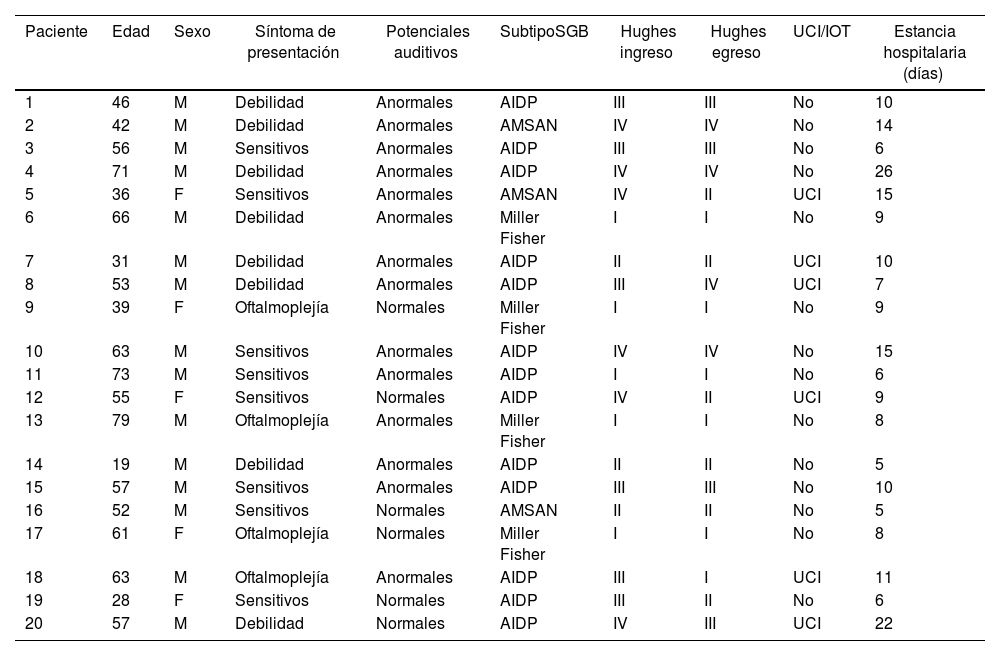
ResultadosDurante el período de estudio, 24 pacientes ingresaron con diagnóstico confirmado de SGB, aunque 4 ingresaron directamente en la UCI y no se les hizo la prueba de los potenciales evocados auditivos. De los 20 pacientes estudiados, 15 (75%) eran hombres, con edades entre 19 y 79 años (media 52). De ellos, 11 (55%) cursaron con un proceso infeccioso previo y uno había sido vacunado contra la influenza poco tiempo antes.
Requirieron monitorización en UCI y soporte ventilatorio con intubación orotraqueal por riesgo de insuficiencia respiratoria 6 pacientes (25%), de los cuales 4 tenían una variante de polineuropatía desmielinizante inflamatoria aguda, uno de ellos una variante faríngea-cervical-braquial y el otro una variante de neuropatía axonal sensorial motora aguda. Ninguno de los pacientes tuvo compromiso asociado de otro nervio craneal. La estancia hospitalaria fue más prolongada en los pacientes ingresados en UCI, aunque un paciente que no ingresó en UCI tuvo una estancia hospitalaria prolongada por causas distintas al cuadro neurológico (enfermedad renal crónica) (tabla 1).
Variables clínicas
| Paciente | Edad | Sexo | Síntoma de presentación | Potenciales auditivos | SubtipoSGB | Hughes ingreso | Hughes egreso | UCI/IOT | Estancia hospitalaria (días) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 46 | M | Debilidad | Anormales | AIDP | III | III | No | 10 |
| 2 | 42 | M | Debilidad | Anormales | AMSAN | IV | IV | No | 14 |
| 3 | 56 | M | Sensitivos | Anormales | AIDP | III | III | No | 6 |
| 4 | 71 | M | Debilidad | Anormales | AIDP | IV | IV | No | 26 |
| 5 | 36 | F | Sensitivos | Anormales | AMSAN | IV | II | UCI | 15 |
| 6 | 66 | M | Debilidad | Anormales | Miller Fisher | I | I | No | 9 |
| 7 | 31 | M | Debilidad | Anormales | AIDP | II | II | UCI | 10 |
| 8 | 53 | M | Debilidad | Anormales | AIDP | III | IV | UCI | 7 |
| 9 | 39 | F | Oftalmoplejía | Normales | Miller Fisher | I | I | No | 9 |
| 10 | 63 | M | Sensitivos | Anormales | AIDP | IV | IV | No | 15 |
| 11 | 73 | M | Sensitivos | Anormales | AIDP | I | I | No | 6 |
| 12 | 55 | F | Sensitivos | Normales | AIDP | IV | II | UCI | 9 |
| 13 | 79 | M | Oftalmoplejía | Anormales | Miller Fisher | I | I | No | 8 |
| 14 | 19 | M | Debilidad | Anormales | AIDP | II | II | No | 5 |
| 15 | 57 | M | Sensitivos | Anormales | AIDP | III | III | No | 10 |
| 16 | 52 | M | Sensitivos | Normales | AMSAN | II | II | No | 5 |
| 17 | 61 | F | Oftalmoplejía | Normales | Miller Fisher | I | I | No | 8 |
| 18 | 63 | M | Oftalmoplejía | Anormales | AIDP | III | I | UCI | 11 |
| 19 | 28 | F | Sensitivos | Normales | AIDP | III | II | No | 6 |
| 20 | 57 | M | Debilidad | Normales | AIDP | IV | III | UCI | 22 |
AIDP: polineuropatía desmielinizante inflamatoria aguda; AMSAN: neuropatía axonal motora y sensitiva.
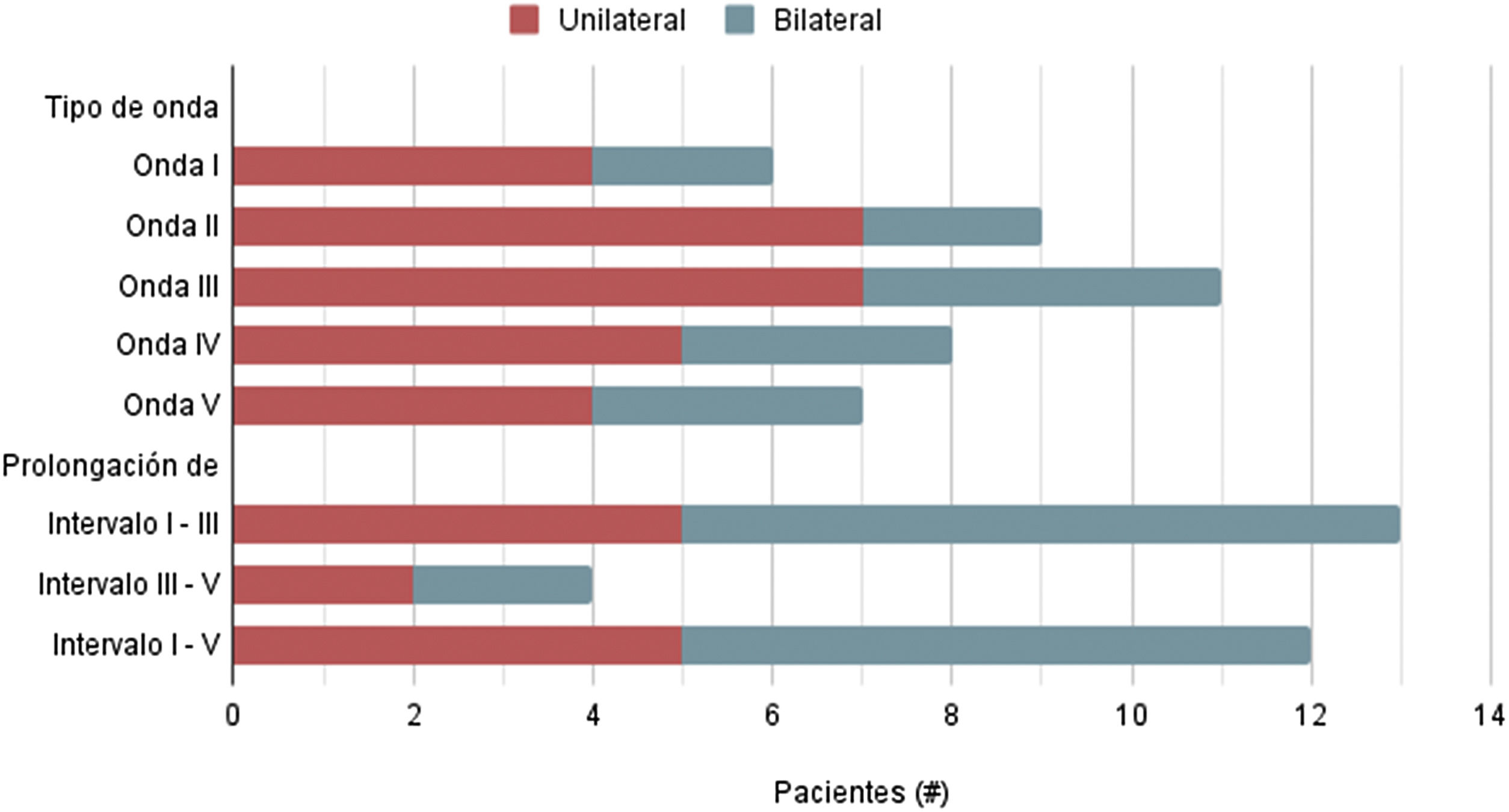
Todos los pacientes evaluados estaban asintomáticos desde el punto de vista audiológico. Los potenciales evocados auditivos fueron anormales en 14 pacientes (70%), con cambios, sobre todo, en el intervalo de conducción central I-V, dado por el retraso del intervalo I-III o, en otros casos, la ausencia de respuestas, lo que indica compromiso periférico del nervio vestibulococlear. Nueve pacientes (45%) tenían afectación bilateral, que era simétrica en 7 de ellos. La afectación fue leve en 9, moderada en uno y grave en 5. El análisis del patrón de potenciales evocados auditivos anormales reveló la mayor participación en la onda III (anormal en 11 potenciales), seguida de la onda II (anormal en 9 potenciales). La afectación unilateral fue más frecuente que la bilateral (figs. 1 y 2).
Distribución de potenciales auditivos anormales de acuerdo con el tipo de onda y prolongación del intervalo.
(tabla 1).
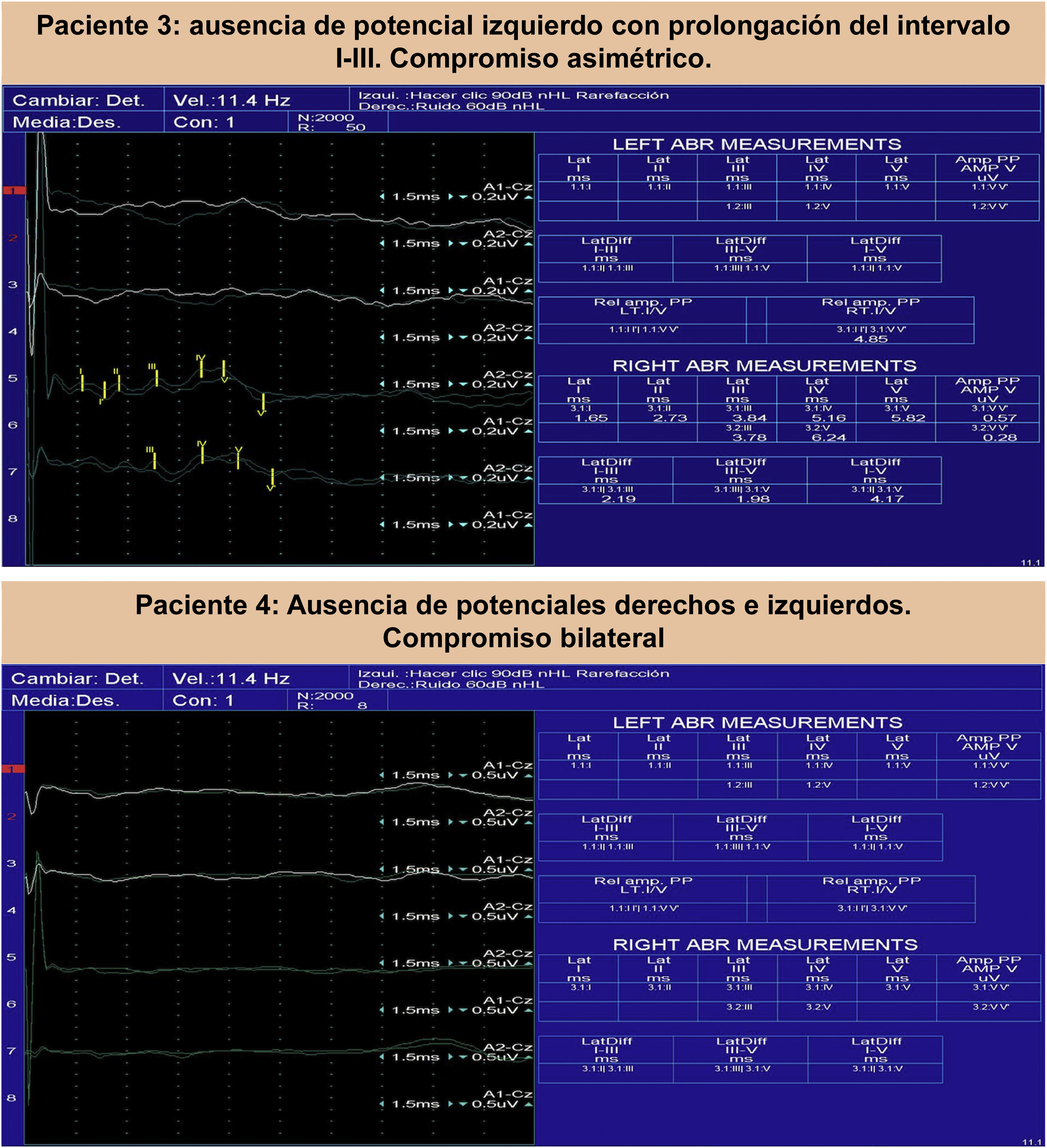
Estos hallazgos son consistentes con cambios en los intervalos de conducción central, donde la prolongación del intervalo I-V se debió principalmente a la prolongación del intervalo I-III (fig. 1). La prolongación de los intervalos de conducción I-III es indicativa de un compromiso periférico de la vía auditiva con preservación del componente central, lo que muestra una afectación de la vía del auditiva entre el nervio vestibulococlear cercano a la cóclea y el tronco encefálico en la protuberancia inferior. Suponemos que la mayor alteración de la conducción se limita al componente periférico y no hubo lesión en la protuberancia, ya que los pacientes no presentaban otros síntomas sugestivos de lesión del sistema nervioso central. Incluso, se obtuvieron las respuestas centrales IV y V en 3 pacientes, no así las respuestas I, II y III.
Todos los pacientes recibieron tratamiento con inmunoglobulina. La estancia hospitalaria varió de 5 a 26 días (tabla 1); fue mayor en pacientes con mayor puntuación de Hughes, entre III y IV, y en pacientes con variantes axonales (frente a pacientes con variantes desmielinizantes).
DiscusiónCuando los médicos se enfrentan a pacientes con SGB se suelen centrar en los síntomas motores y sensitivos, sobre todo debido al riesgo de insuficiencia respiratoria. La importancia de este estudio es que destaca una afectación novedosa: el daño del nervio vestibulococlear. Este estudio, el primero en Latinoamérica en evaluar la vía auditiva en pacientes con SGB, documenta un compromiso auditivo subclínico en la mayoría de los pacientes evaluados. No hubo queja de hipoacusia a pesar de que los estudios electrofisiológicos reflejaron compromiso periférico del nervio vestibulococlear. Incluso los pacientes con lesiones graves reportaron una audición normal, lo que enfatiza la afectación subclínica del nervio vestibulococlear, y el compromiso fue independiente de la variedad o gravedad del SGB.
En cuanto a las características demográficas de la población de estudio, se encontró que el 75% eran hombres, una diferencia por sexo mayor que la reportada en estudios previos de prevalencia3. Por otro lado, 8 de los 20 pacientes (40%) cursaron con un proceso infeccioso previo y uno, con antecedente de vacunación, lo que es similar a las estadísticas ya reportadas1.
Los estudios experimentales han demostrado que la pérdida transitoria de células de Schwann en el nervio coclear puede provocar un déficit auditivo permanente en pacientes con enfermedades desmielinizantes, como el SGB21. Se ha descrito que la afectación de los órganos cocleares vestibulares en neuropatías inflamatorias contribuye al desequilibrio postural y de la marcha en estos pacientes22.
En la literatura científica hay pocos reportes de caso que indiquen la afectación del nervio vestibulococlear en el SGB, la mayoría en poblaciones japonesas y europeas12-16,18, incluyendo un caso en el que se observó este compromiso en la variante Miller Fisher, en Bélgica17.
En un estudio clínico en Polonia en 200419, con potenciales evocados auditivos y visuales del tronco encefálico en 30 pacientes infantiles con SGB, se compararon los hallazgos con un grupo de control. En el estudio se encontró una latencia de onda prolongada en 11 pacientes, lo que señala una participación de las vías visual y auditiva. Sin embargo, en otro estudio previo, en el año 1993, no se encontraron diferencias en los potenciales evocados visuales y auditivos en la fase aguda, pero sí 3 semanas y hasta 3 meses tras el inicio del cuadro20.
Los resultados de este estudio, junto con los datos de la literatura científica, muestran que aunque la afectación en esta enfermedad es principalmente sensorial o motora, es importante realizar una búsqueda activa de daño en otros nervios periféricos. Los resultados también indican el uso de potenciales evocados auditivos como un método complementario para evaluar lesiones silenciosas desde la perspectiva clínica en el tracto auditivo en pacientes con SGB19. En un estudio, Jacot et al. mostraron la utilidad de los potenciales miogénicos evocados vestibulares para el diagnóstico y evaluación de las vías descendentes en neuropatías, así como su utilidad en el seguimiento de la recuperación neurológica23.
El análisis de los potenciales evocados auditivos en los pacientes de este estudio mostró una prolongación de los intervalos de conducción I-V a expensas del segmento I-III. Esto indica una afectación periférica de la vía auditiva con conservación del componente central (intraaxial). Llama la atención que en 3 pacientes no se logró la integración de las respuestas I, II y III mientras se obtenían las respuestas centrales IV y V. Cuando se notó durante la grabación del estudio, se corrigieron los factores técnicos, pero los hallazgos no cambiaron.
Se puede concluir que en pacientes con SGB la topografía de cambios en los potenciales evocados auditivos indica una lesión caudal al complejo olivar. Esto apunta a una afectación periférica de la vía auditiva. Además, la morfología de los potenciales evocados auditivos muestra cronodispersión, lo que indica un compromiso desmielinizante del nervio periférico independiente de la variante SGB.
El pronóstico del SGB es diverso y varía desde debilidad leve y posterior recuperación espontánea, hasta pacientes cuadripléjicos, dependientes del ventilador24, discapacidad permanente grave o muerte (las tasas de mortalidad oscilan entre el 3% y el 7%)11, por lo que la detección temprana de este síndrome y su atención óptima son prioritarias1,3,10,11. El compromiso y los desenlaces en términos de pérdida auditiva son frecuentes según nuestros hallazgos, por lo que es importante considerar esta afectación además del compromiso motor y sensitivo, teniendo en cuenta la discapacidad auditiva potencial. Intentamos correlacionar la gravedad del SGB con la gravedad de la pérdida auditiva; sin embargo, debido al tamaño de la muestra, no fue posible extraer ninguna conclusión válida al respecto.
Los autores identifican un posible sesgo de selección como una limitación de este estudio. No fue posible realizar potenciales evocados auditivos en pacientes que ingresaron tempranamente en UCI, por lo que es necesario continuar con la recolección de datos para esta población. Sin embargo, la mayoría de los casos leves y moderados tenían cambios neurofisiológicos documentados, por lo que es razonable suponer que estos cambios también estarían presentes en los casos graves que requirieron una UCI temprana. Por otro lado, la pequeña población de muestra no permitió un análisis de correlación con χ2 estadísticamente significativo. Aun así, la tendencia porcentual indica que los pacientes con variantes desmielinizantes tenían una afectación más grave del nervio vestibulococlear.
Aunque este estudio muestra una afectación auditiva subclínica en un porcentaje significativo de pacientes con SBG, son necesarios estudios con mayor seguimiento y ampliar la muestra de pacientes para determinar la persistencia de la afectación auditiva a largo plazo y establecer otras correlaciones clínicas.
ConclusiónEste estudio documentó la afectación del nervio vestibulococlear con potenciales evocados auditivos en el 70% de los pacientes con SGB asintomáticos desde el punto de vista auditivo. Los hallazgos incluyeron cambios en los intervalos entre las ondas I y III que estaban claramente más involucrados en comparación con los intervalos entre las ondas III y V, lo que refleja un daño en el segmento periférico de la vía auditiva. Estos resultados apuntan a que la afectación del nervio vestibulococlear en esta enfermedad es frecuente y de presentación asintomática en la mayoría de los casos. El tamaño de la muestra en este estudio es pequeño y se necesita una más grande para permitir el análisis de correlación.
Los resultados muestran la importancia de ir más allá de los cuidados neurológicos motores y sensoriales habituales de los pacientes con SGB y considerar otras afectaciones subclínicas del sistema nervioso periférico.
FinanciaciónEste estudio fue financiado por los autores.
Conflictos de interésLos autores no declaran conflictos de interés.