Los pacientes con enfermedad VIH/sida avanzada presentan un alto riesgo de desarrollar infecciones oportunistas. Las micobacterias no tuberculosas (MNT) como Mycobacterium genavense (MG) son causa de infecciones diseminadas en pacientes con sida. Estos microorganismos se transmiten por inhalación o ingesta, y pueden causar infecciones graves tanto en huéspedes inmunocomprometidos como inmunocompetentes. Se presenta el caso de un paciente que desarrolló una lesión ocupante de espacio cerebral en la que se identificó a MG como agente etiológico.
Caso clínicoSe describe el caso de un paciente con una larga historia de enfermedad VIH/sida avanzada y antecedente de infección diseminada con compromiso del tubo digestivo, la médula ósea y el sistema nervioso central por una micobacteria no identificada dos años antes. Recibió tratamiento antituberculoso ampliado a MNT y fue externado, pero abandonó los controles y el tratamiento indicados. Meses después retorna a la consulta por omalgia izquierda, sin manifestaciones de compromiso neurológico. Una tomografía computarizada cerebral de control mostró un absceso en la región temporo-parietal derecha, con edema perilesional. El examen microbiológico de la lesión posterior a la exéresis neuroquirúrgica mostró el desarrollo de MG.
ConclusionesSe presenta el caso de un paciente con enfermedad VIH/sida avanzada que desarrolló un absceso cerebral debido a MG. La infección por VIH/sida representa el principal factor de riesgo para el desarrollo de infecciones diseminadas por MNT. La micobacteria MG es un agente etiológico muy poco frecuente como causa de lesiones de masa cerebral ocupante en huéspedes inmunocomprometidos. El examen microbiológico directo y los cultivos del material obtenido por biopsia estereotáctica o exéresis quirúrgica es necesario para un correcto diagnóstico y abordaje terapéutico según antibiograma. Finalmente, se efectuó una revisión bibliográfica del tema.
Patients with advanced HIV/AIDS disease are at high risk to developing opportunistic infections. Non-tuberculous mycobacterias (NTM), as Mycobacterium genavense, has been found to cause disseminated infection in patients with AIDS. These organisms are transmitted through inhalation and ingestion and cause serious infections in both, immunocompromised and immunocompetent hosts. We describe an unusual case of a patient with AIDS who presented with a cerebral mass lesion, which was found to be caused by infection with M. genavense.
Clinical caseA 49-year-old man, with a large history of advanced HIV/AIDS disease, and a background of disseminated infection due to a mycobacteria, not identify, two years before, with digestive tract, bone marrow and central nervous system involvement. He was started on antituberculous treatment extended to NTM. He was discharged but interrupted the controls and the treatment. Several months later, he returned with left omalgia without neurological symptoms. A computed tomography of the brain showed a right temporo-parietal mass with surrounding vasogenic edema, concerning for an abscess. Microbiological examination of the surgical piece showed the development of M. genavense.
ConclusionsWe report a case of M. genavense brain abscess in a patient with advanced HIV/AIDS disease. Advanced HIV disease represents the most common risk factor for NTM infections. M. genavense is a very rare etiological agent of brain mass lesions in immunocompromised hosts. Stereotactic brain biopsy or neurosurgical exeresis of the brain abscess followed by the direct and culture examination of the material obtained are necessary to reach the etiological diagnosis and an adequate treatment according to the antibiogram. Additionally, we discuss the microbiology of this organism and review the literature on M. genavense infections.
Mycobacterium genavense (MG) es una micobacteria no tuberculosa (MNT) propuesta como nueva especie de esta clase de microorganismos en 1992 por Börgen et al., a propósito de 18 casos de pacientes reportados en Europa a principio de los años 90, con un cuadro de infección diseminada por micobacterias que no desarrollaban en el medio sólido convencional1,2. La micobacteria MG se comporta como un patógeno oportunista en pacientes inmunocomprometidos, trasplantados, tratados con inmunosupresores, con inmunodeficiencias primarias, enfermedades linfoproliferativas o con infección por el virus de la inmunodeficiencia humana (VIH). En esta última población señalada, es causa de infecciones diseminadas con compromiso principalmente gastrointestinal, linfoganglionar y de médula ósea (MO). La afectación pulmonar es menos frecuente que en otras MNT. Actualmente, la identificación de las MNT requiere de técnicas moleculares que permiten reconocer la especie de acuerdo con la secuenciación del genoma y su sensibilidad a los antibióticos3,4. El compromiso del sistema nervioso central (SNC) bajo la forma de abscesos es muy poco frecuente y ha sido escasamente referida en la literatura5. Se presenta el caso de un paciente que desarrolló una lesión ocupante de espacio cerebral en la que se identificó a MG como agente etiológico.
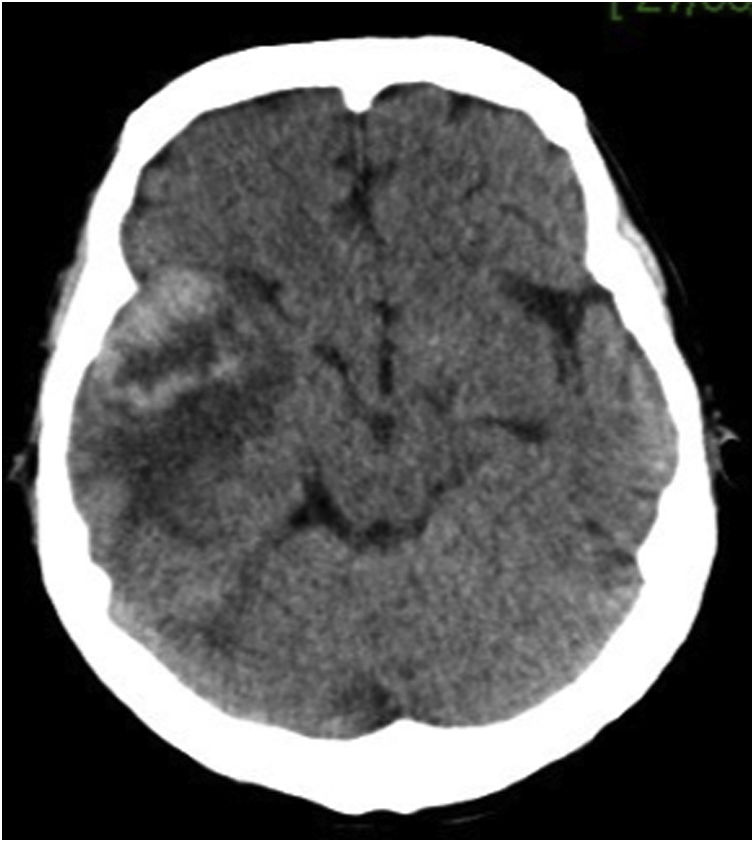
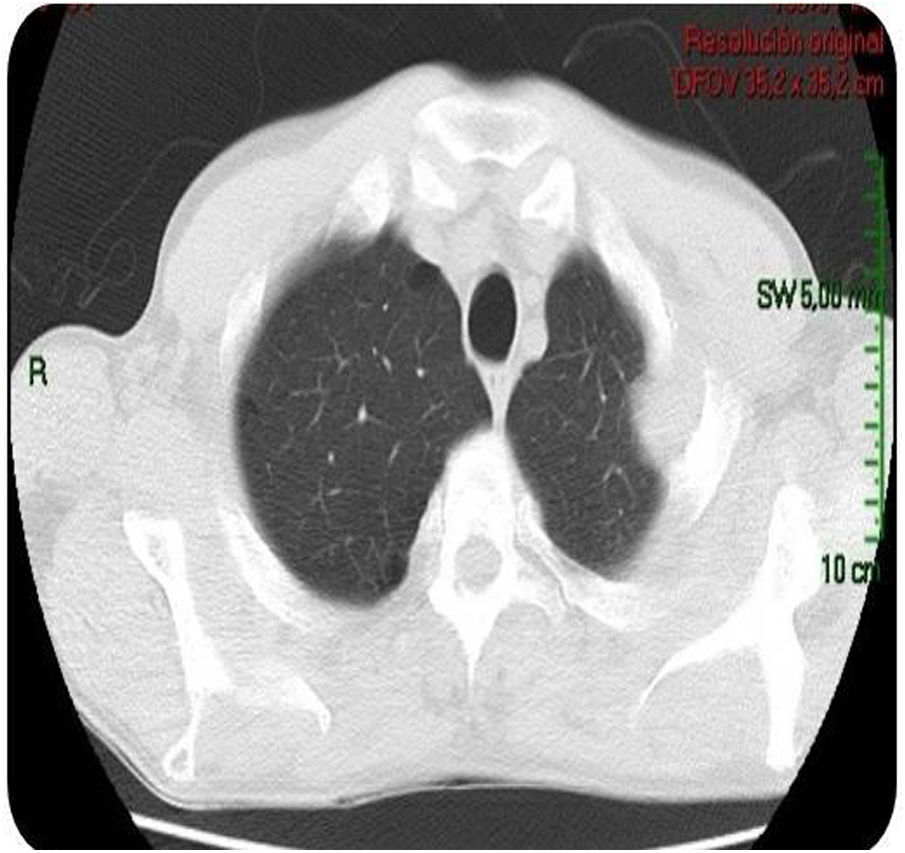
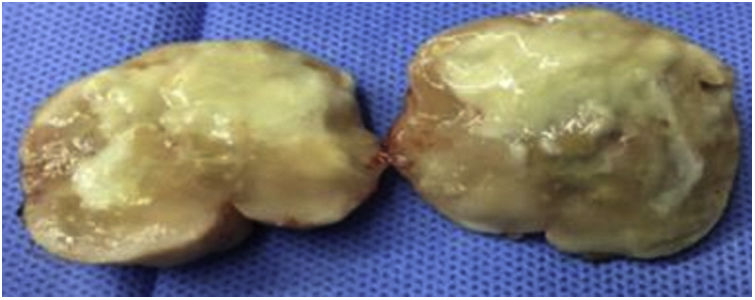
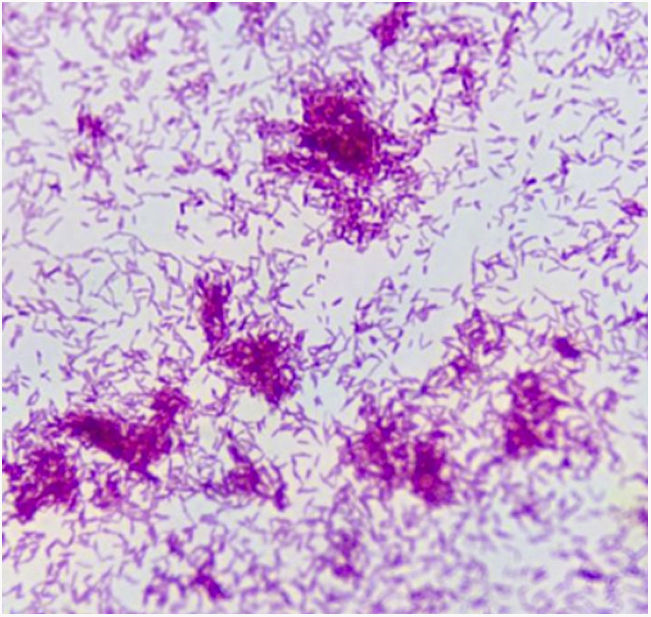
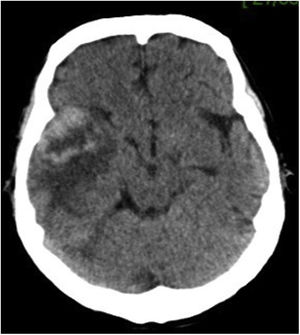
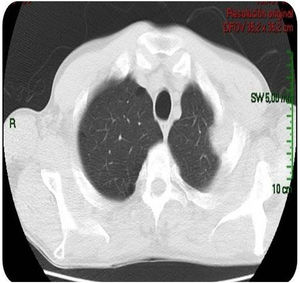
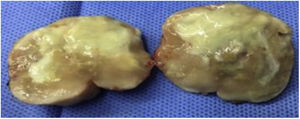
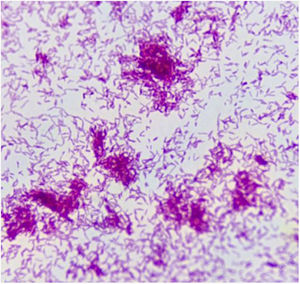
Caso clínicoPaciente varón de 49 años de edad, VIH+ bajo tratamiento antirretroviral (TARV), con carga viral para VIH indetectable y recuento de linfocitos T CD4+ de 100cél/ul. Oriundo de la provincia de Buenos Aires, trabajaba como chófer de automóviles en zona urbana, y refería contacto estrecho con caballos en su lugar de residencia. En relación con su enfermedad de base, VIH/sida, presentaba antecedentes de herpes zóster oftálmico, criptococosis meníngea, meningoencefalitis por citomegalovirus e infección diseminada con compromiso duodenal y de MO por micobacteria no tipificada con respuesta al tratamiento para tuberculosis ampliado para MNT. Dos años antes de su enfermedad actual, había estado internado por cuadro de hipertensión endocraneana asociado con múltiples lesiones cerebrales nodulares, rodeadas de importante edema perilesional, y localizadas a nivel supra e infratentorial observadas en la resonancia magnética (RM) de cerebro. Se indicó tratamiento empírico para toxoplasmosis sin respuesta. Se decidió entonces realizar 2 biopsias estereotácticas que no brindaron diagnóstico etiológico. Por tal motivo, se inició tratamiento empírico para tuberculosis ampliado a MNT con evolución favorable. Es dado de alta, pero abandonó el seguimiento y los controles. En los meses posteriores consulta por omalgia izquierda, por lo que se realizó tomografía computarizada (TC) de tórax que mostró la existencia de un nódulo pulmonar a nivel apical izquierdo. A pesar de encontrarse neurológicamente asintomático, pero por los antecedentes descriptos, se realizó TC cerebral de control, observándose imagen heterogénea, temporo-parietal derecha de 44×47mm, con edema perilesional (fig. 1). Una nueva TC de tórax mostró adyacente al nódulo pulmonar, una formación con densidad de partes blandas que involucra la parrilla costal comprometiendo y engrosando la pleura con lisis del arco costal e irregularidad del mismo (fig. 2). Se realizó exéresis quirúrgica de la lesión cerebral (fig. 3). La baciloscopia del material quirúrgico resultó positiva (+++) con un valor de más de 10 BAAR por campo. El ensayo en GeneXpert® MTB/RIF resultó negativo. No hubo desarrollo en los cultivos en medio sólido luego de 60 días de incubación, pero en medio líquido se detectó crecimiento de una micobacteria atípica, de muy lento desarrollo, a los 33 días de iniciada la incubación (figs. 4 y 5). A continuación se realizó una extracción de ADN genómico, a partir del cual se realizó identificación mediante análisis de perfiles de restricción (PRA). Los perfiles hallados (BstE-II 320/115/0 y HaeIII 130/105/0) fueron compatibles con Mycobacterium genavense tipo 1. La confirmación de la identificación se realizó mediante secuenciación de la región hipervariable A del gen codificante de rARN-16s, que presentó homología de más del 99% con las secuencias de Mycobacterium genavense previamente depositadas en GenBank®.
A partir de este hallazgo se inició tratamiento con claritromicina, rifampicina y etambutol. Presentó buena evolución neurológica, pero con progresión del compromiso pulmonar. Se realizaron 3 biopsias pulmonares donde solo se evidenció fibrosis sin signos de malignidad. Los cultivos para BAAR y hongos de las muestras pulmonares resultaron negativos. El paciente evolucionó de manera desfavorable y falleció por insuficiencia respiratoria.
DiscusiónLa micobacteria MG es responsable entre el 4 y el 13% de las infecciones diseminadas por MNT en pacientes infectados por VIH5. Es una micobacteria de crecimiento muy lento (8 a 12 semanas) y esto se obtiene casi exclusivamente en medio líquido. Para su desarrollo requiere micobactina férrica, y sus ácidos micólicos son idénticos a los de Mycobacterium simiae y Mycobacterium malmoense. Para su identificación se requieren técnicas moleculares, como la secuenciación de la subunidad ribosomal 16s (rRNA3) o el análisis del polimorfismo de los fragmentos de restricción (PRA)4–6. Esta técnica consiste en realizar una PCR de un fragmento de 441 pares de bases del gen codificante de la proteína de shock térmico hsp65 para luego digerirlo con las enzimas de restricción BstE-II y HaeIII. En distintas series de casos publicadas se pudo comprobar que MG es causa de enfermedad diseminada en la mayoría de los pacientes inmunodeprimidos. En un estudio retrospectivo realizado entre 2002 y 20107, en el que se incluyeron 14 pacientes, se encontró enfermedad diseminada en el 100% de los pacientes VIH+ y en el 78% de los inmunodeprimidos por otras causas. El cuadro clínico es similar al ocasionado por Mycobacterium avium complex (MAC) en pacientes con sida. Causa compromiso gastrointestinal, linfoganglionar e invasión de la médula ósea. Sin embargo, el compromiso pulmonar es menos frecuente que en otras MNT. Un trabajo francés, retrospectivo y multicéntrico evaluó el cuadro clínico de la enfermedad debida a MG en 25 pacientes, 20 de ellos VIH+5. La media de LT CD4+ en este último grupo fue 13cél/μl (rango: 0-148). En 24/25 pacientes la enfermedad fue diseminada. Los síntomas más frecuentes fueron: fiebre 18 casos (75%), pérdida de peso 19 pacientes (79%), dolor abdominal 17 enfermos (71%), diarrea 15 casos (62,5%), hepatomegalia 15 pacientes (62,5%) y esplenomegalia 17 enfermos (71%). La detección de adenomegalias abdominales resultó un hallazgo frecuente, comprobándose en 15 pacientes (62,5%) y adenopatías periféricas en 4 enfermos (17%). Solo 5 pacientes presentaron compromiso pulmonar5. Thomsen et al.8, en un trabajo que incluyó pacientes VIH+, compararon los cuadros clínicos producidos por M genavense con los hallazgos en pacientes cursando enfermedad por MAC. No se observaron diferencias estadísticamente significativas en la frecuencia de fiebre, pérdida de peso, anorexia, adenomegalias, anemia, pancitopenia, hepatomegalia y esplenomegalia entre los 2 grupos. El aislamiento del microrganismo en muestras respiratorias fue más común en el grupo de enfermedad diseminada por MAC. Sin embargo, el dolor abdominal fue significativamente más frecuente en los pacientes con MG. Este hallazgo, junto con el aislamiento de esta micobacteria en biopsias de intestino de personas con otras enfermedades no relacionadas, apoyaría la hipótesis de que MG podría colonizar el intestino y diseminarse luego en casos de inmunosupresión9. El compromiso del SNC por MG es poco frecuente. Hasta el momento se han publicado solo 4 casos, 3 de ellos con lesión ocupante de espacio cerebral y el restante con diagnóstico de meningitis en el contexto de una enfermedad diseminada y aislamiento de MG en LCR10–13. Todos los pacientes se encontraban inmunodeprimidos, 3 de ellos eran VIH+ y el restante padecía una inmunodeficiencia primaria11. Uno de los pacientes presentó como único síntoma neurológico visión borrosa12, el segundo convulsiones y síndrome confusional10 y el restante déficit neurológico focal11. El paciente que se describe no presentó síntomas neurológicos en el momento del hallazgo en las imágenes cerebrales. En cuanto a la lesión ocupante de espacio cerebral, en 2 de los pacientes, al igual que en el caso que se presenta, se trataba de una masa única con edema perilesional significativo. En el paciente con la inmunodeficiencia primaria las lesiones fueron descriptas como múltiples masas intracraneales en región subcortical con extenso edema perifocal. Uno de los pacientes presentaba, además, al igual que en el caso que se describe, una lesión pulmonar, aunque en el caso que se relata, no se pudo alcanzar un diagnóstico etiológico de certeza a pesar de las múltiples biopsias realizadas. El tratamiento óptimo y la duración del mismo no están bien establecidos. Los datos de susceptibilidad in vitro están limitados por ser un microorganismo de difícil desarrollo e identificación. En un modelo murino se cuantificó el número de bacterias viables en el bazo de los roedores luego de la administración de distintos antimicrobianos. El mayor descenso de colonias se obtuvo con la combinación de claritromicina y rifabutina. Con la asociación de amikacina y etambutol se logró un descenso menor y más lento. No se encontró efecto alguno con el uso de ciprofloxacina14. En el trabajo de Thomsen et al. se analizó la susceptibilidad de las muestras clínicas. El 100% de los aislamientos fueron sensibles a claritromicina, azitromicina, rifampicina, rifabutina y ácido fusídico. En 10/12 muestras se comprobó la sensibilidad a amikacina y en 9/12 a fluoroquinolonas (ciprofloxacina u ofloxacina). Se observó resistencia a etambutol en 9 de los 12 aislamientos y a isoniacida en 11 de las 12 muestras8. Por lo tanto, estos fármacos utilizados en el tratamiento de primera línea de la tuberculosis no serían de utilidad en los pacientes con enfermedad diseminada por MG. Si bien no existe un tratamiento único consensuado, las guías de ATS/IDSA recomiendan un esquema con múltiples drogas que incluya la claritromicina. La información actual sugiere que la mayor parte de los aislamientos son también sensibles a rifamicinas y aminoglucósidos. La actividad del etambutol parece ser limitada15. Los resultados con relación a quinolonas resultaron discordante en estos 2 trabajos8,14.
ConclusionesAnte una lesión ocupante de espacio cerebral en pacientes inmunodeprimidos con enfermedad VIH/sida avanzada deben plantearse múltiples diagnósticos diferenciales a saber: toxoplasmosis, linfoma primario, tuberculoma, chagoma, nocardiosis e infección por Rhodococcus equi. El compromiso neurológico por MNT es poco frecuente; sin embargo, es fundamental lograr su aislamiento e identificación con antibiograma a fin de poder implementar un tratamiento óptimo. Existen muy pocos casos publicados de infección por MG con compromiso del SNC. Probablemente exista subdiagnóstico de esta complicación por falta de sospecha clínica y dificultades en su aislamiento e identificación que requieren de la biopsia estereotáxica o la exéresis quirúrgica de la lesión para el estudio de las muestras. En pacientes con enfermedad VIH/sida, el tratamiento prolongado y combinado que incluya un macrólido (claritromicina) debe acompañarse de la reconstitución inmune asociada con la terapia antirretroviral de gran actividad o alta eficacia (TARGA). No existen recomendaciones específicas para la prevención de MG. Extrapolando la evidencia disponible para enfermedad diseminada por MAC, se debería indicar profilaxis secundaria hasta lograr un recuento de LTCD4+ mayor de 100 cél/μl durante al menos 6 meses16.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.