El término de epilepsia mioclónica progresiva (EMP) engloba a un conjunto de entidades clínicas de etiología heterogénea. Se caracterizan por diferentes tipos de crisis epilépticas, principalmente mioclónicas, deterioro intelectual y otras manifestaciones clínicas, predominantemente cerebelosas1,2.
Varón de 15 años nacido de embarazo y parto normales con desarrollo psicomotor y escolarización adecuados hasta los 11 años. Tenía un hermano 3 años mayor sano. Los padres no eran consanguíneos, aunque ambos proceden del mismo pueblo que tiene alrededor de 1.000 habitantes.
A los 12 años comenzó con episodios de desconexión del medio de segundos de duración que fueron interpretados como ausencias. Durante los siguientes meses presentó varias crisis tónico-clónicas generalizadas. Se realizó una TC craneal que fue normal y un EEG donde se ponía de manifiesto una lentificación global del trazado de fondo sobre el que aparecía algún complejo difuso punta-onda. Estimulación lumínica intermitente con respuesta fotoparoxística a bajas frecuencias. Durante las fases de somnolencia no aumentaba la actividad epiléptica.
Inicialmente se le diagnosticó de epilepsia mioclónica juvenil y fue tratado con ácido valproico (1.500mg al día) al que se asoció clonazepam (40mg al día). Dada la falta de respuesta al tratamiento se añadió fenobarbital (90mg al día) para intentar reducir las crisis generalizadas y etoxusimida (1.000mg al día) para reducir las ausencias.
Presentó una mala evolución posterior de la epilepsia en los 2 años siguientes con crisis progresivamente más frecuentes. Presentaba diferentes tipos de crisis epilépticas: ausencias atípicas, mioclonías multifocales de origen cortical y crisis tonicoclónicas generalizadas. También se evidenció un deterioro escolar con déficit cognitivos múltiples fundamentalmente de tipo visuoespacial y de la lectoescritura. Con esta sintomatología se llegó al diagnóstico de epilepsia mioclónica progresiva.
La exploración física general no mostraba estigmas cutáneos de facomatosis, visceromegalias ni lesiones retinianas color rojo cereza. En la exploración neurológica se evidenciaba una bradipsiquia y déficit amnésico para hechos recientes. Pares craneales normales, salvo nistagmo horizontal con componente rápido en la dirección de la mirada. Sistema motor y sensibilidad sin alteraciones relevantes. Ataxia troncal, temblor de actitud en las manos que aumentaba intencionalmente, disartria y dismetría dedo-nariz bilateral.
Analítica con hemograma, perfil renal, hepático, tiroideo, cobre, ceruloplasmina, creatincinasa, anticuerpos antineuronales, lactato basal y postejercicio normales. Aminoácidos en sangre y orina normales. El estudio de las enzimas lisosomales fue normal.
La RM cerebral mostraba moderada atrofia cerebral global y de cerebelo.
En el EEG se observa enlentecimiento de fondo con actividad epileptiforme generalizada en forma de complejos punta y polipuntaonda de duración variable y que aparecen muy persistentemente a lo largo de todo el registro. Estimulación lumínica intermitente con respuesta fotoparoxística a bajas frecuencias. Durante las fases de somnolencia no aumentaba la actividad epiléptica.
Biopsia de músculo estriado: conservación de su estructura con diámetro de fibras moderadamente variables. La red basófila intermiofibrilar está aumentada con numerosas fibras formando pequeñas acumulaciones redondeadas, basófilas, que son positivos para el PAS y con las técnicas para enzimas oxidativas.
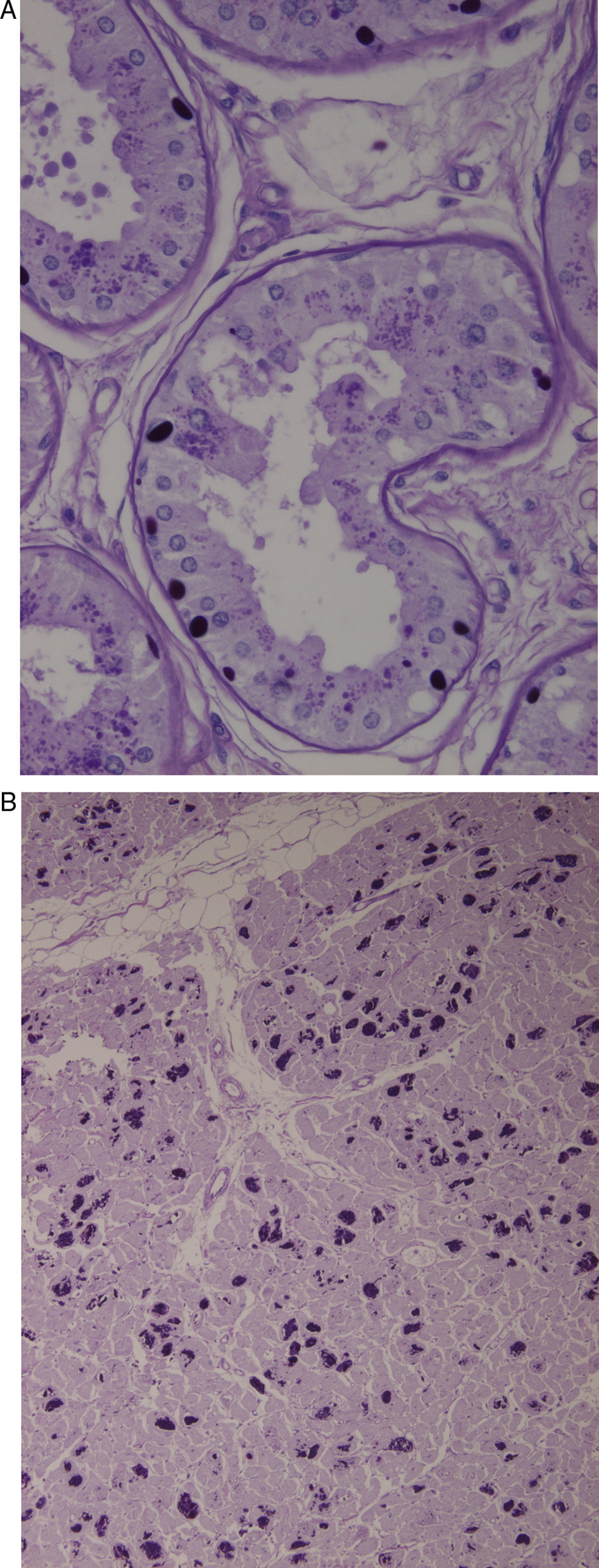
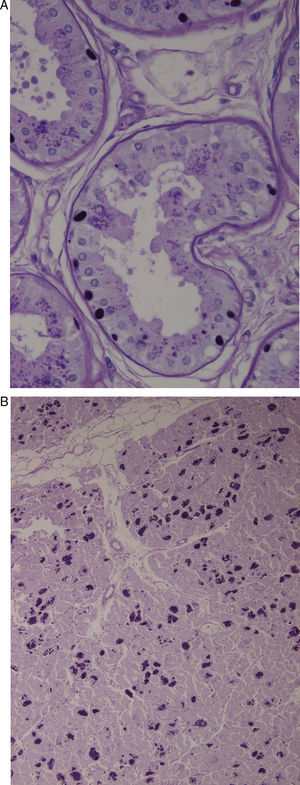
Biopsia de la piel axilar (fig. 1A): se observan formaciones redondeadas intensamente PAS+en las células epiteliales de las glándulas apocrinas y en los conductos de las glándulas ecrinas. Ambas biopsias son compatibles con la enfermedad de Lafora.
A) Biopsia de la piel axilar (Tinción PAS a un aumento de 2×400): se observan formaciones redondeadas intensamente PAS+en las células epiteliales de las glándulas apocrinas y en los conductos de las glándulas ecrinas correspondientes a cuerpos de Lafora. B) Corazón (Tinción PAS a un aumento 1×200). Múltiples cuerpos de Lafora en los miocitos.
La evolución de la enfermedad ha sido agresiva presentando el paciente múltiples crisis epilépticas tonicoclónicas generalizadas, mioclónicas y parciales con sintomatología visual que han persistido a pesar de múltiples combinaciones de fármacos. Su capacidad funcional acabó con invalidez total precisando alimentación por sonda nasogástrica dada la dificultad de deglución por mioclonías palatales frecuentes. Presentó tetraparesia con vida limitada a cama-sillón e incontinencia vesical y fecal. Falleció por neumonía aspirativa a los 8 años del inicio de la enfermedad.
En el estudio necrópsico se evidenciaron los característicos cuerpos de Lafora en múltiples niveles del SNC, fundamentalmente en tálamo y cerebelo, así como en el hígado y en el corazón (fig. 1B).
Las causas más frecuentes y que constituyen la mayoría de los casos de EMP son: enfermedad de Unverricht-Lundborg, enfermedad de Lafora, ceroidolipofuscinosis, sialidosis y citopatías mitocondriales (epilepsia mioclónica con fibras rojo rotas, MERFF) (tabla 1).
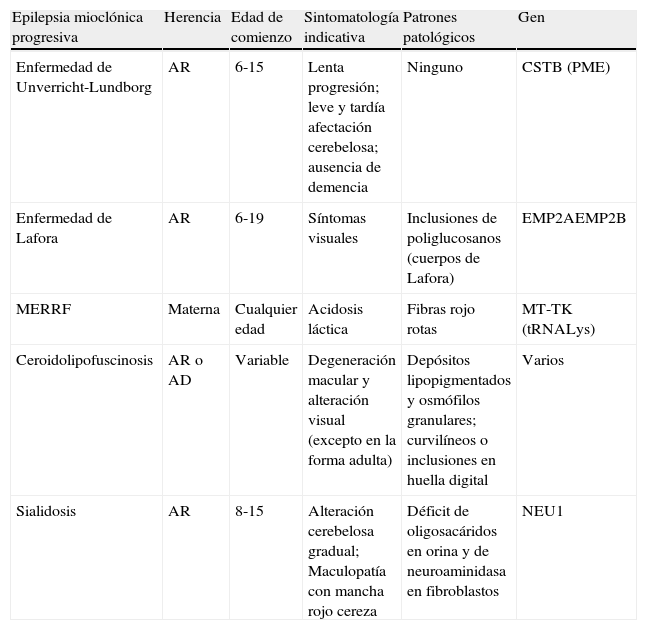
Diagnóstico diferencial de las epilepsias mioclónicas progresivas
| Epilepsia mioclónica progresiva | Herencia | Edad de comienzo | Sintomatología indicativa | Patrones patológicos | Gen |
| Enfermedad de Unverricht-Lundborg | AR | 6-15 | Lenta progresión; leve y tardía afectación cerebelosa; ausencia de demencia | Ninguno | CSTB (PME) |
| Enfermedad de Lafora | AR | 6-19 | Síntomas visuales | Inclusiones de poliglucosanos (cuerpos de Lafora) | EMP2AEMP2B |
| MERRF | Materna | Cualquier edad | Acidosis láctica | Fibras rojo rotas | MT-TK (tRNALys) |
| Ceroidolipofuscinosis | AR o AD | Variable | Degeneración macular y alteración visual (excepto en la forma adulta) | Depósitos lipopigmentados y osmófilos granulares; curvilíneos o inclusiones en huella digital | Varios |
| Sialidosis | AR | 8-15 | Alteración cerebelosa gradual; Maculopatía con mancha rojo cereza | Déficit de oligosacáridos en orina y de neuroaminidasa en fibroblastos | NEU1 |
AD: autosómico dominante; AR: autosómico recesivo; MERFF: epilepsia mioclónica con fibras rojo rotas.
La enfermedad de Lafora fue descrita por el Dr. Rodríguez Lafora por primera vez en el año 19113. Consiste en un trastorno degenerativo y progresivo del sistema nervioso central de herencia autosómica recesiva. No existen diferencias respecto al sexo y predomina en los países del sur de Europa.
Clínicamente se caracteriza por crisis tónico-clónicas generalizadas, mioclonías, deterioro mental progresivo, signos piramidales, extrapiramidales y cerebelosos4. La enfermedad comienza al final de la niñez o durante la adolescencia (6 a 20 años) y conduce a un desenlace fatal en el curso de 10 años desde los primeros síntomas. Se produce por una alteración homocigótica en el gen EPM2 ligada al cromosoma 6q23-25 que codifica una proteína tirosina fosfatasa (laforina) implicada en el control metabólico del glucógeno5.
Histológicamente se caracteriza por la presencia de cuerpos de inclusión intracitoplasmáticos en órganos como el hígado, el corazón y el cerebro y, especialmente, en la biopsia de la piel axilar6. Estos cuerpos los constituyen polímeros de glucosa (poliglucosanos) y su presencia en la biopsia de la piel axilar se consideran prácticamente patognomónicos.
Las mioclonías se vuelven continuas durante la vigilia y son resistentes a la medicación antiepiléptica, asociándose con frecuencia a crisis del lóbulo occipital. Las crisis occipitales se caracterizan por alucinaciones visuales simples, aunque en ocasiones son complejas, que son típicas de la enfermedad de Lafora. Coincidiendo con el inicio de las mioclonías se produce el deterioro progresivo de las funciones corticales y la ataxia.
Las manifestaciones electroencefalográficas en raras ocasiones pueden presentarse antes del inicio de los síntomas. Se caracterizan por paroxismos de punta-onda o polipunta-onda cada vez más frecuentes. Posteriormente, el trazado de base se enlentece y desorganiza, los paroxismos son más frecuentes hasta hacerse continuos y se desencadenan por estimulación lumínica intermitente, siendo típicos los fotoparoxismos a bajas frecuencias7. Además de este hecho para diferenciar estadios iniciales de enfermedad de Lafora de la epilepsia mioclónica juvenil, durante el sueño no aumentan las anomalías epilépticas en la enfermedad de Lafora.
La RM cerebral no muestra alteraciones significativas en fases iniciales e intermedias de la enfermedad, existiendo en las fases finales atrofia cerebral y cerebelosa8.
El consejo genético y el diagnóstico prenatal son teóricamente posibles cuando se ha documentado la anomalía genética en algún miembro de la familia9.
En conclusión, ante un paciente de edad joven (final de la infancia o adolescencia) que comienza con mioclonías seguida de ataxia y deterioro cognitivo progresivo sin evidencia de alteración estructural en las pruebas de neuroimagen ni alteraciones metabólicas en el estudio analítico debemos sospechar la enfermedad de Lafora10.