Las reacciones adversas a medicamentos (RAM) son un problema de salud pública y una importante causa de morbimortalidad a nivel mundial. En el caso de los fármacos antiepilépticos (FAE), la presencia de RAM puede ser un impedimento para lograr el éxito terapéutico al dificultar la adherencia al tratamiento e impactar la calidad de vida del paciente. La farmacogenética busca la identificación de variantes genéticas asociadas a la seguridad de los fármacos. En este artículo se revisan los genes que codifican para enzimas metabolizadoras y transportadores de fármacos, así como en el sistema HLA asociados a RAM inducidas por FAE.
DesarrolloA la fecha, se ha reportado la asociación de los alelos CYP2C9*2 y *3, que codifican para enzimas de actividad reducida, con efectos neurotóxicos por fenitoína (PHT); alelos nulos de GSTM1 asociados con hepatotoxicidad inducida por carbamazepina (CBZ) y ácido valproico (VPA); polimorfismos genéticos de EPHX1 en la teratogénesis inducida por PHT; variantes genéticas de ABCC2 asociadas con RAM neurológicas por CBZ y VPA, y también diversos alelos de HLA (p. ej., HLA-B*15:02, -A*31:01, -B*15:11, -C*08:01) asociados con RAM de tipo cutáneas.
ConclusionesLos hallazgos publicados muestran que existen RAM con base farmacogenética con una alta variabilidad interétnica, lo que refleja la necesidad de que se realicen estudios en distintas poblaciones para poder obtener resultados que sean de utilidad a un número mayor de pacientes. La búsqueda de biomarcadores que permitan la predicción de RAM a FAE podría mejorar la farmacoterapia en la epilepsia.
Adverse drug reactions (ADRs) are a major public health concern and a leading cause of morbidity and mortality in the world. In the case of antiepileptic drugs (AEDs), ADRs constitute a barrier to successful treatment since they decrease treatment adherence and impact patients’ quality of life of patients. Pharmacogenetics aims to identify genetic polymorphisms associated with drug safety. This article presents a review of genes coding for drug metabolising enzymes and drug transporters, and HLA system genes that have been linked to AED-induced ADRs.
DevelopmentTo date, several genetic variations associated with drug safety have been reported: CYP2C9*2 and *3 alleles, which code for enzymes with decreased activity, have been linked to phenytoin (PHT)-induced neurotoxicity; GSTM1 null alleles with hepatotoxicity induced by carbamazepine (CBZ) and valproic acid (VPA); EPHX1 polymorphisms with teratogenesis; ABCC2 genetic variations with CBZ- and VPA-induced neurological ADRs; and HLA alleles (e.g. HLA-B*15:02, -A*31:01, -B*15:11, -C*08:01) with cutaneous ADRs.
ConclusionsPublished findings show that there are ADRs with a pharmacogenetic basis and a high interethnic variability, which indicates a need for future studies in different populations to gather more useful results for larger number of patients. The search for biomarkers that would allow predicting ADRs to AEDs could improve pharmacotherapy for epilepsy.
La farmacogenética, como disciplina formal, surgió en los años 50 producto de diversas observaciones de deficiencias enzimáticas heredables que causaban toxicidad a ciertos medicamentos en un grupo específico de individuos. Su objetivo fundamental ha sido el estudio de variaciones genéticas asociadas a diferencias en la respuesta individual a fármacos1,2.
Los estudios farmacogenéticos consideran la asociación de variantes alélicas de genes que codifican para enzimas metabolizadoras de fármacos (EMF), transportadores y receptores de fármacos, con las variaciones en requerimientos de dosis, eficacia y presencia de reacciones adversas a medicamentos (RAM). Esta revisión se enfocará en los avances farmacogenéticos en el ámbito de las RAM por fármacos antiepilépticos (FAE) debido a la importancia que tienen estas en la adherencia y la calidad de vida de pacientes con epilepsia.
Reacciones adversas a medicamentosLas RAM son un serio problema para los individuos que las presentan y para el sistema de salud pública. Se estima que la incidencia de las RAM en Estados Unidos es del 6,7%3 y del 6,5% en Reino Unido4, mientras que en Suiza constituyen el 3% de los decesos5; aumentando la prevalencia en pacientes mayores de 60 años6. Los pacientes que presentan RAM pueden requerir hospitalización o alargar su estancia hospitalaria, lo cual incrementa los costos de tratamiento7-9.
Por más de 40 años, la Organización Mundial de la Salud ha definido a las RAM como «la respuesta a un fármaco, la cual es nociva, no intencionada y ocurre a dosis estándares utilizadas en el humano como profilaxis, diagnóstico o tratamiento de una enfermedad, o para la modificación de una función fisiológica»10. Se ha señalado la necesidad de contar con nuevas definiciones para incluir en la clasificación las RAM causadas por errores de medicación, usos no autorizados, mal uso y abuso de productos medicinales, así como el manejo de la RAM, por ejemplo, la administración de un tratamiento específico, la suspensión total del medicamento y las precauciones a futuro, entre otras11. Las reacciones se clasifican en diferentes tipos que van desde el A hasta el F, siendo las más comunes los tipos A y B. En la tabla 1 se resumen las características de cada una de ellas11-13.
Clasificación de reacciones adversas a medicamentos
| Tipo de RAM | Características | Ejemplos de RAM inducidas por FAE |
|---|---|---|
| A | Dependiente de dosis; respuesta farmacológica excesiva; predecible; reversible; frecuente; baja severidad | Mareos, cefalea, temblor, somnolencia, insomnio, vértigo, ataxia, diplopía, depresión, hiponatremia, parestesias, trastornos gastrointestinales |
| B | No relacionadas con la dosis ni con el mecanismo de acción farmacológico; relacionadas con la vulnerabilidad individual; no predecible; poco frecuentes; alta morbimortalidad; reversible | Reacciones cutáneas y de hipersensibilidad (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, exantema maculopapular leve, etc.), hepatotoxicidad, anemia aplásica, agranulocitosis |
| C | Relacionadas con la dosis y el tiempo (acumulación de dosis); poco frecuentes; crónicas; la mayoría son reversibles. | Aumento o pérdida de peso, engrosamiento de encías, pérdida visual. |
| D | Relacionadas al tiempo, usualmente a la dosis y a la exposición prenatal; poco frecuentes; irreversible | Teratogénesis |
| E | Relacionadas a la suspensión del medicamento | Insomnio, ansiedad y trastornos después del retiro súbito de benzodiazepinas |
| F | Falla terapéutica no esperada; frecuente; relacionada con la dosis y la interacción de fármacos | Disminución de concentraciones plasmáticas de fármacos debido a inducción enzimática de terapia concomitante |
La epilepsia es uno de los trastornos neurológicos de mayor prevalencia a nivel mundial, afectando aproximadamente a 70 millones de personas en el mundo y al menos 5 millones de ellos se encuentran en América Latina14,15.
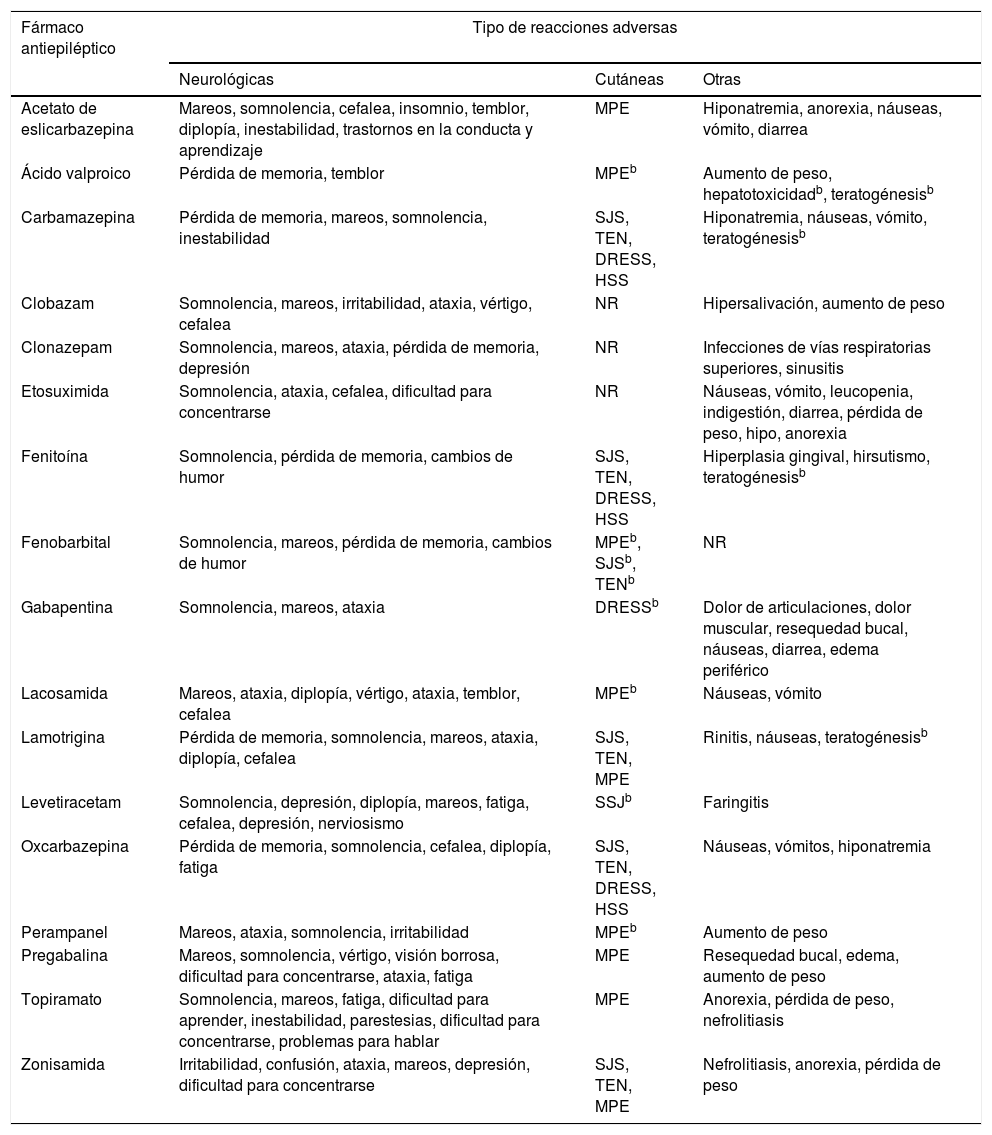
A pesar de los numerosos intentos por desarrollar fármacos seguros e inocuos, resulta inevitable la aparición de RAM. Debido a que los FAE presentan diferentes mecanismos de acción, pueden causar efectos no deseados, principalmente de tipo neurológico y psiquiátrico, aunque también se pueden ver afectados otros órganos y sistemas (tabla 2)16-31.
| Fármaco antiepiléptico | Tipo de reacciones adversas | ||
|---|---|---|---|
| Neurológicas | Cutáneas | Otras | |
| Acetato de eslicarbazepina | Mareos, somnolencia, cefalea, insomnio, temblor, diplopía, inestabilidad, trastornos en la conducta y aprendizaje | MPE | Hiponatremia, anorexia, náuseas, vómito, diarrea |
| Ácido valproico | Pérdida de memoria, temblor | MPEb | Aumento de peso, hepatotoxicidadb, teratogénesisb |
| Carbamazepina | Pérdida de memoria, mareos, somnolencia, inestabilidad | SJS, TEN, DRESS, HSS | Hiponatremia, náuseas, vómito, teratogénesisb |
| Clobazam | Somnolencia, mareos, irritabilidad, ataxia, vértigo, cefalea | NR | Hipersalivación, aumento de peso |
| Clonazepam | Somnolencia, mareos, ataxia, pérdida de memoria, depresión | NR | Infecciones de vías respiratorias superiores, sinusitis |
| Etosuximida | Somnolencia, ataxia, cefalea, dificultad para concentrarse | NR | Náuseas, vómito, leucopenia, indigestión, diarrea, pérdida de peso, hipo, anorexia |
| Fenitoína | Somnolencia, pérdida de memoria, cambios de humor | SJS, TEN, DRESS, HSS | Hiperplasia gingival, hirsutismo, teratogénesisb |
| Fenobarbital | Somnolencia, mareos, pérdida de memoria, cambios de humor | MPEb, SJSb, TENb | NR |
| Gabapentina | Somnolencia, mareos, ataxia | DRESSb | Dolor de articulaciones, dolor muscular, resequedad bucal, náuseas, diarrea, edema periférico |
| Lacosamida | Mareos, ataxia, diplopía, vértigo, ataxia, temblor, cefalea | MPEb | Náuseas, vómito |
| Lamotrigina | Pérdida de memoria, somnolencia, mareos, ataxia, diplopía, cefalea | SJS, TEN, MPE | Rinitis, náuseas, teratogénesisb |
| Levetiracetam | Somnolencia, depresión, diplopía, mareos, fatiga, cefalea, depresión, nerviosismo | SSJb | Faringitis |
| Oxcarbazepina | Pérdida de memoria, somnolencia, cefalea, diplopía, fatiga | SJS, TEN, DRESS, HSS | Náuseas, vómitos, hiponatremia |
| Perampanel | Mareos, ataxia, somnolencia, irritabilidad | MPEb | Aumento de peso |
| Pregabalina | Mareos, somnolencia, vértigo, visión borrosa, dificultad para concentrarse, ataxia, fatiga | MPE | Resequedad bucal, edema, aumento de peso |
| Topiramato | Somnolencia, mareos, fatiga, dificultad para aprender, inestabilidad, parestesias, dificultad para concentrarse, problemas para hablar | MPE | Anorexia, pérdida de peso, nefrolitiasis |
| Zonisamida | Irritabilidad, confusión, ataxia, mareos, depresión, dificultad para concentrarse | SJS, TEN, MPE | Nefrolitiasis, anorexia, pérdida de peso |
DRESS: reacción a fármacos con eosinofilia y síntomas sistémicos; HSS: síndrome de hipersensibilidad; MPE: exantema maculopapular; NR: reacciones no reportadas comúnmente para esos antiepilépticos; SJS: síndrome de Stevens-Johnson; TEN: necrólisis epidérmica tóxica.
Reacciones frecuentes se consideraron aquellas que se presentan en ≥ 1/100 a < 1/10 de los pacientes, y muy frecuentes aquellas reportadas por ≥ 1/10 pacientes.
Estas reacciones adversas se presentan con una frecuencia ≥ 1/100, sin embargo, fueron incluidas por su gravedad e importancia en la farmacogenética.
Tomado de Brogden et al.16, Greenwood17, Herranz et al.18, Hill et al.19, Jarernsiripornkul et al.20, Ketter et al.21, Massot et al.22, Pellock23, Posner et al.24, Tomson y Battino25, Riverol et al.26, Zaccara et al.27, Zaccara et al.28, Zaccara et al.29, Zaccara et al.30 y Zaccara et al31.
La presencia de RAM en la terapia farmacológica para la epilepsia dificulta el control de crisis convulsivas, obstaculiza la adherencia y promueve la suspensión del tratamiento en un 25% de los pacientes32-34. Además de impactar en la calidad de vida del paciente13,35, el aspecto económico también se ve afectado36.
En este sentido, la farmacogenética evalúa la contribución de polimorfismos genéticos en la variabilidad en la respuesta y la susceptibilidad para presentar cierto tipo de RAM2,37. El estudio de estos polimorfismos se centra en genes que codifican para EMF, transportadores de FAE y, de manera más reciente, en genes del sistema HLA2,38-40.
Polimorfismos genéticos en enzimas metabolizadoras asociados a reacciones adversas a antiepilépticosEnzimas de fase iLas RAM tipo A debidas a FAE comprenden las de tipo neurológico y psiquiátrico, deficiencia de vitaminas, trastornos endocrinos e hiponatremia, entre otros41. Debido a que estas RAM son dependientes de dosis, su presencia se ha asociado a polimorfismos en genes codificadores de EMF y transportadores de fármacos.
Las EMF se encargan principalmente del metabolismo de compuestos endógenos y exógenos. En el caso de los FAE, estas funciones las realizan principalmente las enzimas del citocromo P450 (CYP) en metabolismo de fase i, y las enzimas de glucuronidación UDP-glucuronosiltransferasas (UGT) en el metabolismo de fase ii42. Dos enzimas del citocromo P450, CYP2C9 y CYP2C19, son importantes en el metabolismo de fenitoína (PHT), un fármaco de ventana terapéutica estrecha y cinética no lineal. La enzima CYP2C9 es responsable del 90% del metabolismo de PHT, mientras que CYP2C19 se encarga del 10% restante. Se ha reportado que los polimorfismos en los genes que codifican para estos citocromos están asociados con diferentes RAM, especialmente de tipo neurológico. Se han descrito diversas variantes alélicas de CYP2C9, de las cuales las 3 más representativas y que se presentan con mayor frecuencia en caucásicos son: CYP2C9*1 considerada la variante silvestre (Arg144Ile359), CYP2C9*2 (Cys144Ile359) y CYP2C9*3 (Arg144Leu359). Estas 2 últimas variantes codifican para enzimas con menor actividad enzimática. Los portadores del alelo CYP2C9*2 presentan una actividad enzimática del 12% respecto a la variante silvestre, mientras que para CYP2C9*3 la enzima solo presenta una actividad del 5%. En españoles la frecuencia de CYP2C9*2 y *3 es del 16 y el 10%43, respectivamente, mientras que en poblaciones chinas y áfrico-americanas, así como en población mestiza e indígena mexicana, la frecuencia es menor44-46. En estudios en poblaciones áfrico-americanas, se identificaron otros 2 alelos con actividad enzimática reducida: CYP2C9*5 (Ile359Thr) y *6 (c.delA818)47,48. Esto es importante debido a que los individuos portadores de estos alelos presentan un fenotipo de metabolismo lento de PHT que puede ocasionar síntomas como mareos, nistagmo, ataxia, sedación excesiva, alteraciones de la consciencia y confusión mental que deterioran la calidad de vida del paciente e impiden la adherencia al tratamiento49,50. Existen diversos reportes que describen esta asociación (tabla 3); sin embargo, aún es necesario el estudio en otras poblaciones, entre ellas las iberoamericanas, para identificar las variantes de actividad reducida específicas de cada población.
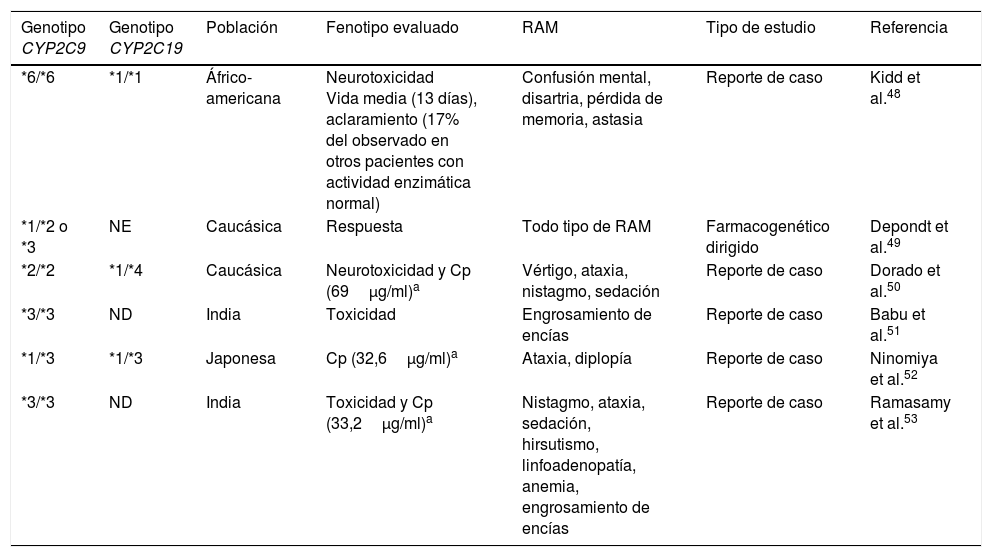
Reportes de variantes de CYP2C9 y CYP2C19 asociadas con desarrollo de reacciones adversas a fenitoína dependientes de dosis
| Genotipo CYP2C9 | Genotipo CYP2C19 | Población | Fenotipo evaluado | RAM | Tipo de estudio | Referencia |
|---|---|---|---|---|---|---|
| *6/*6 | *1/*1 | Áfrico-americana | Neurotoxicidad Vida media (13 días), aclaramiento (17% del observado en otros pacientes con actividad enzimática normal) | Confusión mental, disartria, pérdida de memoria, astasia | Reporte de caso | Kidd et al.48 |
| *1/*2 o *3 | NE | Caucásica | Respuesta | Todo tipo de RAM | Farmacogenético dirigido | Depondt et al.49 |
| *2/*2 | *1/*4 | Caucásica | Neurotoxicidad y Cp (69μg/ml)a | Vértigo, ataxia, nistagmo, sedación | Reporte de caso | Dorado et al.50 |
| *3/*3 | ND | India | Toxicidad | Engrosamiento de encías | Reporte de caso | Babu et al.51 |
| *1/*3 | *1/*3 | Japonesa | Cp (32,6μg/ml)a | Ataxia, diplopía | Reporte de caso | Ninomiya et al.52 |
| *3/*3 | ND | India | Toxicidad y Cp (33,2μg/ml)a | Nistagmo, ataxia, sedación, hirsutismo, linfoadenopatía, anemia, engrosamiento de encías | Reporte de caso | Ramasamy et al.53 |
Cp: concentración plasmática; ND: no determinado; NE: no especificado; RAM: reacción adversa a medicamento.
Aun cuando la agencia reguladora de Estados Unidos (FDA por su sigla, Food and Drug Administration) no ha incluido los polimorfismos de CYP2C9 en la lista de biomarcadores farmacogenéticos para PHT, se ha considerado importante la disminución de la dosis para los portadores de uno o 2 alelos reducidos, así como vigilar la presencia de RAM y de los niveles plasmáticos del fármaco54. El CYP2C19 también participa en el metabolismo de PHT, aunque en menor proporción. Los alelos de CYP2C19 *2A, *2B, *2, *3, *4, *5A, *5B, *6, *7 y *8 presentan una actividad enzimática deficiente, lo que podría aumentar la probabilidad de efectos tóxicos debidos a PHT, aunque estos han sido menos estudiados55,56.
El metabolismo de PHT mediado por CYP2C9 y CYP2C19 produce un intermediario activo tipo epóxido, el cual es inactivado por la enzima microsomal epóxido hidrolasa (EPHX1)57. Un estudio indicó que los efectos teratogénicos de PHT son debidos a la formación de este epóxido58. Al estudiar las variantes genéticas de EPHX1 en madres de niños con anormalidades cráneo-faciales congénitas, tratadas con PHT, se encontró que los polimorfismos EPHX1 113H y 139R son más frecuentes en las madres de los niños afectados, y que el haplotipo EPHX1 Y113/H139 en la madre confería un efecto protector para que los bebés gestados bajo tratamiento de PHT no desarrollaran este tipo de malformaciones congénitas59.
Enzimas de fase iiLa superfamilia de enzimas de fase ii glutatión S-transferasa (GST) también participa en el metabolismo de los FAE. Su intervención es importante en la biotransformación de carbamazepina (CBZ) a los metabolitos responsables de RAM, como son el epóxido 10,11-carbamazepina y los óxidos de areno e iminoquinonas60. Un estudio en japoneses encontró una asociación entre alelos nulos de GSTM1 con la elevación de alanina aminotransferasa y aspartato aminotransferasa en pacientes tratados con CBZ. Este hallazgo se relaciona con la hepatotoxicidad inducida por CBZ, una RAM idiosincrática e impredecible que puede causar un daño irreversible61. De igual manera, un estudio retrospectivo en pacientes japoneses tratados con ácido valproico (VPA) encontró mayores niveles de γ-glutamiltransferasa en los portadores de alelos nulos de GSTM162. Ambas asociaciones deben ser confirmadas en esta y otras poblaciones para ratificar la implicación clínica del alelo nulo de GSTM1 en el daño hepático causado por CBZ y/o VPA.
Las enzimas UGT participan de manera importante en la eliminación de compuestos lipofílicos potencialmente tóxicos para el organismo a través de la formación de glucurónidos a partir del ácido glucurónico uridín difosfato63. En el caso de los FAE, las UGT tienen una función importante en el metabolismo de CBZ, lamotrigina (LTG), oxcarbazepina y topiramato, entre otros64. Se ha reportado que algunos polimorfismos en los genes que codifican para las UGT influyen en la variabilidad interindividual de parámetros farmacocinéticos de FAE. Por ejemplo, diferencias en niveles plasmáticos de LTG se han asociado con la variante de UGT1A4 L48V65 y de VPA con el alelo UGT1A3*566. De manera más reciente, un estudio sugirió la asociación del polimorfismo UGT1A6 552A>C con la presencia de concentraciones plasmáticas elevadas de VPA, así como con RAM inducidas por este FAE, como ataxia, daño hepático, alteraciones metabólicas, temblores, alucinaciones, pancreatitis y aumento excesivo de peso67.
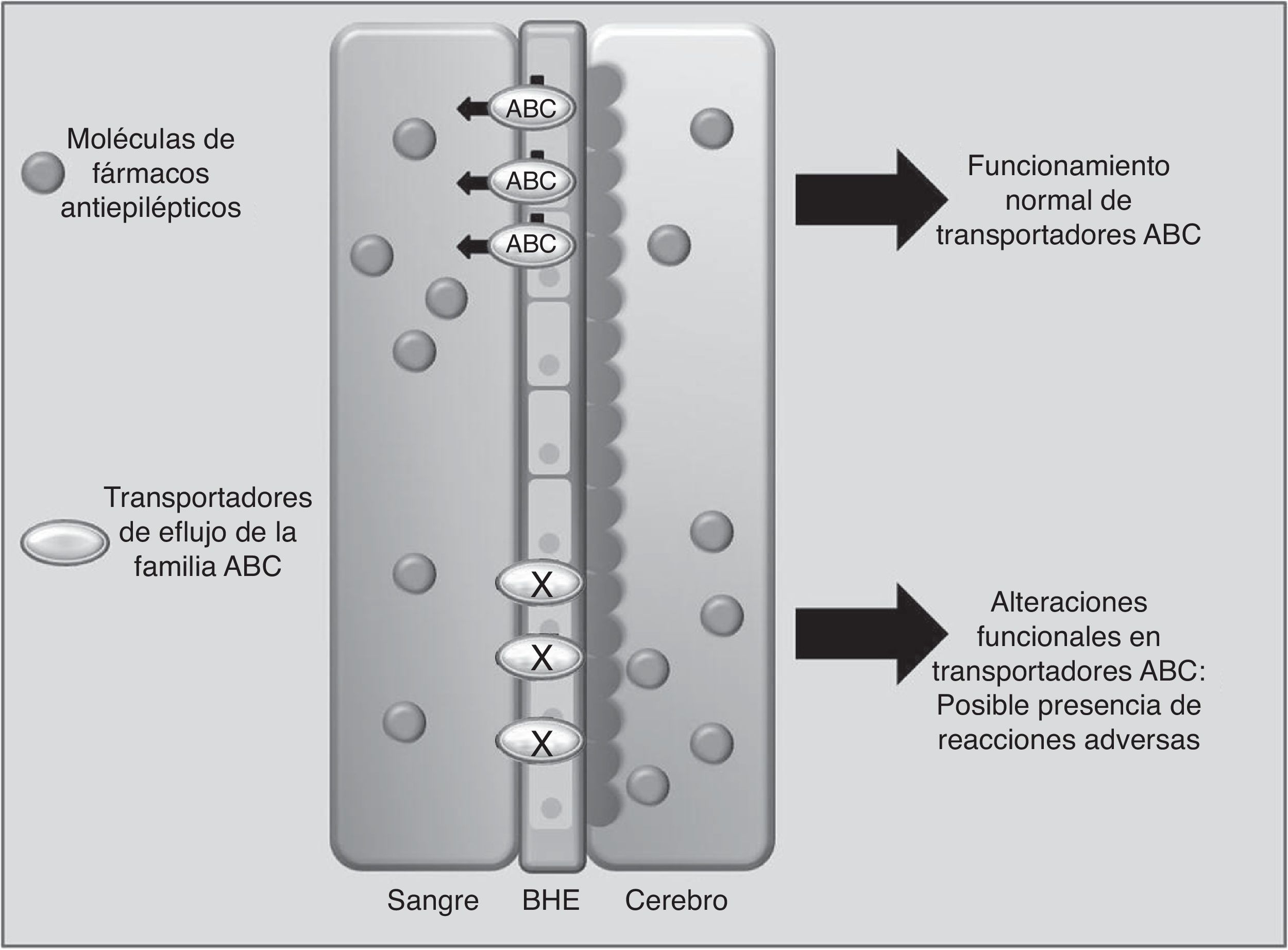
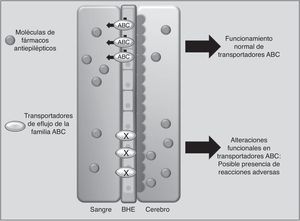
Transportadores de fármacosABCC2 es un transportador de eflujo, miembro de la superfamilia de proteínas transmembranales ABC (por ATP-binding cassette), que mediante la energía liberada por hidrólisis de ATP mueve solutos y fármacos fuera de la célula68. Los FAE como PHT, CBZ y VPA son sustratos de este transportador. Se ha observado que cuando ABCC2 se encuentra sobreexpresado a nivel de la barrera hematoencefálica, se puede presentar epilepsia refractaria del lóbulo temporal en algunos pacientes. En contraste, algunos polimorfismos en el gen ABCC2 pueden resultar en una disminución en la función de eflujo del transportador, lo que lleva a un mayor paso del fármaco hacia el cerebro, desencadenando RAM principalmente de tipo neurológico (fig. 1)69-71. En pacientes de origen coreano en tratamiento con VPA, se encontró que el polimorfismo g.-1774delG de ABCC2 estaba asociado a la presencia de RAM, de tal manera que los pacientes portadores del alelo G tenían mayor posibilidad de presentar mareos, dolores de cabeza, somnolencia, diplopía, disartria y temblor, que aquellos que portaban la deleción (p=0057). Asimismo, encontraron que la frecuencia del alelo T en la posición g.-24C>T (rs717620) era mayor en el grupo de pacientes con RAM neurológicas en comparación con el grupo de pacientes que no la presentaron (p=0,0274)71. Sin embargo, otros estudios en poblaciones del mismo origen y de origen japonés no encontraron asociación entre polimorfismos de ABCC2 y la presencia de RAM por VPA72,73.
Otro estudio en pacientes de Corea en tratamiento con CBZ demostró asociación entre el polimorfismo de ABCC2 c.1249G>A y la presencia de RAM de tipo neurológicas. Los pacientes portadores de los genotipos GA o AA en esta posición reportaron mayor frecuencia de RAM de tipo neurológicas (p=0,005)74. Un reporte previo describió que el polimorfismo de ABCC2g.-1774delG y el haplotipo conformado por los polimorfismos en las posiciones g.-1549G>A,g.-24C>T, c.334-49C>T y c.3972C>T son un factor de predisposición para desarrollar complicaciones hepáticas a diversos fármacos75; sin embargo, en FAE no han sido estudiados.
La glucoproteína P (P-gp) codificada por el gen ABCB1 es otro transportador de la superfamilia ABC ampliamente estudiado en la resistencia a FAE y en la variabilidad farmacocinética de aquellos FAE que son sustratos de P-gp, como PHT, fenobarbital y LTG76. Aun cuando se han asociado 3 polimorfismos de ABCB1 (3435C>T, 2677G>T/A y 1236C>T) con la variabilidad en los niveles plasmáticos de PHT77,78, la relación de estos polimorfismos con los efectos neurotóxicos aún no es clara50,79.
Reacciones adversas cutáneas a antiepilépticos y su asociación a los alelos del sistema Antígeno leucocitario humano (HLA)Las reacciones tipo B son de naturaleza idiosincrática, y aun cuando se presentan en una menor proporción, son de mayor patogénesis, presentan una mayor morbimortalidad, y requieren de la suspensión inmediata del medicamento o incluso un tratamiento adicional para controlar la RAM41. Dentro de ellas, se encuentran las RAM de tipo cutáneas (RAMc), las cuales se han reportado para FAE y otros grupos de fármacos, siendo su incidencia de 10 casos por cada 1.000 nuevos usuarios80.
Existen diversos subtipos de RAMc de diferente grado de severidad. El exantema maculopapular (MPE por su sigla, maculopapular exanthema) es la forma más leve, normalmente solo hay afectación dermatológica sin síntomas sistémicos y se resuelve con la suspensión del medicamento causante de la reacción81. El síndrome de hipersensibilidad inducido por fármacos (DIHS por su sigla, drug induced hypersensitivity syndrome) y la reacción a fármacos con eosinofilia y síntomas sistémicos (DRESS por su sigla, drug reaction with eosinophilia and systemic symptoms) inician entre 3 semanas y 3 meses después de iniciado el tratamiento, se caracterizan por erupción cutánea, usualmente prurítica, linfoadenopatía, fiebre entre 38 y 40°C y reactivación del virus de herpes tipo 6, llegando a mantenerse por semanas después de retirado el medicamento82,83.
Las formas más severas de RAMc son el síndrome de Stevens Johnson (SJS por su sigla, Stevens-Johnson syndrome) y la necrólisis epidérmica tóxica (TEN por su sigla, toxic epidermal necrolysis), cuya mortalidad es de hasta el 5% en SJS y 30% en TEN, con una incidencia calculada de 2 casos por un millón de habitantes84,85. Ambas son variantes de la misma afección pero difieren en el porcentaje de desprendimiento de piel, el cual es menor del 10% para el SJS y más del 30% para TEN86,87. Una de las más importantes secuelas es a nivel ocular, donde hasta el 75% de los pacientes con TEN pueden presentar complicaciones oftálmicas tan severas como ceguera88,89.
Aunque el mecanismo de las RAMc no está del todo definido, se han propuesto 2 teorías: la de hapteno/prohapteno y la de interacciones farmacológicas entre los fármacos y los receptores inmunológicos (p-i). En el primer caso, se plantea que, dado que la molécula de un fármaco es muy pequeña como para inducir una respuesta inmunológica, esta actúa como hapteno o prohapteno y, mediante un enlace covalente, se une a proteínas endógenas, formando un complejo hapteno-acarreador y se convierte en inmunogénico90. Este complejo es procesado por las células presentadoras de antígeno en el complejo principal de histocompatibilidad (MHC por su sigla, major histocompatibility complex) localizadas en los nódulos linfáticos y otros tejidos, con lo que se estimula la producción de células T y las consecuentes manifestaciones clínicas91. En contraste, la teoría p-i (interacciones farmacológicas de los fármacos con receptores inmunológicos) propone que algunos fármacos pueden unirse directa y reversiblemente (unión no covalente) a receptores inmunológicos, como el MHC o el receptor de células T para estimular células T específicas para el fármaco inductor92.
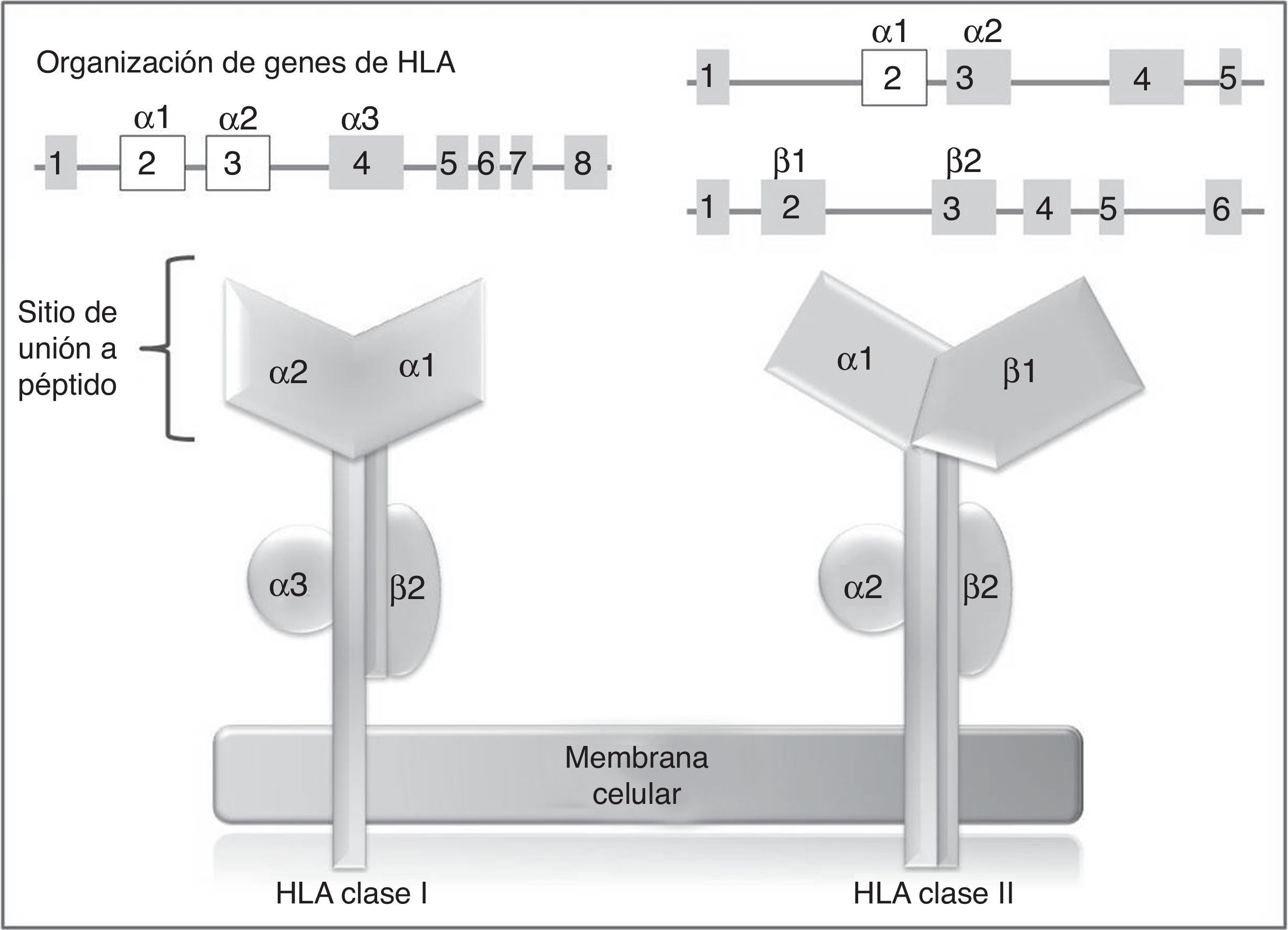
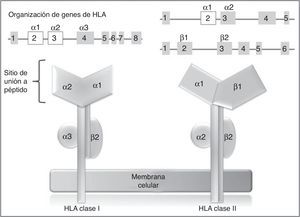
En los humanos, la región genética del MHC se conoce como sistema de antígenos leucocitarios humanos (HLA por su sigla, human leucocyte antigen) y está constituido por un grupo de genes altamente polimórficos ubicados en 6p2193. A su vez, el sistema HLA está dividido de manera arbitraria en 3 regiones designadas como clase i, ii (sistema clásico) y iii. En los genes del sistema clásico, los exones más polimórficos son aquellos que codifican para el sitio de unión a péptido de las moléculas de HLA clase i y ii94 (fig. 2), de ahí que en los últimos años, los estudios farmacogenéticos se han centrado en la identificación de alelos de HLA clase i, y en menor proporción de clase ii, con el desarrollo de RAMc (tabla 4).
Genes y moléculas de HLA clase i y clase ii arriba: organización de los genes del sistema HLA, en recuadros se muestran los exones y en líneas los intrones; por encima de los recuadros, se muestran los dominios de las moléculas de HLA (abajo) para los cuales codifican esos exones; en blanco se destacan los exones que contienen la mayor parte de los polimorfismos contenidos en estos genes.
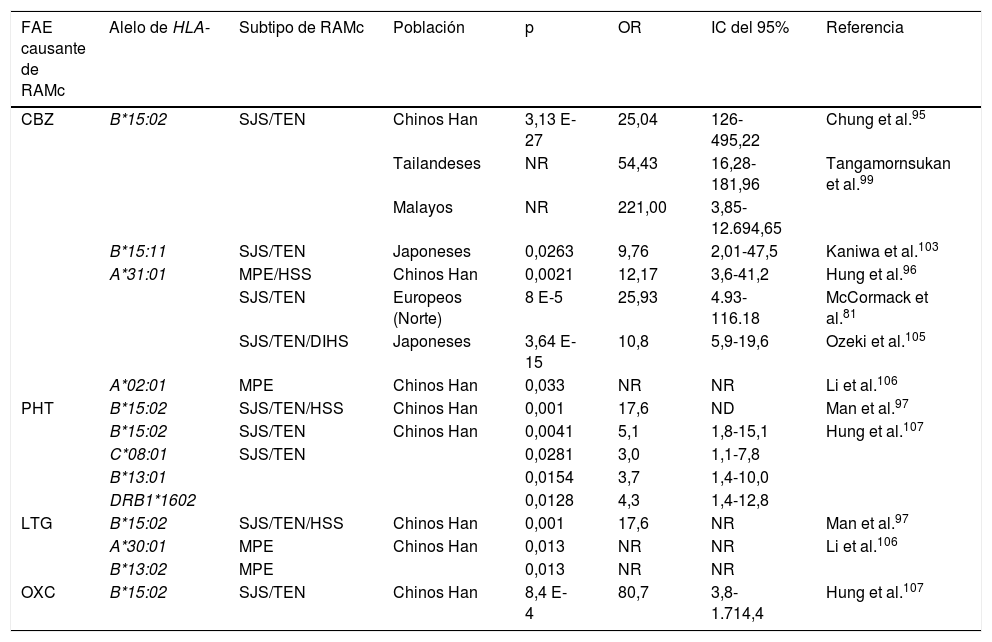
Alelos de HLA asociados a reacciones adversas cutáneas por antiepilépticosa
| FAE causante de RAMc | Alelo de HLA- | Subtipo de RAMc | Población | p | OR | IC del 95% | Referencia |
|---|---|---|---|---|---|---|---|
| CBZ | B*15:02 | SJS/TEN | Chinos Han | 3,13 E-27 | 25,04 | 126-495,22 | Chung et al.95 |
| Tailandeses | NR | 54,43 | 16,28-181,96 | Tangamornsukan et al.99 | |||
| Malayos | NR | 221,00 | 3,85-12.694,65 | ||||
| B*15:11 | SJS/TEN | Japoneses | 0,0263 | 9,76 | 2,01-47,5 | Kaniwa et al.103 | |
| A*31:01 | MPE/HSS | Chinos Han | 0,0021 | 12,17 | 3,6-41,2 | Hung et al.96 | |
| SJS/TEN | Europeos (Norte) | 8 E-5 | 25,93 | 4.93-116.18 | McCormack et al.81 | ||
| SJS/TEN/DIHS | Japoneses | 3,64 E-15 | 10,8 | 5,9-19,6 | Ozeki et al.105 | ||
| A*02:01 | MPE | Chinos Han | 0,033 | NR | NR | Li et al.106 | |
| PHT | B*15:02 | SJS/TEN/HSS | Chinos Han | 0,001 | 17,6 | ND | Man et al.97 |
| B*15:02 | SJS/TEN | Chinos Han | 0,0041 | 5,1 | 1,8-15,1 | Hung et al.107 | |
| C*08:01 | SJS/TEN | 0,0281 | 3,0 | 1,1-7,8 | |||
| B*13:01 | 0,0154 | 3,7 | 1,4-10,0 | ||||
| DRB1*1602 | 0,0128 | 4,3 | 1,4-12,8 | ||||
| LTG | B*15:02 | SJS/TEN/HSS | Chinos Han | 0,001 | 17,6 | NR | Man et al.97 |
| A*30:01 | MPE | Chinos Han | 0,013 | NR | NR | Li et al.106 | |
| B*13:02 | MPE | 0,013 | NR | NR | |||
| OXC | B*15:02 | SJS/TEN | Chinos Han | 8,4 E-4 | 80,7 | 3,8-1.714,4 | Hung et al.107 |
CBZ: carbamazepina; DIHS: síndrome de hipersensibilidad inducido por fármacos; FAE: fármaco antiepiléptico; HLA: antígeno leucocitario humano; HSS: síndrome de hipersensibilidad; IC: intervalo de confianza; LTG: lamotrigina; MPE: exantema maculopapular; NR: no reportado; OR: odds ratio; OXC: oxcarbazepina; PHT: fenitoína; RAMc: reacción adversa cutánea a medicamentos; SJS: síndrome de Stevens-Johnson; TEN: necrólisis epidérmica tóxica.
En 2004, Chung et al. demostraron una fuerte asociación entre el alelo HLA-B*15:02 y el SJS inducido por CBZ en pacientes chinos de la provincia Han95. El 100% (n = 44) de los pacientes con SJS fueron positivos para este alelo, mientras que solo el 3% (n=101) de los pacientes tolerantes y el 8,6% de individuos sanos portaban el alelo HLA-B*15:02 (n=93) (OR: 2,504, IC del 95%, 1,26-49,522, p < 0,001). Esta asociación fue confirmada por otros estudios en individuos de la provincia Han, así como en el centro y sureste de China96-98, malayos y tailandeses99. La relevancia de este hallazgo ocasionó que la FDA incluyera esta información en el marbete de CBZ, recomendando la realización de pruebas genéticas dirigidas a alelos de HLA antes de iniciar el tratamiento en pacientes con ascendencia asiática100. En contraste, otros estudios demostraron que este alelo no era universal y que dependía de la población estudiada. Así, en población caucásica y japonesa no encontraron una asociación entre el alelo HLA-B*15:02 y pacientes con SJS101,102; sin embargo, se reportó una mayor frecuencia alélica de HLA-B*15:11 en pacientes japoneses con SJS que en la población en general103.
También se reportó la asociación entre el alelo HLA-A*31:01 y MPE o síndrome de hipersensibilidad (HSS) inducidos por CBZ, en chinos de la provincia Han, encontrándose en el 25,8% de los pacientes con RAMc pero solo en el 2,8% de pacientes tolerantes a CBZ96. Este mismo alelo se encontró asociado a RAMc por CBZ en pacientes del norte de Europa81, pero no a RAMc inducida por PHT o LTG104.
De manera similar, se han reportado 3 haplotipos de HLA asociados a RAMc por FAE: el haplotipo ancestral 8.1 HLA-A*01:01/-Cw*07:01/B*08:01/-DRB1*03:01/-DQA1*05:01/-DQB1*02:01 asociado a HSS por CBZ en caucásicos108; HLA-A*24:01/-B*59:01/-C*01:02 y HLA-A*02:01/-B*15:18/-C*07:04 con valores altos de riesgo relativo para RAMc severas por CBZ en japoneses: 16,09 y 28,94, respectivamente109.
También se ha informado la asociación de variantes genéticas cerca del locus de HLA-E (rs1264511), en el gen de motilina (rs2894342) y en el gen CYP2B6 (rs1042389) con la aparición de RAMc por CBZ en población china de la provincia Han; sin embargo, los resultados no fueron contundentes96.
ConclusiónLa información revisada muestra que la variabilidad interétnica influye en gran medida en la asociación de polimorfismos genéticos con la presencia de RAM a FAE. A la fecha, el estudio del alelo HLA-B*15:02 y su relación con RAMc inducidas por CBZ en pacientes asiáticos o con ascendencia asiática ha sido de marcada importancia en la farmacogenética de RAM inducidas por antiepilépticos. Por esta razón, agencias regulatorias como la FDA han integrado este alelo como un biomarcador farmacogenético para esas poblaciones. Sin embargo, aún existe controversia en la replicación de los resultados en otras poblaciones, incluyendo la asiática.
Otro hallazgo importante en la farmacogenética de FAE son los alelos CYP2C9*2 y *3, los cuales están relacionados con el desarrollo de RAM tipo neurológico por disminución de la actividad enzimática de CYP2C9. Asimismo, las variantes de ABCC2 están tomando importancia en la presencia de RAM al participar en el paso del FAE a través de la barrera hematoencefálica; no obstante, no se ha encontrado una asociación contundente. Por otro lado, sería de interés evaluar la participación de genes que codifiquen para receptores de FAE, como SCN1A, SCN2A y GABRA1 en la presencia de RAM.
La identificación de biomarcadores farmacogenéticos que permitan predecir efectos no deseados de FAE podría contribuir a aumentar la seguridad en la prescripción de los mismos.
FinanciaciónEste artículo de revisión se escribió como parte del proyecto financiado por el Consejo Nacional de Ciencia y Tecnología (CONACYT #167261) y la beca otorgada (CONACYT #369708) a Ingrid Fricke-Galindo para la obtención del grado de doctora. Este trabajo fue coordinado en la Red Iberoamericana de Farmacogenética y Farmacogenómica (SIFF-RIBEF www.ribef.com).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.