Muchas enfermedades que cursan con trastornos del movimiento hipercinético comienzan o afectan a mujeres en edad fértil. Es importante conocer los riesgos que tienen las mujeres con estas enfermedades durante el embarazo, así como los posibles efectos de los tratamientos sobre el feto.
ObjetivosDefinir las características clínicas y los factores que condicionan la vida de la mujer en edad fértil con distonía, corea, síndrome de Tourette, temblor y síndrome de piernas inquietas. Definir una guía de actuación y manejo del embarazo y lactancia en las pacientes con esta enfermedad.
DesarrolloEste documento de consenso se ha realizado mediante una búsqueda bibliográfica exhaustiva y discusión de los contenidos llevadas a cabo por un Grupo de Expertos en Trastornos del Movimiento de la Sociedad Española de Neurología (SEN).
ConclusionesEn todas las mujeres que padecen o comienzan con trastornos del movimiento hipercinéticos se debe valorar el riesgo-beneficio de los tratamientos, reducir al máximo la dosis eficaz o administrarlo de forma puntual en los casos en que sea posible. En aquellas enfermedades de causa hereditaria es importante un consejo genético para las familias. Es importante reconocer los trastornos del movimiento desencadenados durante el embarazo como determinadas coreas y síndrome de piernas inquietas.
Many diseases associated with hyperkinetic movement disorders manifest in women of childbearing age. It is important to understand the risks of these diseases during pregnancy, and the potential risks of treatment for the fetus.
ObjectivesThis study aims to define the clinical characteristics and the factors affecting the lives of women of childbearing age with dystonia, chorea, Tourette syndrome, tremor, and restless legs syndrome, and to establish guidelines for management of pregnancy and breastfeeding in these patients.
ResultsThis consensus document was developed through an exhaustive literature search and a discussion of the content by a group of movement disorder experts from the Spanish Society of Neurology.
ConclusionsWe must evaluate the risks and benefits of treatment in all women with hyperkinetic movement disorders, whether pre-existing or with onset during pregnancy, and aim to reduce effective doses as much as possible or to administer drugs only when necessary. In hereditary diseases, families should be offered genetic counselling. It is important to recognise movement disorders triggered during pregnancy, such as certain types of chorea and restless legs syndrome.
Los trastornos del movimiento hipercinéticos son un grupo heterogéneo de síndromes y enfermedades que pueden ocurrir desde edades tempranas hasta la senectud. Por lo tanto, tal como ocurre en la enfermedad de Parkinson su aparición en época fértil de la mujer es un hecho en muchas de ellas, y debemos conocer y saber afrontar estas enfermedades en esta etapa de la vida.
Un grupo de expertos del Grupo de Estudio de Trastornos del Movimiento de la Sociedad Española de Neurología (SEN) ha elaborado un documento de consenso con el objetivo de facilitar el manejo diagnóstico-terapéutico de los trastornos del movimiento en la mujer durante la edad fértil, y en especial durante el embarazo y la lactancia, dado el riesgo que conlleva esta situación y la responsabilidad que genera. En esta segunda parte abordamos el manejo de los trastornos del movimiento hipercinéticos, como distonía, corea, síndrome de Tourette, temblor y síndrome de piernas inquietas, por ser los más prevalentes y los que más repercusión tienen en las pacientes.
Dicho documento se ha llevado a cabo a través de una revisión exhaustiva de la literatura mediante la búsqueda bibliográfica en la que se emplearon las siguientes bases de datos: Brain, PubMed, Web of Science, PEDro, Scopus, CINHAL y ScienceDirect, así como el conocimiento derivado de la práctica clínica. A partir de esta revisión se ha redactado unas recomendaciones consensuadas por todos, que pretenden orientar el manejo de los trastornos del movimiento durante el embarazo y la lactancia.
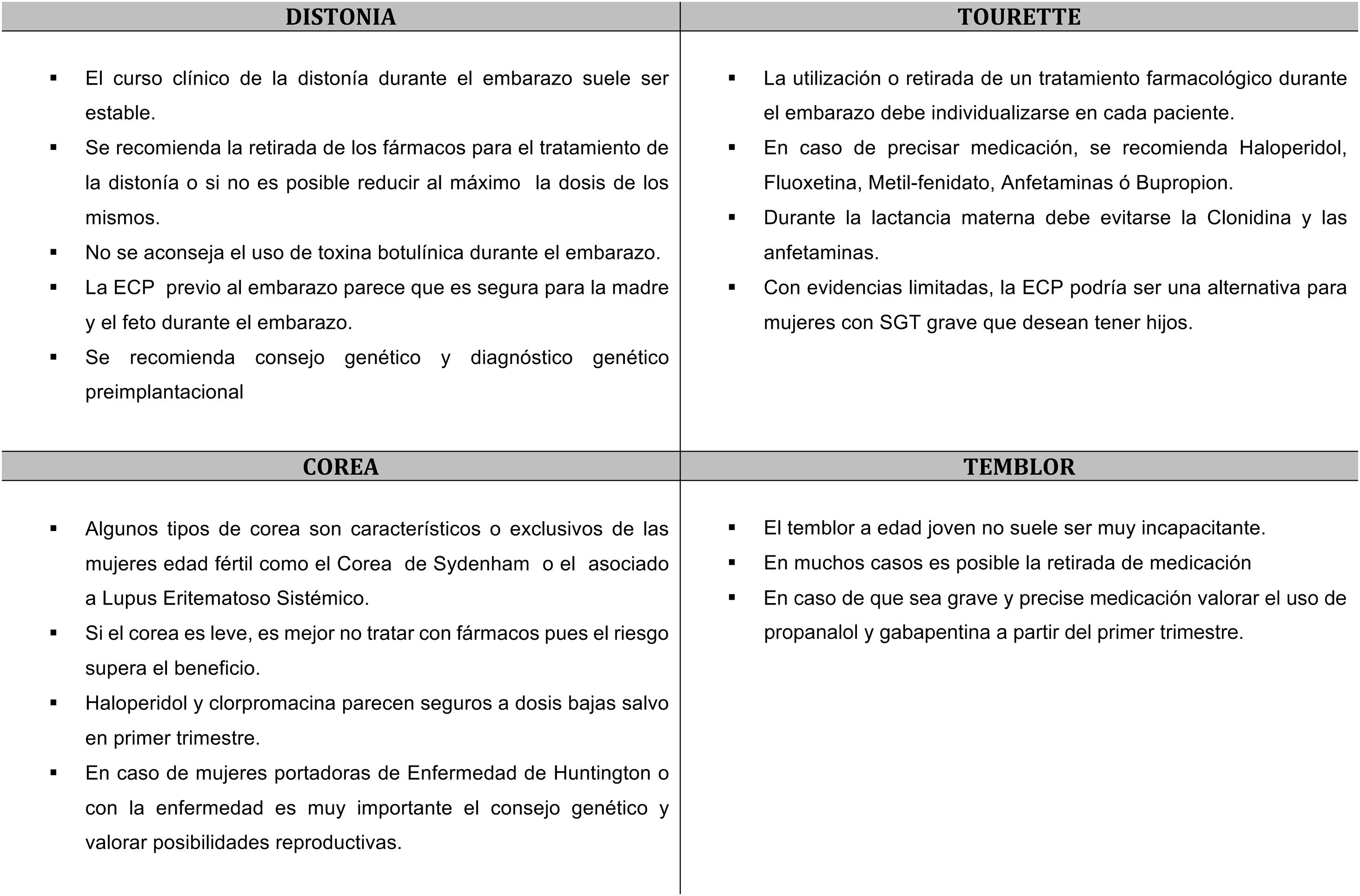
Distonía y mujer en edad fértilLa distonía es un trastorno del movimiento que en la mayoría de los casos comienzan en la edad adulta joven y algunas en la infancia, por lo que es probable que podamos encontrarnos con pacientes con distonía embarazadas o con deseo de tener descendencia. El embarazo en las pacientes con distonía requiere un abordaje multidisciplinar.
Se han descrito casos de distonía de inicio durante el embarazo con resolución antes del parto o tras el mismo. Esta entidad, por su analogía con la corea gravídica, se ha denominado distonía gravídica1,2. Por otro lado, las reacciones distónicas agudas a fármacos como la metoclopramida también pueden ocurrir en mujeres embarazadas3.
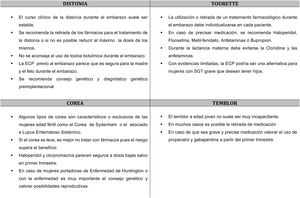
El curso clínico durante el embarazo de una distonía existente previamente durante el embarazo suele ser estable, aunque es posible encontrar mejorías o empeoramientos4,5.
Los tratamientos disponibles para la distonía son sintomáticos y crónicos, por lo que no siempre se puede realizar una retirada completa de la medicación. Por regla general, en mujeres embarazadas siempre hay que realizar un minucioso balance de riesgo/beneficio de los fármacos, y utilizar la dosis mínima posible que controle la distonía de forma aceptable. Por tanto, intentaremos una reducción gradual de la dosis de los fármacos antes del embarazo en caso de embarazos programados o durante el mismo, en los no planificados (fig. 1).
Tratamientos utilizados durante el embarazo en pacientes con distoníaFármacos oralesLos fármacos orales habitualmente utilizados para la distonía son:
Trihexifenidilo: fármaco anticolinérgico. No hay estudios del riesgo teratogénico o toxicidad embrionaria en animales, y no hay datos concluyentes en humanos. Su uso se ha relacionado con convulsiones eclámpticas6.
Baclofeno: agonista GABAérgico. Estudios en roedores han mostrado un aumento de la incidencia de espina bífida7 y un neonato sufrió convulsiones tras una exposición a baclofeno intrautero8. Se aconseja una reducción gradual, debido al riesgo de síndrome de retirada (convulsiones). En el supuesto de que esto ocurra, es aconsejable su reintroducción7. Existen varios casos reportados de uso de baclofeno intratecal para espasticidad y distonía mostrando una buena seguridad para la madre y el feto. En la mayoría de los casos, en el parto se optó por una cesárea programada, aunque también hay algunos casos descritos de parto vaginal sin incidencias9.
Benzodiacepinas: no parecen asociarse a riesgo de malformaciones fetales, sin embargo, en el neonato pueden causar un síndrome de retirada, riesgo de convulsiones, depresión respiratoria e hipotonía10. En caso de decidir mantener el fármaco, se aconseja utilizar dosis bajas e informar detalladamente a la madre sobre los posibles riesgos.
Levodopa: es el tratamiento de elección en la distonía con respuesta a levodopa.
Toxina botulínicaLas infiltraciones de toxina botulínica suelen ser el tratamiento de elección en las distonías focales.
No hay una recomendación clara respecto al uso de la toxina botulínica en el embarazo. Los estudios en humanos son escasos y los estudios en animales han mostrado efectos adversos sobre el feto. La toxina botulínica es una molécula grande, por lo que probablemente no atraviese la barrera placentaria de forma pasiva. No obstante, no se puede excluir un transporte activo de la molécula11. Con los años se han ido reportando casos de embarazo durante el tratamiento con toxina botulínica, sin afectación del feto12 y, aunque por regla general no se recomienda el tratamiento durante el embarazo13, la creciente evidencia apoya su uso en casos seleccionados.
Por tanto, lo aconsejable sería suspender esta terapia siempre que sea posible. Cuando su suspensión pueda suponer un riesgo inaceptable para la madre, se puede plantear continuar el tratamiento siempre intentando utilizar las dosis mínimas eficaces y con los controles fetales adecuados.
Estimulación cerebral profundaLa estimulación cerebral profunda (ECP) del globo pálido interno (GPI) es un tratamiento eficaz en la distonía generalizada y en algunas formas de distonías focales14. La ECP permite una reducción o incluso suspensión de la medicación convencional, lo que sin duda tiene un beneficio ante futuros embarazos.
En una serie de 11 pacientes que quedaron embarazadas y que se habían intervenido previamente con ECP por trastornos del movimiento (5 con distonía), no se produjeron complicaciones durante el embarazo, parto o/ni tampoco problemas pediátricos. En una paciente la localización del neuroestimulador a nivel subclavicular limitó la lactancia por dolor local y en otra paciente con el neuroestimulador a nivel abdominal, se produjo malestar por estiramiento del cable extensor conforme progresaba el embarazo. Posibles empeoramientos de la distonía durante el embarazo pueden hacer necesarios ajustes en los parámetros de estimulación. El parto fue vía vaginal en 3 pacientes y cesárea en el resto. En la mayoría de los partos por cesárea, esta se realizó por precaución, ante el desconocimiento de los riesgos asociados a los partos con sistemas implantados15.
En otra serie de 6 pacientes16 tratadas con ECP del globo pálido, los embarazos y los partos se desarrollaron sin complicaciones, excepto un niño que nació prematuro (35 semanas). En 4 pacientes el parto fue vaginal y en el resto se hizo por cesárea programada.
En caso de cesárea, es necesario apagar la neuroestimulación si se va a utilizar una electrocoagulación monopolar y recordar que la diatermia está contraindicada. Una adecuada profilaxis antibiótica también es aconsejable para evitar bacteriemias y riesgo de infección del sistema de ECP.
Seguimiento del embarazo y partoLa situación ideal sería que el embarazo fuera planeado y que pudiéramos discutir, de antemano, con nuestras pacientes las implicaciones del mismo: evolución de la distonía, manejo farmacológico, parto y lactancia.
En las pacientes con tratamientos con riesgo de teratogenia es aconsejable la valoración por una unidad de diagnóstico prenatal. En esta unidad se valora el riesgo teratógeno del tratamiento y se realizan los seguimientos oportunos como embarazos de alto riesgo.
LactanciaLos datos sobre la excreción en la leche materna de los fármacos usados para el tratamiento de la distonía es escasa o desconocida. Los fármacos anticolinérgicos tienen riesgo de producir efectos antimuscarínicos en el lactante, y las benzodiacepinas y el baclofeno riesgo de sedación. No hay estudios sobre el uso de la toxina botulínica en la lactancia. Dado que los datos son insuficientes, no se recomienda su uso, aunque parece poco probable que la toxina botulínica se excrete en la leche materna13. La ECP parece segura en cuanto a la lactancia. No obstante, si el neuroestimulador se localiza a nivel subclavicular puede causar cierto malestar.
Consejo genéticoEn los casos de distonía con diagnóstico genético es necesario el consejo genético y ofrecer la posibilidad de diagnóstico preimplantación o prenatal.
Es posible en casos seleccionados realizar un diagnóstico de preimplantanción con selección de embriones no afectos o de diagnóstico prenatal, bien por amniocentesis o por un método más novedoso y no invasivo que detecta el ADN fetal en la sangre materna.
CoreaEl corea puede aparecer en mujeres de edad fértil, dado que muchas causas de corea secundario son hereditarias. Pero algunas causas heredodegenerativas de corea tienen peculiaridades en las mujeres de edad fértil afectas. En la enfermedad de Huntington se ha objetivado mayor velocidad de progresión, mayor gravedad en escalas motoras y funcionales, y mayor frecuencia de depresión17.
En la ataxia telangiectasia existe un aumento de riesgo de cáncer de mama (OR: 2,9), con un riesgo vital de hasta el 25% por lo que se recomienda mamografía anual al menos desde los 40 años18. La enfermedad de Wilson conlleva un riesgo aumentado de hepatotoxicidad en el feto, así como la muerte fetal y el empeoramiento de la función hepática y la anemia hemolítica para la madre (fig. 1).
Algunos tipos de corea son característicos o exclusivos de las mujeres en edad fértil como el corea de Sydenham o el asociado al lupus eritematoso sistémico19. El corea que comienza durante el embarazo suele ser de causa inmune, secundario (vascular, tirotoxicosis, hiperglucemia no cetósica en diabetes mellitus o farmacológico) o por enfermedades heredodegenerativas (Wilson, Huntington)3.
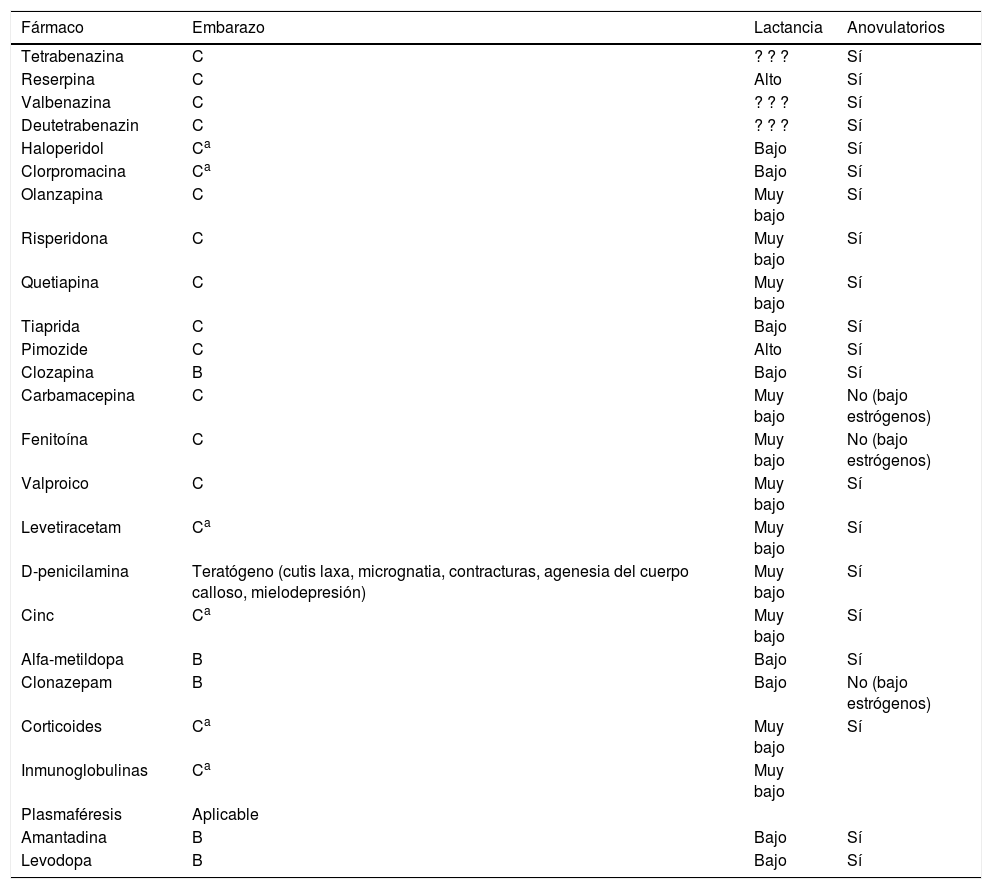
Si el corea es leve, el riesgo de los fármacos anticoreicos no supera el beneficio, pero en los casos graves (hipertermia, rabdomiolisis, mioglobinuria) pueden cursar con morbimortalidad materna y fetal, y deben tratarse. Haloperidol y clorpromacina parecen seguros a dosis bajas salvo en el primer trimestre, y su complicación más frecuente son los fenómenos distónicos transitorios. Se han comunicado embarazos a término (un caso de pequeño defecto ventricular) expuestos a tetrabenazina desde el segundo trimestre. Un caso de chorea gravidarum por Moya-Moya se trató con éxito con alfametildopa, que tiene mejor perfil de seguridad (B) en el embarazo20. En los casos de enfermedad de Wilson en los que el tratamiento quelante debe mantenerse el cinc es más seguro que la penicilamina3 (tabla 1).
Resumen de los tratamientos del corea en el embarazo, la lactancia y la toma de anovulatorios
| Fármaco | Embarazo | Lactancia | Anovulatorios |
|---|---|---|---|
| Tetrabenazina | C | ? ? ? | Sí |
| Reserpina | C | Alto | Sí |
| Valbenazina | C | ? ? ? | Sí |
| Deutetrabenazin | C | ? ? ? | Sí |
| Haloperidol | Ca | Bajo | Sí |
| Clorpromacina | Ca | Bajo | Sí |
| Olanzapina | C | Muy bajo | Sí |
| Risperidona | C | Muy bajo | Sí |
| Quetiapina | C | Muy bajo | Sí |
| Tiaprida | C | Bajo | Sí |
| Pimozide | C | Alto | Sí |
| Clozapina | B | Bajo | Sí |
| Carbamacepina | C | Muy bajo | No (bajo estrógenos) |
| Fenitoína | C | Muy bajo | No (bajo estrógenos) |
| Valproico | C | Muy bajo | Sí |
| Levetiracetam | Ca | Muy bajo | Sí |
| D-penicilamina | Teratógeno (cutis laxa, micrognatia, contracturas, agenesia del cuerpo calloso, mielodepresión) | Muy bajo | Sí |
| Cinc | Ca | Muy bajo | Sí |
| Alfa-metildopa | B | Bajo | Sí |
| Clonazepam | B | Bajo | No (bajo estrógenos) |
| Corticoides | Ca | Muy bajo | Sí |
| Inmunoglobulinas | Ca | Muy bajo | |
| Plasmaféresis | Aplicable | ||
| Amantadina | B | Bajo | Sí |
| Levodopa | B | Bajo | Sí |
EP: enfermedad de Parkinson; NR: no reportado; TM: trastornos del movimiento.
Los fármacos presentan un perfil más favorable de riesgo/beneficio en casos graves.
Fuente: adaptada de Seier e Hiller45.
La enfermedad de Huntington (EH; OMIM #143100) es autosómica dominante, y se debe a la expansión de la secuencia repetida del trinucleótido CAG en el exón 1 del gen de la huntingtina (HTT). Según el número de repeticiones, distinguimos: alelos en rango de normalidad (hasta 26 repeticiones CAG), alelos intermedios (27 a 35 repeticiones) y alelos patológicos, con más de 36 repeticiones. Entre 36 y 39 repeticiones hablamos de penetrancia incompleta, y a partir de 40 repeticiones es completa, implicando que el sujeto desarrollará invariablemente la enfermedad en algún momento. A partir de 27 repeticiones existe riesgo de expansión en la descendencia, incluso, y dependiente del número, hasta alcanzar el rango patológico.
La EH es la causa más frecuente de corea hereditario. Como el inicio clínico de la EH suele ser entre los 30 y los 50 años, impacta de forma crucial en la franja fértil, y supone un alto estrés tanto para los sujetos en riesgo, como para los neurólogos, por la complejidad de las decisiones a tomar, y cómo transmitirlas a los pacientes. Podemos enfrentarnos a varios escenarios: sujetos jóvenes, asintomáticos, con antecedentes familiares y deseo de descendencia, o pacientes ya sintomáticos, que expresen el deseo de tener hijos.
Al realizar el consejo genético se debe incluir la discusión pormenorizada de las diferentes opciones reproductivas: diagnóstico genético preimplantacional (DGP), diagnóstico prenatal (DP), continuar con el embarazo sin test genético, donante sano o adopción. Así mismo, deberíamos asegurarnos de que los futuros padres conocen los posibles resultados e implicaciones: mutaciones con penetrancia completa/incompleta, rango intermedio y normal.
Es muy importante realizar el test predictivo siempre en mayores de edad con valoración previa por psiquiatría y psicología, y dar el resultado de manera multidisciplinar. El protocolo de cómo llevarlo a cabo está en las recomendaciones internacionales publicadas en 201321.
El DGP está permitido en España en caso de enfermedades graves de aparición precoz y no susceptibles de curación, incluyéndose la EH. En el DP el estudio genético se realiza sobre la gestación en curso, y en caso de feto afecto, los padres se enfrentan a la decisión de tener que abortar. Si los futuros padres tienen claro que no abortarían, no está indicado realizar DP. Recientemente algunos grupos22 proponen el estudio de ambos progenitores, y no solo el que esté en riesgo de EH, basándose en estudios que han probado que la expansión CAG se observa con más frecuencia en población general de lo previamente estimado, debiendo considerar esta opción cuidadosamente de cara a futuro.
En el resto de las enfermedades hereditarias que causan corea se debe seguir el mismo protocolo.
TouretteDado que los tics en el síndrome de Tourette (ST) se establecen en su mayor parte en la infancia o en la adolescencia, no es raro encontrar mujeres con ST en edad fértil23.
Aunque con evidencias limitadas, parece que el curso del SGT es diferente en varones y mujeres en la edad adulta19,24. Las mujeres presentan mayor probabilidad de extensión de los tics a otras regiones corporales, y de empeoramiento de los tics después de la adolescencia (en contraste con la mejoría de los tics en los varones), mayor gravedad24 y más afectación funcional en dominios sociales19.
No existe una asociación consistente entre la gravedad de los tics y los niveles de hormonas sexuales. En una encuesta sobre el efecto de los cambios hormonales en los tics en 47 mujeres en edad reproductiva, un 26% de las mujeres referían empeoramiento de la frecuencia de los tics en la fase premenstrual. No obstante, no refirieron cambios en otras condiciones sujetas a cambios hormonales, como el embarazo, la ingesta de anticonceptivos orales o la menopausia25. Un estudio prospectivo en 8 mujeres con ciclos menstruales regulares, no objetivó relación entre niveles de estrógenos y la severidad del TOC o de los tics26. El ST no parece tener un efecto negativo sobre el embarazo25 (fig. 1).
Tratamiento farmacológico durante el embarazoEl tratamiento debe individualizarse, considerando riesgo-beneficio, posibles efectos teratogénicos sobre el feto, y procurando utilizar la dosis menor posible que controle la sintomatología en la madre.
En la mayor parte de las mujeres con SGT los tics no son incapacitantes, y se tolera bien la retirada de la medicación durante el embarazo3. No obstante, en los casos graves con tics violentos, puede ser necesario mantener el tratamiento para evitar riesgos físicos durante la anestesia epidural y el parto.
Neurolépticos: los neurolépticos se consideran seguros para el embarazo, si bien los datos de seguridad —en especial para los de nueva generación—, son limitados. El haloperidol se prefiere en el embarazo frente a otros neurolépticos debido a que así se minimizan los efectos anticolinérgicos, antihistamínicos e hipotensivos de otros neurolépticos. Deben evitarse los medicamentos de liberación prolongada (depot), para limitar la duración de los efectos adversos en el neonato26.
Antidepresivos: los antidepresivos son utilizados comúnmente en el TOC asociado al ST. Los inhibidores de la recaptación de serotonina y noradrenalina (ISRN) se consideran seguros en el embarazo48. Si es necesaria la terapia farmacológica, se recomienda utilizar fluoxetina26. Se consideran alternativas aceptables, aunque con menos nivel de evidencia, la fluvoxamina, la paroxetina o la sertralina. Debe monitorizarse al neonato para descartar efectos de la medicación o síndrome de retirada26.
Alfa-adrenérgicos: los datos que existen sobre el uso metilfenidato y anfetaminas durante el embarazo en pacientes con trastorno por déficit de atención e hiperactividad (TDAH) indican que no aumentan la tasa de anomalías congénitas mayores27. Hay muy pocos datos sobre el uso de atomoxetina y guanfacina. El uso de la clonidina como antihipertensivo y de bupropión como antidepresivo, no parecen incrementar la tasa de anomalías congénitas. En caso de ser imprescindible el tratamiento, se recomienda metil-fenidato, anfetaminas o bupropión27,28. Aunque la mayor parte de estos fármacos se secretan en leche materna, las concentraciones en los neonatos son bajas excepto para la clonidina y las anfetaminas, que deben evitarse en esta situación.
Estimulación cerebral profundaLa estimulación cerebral profunda (ECP) podría tener un papel en el tratamiento de mujeres con SGT incapacitante que desean tener hijos9. En un estudio retrospectivo de 11 mujeres embarazadas con diversos trastornos del movimiento tratadas con ECP, 2 pacientes con SGT pudieron retirar por completo la medicación después de la cirugía. Los parámetros fueron modificados durante el embarazo, precisando incremento del voltaje durante el embarazo, y se volvió a los parámetros originales a los 3 meses del parto. Los embarazos se produjeron a término, siendo posible la lactancia materna15.
TemblorEl temblor esencial es uno de los trastornos del movimiento más comunes, y afecta aproximadamente al 1% de la población mundial. La incidencia aumenta con la edad, y no existen diferencias en la prevalencia entre varones y mujeres. La edad de inicio puede ser tan temprana como durante la infancia, y tiene una distribución bimodal, con picos de edad en la segundo y sexta décadas de la vida29. De ahí que es frecuente que existan mujeres en edad fértil con temblor esencial.
Entre las causas de temblor secundario, es muy importante descartar durante el embarazo causas farmacológicas, metabólicas (alteraciones tiroideas, glucemia), estrés o el comienzo de una enfermedad neurodegenerativa como parkinsonismo o distonía19.
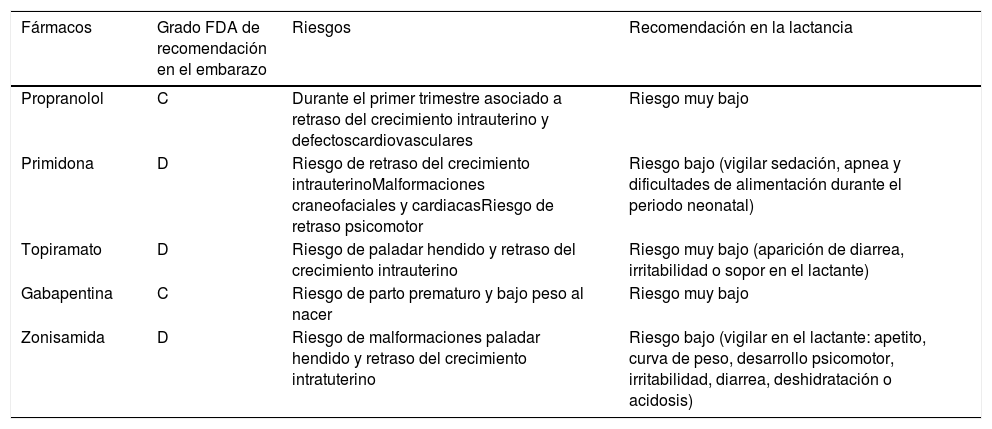
El tratamiento del temblor durante el embarazo solo está indicado cuando el temblor es incapacitante30. Se debe valorar el riesgo-beneficio del tratamiento y en la mayoría de los casos es aconsejable retirar los fármacos. En los embarazos planificados hay que quitarlo antes, excepto en pacientes muy incapacitadas, siempre teniendo en cuenta los riesgos de teratogenia. Si la paciente quedara embarazada estando en tratamiento se debe valorar el riesgo-beneficio de los fármacos y retirar siempre que sea posible. Los fármacos más frecuentemente usados en el temblor son propranolol, primidona, topiramato, gabapentina y zonisamida, consultar la tabla 2 para ver el grado de recomendación en el embarazo. En casos graves está indicado el tratamiento del temblor con ECP talámica o ultrasonidos focalizados a alta frecuencia (HIFU), los cuales, se deben realizar antes o después del embarazo (fig. 1).
Recomendaciones en el embarazo y en la lactancia de los fármacos más frecuentemente usados en el tratamiento del temblor
| Fármacos | Grado FDA de recomendación en el embarazo | Riesgos | Recomendación en la lactancia |
|---|---|---|---|
| Propranolol | C | Durante el primer trimestre asociado a retraso del crecimiento intrauterino y defectoscardiovasculares | Riesgo muy bajo |
| Primidona | D | Riesgo de retraso del crecimiento intrauterinoMalformaciones craneofaciales y cardiacasRiesgo de retraso psicomotor | Riesgo bajo (vigilar sedación, apnea y dificultades de alimentación durante el periodo neonatal) |
| Topiramato | D | Riesgo de paladar hendido y retraso del crecimiento intrauterino | Riesgo muy bajo (aparición de diarrea, irritabilidad o sopor en el lactante) |
| Gabapentina | C | Riesgo de parto prematuro y bajo peso al nacer | Riesgo muy bajo |
| Zonisamida | D | Riesgo de malformaciones paladar hendido y retraso del crecimiento intratuterino | Riesgo bajo (vigilar en el lactante: apetito, curva de peso, desarrollo psicomotor, irritabilidad, diarrea, deshidratación o acidosis) |
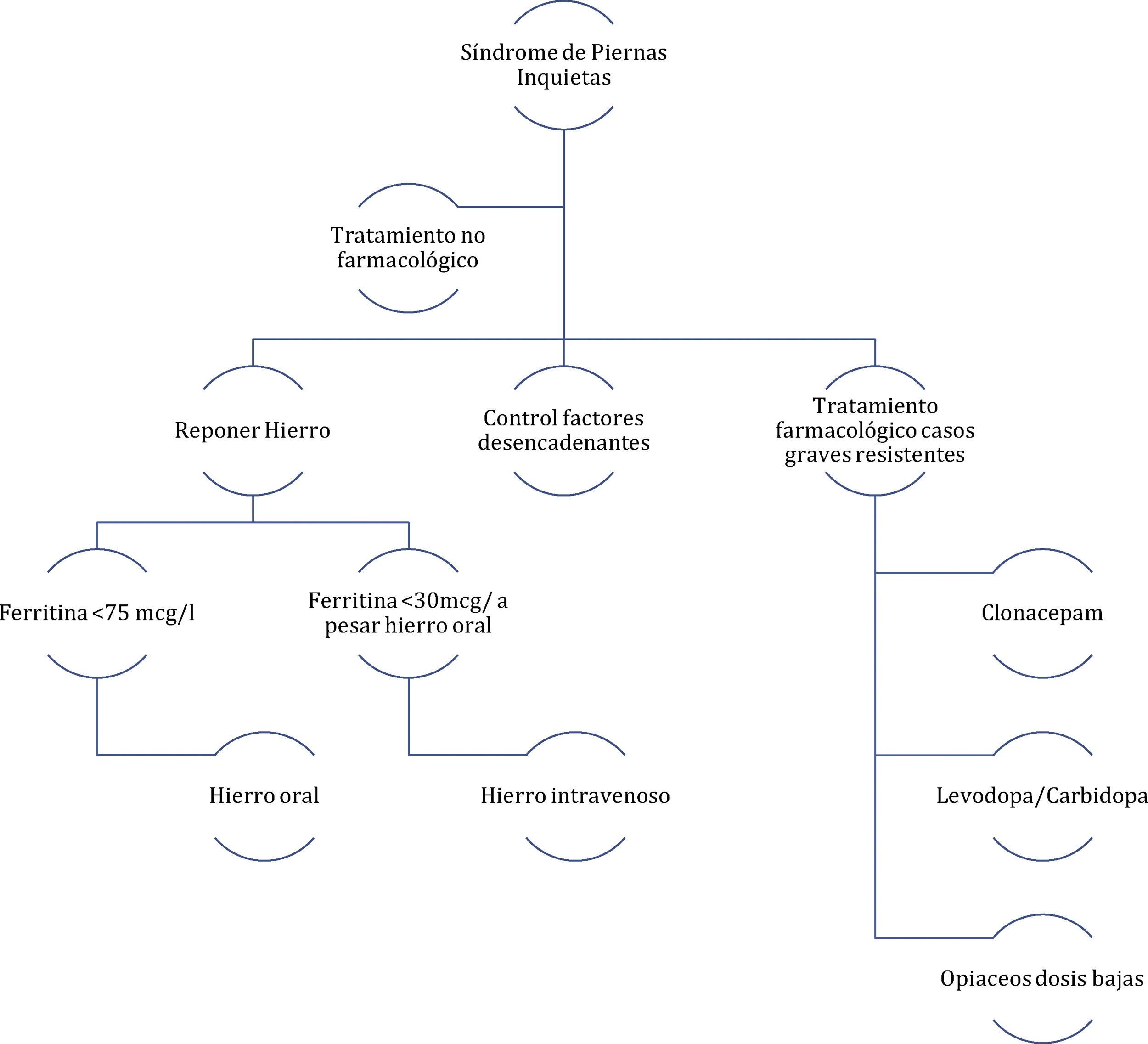
El síndrome de piernas inquietas (SPI) es una entidad muy prevalente, pues aparece entre el 2-10% de la población31. Es 2 veces más frecuente en mujeres que en varones32. El embarazo se considera un factor de riesgo, pues el SPI es más frecuente en mujeres que han tenido embarazos, comparado con varones y mujeres nulíparas33.
La prevalencia del SPI durante el embarazo según los estudios publicados está entre el 15-25%. Suele comenzar en el segundo trimestre, los síntomas más graves son en el tercer trimestre y acostumbra a desaparecer después del parto. En general, parece que el SPI que se manifiesta por primera vez durante el embarazo tiene buen pronóstico y suele desaparecer tras un mes del parto34. Pero en algunos casos, los síntomas aparecen por primera vez durante el embarazo para luego persistir después del parto como SPI idiopático. Se consideran factores de riesgo independientes para el SPI durante el embarazo: tener antecedentes familiares, haber padecido SPI en embarazos previos, tener SPI previo al embarazo y tener una hemoglobina de <1g/dl previa al embarazo35.
El SPI durante el embarazo puede producir alteraciones en el curso del mismo, debido a que los síntomas pueden asociarse con gran estrés, alteraciones del sueño y de esta manera influir negativamente en las pacientes y el desarrollo del feto. Se ha asociado a complicaciones durante el embarazo como la hipertensión, la enfermedad cardiovascular, la preeclampsia y el parto prematuro36.
La fisiopatología del comienzo del SPI durante el embarazo es compleja. Se sabe que influyen factores dietéticos (déficit de hierro, vitamina D y ácido fólico), factores hormonales (aumento de estrógenos), cambios fisiológicos (insuficiencia venosa y ganancia de peso) y predisposición genética durante el embarazo. Esto es importante tenerlo en cuenta para hacer un correcto e individualizado abordaje terapéutico37.
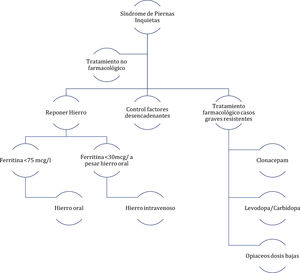
Un comité de expertos publicó en el año 201438 unas recomendaciones para el abordaje de mujeres embarazadas con SPI. De entre las principales recomendaciones destacan como reglas generales del tratamiento las siguientes: las decisiones de tratamiento deben basarse en la gravedad de los síntomas, los riesgos beneficios de los fármacos y consideraciones individuales de la paciente; se deben considerar las terapias no farmacológicas como primera elección; para el tratamiento farmacológico usar la menor dosis eficaz y, si es posible mediante administración puntual; reponer de hierro a todas las pacientes (fig. 2).
Algoritmo de manejo del síndrome de piernas inquietas en embarazadas.
Fuente: figura modificada de Picchietti et al.38.
Se recomienda realizar ejercicio físico de moderada intensidad, así como yoga. Las medidas que favorecen el retorno venoso también pueden ser eficaces tales como masajes, medias de comprensión elástica y métodos de comprensión neumática de las piernas. Igualmente es importante revisar todas las medicaciones que toma la paciente y retirar aquellas que puedan estar influyendo negativamente. En los casos con SAOS el tratamiento de este puede mejorar la clínica del SPI38.
Tratamiento farmacológicoHierro: se recomienda reponer con hierro a las embarazadas con SPI y ferritina <75μg/l. Inicialmente se debe recomendar hierro oral. Para aquellas mujeres con síntomas graves, que estén en el tercer trimestre y que a pesar de la administración de hierro oral la ferritina sea <30μg/l se debe valorar tratamiento con hierro intravenoso39.
Agonistas dopaminérgicos: por su grado de recomendación C, no se recomiendan durante el embarazo. Pueden inhibir la prolactina durante la lactancia40,45.
Benzodiacepinas: el clonacepam es el tratamiento de elección en el SPI. En embarazadas en el segundo y tercer trimestre, se pueden recomendar dosis bajas de 0,5 o 1mg por la noche. Hay que vigilar la aparición de síndrome de abstinencia en el neonato41.
Levodopa: se pueden recomendar pequeñas dosis de levodopa/carbidopa por la tarde o noche en pacientes con síntomas graves. Siempre teniendo en cuenta el riesgo-beneficio42,45.
Opiáceos: en pacientes con síntomas muy graves durante el segundo y tercer trimestre del embarazo, se pueden recomendar pequeñas dosis de tramadol. Estos pueden producer un síndrome de abstinencia de opiáceos en el neonato43.
Otros: durante la lactancia se pueden considerar dosis bajas de gabapentina (300-900mg/día)44,47.
ConclusionesEn todas las mujeres que padecen o comienzan con trastornos del movimiento hipercinéticos se debe valorar el riesgo-beneficio de los tratamientos, reducir al máximo la dosis eficaz o administrarlos de forma puntual en los casos en que sea posible. En aquellas enfermedades de causa hereditaria es importante un consejo genético para las familias. Es importante reconocer los trastornos del movimiento desencadenados durante el embarazo como determinadas distonías, coreas, temblor y síndrome de piernas inquietas.
Conflicto de interesesNo existe ningún conflicto de intereses de los autores en este artículo.