En los próximos 20 años se duplicará la cantidad de personas con deterioro cognitivo (DC) apremiando su pronta detección.
ObjetivosValidar una prueba de cribado de DC aplicable en<de 5 min.
MétodosAdultos ≥60 años reclutados desde la comunidad y las clínicas de memoria de la zona urbana de Santiago de Chile fueron clasificados clínicamente en: dementes, DC leve (DCL) y sin DC (SDC). Se evaluó la validez de un nuevo test, MEFO, consistente en la evaluación de: memoria (5 puntos), fluidez fonética (2 puntos) y orientación (6 puntos) contrastado con los resultados del MMSE.
ResultadosSe evaluó a 214 personas: 49 con demencia, 47 con DCL y 118 SDC. El MEFO diferenció a los 3 grupos clínicos entre sí, mientras que el MMSE no permitió discriminar DCL de SDC. El área bajo la curva ROC en el MEFO para diferenciar los grupos SDC versus: a) demencia fue =0,97; b) DC (dementes+DCL) fue=0,89; y c) DCL fue=0,80; siendo estos valores para el MMSE de 0,95, 0,84, y 0,73, respectivamente. Un punto de corte (PC) del MEFO=6/7 distinguió a las personas con demencia con una sensibilidad (S)=86% y una especificidad (E)=96%; y un PC=8/9 distinguió a aquellos con DC con una: S=83% y E=75%.
ConclusionesEl MEFO resultó una prueba confiable y válida para diferenciar a personas con demencia y DC, similar al MMSE en estos casos, pero con mayor utilidad para distinguir a los pacientes con DCL y de menor duración de aplicación.
The prevalence of cognitive impairment (CI) will double in the next 20 years, making early detection a key priority.
ObjectivesValidation of a 5-minute CI screening test.
MethodsAdults aged 60 and older were recruited from memory clinics and the community at large in the Santiago, Chile metropolitan area. Based on clinical examination they were categorised as No CI (NCI), Mild CI (MCI) and dementia sufferers (DS). We measured the validity of a new test, MEFO, evaluating memory (5 points), phonetic verbal fluency (2 points) and orientation (6 points) by comparing its results with those from the MMSE.
ResultsWe evaluated 214 subjects, comprising 49 with dementia, 47 with MCI, and 118 with no CI. The MEFO differentiated between all 3 groups whereas the MMSE did not discriminate between the MCI and NCI groups. The area under the ROC curve (AUC) for the MEFO distinguishing NCI subjects from dementia sufferers was 0.97; for NCI vs CI (dementia+MCI), 0.89; and for NCI vs MCI, 0.80. On the MMSE these values were 0.95, 0.84, and 0.73, respectively. A cut-off score of 6/7 on the MEFO identified dementia sufferers with a sensitivity of 86% and a specificity of 96%. A cut-off score of 8/9 distinguished CI from NCI subjects with a sensitivity of 83% and a specificity of 75%.
ConclusionsThe MEFO is a valid and reliable test for discriminating between dementia and CI sufferers and subjects with no CI. Its validity is similar to that the MMSE under these conditions, but it is more effective for identifying subjects with MCI and its administration time is shorter.
Debido al progresivo envejecimiento poblacional, el cual es especialmente acelerado en países asiáticos y latinoaméricanos1, se espera que cada 20 años se duplique la cantidad de personas con demencia y deterioro cognitivo (DC)2. Si bien para un diagnóstico preciso es indispensable una evaluación clínica detallada3,4, desde el punto de vista de salud pública es cada vez más necesario contar con métodos de cribado que sean cortos, fáciles de aplicar y de puntuar, con adecuada sensibilidad y especificidad, y con poco sesgo educacional5. Las pruebas de cribado deberían ser sensibles en etapas iniciales del DC e incluir, al menos, una evaluación de la memoria episódica y funciones ejecutivas, ya que son los dominios más alterados en la enfermedad de Alzheimer (EA)6 y el DC vascular7, las causas más frecuentes de DC8. Existen varias pruebas de cribado de demencias aplicables en menos de 10 min validadas al español3-5, dentro de las cuales destacan por su alta sensibilidad y especificidad: el MIS9-11, el test del Reloj12, el Minicog13, el test de los 7 minutos14, el Fototest15,16, el Eurotest17 y el test de alteración de memoria (M@T)18. En el marco de una certificación internacional de estudio de las demencias19, se ha validado al Minimental test (MMSE) (del inglés, Minimental State Examination)20 asociado al cuestionario de actividades funcionales de Pfeffer (PFAQ) (del inglés, Pfeffer functional activities questionnaire)21 como métodos de cribado de demencias. Este estudio en Chile mostró que aunque el MMSE con un punto de corte (PC) de 21/22 resultó sensible: 93%, fue muy poco específico: 46%; pero al asociarlo al PFAQ la especificidad mejoró a 83%22. Entre las desventajas del MMSE cabe destacar que posee un importante sesgo educacional con variaciones de más de 7 puntos en población sana23, tiene efecto techo y no mide funciones ejecutivas, siendo poco sensible en el DC leve de tipo amnésico24 y en el DC de predominio subcortical25,26. En este trabajo hemos querido probar la utilidad de una nueva prueba denominada «Memoria, Fluidez y Orientación» (MEFO), consistente en: a) recuerdo libre diferido; b) fluencia fonética con la letra P, y c) orientación témporo-espacial. Se eligieron estas pruebas debido a la alta sensibilidad que ha demostrado el estudio del recuerdo libre diferido en la pesquisa de EA inicial6,9-18. La fluencia verbal fonética ha demostrado ser una prueba útil para evaluar funciones ejecutivas27 y la orientación témporo-espacial es muy sensible para el cribado de demencias en general18,20. Además, la evaluación de estos 3 dominios cognitivos ha sido recomendada como cribado del DC en menos de 5 min28. El objetivo de este trabajo es validar el test MEFO en español como test de cribado de demencias y DC y comparar sus resultados con el MMSE.
Sujetos y métodosLa muestra se compone de sujetos chilenos ≥60 años residentes en Santiago, de ambos sexos, divididos en 3 grupos: a) pacientes con demencia; b) sujetos con DC leve (DCL), y c) controles sin DC (SDC). Los pacientes con demencia y DCL fueron reclutados prospectivamente desde clínicas de memoria del Hospital Clínico de la Universidad de Chile (HCUCH) y del Hospital Salvador durante el período 2007-2011. El grupo control SDC se reclutó entre los familiares de los pacientes atendidos en dichos centros, información boca a boca y desde centros municipales de Santiago. Todos los sujetos fueron evaluados por neurólogos con experiencia en el estudio de las demencias, quienes realizaron una entrevista estructurada con el paciente y los familiares o informantes, diagnosticando el estado cognitivo y graduando su severidad mediante la «Escala del Deterioro Global» (GDS) (del inglés, Global Deterioration Scale)29. Dos tercios de los pacientes con demencia contaron con un estudio de neuroimágenes y exámenes serológicos incluyendo hemograma, perfil bioquímico y hormonas tiroideas. El diagnóstico de demencia se estableció según los criterios diagnósticos del DSM-IV30, considerándose una alteración de la funcionalidad importante y significativa cuando el puntaje en el PFAQ era ≥5. Se utilizaron los criterios NINCDS-ADRDA31 para probable demencia tipo Alzheimer y NINDS AIREN32 para demencia vascular. Aquellos pacientes que no tenían suficientes estudios fueron clasificados como demencias no especificadas. El diagnóstico de DCL se estableció según los criterios del «Grupo de Trabajo Internacional»: sujetos que no estén dementes pero tampoco sean normales; que tengan un declinar en sus funciones cognitivas reportado por ellos o por sus acompañantes, objetivadas con una prueba neuropsicológica y con preservación o mínima alteración de las actividades instrumentales33. El grupo control no debía reportar deterioro en su nivel cognitivo, tanto por la información de ellos mismos como por la de sus informantes. Todos los sujetos, al ingresar en el estudio, firmaron el consentimiento informado aprobado por el comité de ética del HCUCH. Los criterios de exclusión para los 3 grupos fueron: edad menor 60 años; alteraciones sensoriales que impidieran la administración de los instrumentos; trastorno depresivo mayor; alteraciones del nivel de consciencia y ausencia de informantes confiables.
Evaluación neuropsicológicaFue realizada por evaluadores ciegos al diagnóstico clínico en todos los sujetos incluidos en el estudio. Esta se iniciaba con la aplicación del MEFO y el MMSE. El MEFO incluye las pruebas de: recuerdo libre diferido, fluencia verbal y orientación témporo-espacial. Elegimos estas pruebas basándonos en la recomendación de su uso como cribado cognitivo en 5 min por el «Grupo de estandarización del deterioro cognitivo vascular»27. La administración se inicia con la prueba de memoria consistente en enunciar 5 palabras de uso frecuente, con 2 ensayos, seguido de evaluación de fluencia fonológica consistente en solicitar al sujeto decir la mayor cantidad de palabras en un minuto iniciadas con la letra P. Luego se administraban las preguntas de orientación y finalmente se indicaba enunciar las 5 palabras del ítem de memoria (anexo 1). Posteriormente, se administraba la versión del MMSE validada en Chile22. Además se evaluó el estado cognitivo global con el Addenbrooke's Cognitive Examination Revised Version (ACE-R)34. La presencia de depresión se evalúo con la escala de depresión geriátrica de Yesavage (GDS-15)35. A los informantes se les solicitaba responder el PFAQ21,22 y el Cuestionario sobre pérdida de memoria de 8 preguntas «Alzheimer Disease 8» (AD8), cuyo puntaje>2ha demostrado ser sensible para detectar la presencia de DC36 y está validado en Chile37.
EstadísticaPara el análisis se utilizó el programa SPSS-17®. Se realizó un estudio descriptivo de toda la muestra, tanto de las variables demográficas como de los datos neuropsicológicos. Se compararon los resultados entre grupos de clasificación cognitiva mediante el test de ANOVA de una vía, corregidos por edad y escolaridad, usando el test de Bonferroni en el análisis post hoc para las variables cuantitativas, y el test de la χ2 para las categóricas.
Para estudiar la influencia de las variables demográficas sobre la clasificación diagnóstica, se realizaron regresiones logísticas multivariadas, usando como variables dependientes los grupos cognitivos, comparando al grupo SDC con los grupos: a) demente; b) DC (DCL+dementes), y c) DCL. Como variables independientes se usó el puntaje de las pruebas cognitivas: MEFO o MMSE (variables continuas), la edad (variable continua), la escolaridad (variable continua) y el sexo (variable dicotómica)18. Todas las comparaciones se interpretaron como significativas, con un error del 5% bilateral, considerando un p<0,05. La consistencia interna se calculó con el índice alpha de Cronbach. Para determinar la confiabilidad test-retest, se aplicó la prueba en 2 ocasiones separadas por un mes y se determinó la correlación entre ambas. Para determinar la validez convergente se realizaron correlaciones de Pearson entre el MEFO con los otros test de evaluación cognitiva global y con las escalas del informante. Se usaron como estándar de oro en la clasificación diagnóstica la evaluación clínica+la neuropsicológica (sin incluir los resultados de MMSE ni MEFO). La validez discriminativa del MEFO se determinó mediante curvas ROC, midiendo el área bajo la curva (ABC) para diferenciar personas con demencia, DC (demencia + DCL) y DCL de los controles SDC. Estos valores se compararon con las áreas obtenidas con el MMSE mediante el método de comparación de curvas ROC de Hanley y Mc Neil38. Se determinó también la precisión diagnóstica (proporción de personas correctamente clasificadas) con cada prueba. Se calcularon los cocientes de probabilidad positivos y negativos para determinar la probabilidad de enfermedad o ausencia de esta.
ResultadosMuestraSe reclutó en total a 287 sujetos ≥ 60 años que cumplían con los criterios de inclusión y exclusión. De estos, 73 sujetos (45 controles, 11 DCL y 17 dementes) fueron excluidos por no completar la evaluación neuropsicológica. El grupo excluido tenía significativamente mayor edad que el grupo estudiado (74±8 vs. 72±7, p=0,035), sin diferencias en la escolaridad, el género ni en la distribución por grupos cognitivos. Los motivos para no completar la evaluación fueron: deserción del estudio=19, imposibilidad de asistir a las evaluaciones=23, enfermedad del paciente o informante=8, pérdida del contacto=11, no especificado=12. De las 214 personas que completaron el estudio: 118 (55%) fueron controles SDC, 47 tenían DCL (22%) y 49 (23%) estaban dementes. De los 118 individuos del grupo control 66 (56%) pertenecía a centros de adulto mayor municipales, 29 (25%) correspondía a familiares de pacientes o contacto boca a boca y 13 (20%) eran pacientes que se atendían en centros de la tercera edad de los hospitales incluidos en el estudio. De las 47 personas con DCL, 10 (21%) tenían un DC de tipo amnésico y 37 (79%) correspondían a DC no amnésicos, según los resultados de la evaluación clínica y neuropsicológica. De los 49 pacientes con demencia, 25 (51%) cumplían criterios para EA probable, 7 (14%) de demencia vascular, 5 (10%) otras demencias (3 demencias por cuerpos de Lewy, una demencia asociada a enfermedad de Parkinson y una demencia frontotemporal) y 12 (25%) correspondían a demencia no especificada. Los pacientes con demencia tenían una severidad entre leve (GDS=3, N=3) a moderada (GDS=4, N=46).
Datos demográficosLa edad promedio fue de 72±7 años, siendo el grupo SDC más joven que los otros grupos (F=9,5; p<0,001); la escolaridad promedio fue de 11±4 años, de los cuales un 21% (45) tenía < 6 años de escolaridad, un 46% (99) entre 6-12 años y un 33% (70)>de 12 años de escolaridad. El grupo con DCL fue menos escolarizado que los otros 2 grupos (F=6,5, p=0,002) con mayor proporción de personas con < 6 años de escolaridad (44%), que los controles (12%) y los con demencia (24%) (χ2=18, p=0,001). En total hubo 122 (57%) mujeres, siendo la proporción de mujeres menor en el grupo con demencia (39%) respecto al grupo SDC (66%) (χ2=11; p=0,004) (tabla 1).
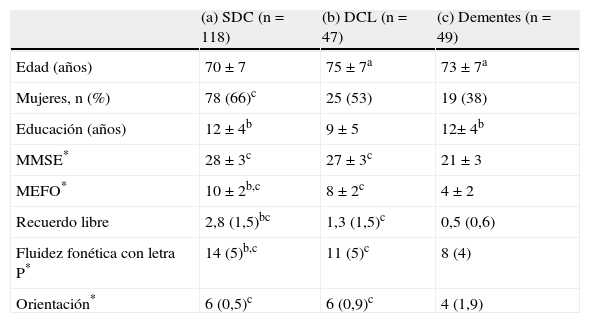
Características demográficas y rendimiento en los test de evaluación neuropsicológica según el grupo diagnóstico
| (a) SDC (n=118) | (b) DCL (n=47) | (c) Dementes (n=49) | |
| Edad (años) | 70±7 | 75±7a | 73±7a |
| Mujeres, n (%) | 78 (66)c | 25 (53) | 19 (38) |
| Educación (años) | 12±4b | 9±5 | 12± 4b |
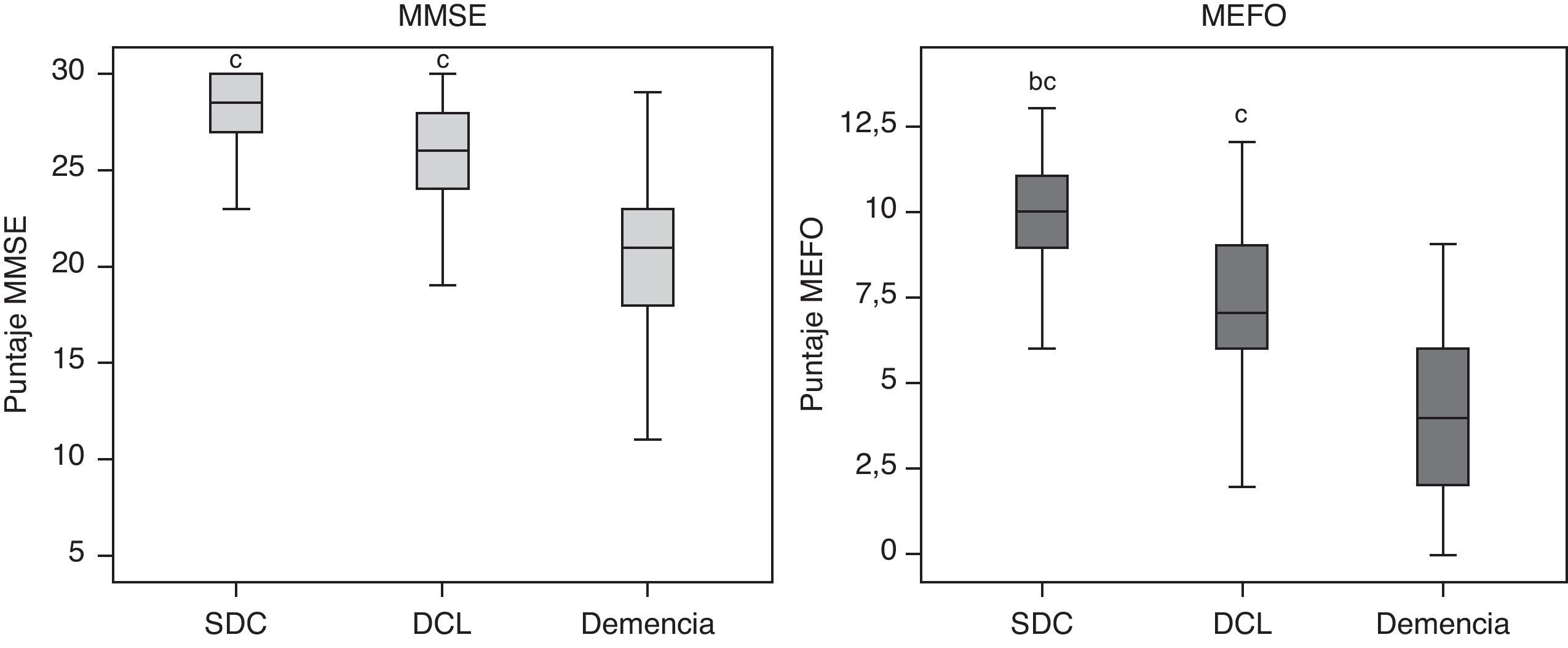
| MMSE* | 28±3c | 27±3c | 21±3 |
| MEFO* | 10±2b,c | 8±2c | 4±2 |
| Recuerdo libre | 2,8 (1,5)bc | 1,3 (1,5)c | 0,5 (0,6) |
| Fluidez fonética con letra P* | 14 (5)b,c | 11 (5)c | 8 (4) |
| Orientación* | 6 (0,5)c | 6 (0,9)c | 4 (1,9) |
Se muestran los promedios±DE.
DC: deterioro cognitivo; DCL: DC leve; MEFO: test de memoria, fluencia y orientación; MMSE: Minimental State Examination; SDC: sin DC.
*Valores corregidos por edad y escolaridad. a, b, c: valores significativos considerando p<0,05. a: mayor que los SDC; b: mayor que los DCL; bc: mayor que los DCL y dementes; c: mayor que los dementes.
No hubo diferencias significativas al comparar el puntaje en las pruebas cognitivas según el género en el grupo total, pero en el grupo con demencia las mujeres tuvieron peor rendimiento que los hombres en el MEFO, (t=2,1; p=0,04) y el MMSE, (t=2,4; p=0,03). Hubo correlaciones bajas pero significativas (p<0,001) entre las pruebas diagnósticas con la edad y escolaridad, siendo la relación inversa con la edad: MEFO r=–0,24, MMSE r=–0,23 y directa con las escolaridad: MEFO r=0,20, MMSE r=0,22. Para estudiar la influencia de las variables demográficas sobre la clasificación diagnóstica, se realizaron regresiones logísticas multivariadas. Para la clasificación del grupo con demencia, la variable genero influyó en la clasificación del MEFO (p=0,009) y MMSE (p=0,002). Para la clasificación de los DC no hubo influencia significativa de las variables demográficas con el MEFO; con el MMSE hubo influencia del género (p=0,002). En la clasificación del grupo DCL no hubo influencia de las variables demográficas con el MEFO; con el MMSE hubo influencia del género (p=0,049) y la edad (p=0,04).
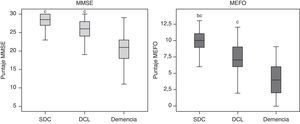
En la tabla 1 y la figura 1 se muestra una comparación de los valores en las pruebas neuropsicológicas entre los 3 grupos de clasificación cognitiva ajustados por edad y escolaridad, encontrándose diferencias significativas con el MEFO en todas las comparaciones (F=110; p<0,001), mientras que con el MMSE no hubo diferencias entre los DCL y los SDC (p=0,6).
Confiabilidad internaLos ítems del MEFO estandarizados tuvieron un índice alfa de Cronbach = 0,69, siendo la correlación entre orientación y recuerdo diferido r=0,44, orientación y fluidez fonética r=0,39 y fluidez fonética con recuerdo libre r=0,45.
Se determinó la validez de cada uno de los ítems por separado; los más discriminativos para demencia fueron: orientación ABC=0,89 (IC 95%,: 0,83-0,96) y recuerdo diferido ABC=0,917 (IC 95%, 0,88-0,96), mientras que los con mayor valor discriminativo para DCL fueron el recuerdo diferido ABC=0,77 (IC 95%, 0,69-0,85) y fluencia verbal ABC = 0,69(IC 95%, 0,69-0,85).
DuraciónLa aplicación de la prueba demoró en promedio 270±30 s.
Validez convergenteEl MEFO demostró correlaciones directas y significativas (p<0,001) con el MMSE (Pearson r=0,77) y el ACE-R (r=0,85), e inversas con los cuestionarios sobre funcionalidad: PFAQ (r=–0,58), y quejas de memoria: AD8 (r=−0,74). No se correlacionó con la escala de depresión.
Confiabilidad test retestSetenta y nueve sujetos pertenecientes a los 3 grupos estudiados fueron testeados en 2 ocasiones, encontrándose una alta correlación entre las 2 mediciones (r=0,82, p<0,001), hubo un aumento del rendimiento en la segunda evaluación de 1 ± 1,8 puntos, siendo significativo el aumento del rendimiento en el recuerdo de las 5 palabras.
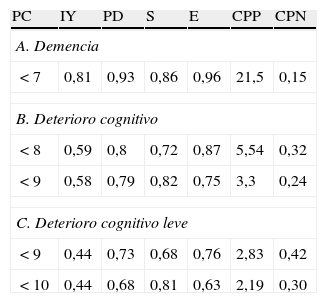
Validez discriminativaUtilizando curvas ROC se testeó la validez discriminativa para: a) demencia (N=49); b) DC (DCL más demencia) (N=96), y c) DCL (N=47). Utilizamos como control a grupo SDC (N=118). Se usó el diagnóstico clínico más el resultado de las pruebas: ACE-R, PFAQ y AD8 como estándar de oro y se compararon los resultados del MEFO y el MMSE. La comparación de las curvas ROC y las ABC de cada prueba se detallan en la figura 2. Los valores de Z encontrados en la comparación del ABC entre las curvas ROC del MEFO y el MMSE fueron: Z=0,85, p=0,19 para demencia; Z=1,34, p=0,08 para DC, y Z=1,3, p=0,11 para DCL. Para el cálculo de la sensibilidad, especificidad y certeza diagnóstica de las pruebas de cribado se utilizó el punto de corte (PC) en que se obtenía el mejor balance entre sensibilidad y especificidad según las coordenadas de las curvas ROC (índice de Youden); estos y los datos normativos del MEFO se muestran en la tabla 2.
Datos normativos del MEFO
| PC | IY | PD | S | E | CPP | CPN |
| A. Demencia | ||||||
| < 7 | 0,81 | 0,93 | 0,86 | 0,96 | 21,5 | 0,15 |
| B. Deterioro cognitivo | ||||||
| < 8 | 0,59 | 0,8 | 0,72 | 0,87 | 5,54 | 0,32 |
| < 9 | 0,58 | 0,79 | 0,82 | 0,75 | 3,3 | 0,24 |
| C. Deterioro cognitivo leve | ||||||
| < 9 | 0,44 | 0,73 | 0,68 | 0,76 | 2,83 | 0,42 |
| < 10 | 0,44 | 0,68 | 0,81 | 0,63 | 2,19 | 0,30 |
CPN: cociente de probabilidad negativo; CPP: cociente de probabilidad positivo; E: especificidad; IY: índice de Youden; PC: punto de corte; PD: precisión diagnóstica (proporción de correctamente clasificados); S: sensibilidad.
Nos propusimos validar el MEFO, una nueva prueba de cribado para DC y demencia con una duración menor de 5 min, y comparar su validez con el MMSE. Las 2 pruebas mostraron alta validez discriminativa para demencia, con valores de sensibilidad (S) y especificidad (E) adecuados y similares entre sí (fig. 2), otorgando una precisión diagnóstica de alrededor de 95%. La validez discriminativa para demencia encontrada para el MMSE en nuestro estudio fue similar a la publicada en otros estudios con poblaciones de alta escolaridad23,39, y superior a la de reportes con población de menor nivel de escolarización, como el estudio de validación chileno del MMSE, donde la mitad de la población tenía<6 años de escolaridad22. Debido a la alta escolaridad de la población estudiada en nuestro trabajo (11±4 años), donde solo un 21% tenía menos de 6 años de escolaridad, es posible que la especificidad de todas las pruebas aplicadas hubiese sido mayor de lo esperado si el estudio hubiese incluido población rural. A pesar de esto, creemos que nuestros resultados son igualmente válidos, ya que el MEFO demostró una baja correlación con la escolaridad. Además, a diferencia del MMSE, no tuvo influencia de la edad en la clasificación diagnóstica.
El MEFO, al no requerir leer ni el uso de lápiz y papel, sería aplicable en personas analfabetas40, pero no se pudo comprobar su validez discriminativa en este estudio debido al bajo número de sujetos analfabetos en nuestra muestra.
En cuanto a la capacidad de discriminación de todos los tipos de DC (DCL+dementes) (fig. 2, tabla 2), el MEFO mostró una validez similar al MMSE, con una precisión diagnóstica de alrededor de 80%. Al evaluar la validez discriminativa para DCL, el MEFO mostró mayor utilidad que el MMSE, ya que fue capaz de diferenciar a las personas con DCL de los SDC. De los tipos de DCL, el de tipo amnésico es el más homogéneo, ya que correspondería una etapa inicial de la EA6,33,41, y es muy sensible a las pruebas de memoria episódica. En nuestro estudio, solo 10 de los 47 individuos con DCL eran de tipo amnésico, lo cual puede haber influido en la menor precisión diagnóstica del MEFO al compararlo con el de otros estudios que solo incluyeron DCL de tipo amnésico18,23.
En la población>60 años se estima que alrededor de 20-30% tiene DC (3-19% DCL41,42, 5-10% demencia2,42). Creemos que a nivel de salud pública lo más útil es la discriminación del grupo con DC, ya que incluye a personas con claros trastornos cognitivos y a aquellas con déficits iniciales, potencialmente tratables. Así, para realizar estudios de cribado poblacionales, recomendamos utilizar un PC de MEFO=7/8, que otorga una sensibilidad=0,72, una especificidad=0,87, un valor predictivo positivo = 60% y un valor predictivo negativo = 93%. En cambio, para el uso en clínicas de memoria donde se estiman prevalencias mayores de DC sugerimos el uso de un PC=8/9, lo que aumenta la sensibilidad al 82% (tabla 2).
Entre las limitaciones de nuestro estudio, cabe destacar que se realizó exclusivamente en la zona urbana de Santiago, con población más escolarizada que la del resto del país, y que la mayor parte de la muestra no se extrajo de atención primaria, que corresponde a nuestra población objetivo. Otro sesgo de la muestra es que los controles fueron más jóvenes y más escolarizados que los otros grupos. Este sesgo es frecuente en los estudios de deterioro cognitivo18,40, posiblemente debido a que la mayor edad y menor escolaridad son factores de riesgo para el DC. Para disminuir la influencia de la edad y la escolaridad, se corrigieron los resultados por estos factores. También, a diferencia de otros estudios, en nuestra muestra hubo una cantidad mayor de hombres dentro del grupo de personas con demencia. Creemos que esto puede deberse a que las acompañantes femeninas fueron más responsables que los acompañantes varones para acudir a todas las evaluaciones para completar el estudio.
ConclusionesEl MEFO demostró ser una prueba con una adecuada confiabilidad interna y test retest con alta capacidad discriminativa para demencias y DC, siendo similar al MMSE y otras pruebas abreviadas. Mostró mayor utilidad que el MMSE en la discriminación de personas con DCL, lo cual sumado a su menor tiempo de aplicación (menos de 5min), además de no requerir de lectura ni uso de lápiz o papel, la hacen una prueba adecuada para el cribado de DC a nivel poblacional.
FinanciaciónEste trabajo se realizó utilizando fondos provenientes de los proyectos Fondecyt: 1100975 y 1110189.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| MEFO | ||||||
| Memoria 1«Le leeré una lista de 5 palabras, Ud. debe recordarla y repetirlas inmediatamente sin importar el orden. Se las preguntaré en un rato». (Dos intentos, dar a una velocidad de 1 por segundo.) | ||||||
| Rojo | Cara | Seda | Iglesia | Clavel | Sin puntos | |
| 1.er intento | ||||||
| 2.° intento | ||||||
| Fluidez verbal«Diga el mayor número posible de palabras que comiencen con la letra “P” en 1 min».«No pueden ser nombres propios ni tampoco palabras derivadas, por ejemplo, mano-manito». | ||||||
| Total palabras (n) | Asignar 0 punto si n < 8; 1 punto si n ≥ 8 y < 15, asignar 2 puntos si es ≥ 15 palabras | Puntaje Total / 2 | ||||
| OrientaciónDígame por favor el: | ||||||
| Día del mes | Mes | Año | Día de la semana | Lugar | Comuna | Puntaje Total / 6 |
| Memoria 2: recuerdo diferido«Recuerde las 5 palabras que le dije hace un momento». Solo se puntúa el recuerdo libre. (Si no recuerda espontáneamente ofrecer pistas.) | ||||||
| Rojo | Cara | Seda | Iglesia | Clavel | Puntaje Total / 5 | |
| 1. Recuerdo libre | ||||||
| 2. Recuerdo con clave semántica | No se puntúa | |||||
| Puntaje total MEFO: Orientación + fluidez verbal + recuerdo libre | /13 | |||||