Las baterías neuropsicológicas empleadas tradicionalmente para el diagnóstico del deterioro cognitivo (DC) en la esclerosis múltiple son pruebas complejas que conllevan mucho tiempo. Se necesitan test más simples para detectar el DC en la práctica clínica diaria.
ObjetivoEvaluar la validez diagnóstica y la fiabilidad de la escala Montreal Cognitive Assessment (MoCA) como herramienta de cribado de DC en la esclerosis múltiple frente a la Batería Neuropsicológica Breve.
Material y métodosSe seleccionaron 52 pacientes (61,5% mujeres, edad media [desviación estándar] 41,7 [11,5] años). Se analizaron la fiabilidad (consistencia interna, interobservador y test-retest) y la validez de constructo (análisis factorial, coeficiente de correlación de Pearson y coeficiente de determinación) y de criterio (curva ROC, sensibilidad, especificidad, acuerdo global, valores predictivos positivo y negativo, cocientes de probabilidad positivo y negativo y nomograma de Fagan).
ResultadosLa prevalencia de DC fue del 21,2% según la Batería Neuropsicológica Breve y del 25% según el MoCA. El MoCA mostró buena consistencia interna (alfa de Cronbach 0,822) y buena fiabilidad interobservador y test-retest (coeficiente de correlación intraclase de 0,80 y 0,96, respectivamente). El coeficiente de correlación entre la puntuación total de la Batería Neuropsicológica Breve y el MoCA fue de 0,82. El punto óptimo de corte en la curva ROC fue 25-26, con una sensibilidad del 91% y una especificidad del 93%.
ConclusiónEl MoCA es una herramienta de cribado válida y fiable para la detección de DC en pacientes con esclerosis múltiple.
The neuropsychological batteries traditionally used for the assessment of cognitive impairment (CI) in patients with multiple sclerosis are complex tests requiring a long time to administer. Simpler tests are needed to detect cognitive impairment in daily clinical practice.
ObjectiveWe aimed to evaluate the diagnostic validity and reliability of the Montreal Cognitive Assessment (MoCA) test as a screening tool for CI in patients with multiple sclerosis, as compared against the Brief Neuropsychological Battery.
Material and methodsWe recruited 52 patients with multiple sclerosis (61.5% women; mean age [standard deviation]: 41.7 [11.5] years). We analysed the reliability (internal consistency, interobserver reliability, and test-retest reliability), construct validity (factor analysis, Pearson correlation coefficient, and coefficient of determination), and criterion validity (ROC curve, sensitivity, specificity, total agreement, positive and negative predictive values, positive and negative likelihood ratios, and Fagan nomogram) of the MoCA test in this population.
ResultsThe prevalence of CI was 21.2% according to findings from the Brief Neuropsychological Battery, and 25% according to the MoCA test. The MoCA test showed good internal consistency (Cronbach alpha, 0.822) and interobserver and test-retest reliability (intraclass correlation coefficient 0.80 and 0.96, respectively). The correlation coefficient between total Brief Neuropsychological Battery and MoCA test scores was 0.82. The optimal cut-off point on the ROC curve was 25-26, yielding 91% sensitivity and 93% specificity.
ConclusionThe MoCA test is a valid and reliable tool for screening for CI in patients with multiple sclerosis.
Se estima que entre el 45 y el 65% de los paciente con esclerosis múltiple (EM) sufren deterioro cognitivo (DC)1,2. El DC puede afectar a pacientes con cualquier forma de EM o en cualquier estadio de la enfermedad3. Aunque los síntomas y la gravedad del mismo son variables, el aprendizaje, la memoria, la atención, la velocidad de procesamiento, las habilidades visuoespaciales y las funciones ejecutivas son los dominios que se afectan con mayor frecuencia1.
En la actualidad, el diagnóstico del DC asociado a la EM se lleva a cabo con baterías neuropsicológicas validadas, entre las cuales las más empleadas son la Brief Repeatable Battery of Neuropsychological Tests, de Rao4, y la batería Minimal Assessment of Cognitive Function in Multiple Sclerosis5. Estas baterías son complejas, consumen mucho tiempo y deben administrarse por especialistas capacitados, lo que impide su uso rutinario en la práctica clínica. La Batería Neuropsicológica Breve (BNB)6 es una versión reducida y validada de la Brief Repeatable Battery of Neuropsychological Tests, que requiere un menor tiempo de administración y que puede ser aplicada por cualquier profesional sanitario con una formación adecuada; aun así, el tiempo de administración de la BNB se aproxima a los 20min. En este contexto, surge la necesidad de disponer de test sencillos y rápidos que permitan detectar en unos minutos y con una medida objetiva aquellos pacientes que puedan padecer un DC y que puedan requerir derivación para valoración neuropsicológica especializada. Dentro de las pruebas cognitivas de cribado, muchos instrumentos de evaluación utilizados normalmente para la enfermedad de Alzheimer, como el Mini-Mental State Examination y sus variantes, son insensibles a la alteración cognitiva relacionada con la EM7. Otras, como el Symbol Digit Modality Test (SDMT)8, la Brief International Cognitive Assessment for Multiple Sclerosis9 o el Multiple Sclerosis Neuropsychological Screening Questionnaire10 se han empleado en la EM con limitaciones11. Por ejemplo, los resultados de este último pueden estar influidos por el estado anímico del paciente, mientras que la aplicación del Brief International Cognitive Assessment for Multiple Sclerosis es, en ocasiones, compleja y con un tiempo de administración prolongado (de unos 15min)11. Por otra parte, el SDMT ha demostrado unos excelentes valores de sensibilidad y especificidad, pero solo nos proporciona una información parcial del rendimiento cognitivo de pacientes con EM12.
La Evaluación Cognitiva de Montreal (MoCA) es un test de cribado con un tiempo de administración inferior a 10min. Se ha validado en múltiples idiomas y ha demostrado buena especificidad y sensibilidad en otras enfermedades, como el DC leve y la demencia debida a enfermedad de Alzheimer. Es además una herramienta de uso muy extendido para la valoración del DC con alteración disejecutiva, como el DC asociado a la enfermedad de Parkinson13, enfermedad en la que también ha demostrado una buena especificidad (75%) y sensibilidad (82%). Los escasos estudios publicados sobre la utilización del MoCA en EM parecen corroborar su utilidad como herramienta breve de cribado para la detección del DC en pacientes con esta enfermedad14. Sin embargo, hasta hace poco tiempo no existían estudios que analizaran la precisión del MoCA para la detección del DC asociado a EM, ni puntos de corte claramente definidos. Recientemente, la versión portuguesa del MoCA ha mostrado ser un instrumento psicométricamente válido en pacientes con EM15. El objetivo de este trabajo es validar la versión española del MoCA como herramienta de cribado de DC en la EM, frente a la BNB. Además, nos propusimos analizar los posibles factores demográficos y clínicos relacionados con la presencia de DC según la escala BNB.
Material y métodosDiseño del estudioSe trata de un estudio observacional y transversal en el que se seleccionaron pacientes con EM atendidos consecutivamente, a lo largo de 4 meses, en la consulta monográfica de enfermedades desmielinizantes. El diseño del estudio, la base de datos de recogida de la información y el consentimiento informado fueron evaluados y aprobados por el Comité Ético del hospital.
PacientesSe incluyeron 52 pacientes con el diagnóstico de síndrome neurológico aislado o EM según los criterios de McDonald de 201016, que aceptaron participar en el estudio y que firmaron el consentimiento informado. Los criterios de inclusión fueron: 1) edad mayor de 18 años; 2) ausencia de brotes o tratamiento con pulsos de corticoides en las 12 semanas previas a la inclusión en el estudio, y 3) audición, visión y condiciones físicas adecuadas para realizar las evaluaciones y acudir a la/s entrevista/s. Por otro lado, consideramos los siguientes criterios de exclusión: 1) enfermedad sistémica grave intercurrente, o bien crónica, que pudiera tener impacto en las capacidades mentales; 2) enfermedad neurológica distinta de la EM que pudiera alterar la cognición (afección vascular cerebral, enfermedad de Parkinson, epilepsia, hidrocefalia, etc.); 3) lengua nativa distinta al español, y 4) analfabetismo.
Se recogieron datos demográficos (edad en el momento del estudio, nivel educativo y sexo) y clínicos (edad en el momento del diagnóstico, duración de la enfermedad, tipo de brote inicial, forma clínica de EM, discapacidad según la Expanded Disability Status Scale17,18, presencia de tratamiento y modalidad de tratamiento).
Evaluación cognitivaLa escala de evaluación objeto del estudio de validación fue la versión española del MoCA. En este test las capacidades visuoespaciales se valoran mediante el dibujo de un reloj (3 puntos) y la copia de un cubo (un punto). La identificación se evalúa mediante la denominación de 3 animales poco familiares (3 puntos). La atención/concentración se evalúa mediante secuenciación numérica directa e inversa (un punto cada uno), prueba de concentración (un punto) y resta de 7 en 7 seriada (un punto). El lenguaje se valora mediante la repetición de 2 frases sintácticamente complejas (2 puntos) y un test de fluencia verbal (un punto). Las funciones ejecutivas/abstracción se evalúan mediante el test de fluencia verbal mencionado previamente, una versión corta del Trail Making B Test (un punto) y tareas de abstracción verbal (2 puntos). La memoria a corto plazo se valora por el recuerdo de 5 palabras a los 5min (5 puntos). Por último, la orientación se evalúa mediante 4 preguntas de orientación temporal y 2 de orientación espacial (6 puntos). La puntuación máxima es 30 y la presencia de DC se establece con una puntuación menor de 2619. Está disponible libremente y en diversos idiomas en www.mocatest.org.
Como prueba de referencia se utilizó la BNB. Esta batería consta de 4 test neuropsicológicos. Contiene una prueba para la evaluación de la memoria declarativa episódica que toma 12 ítems del test de los 7min20, mediante lectura de los ítems y refuerzo semántico, con recuerdo libre y con pistas. El lenguaje se valora mediante un test de fluencia semántica, otro de fluencia fonémica y otro de fluencia sin incluir una letra. Por último, el SDMT y el Paced Auditory Serial Addition Test valoran la función ejecutiva/abstracción. En esta versión, el Paced Auditory Serial Addition Test se administra de manera verbal y el paciente puede contestar a su ritmo, para reflejar con exactitud la velocidad de procesamiento6. Definimos DC como una puntuación por debajo de 2 desviaciones estándar de los valores normativos en 2 subescalas (memoria, lenguaje o función ejecutiva/abstracción) y/o en la puntuación total de la BNB.
Evaluación psicológica y de calidad de vidaSe evaluó la presencia de depresión mediante el Inventario de Depresión de Beck, segunda edición, la presencia de ansiedad mediante la Escala de Ansiedad de Hamilton, la fatiga mediante la Modified Fatigue Impact Scale y, por último, la calidad de vida mediante la Escala de Evaluación Funcional de la Esclerosis Múltiple y el Multiple Sclerosis Quality of Life-54.
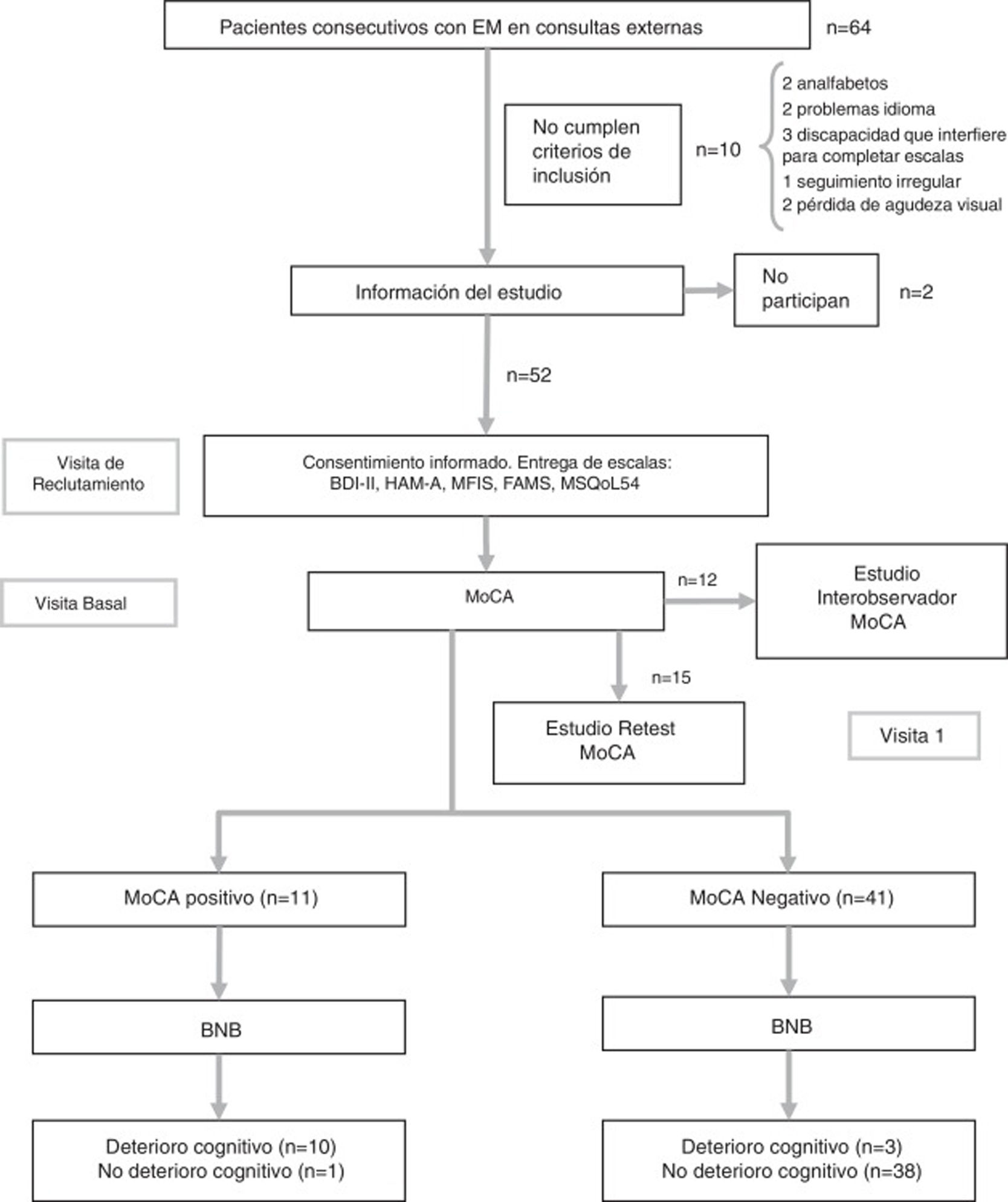
Protocolo del estudioEn la visita de selección se entregó un cuadernillo con las escalas psicológicas y de calidad de vida, siempre en el mismo orden, y se recogieron datos demográficos y clínicos. En la visita basal los pacientes entregaron el cuadernillo cumplimentado y se aplicaron los test de DC (BNB y MoCA). Durante esta visita, además, los primeros 12 pacientes fueron sometidos a una segunda evaluación del MoCA por parte de otro facultativo del Servicio de Neurología, de manera ciega e independiente, con objeto de medir la fiabilidad interobservador. Mientras el paciente completaba el test, ambos neurólogos recogían los datos separados por una cortina; el paciente utilizó una sola hoja para el dibujo del reloj, el cubo y la realización del Trail MakingTest, que fueron posteriormente analizados de manera independiente por cada uno de los neurólogos. Por último, a 15 de los pacientes que aceptaron se les programó una tercera visita en un plazo comprendido entre 2 y 3 semanas, para la valoración de la fiabilidad test-retest del MoCA (fig. 1). Ninguno de los pacientes sufrió un brote entre las 2 evaluaciones. En estudios anteriores, la realización del estudio test-retest ha demostrado fiabilidad sin efecto de aprendizaje significativo19. El flujo de pacientes se puede observar en la figura 1.
Flujo de pacientes.
BNB: Batería Neuropsicológica Breve; EM: esclerosis múltiple; FAMS: Functional Assessment of Multiple Sclerosis Scale; HAM-A: Escala de Ansiedad de Hamilton; MFIS: Escala Modificada de Fatiga; MoCA: Montreal Cognitive Assessment; MSQoL-54: Multiple Sclerosis Quality of Life-54.
Se realizó un análisis descriptivo de las diferentes variables demográficas y clínicas. Las variables cualitativas se muestran mediante la distribución de frecuencias y las cuantitativas se expresan con la media y la desviación estándar o la mediana y el rango intercuartilíco en caso de asimetría.
El estudio de la fiabilidad del MoCA incluyó la valoración de la consistencia interna (mediante el alfa de Cronbach), así como la fiabilidad interobservador y la fiabilidad test-retest (mediante el índice Kappa y el coeficiente de correlación intraclase). En el estudio de validez del MoCA se analizaron la validez de constructo, tanto interna (mediante la realización de un análisis factorial) como externa (mediante el coeficiente de correlación de Pearson y el coeficiente de determinación), y la validez de criterio (mediante la determinación del área bajo la curva ROC, la sensibilidad, la especificidad, el acuerdo global, los valores predictivos positivo y negativo, los cocientes de probabilidad positivo y negativo y el nomograma de Fagan).
Asimismo, se llevó a cabo un análisis para identificar los factores sociodemográficos y clínicos que podían estar asociados con la presencia de DC según la puntuación en la escala BNB. En la comparación de variables cuantitativas se emplearon la t de Student o el análisis de la varianza con corrección de Bonferroni. La relación lineal entre variables cuantitativas se analizó mediante el coeficiente de correlación de Pearson. Se utilizaron los correspondientes test no paramétricos (U de Mann-Whitney, coeficiente de correlación de Spearman) en los casos en que la distribución de la variable no cumplía el supuesto de normalidad. Se ajustó un modelo de regresión lineal múltiple con aquellas variables que en el análisis univariado presentaron una p<0,05 para cuantificar los efectos sobre la puntuación en la escala BNB.
Para los análisis se empleó el programa estadístico SPSS 20. Se rechazaron las hipótesis nulas con p<0,05.
ResultadosSe incluyeron 32 mujeres y 20 varones, con una edad media de 41,7 años (desviación estándar 11,5). El flujo de los pacientes se puede observar en la figura 1. Sus características demográficas y clínicas quedan resumidas en la tabla 1. El tiempo medio de administración del MoCA fue de 8min y el de la escala BNB de 18min. Según la escala BNB, la prevalencia de deterioro cognitivo en la muestra fue del 21,2% (n=11), y según el MoCA, del 25% (n=13).
Características basales de la población de estudio (n=52)
| Variables | |
|---|---|
| Edad en años, media (DE) | 41,7 (11,5) |
| Sexo, n (%) | |
| Femenino | 32 (61,5) |
| Masculino | 20 (38,5) |
| Años de escolarización, media (DE) | 13,5 (3,6) |
| Estudios, n (%) | |
| Básicos | 14 (26,9) |
| Medios | 24 (46,2) |
| Superiores | 14 (26,9) |
| Tipo de EM, n (%) | |
| SNA | 4 (7,7) |
| EMRR | 42 (80,8) |
| EMSP | 5 (9,6) |
| EMPP | 1 (1,9) |
| Tiempo de evolución de la EM en años, mediana (RIC) | 6 (4-13) |
| EDSS, mediana (RIC) | 1,5 (1,0-2,0) |
| 0-3 (discapacidad leve), n (%) | 44 (84,6) |
| 3,5-6 (discapacidad moderada), n (%) | 8 (15,4) |
| 6,5-10 (discapacidad grave), n (%) | 0 (0,0) |
| Tratamiento modificador, n (%) | 41 (79,8) |
| Tasa anual de brotes | 0,65 |
DE: desviación estándar; EDSS: Expanded Disability Status Scale; EM: esclerosis múltiple; EMPP: esclerosis múltiple primaria progresiva; EMRR: esclerosis múltiple remitente-recurrente; EMSP: esclerosis múltiple secundaria progresiva; RIC: rango intercuartílico; SNA: síndrome neurológico aislado.
El alfa de Cronbach total del MoCA fue de 0,822. Al eliminar cada uno de los ítems, este coeficiente se mantenía en valores más bajos, entre 0,67 y 0,77 (tabla 2). Los coeficientes de correlación entre cada una de las subescalas y la puntuación total del test, así como los coeficientes corregidos por eliminación de la subescala correspondiente, se muestran en la tabla 2.
Correlación entre los diferentes ítems de la Escala Cognitiva de Montreal y la puntuación total de la escala
| r | r corregido | Alfa de Cronbach corregido | |
|---|---|---|---|
| Visuoespacial | 0,75 | 0,61 | 0,68 |
| Identificación | 0,72 | 0,66 | 0,71 |
| Atención | 0,78 | 0,65 | 0,67 |
| Lenguaje | 0,59 | 0,41 | 0,73 |
| Abstracción/función ejecutiva | 0,60 | 0,52 | 0,73 |
| Memoria a corto plazo | 0,72 | 0,44 | 0,77 |
| Orientación | 0,58 | 0,49 | 0,73 |
MoCA: Escala Cognitiva de Montreal; r: coeficiente de correlación de Pearson entre el ítem y la puntuación total del MoCA; r corregido: coeficiente de correlación entre el ítem y la puntuación total del MoCA sin considerar el ítem evaluado.
El coeficiente de correlación intraclase fue de 0,80 (p<0,001) para la fiabilidad interobservador y de 0,96 (p<0,001) para la fiabilidad test-retest. El índice Kappa fue de 1 en ambos casos.
El análisis factorial mostró que los 2 primeros componentes explicaban el 77,85% de la varianza de los datos, aunque por criterios clínicos se decidió analizar la solución de 3 factores. En el factor 1 se agruparon las subescalas visuoespacial, identificación, atención y función ejecutiva; en el factor 2 se agruparon las subescalas de lenguaje y memoria a corto plazo; y, finalmente, en el factor 3 se incluyó la subescala de orientación. Las correlaciones entre las variables y los factores (cargas factoriales) después de la rotación oblicua se pueden observar en la tabla 3.
Correlaciones entre las variables y los factores (cargas factoriales) después de la rotación oblicua
| Factor 1 | Factor 2 | Factor 3 | |
|---|---|---|---|
| Visuoespacial, identificación, atención y abstracción/función ejecutiva | Lenguaje y memoria a corto plazo | Orientación | |
| Visuoespacial | 0,806 | −0,062 | 0,151 |
| Identificación | 0,871 | −0,325 | 0,069 |
| Atención | 0,829 | −0,040 | −0,250 |
| Lenguaje | 0,405 | 0,789 | 0,003 |
| Abstracción/función ejecutiva | 0,732 | −0,292 | −0,475 |
| Memoria a corto plazo | 0,508 | 0,622 | −0,108 |
| Orientación | 0,677 | −0,082 | 0,631 |
En negrita, las cargas factoriales de componentes de cada factor.
El coeficiente de correlación entre la puntuación total de la escala MoCA y la escala BNB fue de 0,82 (p<0,001), y el coeficiente de determinación fue de 0,676. El análisis pormenorizado de las correlaciones entre la puntuación total de la BNB y las puntuaciones de cada una de las subescalas del MoCA mostró grados de correlación moderados, siendo máxima la correlación con el recuerdo diferido (r=0,59) y mínima la correlación con la abstracción (r=0,30).
La correlación entre las diferentes subescalas de la BNB y del MoCA agrupadas por categorías (memoria a corto plazo, función ejecutiva, atención y lenguaje) fueron moderadas, pero todas ellas significativas, como se observa en la tabla 4. La mayor correlación se encontró entre las subescalas que valoraban lenguaje (r=0,58), y en el estudio de la atención y funciones ejecutivas (r=0,55), en ambos casos con p<0,001.
Correlaciones entre las subescalas de la Escala Cognitiva de Montreal y de la Batería Neuropsicológica Breve (memoria, lenguaje, capacidad ejecutiva y atención)
| BNB - Memoria a corto plazo | BNB - Lenguaje | BNB - Abstracción/función ejecutiva | MoCA - Memoria a corto plazo | MoCA - Lenguaje | MoCA - Abstracción/función ejecutiva | ||
|---|---|---|---|---|---|---|---|
| BNB - Memoria a corto plazo | r | 1 | |||||
| p | |||||||
| BNB - Lenguaje | r | 0,353* | 1 | ||||
| p | 0,011 | ||||||
| BNB - Abstracción/función ejecutiva | r | 0,336* | 0,702** | 1 | |||
| p | 0,016 | <0,001 | |||||
| MoCA - Memoria a corto plazo | r | 0,340* | 0,516** | 0,536** | 1 | ||
| p | 0,015 | <0,001 | <0,001 | ||||
| MoCA - Lenguaje | r | 0,126 | 0,576** | 0,540** | 0,439** | 1 | |
| p | 0,378 | <0,001 | <0,001 | 0,001 | |||
| MoCA - Ejecutiva | r | 0,133 | 0,506** | 0,546** | 0,353* | 0,303* | 1 |
| p | 0,350 | <0,001 | <0,001 | 0,011 | 0,031 |
BNB: Batería Neuropsicológica Breve; MoCA: Escala Cognitiva de Montreal; PASAT: Paced Auditory Serial Addition Test; r: coeficiente de correlación de Pearson; SDMT: Symbol Digit Modalities Test.
En negrita pueden observarse las correlaciones más elevadas y la menor obtenidas, estadísticamente significativas.
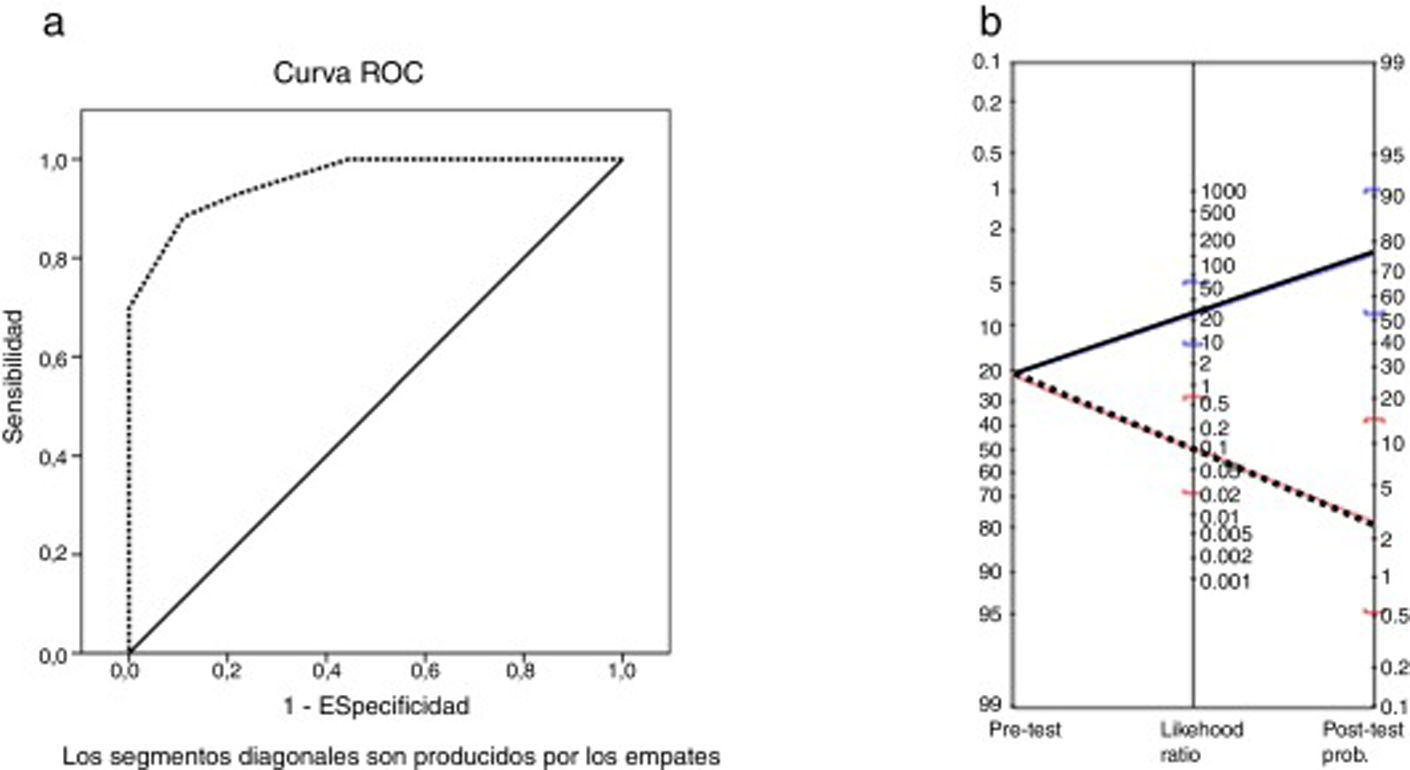
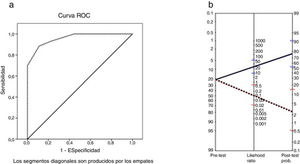
El área bajo la curva ROC fue de 0,96 (p<0,001). Los puntos de corte seleccionados que maximizaron los valores de sensibilidad y especificidad para el MoCA fueron el 25 y el 26 (tabla 5), de manera que el mejor punto de corte para identificar el DC en pacientes con EM fue una puntuación por debajo de 26. La sensibilidad fue del 91% (IC 95% 62-98), la especificidad del 93% (IC 95% 81-97) y el acuerdo global del 92% (IC 95% 82-97). El valor predictivo positivo fue del 77% (IC 95% 50-92) y el valor predictivo negativo del 97% (IC 95% 87-100). El cociente de probabilidad positivo fue de 12,42 (IC 95% 4,1-32,0) y el negativo, de 0,09 (IC 95% 0,02-0,64). El nomograma de Fagan se puede observar en la figura 2. La odds ratio diagnóstica fue de 137,8.
Criterios de validez, sensibilidad y especificidad y puntos de corte para la Escala Cognitiva de Montreal respecto al diagnóstico de deterioro cognitivo según la Batería Neuropsicológica Breve
| Punto de corte | Acuerdo global | Kappa | Sensibilidad (IC 95%) | Especificidad (IC 95%) |
|---|---|---|---|---|
| <24 | 0,90 | 0,70 | 72,73 (43,44-90,25) | 95,12 (83,86-98,65) |
| <25 | 0,92 | 0,78 | 90,91 (62,26-98,38) | 92,68 (80,57-97,48) |
| <26 | 0,92 | 0,78 | 90,91 (62,26-98,38) | 92,68 (80,57-97,48) |
| <27 | 0,75 | 0,45 | 90,91 (62,26-98,38) | 70,73 (55,52-82,39) |
IC 95%: intervalo de confianza del 95%.
a) Curva ROC para la variable puntuación total de la Escala Cognitiva de Montreal vs. deterioro cognitivo según la Batería Neuropsicológica Breve. b) Nomograma de Fagan con los cocientes de probabilidad de la Escala Cognitiva de Montreal. Línea azul: likehood ratio y probabilidad post-test positiva. Línea roja: likehood ratio y probabilidad post-test negativa.
No hubo correlaciones significativas entre la puntuación en la escala BNB y la edad de los pacientes en el momento del diagnóstico o la edad en el momento del estudio. Tampoco hubo asociación con el sexo de los pacientes. En cambio, las puntuaciones en dicha escala sí mostraron una relación con los niveles de escolarización, de modo que los valores fueron significativamente más bajos en el grupo de estudios básicos que en los grupos de estudios medios y universitarios (p=0,001). La puntuación de la BNB mostró una correlación negativa con la duración de la enfermedad, que no fue estadísticamente significativa (rho de Spearman=−0,21, p=0,13). También presentaron una menor puntuación en la escala BNB los pacientes con discapacidad moderada (Expanded Disability Status Scale 3,5-6) con respecto a aquellos con discapacidad leve (Expanded Disability Status Scale 0-3) (p=0,04). No pudimos establecer una asociación entre el DC y el tipo de EM con fiabilidad, puesto que solo se incluyeron un paciente con EMPP y 5 con EMSP. En el modelo de regresión lineal, los años de escolarización y el grado de discapacidad fueron los factores que se asociaron de forma independiente con la puntuación de la escala BNB. En el caso de los años de escolarización, se estimó un incremento medio de 5 puntos en la escala BNB (IC 95% 2-8, p<0,001) por cada año de escolarización. El grado de discapacidad moderado obtuvo una diferencia absoluta de la puntuación media de 33 puntos (IC 95% 6-60, p=0,017) frente a la discapacidad leve. No se detectaron asociaciones significativas entre la presencia de DC y el grado de depresión, ansiedad y fatiga, o la calidad de vida.
DiscusiónLa valoración cognitiva en los pacientes con EM ha tomado relevancia en los últimos años, poniendo de manifiesto la necesidad de disponer de herramientas de cribado útiles en la consulta. En estudios previos el MoCA ha mostrado buenas correlaciones con diferentes baterías de cribado de DC asociado a la EM14,15,21. Sin embargo, solo uno de ellos, que utiliza la versión portuguesa del MoCA15, examina completamente la validez discriminativa y la precisión diagnóstica del MoCA en la detección del DC en la EM utilizando estándares de referencia para la comparación. Nuestro objetivo era confirmar la utilidad de la versión española del MoCA para el cribado del DC en pacientes con EM siguiendo las guías adecuadas para este tipo de estudios (Standards for Reporting Diagnostic accuracy studies)22 y compararla con una herramienta validada. Los resultados de nuestro estudio apoyan la utilización de la versión española del MoCA con este propósito, incluso en pacientes con discapacidad leve. Además, hemos demostrado que el MoCA es una herramienta muy útil tanto para la detección del DC en la práctica clínica como para el seguimiento del mismo, incluso cuando es administrada por diferentes evaluadores, dados los excelentes valores de fiabilidad interobservador y test-retest23.
En el estudio de la consistencia interna, el alfa de Cronbach global fue alto y similar al obtenido en la validación inicial de la escala19, así como en una de las validaciones al castellano24 y en el estudio de la versión portuguesa15, y por encima del requerido (0,80) cuando el objetivo es el diagnóstico o clasificación23. Tanto las diferentes correlaciones calculadas entre la puntuación de cada subescala con la puntuación total corregida como el alfa de Cronbach calculado para el mismo supuesto y el alfa de Cronbach corregido por la eliminación de cada subescala indican que el MoCA es un instrumento fiable. Todo esto confirma que el MoCA mide con buena exactitud y con consistencia aquello que pretende medir: el DC asociado a la EM. Además, la buena validez convergente con la puntuación total de la BNB obtenida en las pruebas de validez de contenido implica que ambas escalas miden el mismo constructo (DC), como se ha demostrado en otros estudios15.
Como en otros trabajos en EM14,15,21, el MoCA ha demostrado una muy buena sensibilidad sin perder especificidad, con valores predictivos positivo y negativo mejores que los obtenidos en la enfermedad de Parkinson13. Por tanto, el MoCA parece identificar incluso mejor el DC asociado a la EM que el relacionado con la enfermedad de Parkinson. Según los niveles de referencia del Evidence-based Medicine Working Group25, los cocientes de probabilidad positivo y negativo del MoCA que hemos obtenido han sido relevantes, y junto con los datos obtenidos en el nomograma de Fagan, nos permiten concluir que el MoCA aporta una buena capacidad discriminativa entre los pacientes con DC asociado a la EM frente a los que no lo tienen. Además, el área bajo la curva (0,96) obtenido es consistente con una alta precisión diagnóstica, mejor que la obtenida en otros estudios (0,87)15. Los puntos de corte que mejores valores de sensibilidad y especificidad han mostrado para el MoCA coinciden con el punto de corte de los estudios de validación de la escala19. Estos excelentes valores de precisión diagnóstica, junto con el menor tiempo medio de administración frente a la BNB, hacen del MoCA un buen método de cribado del DC asociado a la EM26. Aun así, podría resultar interesante en un futuro la comparación del MoCA con otras herramientas de cribado breve comúnmente utilizadas en la EM, como el SDMT, para una mejor definición de su uso clínico.
Tanto con la escala BNB como con el MoCA, la prevalencia de DC en nuestra muestra se sitúa dentro del rango del 24-29%. Aunque las diferentes frecuencias publicadas sobre el DC en EM varían ampliamente, nuestros resultados se encuentran en línea con la prevalencia encontrada en pacientes con diagnóstico reciente de síndrome neurológico aislado o EMRR con discapacidad leve27. Hemos encontrado una relación entre el nivel educativo y el DC, en consonancia con lo publicado recientemente en estudios longitudinales que ponen de manifiesto que el nivel educativo es un componente de la reserva cognitiva y que protege frente al DC asociado a la EM28. En cambio, no hemos encontrado diferencias en función del sexo de los pacientes, la edad en el momento del diagnóstico o la edad en el momento del estudio.
Debemos reconocer algunas limitaciones en nuestro estudio. En primer lugar, hemos recurrido a la BNB como herramienta diagnóstica en lugar de los test neuropsicológicos estándar (Minimal Assessment of Cognitive Function in Multiple Sclerosis, Brief Repeatable Battery of Neuropsychological Tests, de Rao); no obstante, se ha demostrado que las puntuaciones de la BNB tienen una muy buena correlación con la Brief Repeatable Battery of Neuropsychological Tests (r=0,78, p<0,001)6. En segundo lugar, y dadas las características del centro donde se ha llevado a cabo el estudio, nuestra muestra es representativa de una población con diagnóstico reciente de la enfermedad y con pocos pacientes con una discapacidad grave; en todo caso, con los buenos resultados obtenidos en este tipo de población, queda patente la utilidad del MoCA como herramienta de cribado de DC asociado a la EM en etapas precoces de la enfermedad.
En conclusión, el MoCA ha mostrado ser una herramienta válida y fiable como método de cribado del DC asociado a la EM. Esta escala posee una excelente rentabilidad diagnóstica. El DC medido por la BNB se relacionó de forma independiente con el nivel educativo y el grado de discapacidad.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Nos gustaría agradecer a todos los pacientes su participación desinteresada.