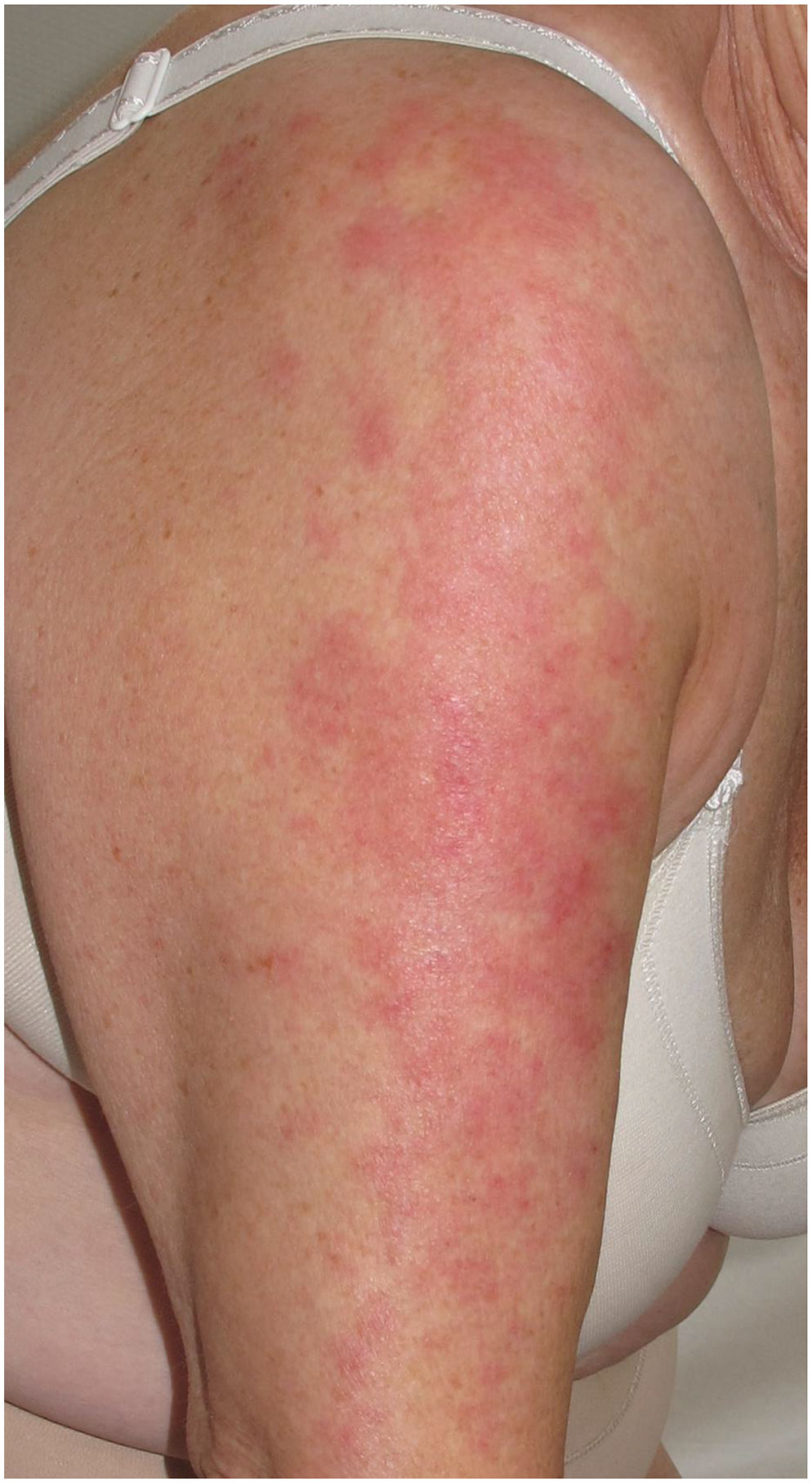
El uso de la terapia biológica para el tratamiento de las enfermedades inmunomediadas se ha relacionado con diferentes reacciones cutáneas inmunoinducidas que no cumplen con los criterios para ser consideradas paradójicas, como reacciones eccematosas, lupus, vasculitis, alopecia areata, vitíligo, reacciones liquenoides y reacciones granulomatosas. Aunque los anti-TNF son los fármacos más asociados, los inhibidores de la IL-17 y de la IL-23 también se están viendo implicados. Los dermatólogos tenemos que reconocerlas y manejarlas para mejorar la calidad de vida de estos pacientes y evitar cambios de líneas terapéuticas innecesarias.
The use of biological therapies for the treatment of immune-mediated inflammatory diseases has been associated with different skin reactions such as eczema, lupus, vasculitis, alopecia areata, vitiligo, lichenoid reactions and granulomatous disorders that do not meet the criterion to be considered paradoxical. Although anti-TNF drugs are the most commonly associated, Il-17 and Il-23 inhibitors are also being reported. Dermatologists need to recognize and manage these reactions to improve the quality of life of these patients and avoid changing therapeutic approaches unnecessarily.