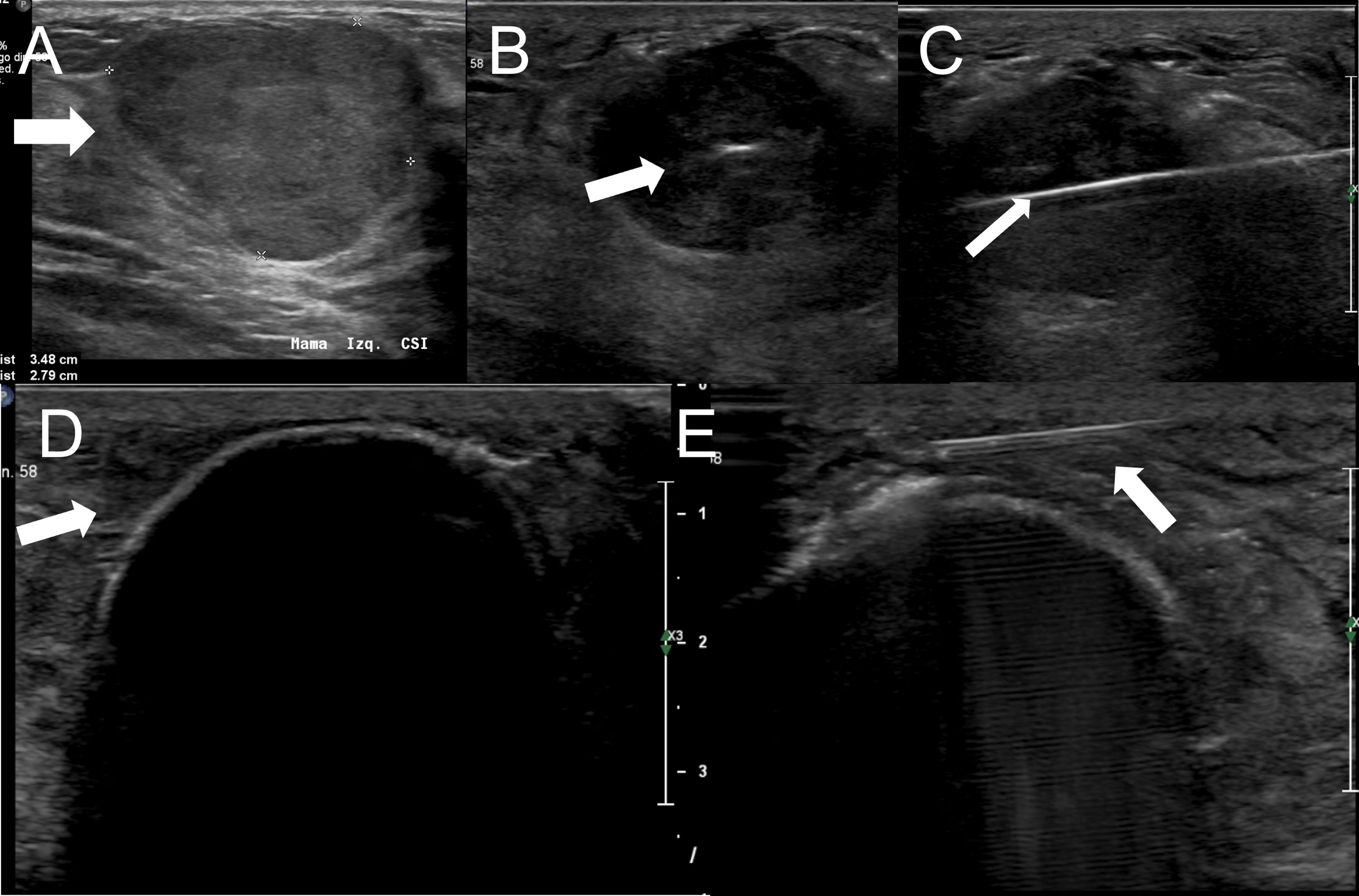
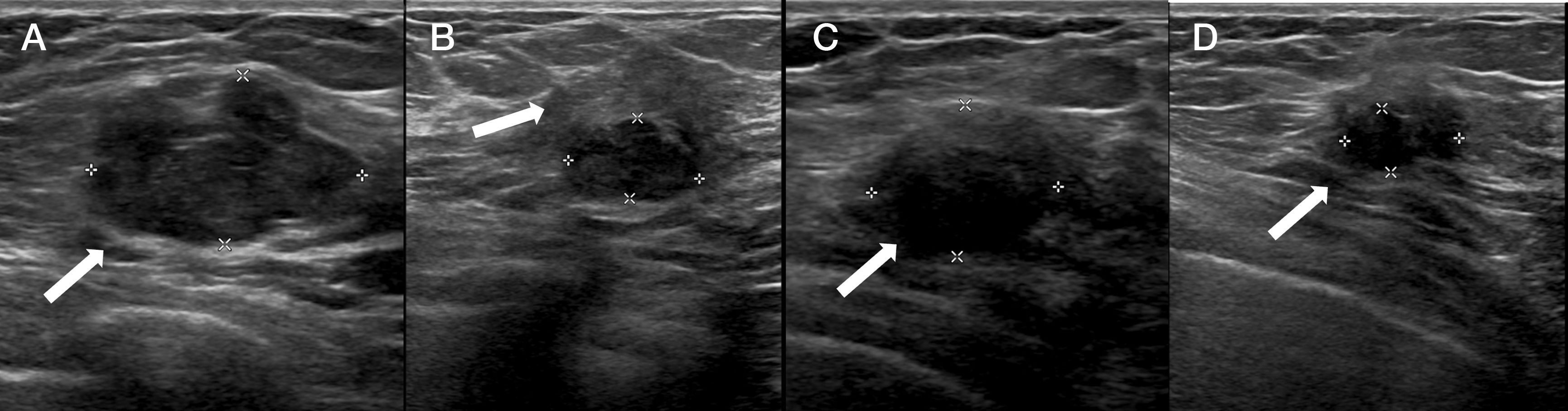
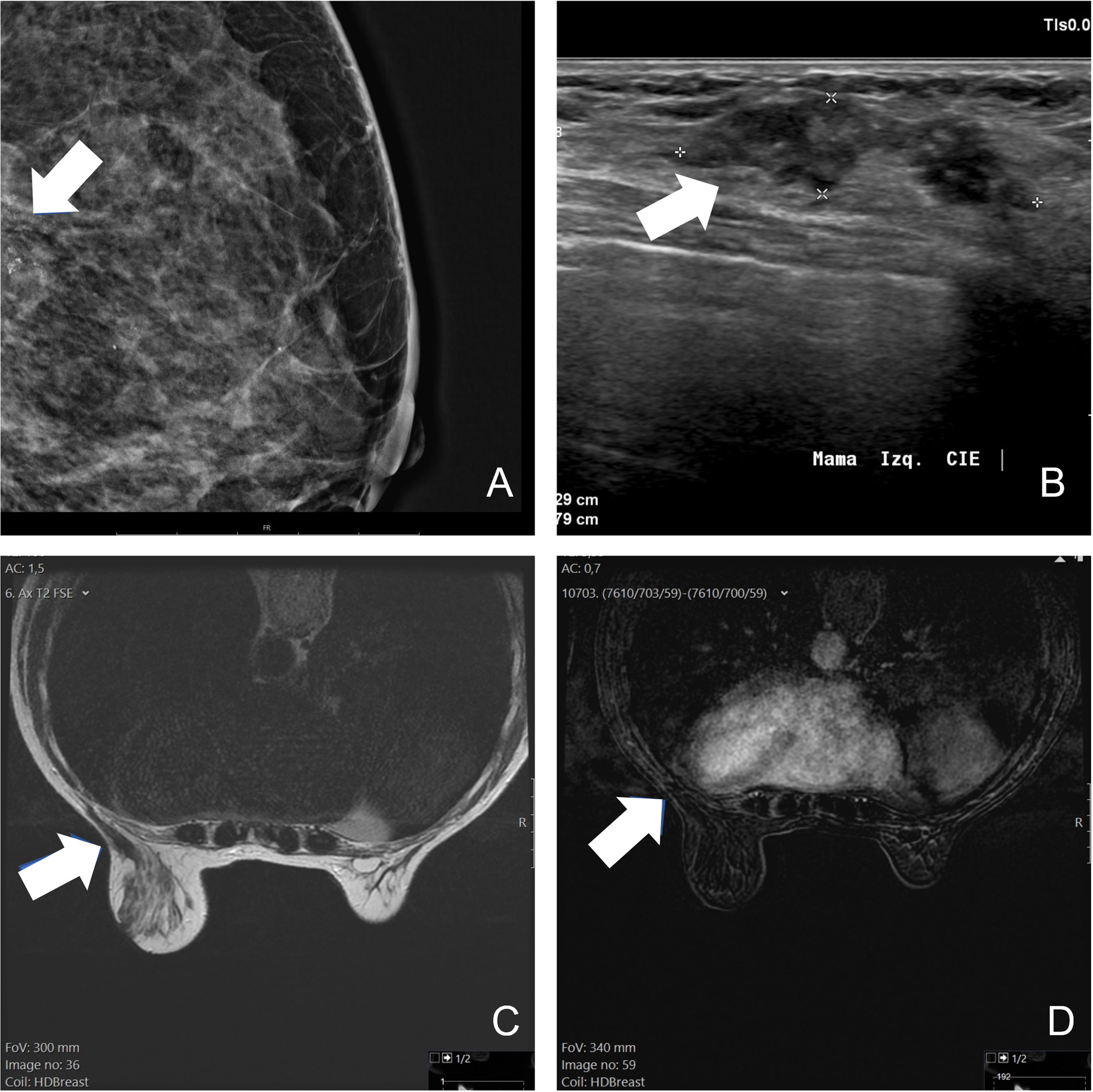
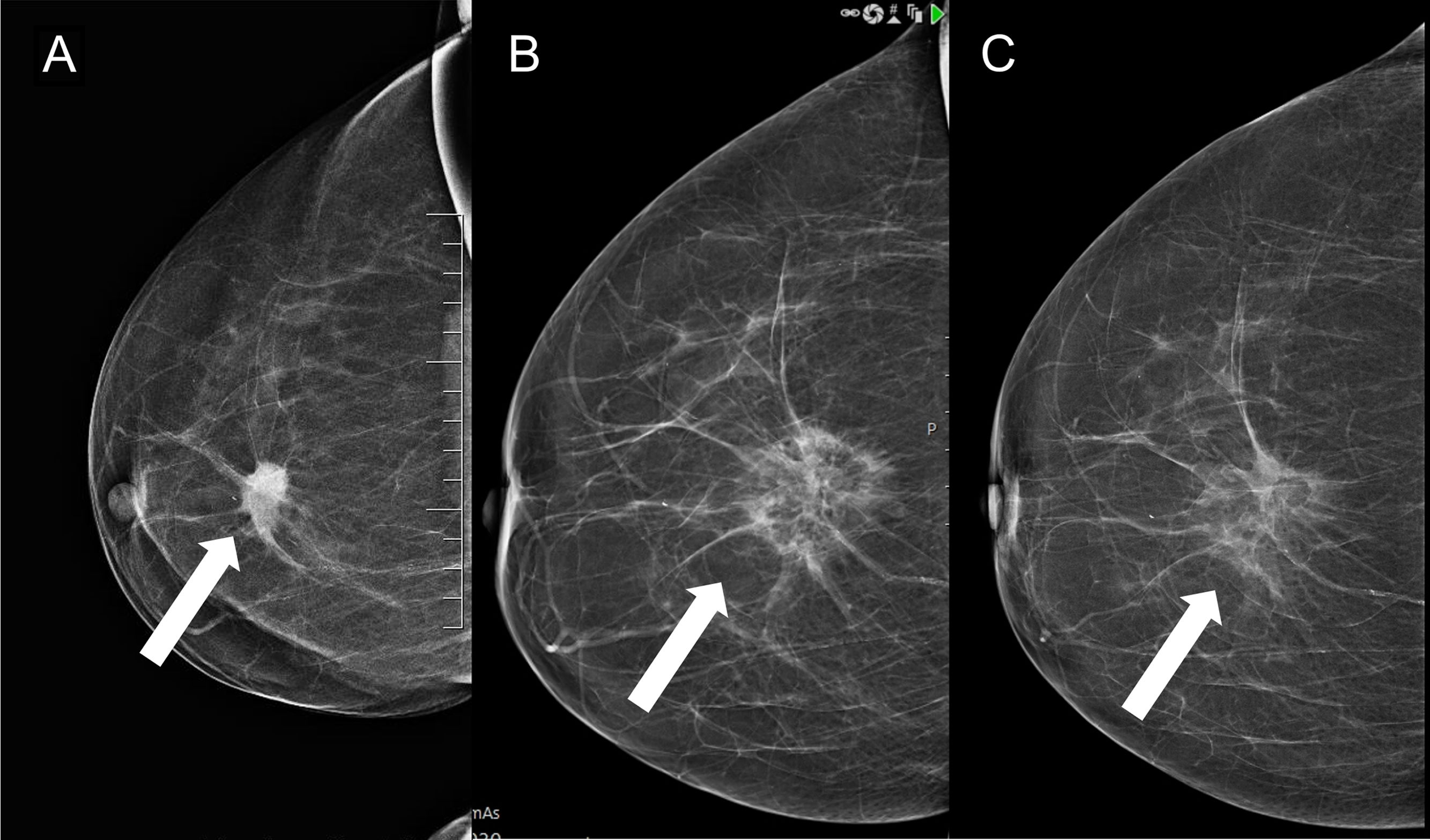
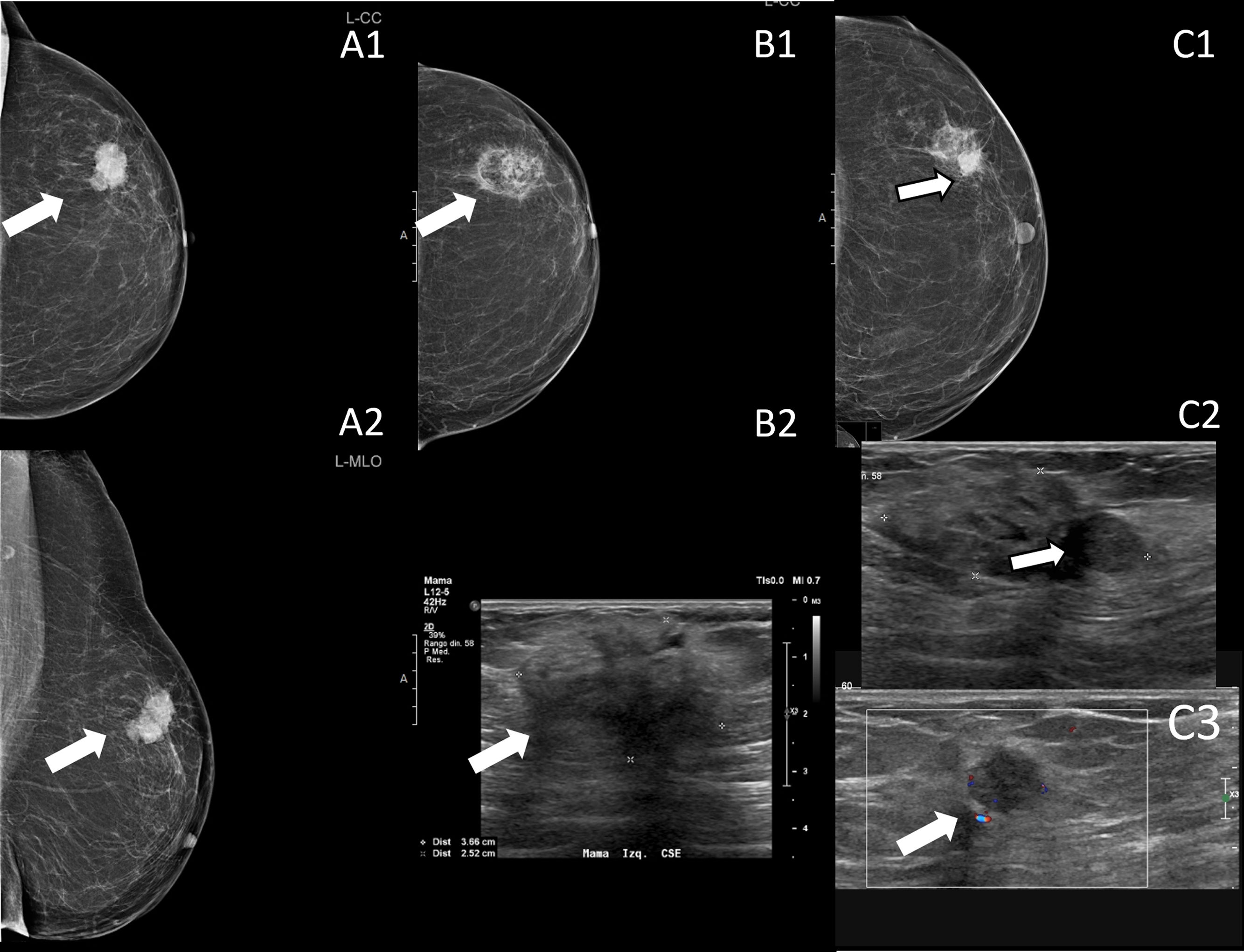
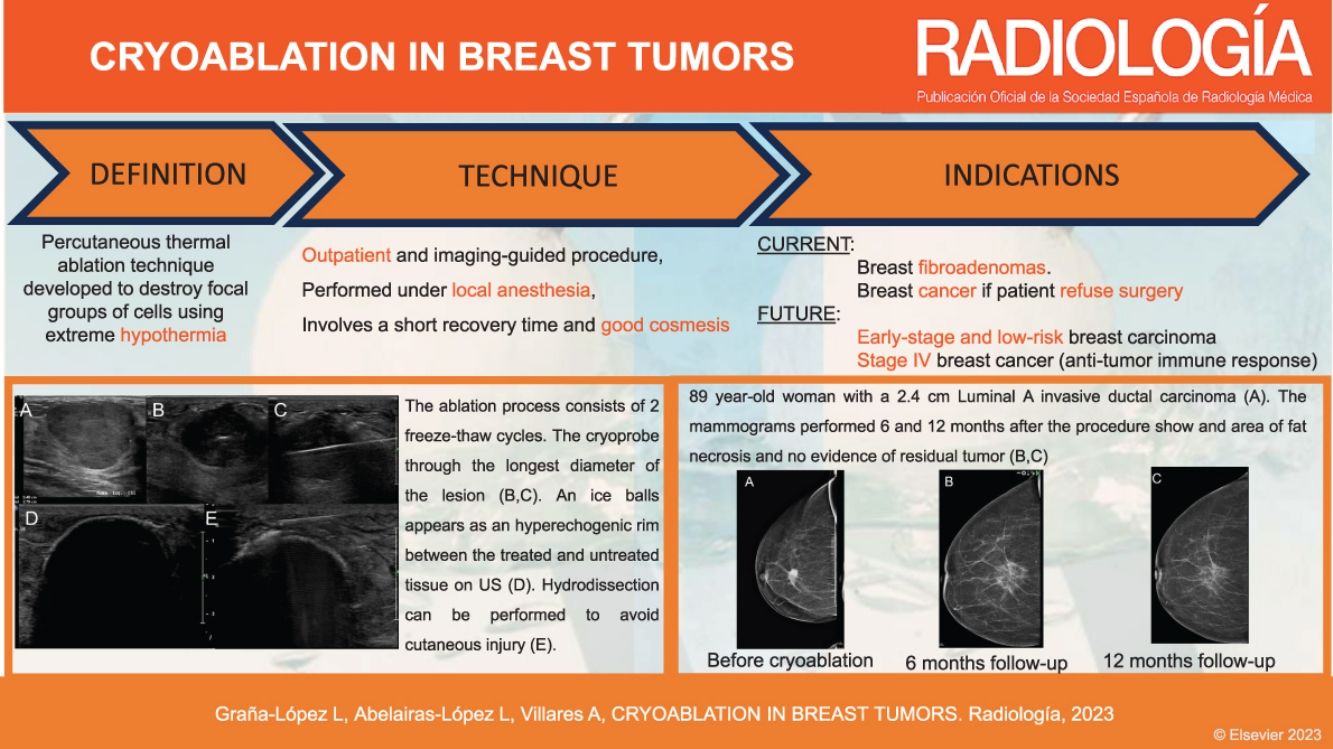
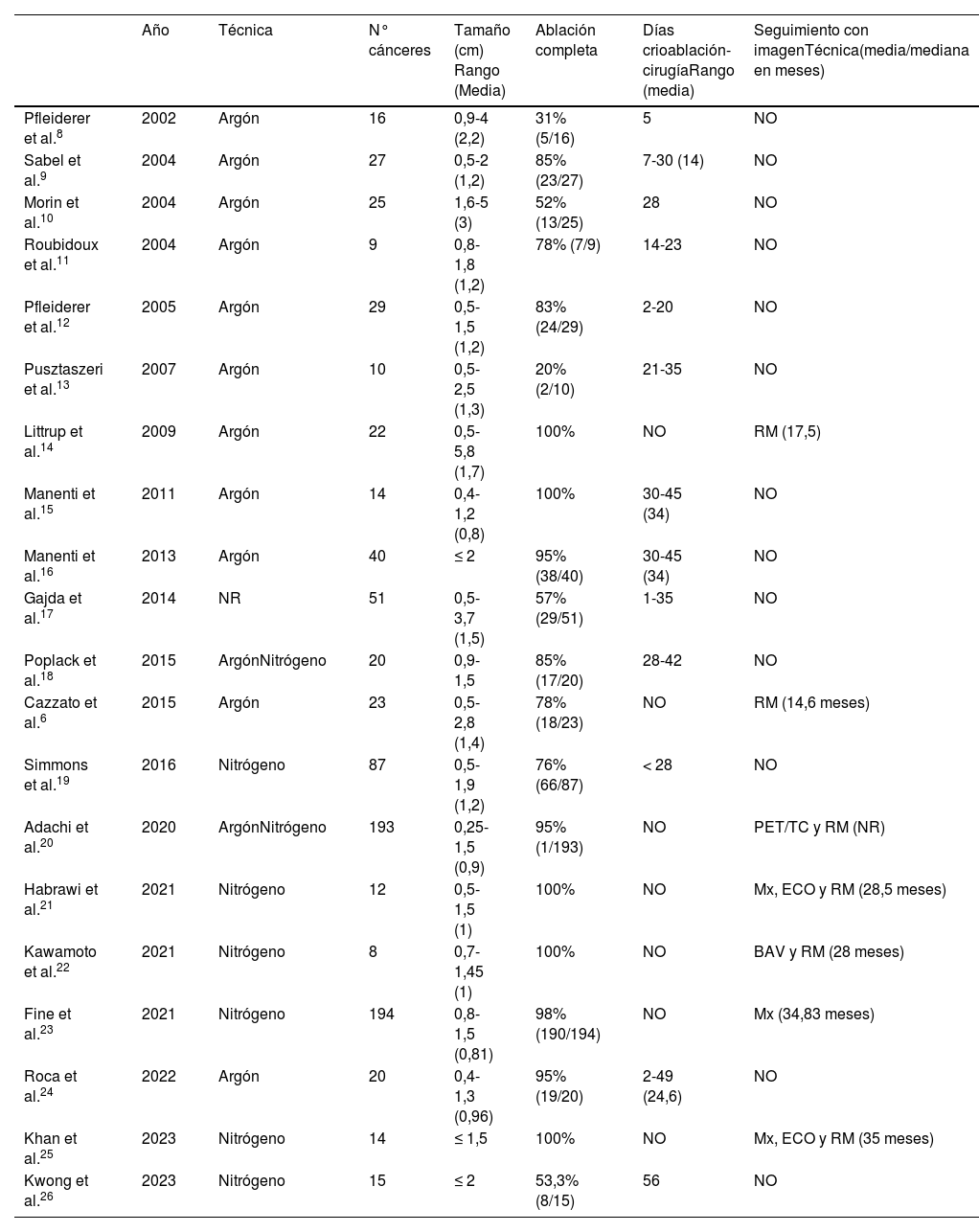
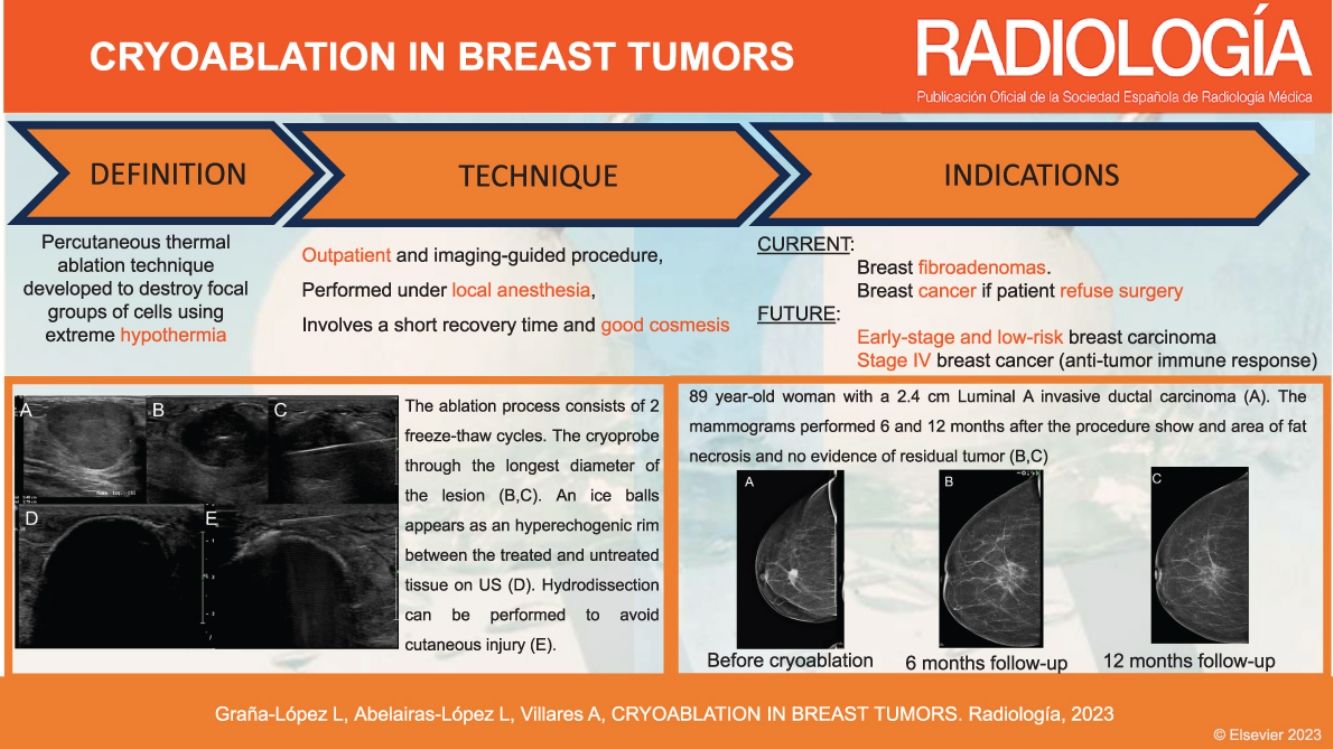
La crioablación es una técnica de ablación térmica que provoca destrucción celular gracias a los efectos del frío. Es un procedimiento que se realiza guiado por imagen, de forma ambulatoria y con anestesia local. Es sencillo, seguro y bien tolerado. Ha demostrado su eficacia en el manejo de los fibroadenomas. Se emplea en el tratamiento del cáncer de mama en mujeres que rechazan la cirugía o no son candidatas quirúrgicas. Según el resultado de los estudios publicados, en un futuro próximo, podría ser una alternativa a la cirugía en el cáncer de mama precoz y de bajo riesgo. Asimismo, se ha demostrado que la crioablación estimula la respuesta inmune antitumoral, por lo que podría tener también efecto sistémico. El objetivo de este artículo es describir la técnica de la crioablación en las lesiones de la mama y revisar sus indicaciones de acuerdo con la evidencia científica disponible.
Cryoablation is a percutaneous thermal ablation technique developed to destroy focal groups of cells using extreme cold. It is an outpatient and image-guided procedure, performed under local anaesthesia, with typically short recovery times and good outcomes. Percutaneous cryoablation has good success rates for treating breast fibroadenomas. It is used in cases of malignant tumours mainly when a patient refuses surgery or is not considered to be a suitable candidate. Some studies indicate that cryoablation could be as effective and safe as lumpectomy in cases of low-risk early-stage breast cancer. Moreover, some studies have reported a regression of metastatic foci after ablation of a primary tumour thanks to an anti-tumour immune response stimulated by cryoablation. This article describes the technique and its indications with regards to breast tumours according to the existing literature.