El síndrome pulmón-riñón asociado con el lupus eritematoso sistémico es una condición poco frecuente, pero con alta carga de morbimortalidad, de la que se tiene escasa evidencia en cuanto a su prevalencia y distribución, y menos aún sobre opciones terapéuticas. Es de resaltar el impacto que representa la instauración temprana y eficaz del tratamiento en la evolución natural de esta patología, un campo poco explorado que por lo mismo requiere mayores ensayos clínicos y con esto, su evidencia. Esta es la razón para llevar a cabo una revisión semiestructurada de la literatura acerca de las estrategias terapéuticas disponibles, representadas en el uso de ciclofosfamida y rituximab, plasmaféresis y corticoesteroides, así como su impacto en la mortalidad y los desenlaces, que pueden comprometer órganos vitales, derivar en insuficiencia respiratoria aguda y en algunos casos requerir terapia de reemplazo renal.
The lung-kidney syndrome associated with Systemic Lupus Erythematosus is a rare condition, but with a high burden of morbidity and mortality. There is little evidence regarding the prevalence, distribution of the disease and, even less regarding the therapeutic options. It is worth highlighting the impact that the early and effective establishment of treatment represents in the natural evolution of this pathology. This is a field that has been very little explored and that therefore requires more clinical trials and from them evidence. This is the reason for conducting a semi-structured review of the literature about the therapeutic strategies available at this time, represented using cyclophosphamide and rituximab, plasmapheresis, and corticosteroids, as well as their impact on mortality and outcomes. These therapies can compromise vital organs that can lead to acute respiratory failure and in other cases, require renal replacement therapy.
El síndrome pulmón-riñón (SPR) se define como la manifestación simultánea de hemorragia alveolar difusa (HAD) y glomerulonefritis rápidamente progresiva (GNRP). Las vasculitis asociadas con anticuerpos anticitoplasma del neutrófilo (ANCA) constituyen la principal causa en más del 65% de los casos, seguidas de la enfermedad antimembrana basal glomerular, en menor proporción, aproximadamente en el 12-17,5% de los casos. Aún menos frecuente resultan ser algunas enfermedades autoinmunes como el lupus eritematoso sistémico (LES), la polimiositis y el escleroderma, que representan en conjunto menos del 10% de los casos, seguidas de las vasculitis ANCA (-) y las inducidas por medicamentos1.
En el caso de las vasculitis asociadas con ANCA, el SPR tiene una incidencia que varía de 1 a 10 casos por 10 millones de habitantes/año. Dada su rara presentación en LES, no se dispone de datos epidemiológicos, sin embargo, cuando se las considera entidades independientes, la nefritis lúpica está presente en entre un 40 y hasta un 90% en pacientes con LES (asociada o no con compromiso renal rápidamente progresivo), mientras que la HAD tiene una prevalencia menor del 2%1,2 pero con un alarmante impacto en mortalidad que es de alrededor del 50%, e incluso mayor.
En la actualidad, aún existe discrepancia con respecto a los esquemas terapéuticos en esta condición clínica, poco frecuente pero catastrófica, que puede poner en riesgo la funcionalidad de un órgano e incluso conducir a la muerte3. Consecuentemente con ello, se plantea la realización de una revisión semiestructurada de la literatura, a efectos de establecer la evidencia disponible en relación con esta condición, las posibilidades terapéuticas y los desenlaces en mortalidad y compromiso en funcionalidad de órganos específicos en los pacientes con LES que presentan SRP asociado.
MétodosPara abordar la referida labor, se realizó una búsqueda en las bases de datos PubMed y Embase, utilizando los términos Mesh y no Mesh para «Síndrome pulmón-riñón», «Lupus eritematoso sistémico», «Hemorragia alveolar difusa», «Nefritis lúpica, «Ciclofosfamida», «Rituximab» y «Plasmaféresis», filtrando las publicaciones realizadas entre 1980 y octubre del 2020, en personas mayores de 18 años.
Además, se incluyeron metaanálisis, estudios experimentales, revisiones sistemáticas e informes de casos y series en los cuales los pacientes tenían un diagnóstico de LES asociado con HAD y/o GNRP. Los criterios de exclusión incluían la edad de menores de 18 años, el estado de embarazo, la positividad de los ANCA y otras afecciones que se sabe causan hemorragia pulmonar, como el síndrome de anticuerpos antifosfolípidos concomitante, la uremia, la coagulación intravascular diseminada o la neumonía por citomegalovirus (CMV). Se excluyeron los artículos que no disponían de datos individuales de supervivencia.
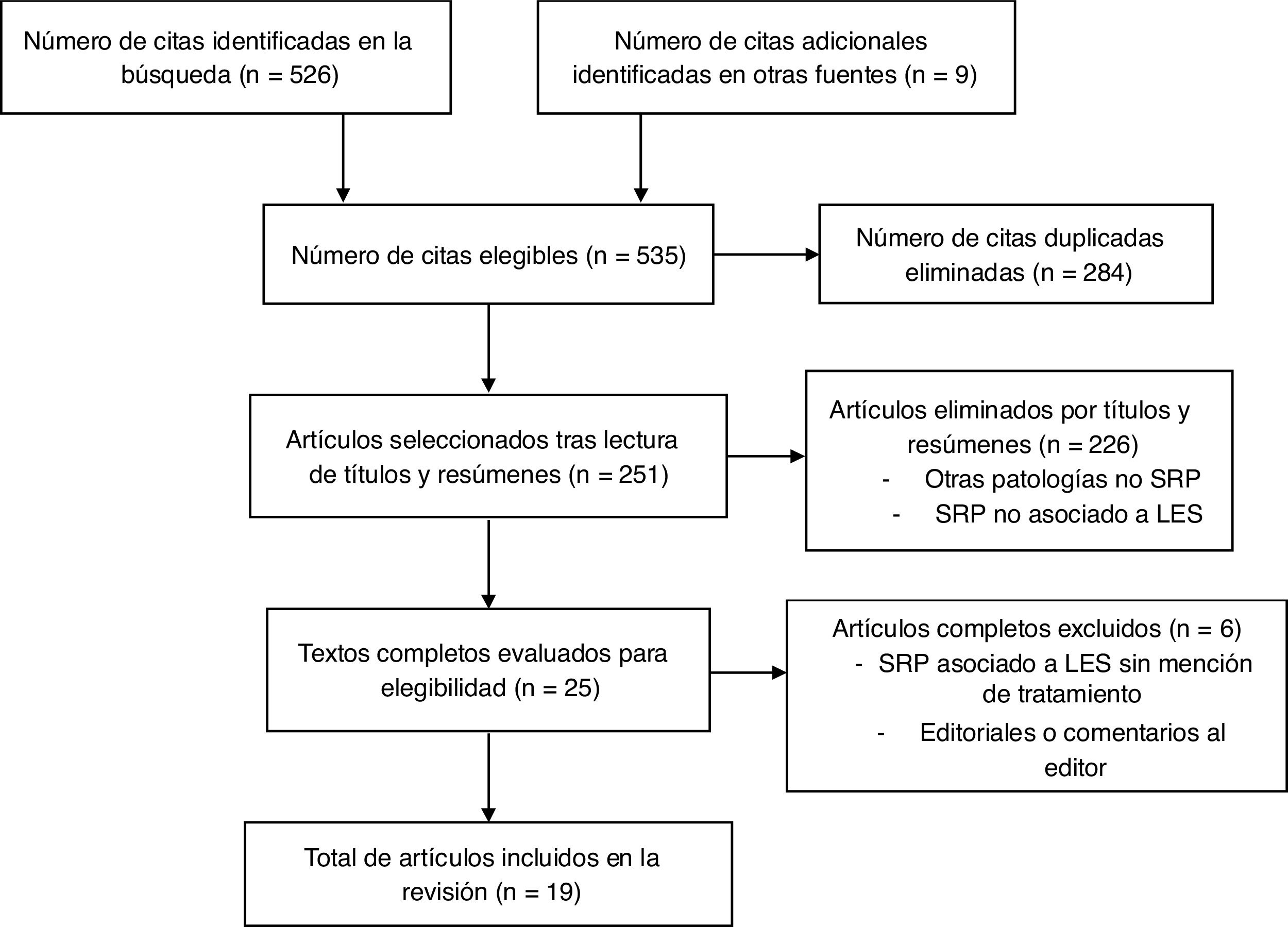
La búsqueda inicial arrojó un total de 242 resultados, de los cuales se filtraron 19 artículos por revisión de cada título, los que se incluyeron en el análisis final. Se analizaron datos de efectos adversos, supervivencia y desenlaces organoespecíficos (fig. 1).
Síndrome pulmón-riñónTérmino implementado en 1919 por Goodpasture, implica la presentación simultánea de insuficiencia renal y ventilatoria como manifestaciones de GNRP y HAD, respectivamente, en el contexto de autoinmunidad. Implica una mortalidad a corto plazo de hasta el 40% en caso de no realizarse intervención oportuna, además de un riesgo de recaída de alrededor del 15% a 18 meses. No obstante, afortunadamente, es una condición clínica de baja prevalencia. Las cifras en tendencia de supervivencia parecen demostrar un cambio significativo en las últimas décadas: aproximadamente el 25% hacia 1980 vs. el 67% en la década actual.
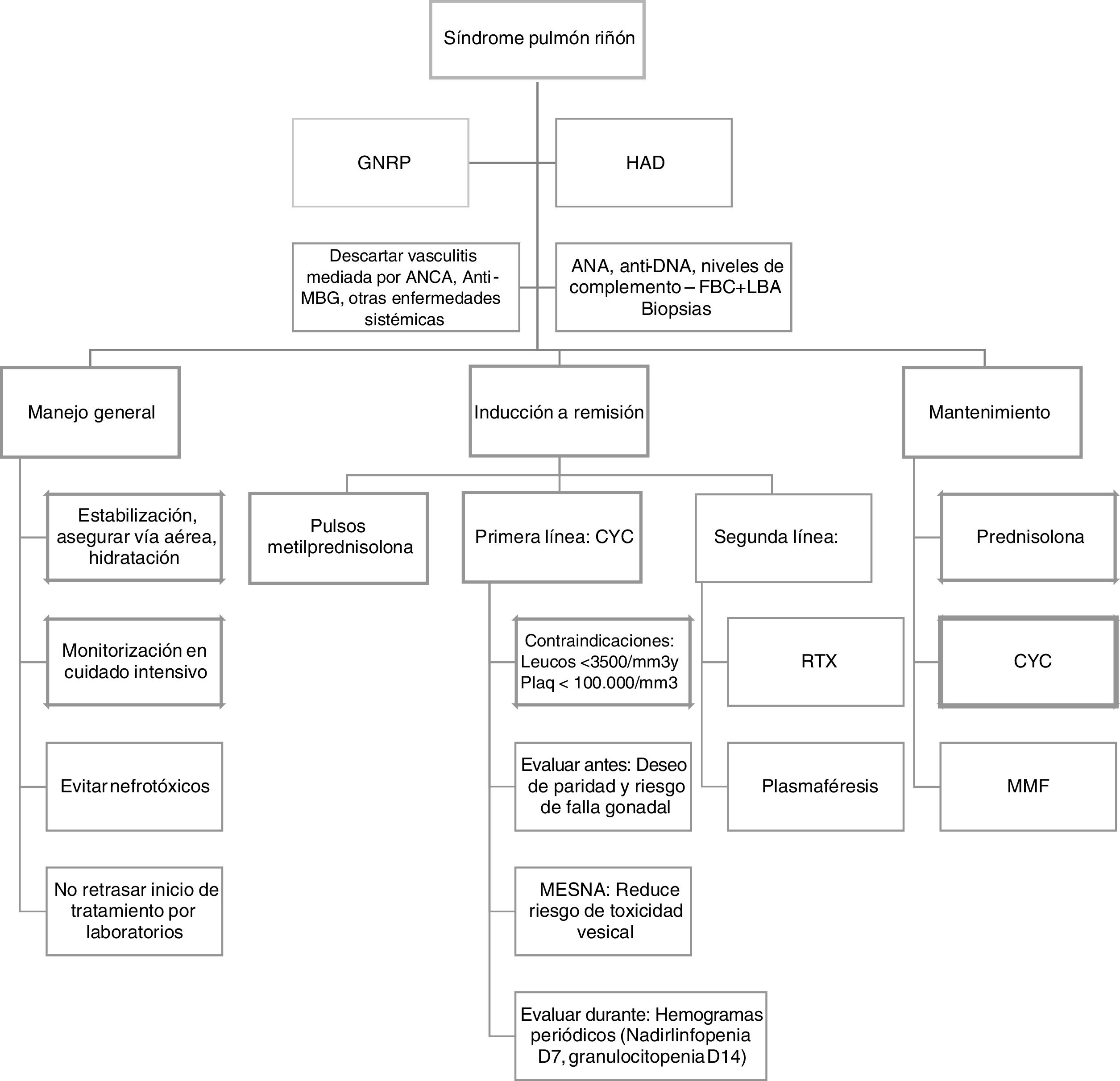
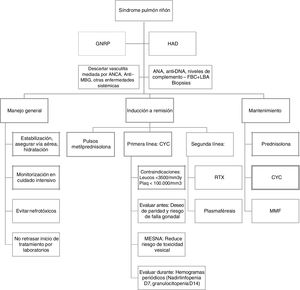
Para el tratamiento, idealmente se considera como prerrequisito que los pacientes ingresen a unidad de cuidado intensivo para monitorización, procesos de reanimación y estabilización, así como el inicio de la terapia dirigida (fig. 2).
Algoritmo terapéutico1,2,4. ANA: anticuerpos antinucleares; ANCA: anticuerpos anticitoplasma del neutrófilo; Anti-MBG: anticuerpos antimembrana basal glomerular; CYC: ciclofosfamida; FBC+LBA: fibrobroncoscopia + lavado broncoalveolar; GNRP: glomerulonefritis rápidamente progresiva; HAD: hemorragia alveolar difusa; MESNA: 2-mercaptoetanol sulfonato de sodio; MMF: mofetil micofenolato; RTX: rituximab.
Este agente alquilante se ha usado ampliamente en pacientes con diagnóstico de LES con actividad de la enfermedad que comprometa la vida, como también en aquellos pacientes con nefritis lúpica, y se ha logrado el control de la enfermedad de una forma eficaz, incluso hasta lograr la remisión en el 71% de los casos, según los resultados del The Euro-Lupus Nephritis Trial4.
En relación con los pacientes que además cursan con hemorragia alveolar, la evidencia apunta a señalar que, en combinación con esteroide, la ciclofosfamida parece mejorar la supervivencia hasta en un 67%, de acuerdo con los resultados de la revisión sistemática publicada por Ednalino et al. en el 20155. Sin embargo, la evidencia inicialmente señalaba que, hacia el año 1997, aquellos pacientes con LES y hemorragia alveolar que recibían ciclofosfamida presentaban un aumento en la mortalidad debido al requerimiento de ventilación mecánica invasiva, y mayor tendencia a infección, de acuerdo con los resultados de Zamora et al.6. Es probable que la ciclofosfamida no conlleve por sí misma un incremento en la mortalidad, por el contrario, los pacientes que la recibieron tenían más factores asociados con muerte. Lo anterior se considera un error de interpretación, pues con el tiempo se demostró que se trataban de pacientes clínicamente más enfermos, con mayor probabilidad de desenlaces fatales.
Se resalta que el hecho de que el paciente con LES comience con GNRP asociada con la hemorragia alveolar, se considera una manifestación poco común pero letal y se relaciona directamente con la actividad de la enfermedad, con una mortalidad extrapolada de series de casos con HAD mayor del 50%7.
A la fecha, no hay evidencia en relación con aquellos casos de LES que cursan con SPR, diferente de algunos reportes de casos en los que debido a la ausencia de una guía de manejo clara de la literatura, el enfoque del tratamiento sigue siendo individualizado y depende de la condición clínica del paciente; sin embargo, la evidencia sugiere inicio de tratamiento temprano y agresivo, pues se trata de una condición con alta tasa de mortalidad a corto y largo plazo.
PlasmaféresisLa plasmaféresis terapéutica es un procedimiento extracorpóreo en el que se remueve sangre total, posteriormente se separan sus componentes, los cuales se filtran a través de una membrana de alta permeabilidad, y se separan las sustancias con peso molecular superior a 3×10 exp 6Da (e. g., inmunoglobulinas, complejos inmunes, factores de complemento), para posteriormente aplicarlo al paciente. Durante el procedimiento se extrae un volumen determinado de plasma, estimado por el cálculo de la presión oncótica, empleando un nomograma, mediante la fórmula de Kaplan, la cual depende del peso y el hematocrito del paciente8:
Volumen de plasma estimado= (0,065×peso (kg))×(1- hematocrito)
Una vez se extrae el volumen de plasma, este es sustituido por una solución con adecuada actividad coloidal (plasma o solución de albúmina), siendo la indicación de cada una individualizada. En el caso de albúmina 5%, tiene las ventajas de un menor riesgo de infección, baja incidencia de efectos secundarios y el ser isooncótica; sin embargo, es de mayor costo y el paciente puede presentar hipotensión, náuseas y depleción de proteínas plasmáticas. Con respecto al plasma fresco congelado, se encuentra principalmente indicado en pacientes con antecedentes de déficit de factores de coagulación o inmunodeficiencias, tiene la ventaja de no depletar proteínas plasmáticas y aporta factores de coagulación deficientes; sin embargo, tiene la desventaja en cuanto al riesgo de transmisión de infecciones, reacciones alérgicas y la compatibilidad del sistema ABO, además de su elevado costo8.
Se requieren en promedio de tres a cinco sesiones de plasmaféresis, teniendo en cuenta que en cada sesión se remueven entre el 45% y el 75% del total de inmunoglobulinas, hasta llegar al 90% de remoción al finalizar las sesiones indicadas. No obstante, posteriormente al procedimiento se presenta reacumulación de moléculas en el espacio intravascular debido a: drenaje linfático, difusión simple a través de pared capilar y síntesis endógena por células plasmáticas9.
Debido a la baja frecuencia de presentación de SPR en el contexto de LES, no existen estudios que evalúen la plasmaféresis en este contexto; sin embargo, se encuentran publicaciones en las que sus desenlaces se evalúan de manera separada en HAD y nefritis lúpica. En una revisión sistemática realizada por Enaldino et al. en el 20155 con 140 pacientes que presentaron HAD/LES, se encontró que el 80% tenía compromiso renal, sin aclarar la clase histológica; 43 pacientes recibieron plasmaféresis, con una supervivencia del 53% (23 pacientes), en comparación con aquellos pacientes que recibieron ciclofosfamida, grupo en el cual la supervivencia fue mayor en comparación con aquellos que no recibieron dicha terapia (71% vs. 49%)5.
En otro estudio clínico aleatorizado multicéntrico, publicado en 1992 por Lewis et al.10, que involucró a 86 pacientes, se evaluaron desenlaces en mortalidad y renales en pacientes con nefritis lúpica. De este grupo, 46 pacientes recibieron terapia estándar (prednisona+ciclofosfamida) y 40 recibieron terapia estándar+plasmaféresis. En un seguimiento de 136 semanas, no hubo diferencias estadísticamente significativas entre los dos grupos en cuanto a mortalidad (13% en grupo control y 20% en grupo intervención) y falla renal (17% en grupo control y 25% en grupo intervención).
Recientemente se publicó el estudio Pexivas11, en el que se evaluaron desenlaces de plasmaféresis en pacientes con vasculitis asociada con ANCA, aclarando que se excluyeron pacientes con LES, y los investigadores concluyeron nuevamente que no había diferencias en mortalidad, pero se demostró que un régimen de dosis bajas de corticoides no es inferior a la dosis estándar.
En conclusión, hasta el momento, la plasmaféresis no ha demostrado reducir la mortalidad en los pacientes que se presentan con nefritis lúpica o HAD, y extrapolando los datos anteriores al contexto de un SRP, hoy en día no existe evidencia que avale esta intervención en este grupo de pacientes; no obstante, es de resaltar su posible beneficio en el ahorro de corticoesteroides, grupo farmacológico asociado a un gran volumen de efectos adversos.
GlucocorticoidesEn la terapia estándar del SPR asociado con LES, además de la eliminación de anticuerpos, es fundamental el papel que desempeña el uso de glucocorticoides, los cuales se administran como coadyuvantes en la terapia inmunosupresora, en pro de un doble objetivo terapéutico: bloquear la producción de nuevos autoanticuerpos y limitar la propagación de lesiones inflamatorias en los órganos diana. De esta manera, los glucocorticoides (en combinación con la ciclofosfamida) terminan siendo uno de los pilares en el tratamiento de inducción de la remisión, durante la cual se recomienda administrar metilprednisolona en pulsos de 500-1.000mg/kg durante tres a cinco días (aunque no siempre parece necesario en el caso de inicio temprano de la plasmaféresis), seguido de prednisolona oral de 1mg/kg en dosis decrecientes durante seis a doce meses, hasta una dosis de mantenimiento de 10mg a los seis meses12.
RituximabEs un anticuerpo monoclonal quimérico, específico para la molécula proteínica transmembrana CD20, presente en linfocitos B (la mayoría de ellos) en estadios pre-B y formas maduras, ocasionando depleción transitoria y selectiva de esta subpoblación13, de aproximadamente 24 semanas, por medio de citotoxicidad dependiente de anticuerpos y mediada por complemento14. Como consecuencia, se logra la preservación de células pro-B y plasmocitos con diferenciación terminal, que no expresan CD2015. Su rol en la regulación inmune mediada por células B ha justificado el interés en los últimos años por las enfermedades sistémicas autoinmunes.
Como tratamiento en SPR, tiene evidencia sólida en vasculitis asociada con ANCA, con aprobación por la FDA (Food and Drug Administration) desde el 2011 para pacientes con diagnóstico de granulomatosis con poliangeítis y poliangeítis microscópica14. Sin embargo, en SPR mediada por inmunocomplejos, particularmente en asociación con LES, la información es escasa16, por lo que su uso se basa en extrapolación de otras condiciones clínicas.
En LES, así como en otras enfermedades reumáticas autoinmunes sistémicas diferentes de la artritis reumatoide, en las cuales los linfocitos B desempeñan un rol central en la fisiopatología17, se ha descrito su utilidad en pacientes refractarios a terapias convencionales, en espera de estudios con evidencia sólida que la consoliden como una opción terapéutica de primera línea. Se han evaluado regímenes en contexto de LES asociado con nefritis (Lunar 201218, clases III y IV) o LES complicado por otras condiciones (Explorer 201019), en las que hay compromiso específico de órgano extrarrenal: anemia hemolítica y trombocitopenia, compromiso articular, asociación con síndrome antifosfolípido y prevención en la recurrencia de eventos trombóticos14. Todos estos, en su gran mayoría, son estudios no controlados en los que se resalta el efecto de ahorrador del corticoesteroide, sin gran soporte en la superioridad con respecto a otras terapias, pero permitiéndole un espacio en las guías ACR y Eular como recomendación en casos refractarios17.
En nefritis lúpica, en el 2005, Sfikakis et al.20 pusieron en evidencia, en un grupo de 10 pacientes con NL proliferativa activa, que ocho de ellos alcanzaban metas de remisión parcial con una media de dos meses, en tanto que cinco lograban remisión completa en tres meses, que se sostenía en un tiempo de un año en cuatro pacientes, asociado con glucocorticoides. Resultados menos prometedores, pero en los que no se describe inferioridad, se han observado en terapias junto con ciclofosfamida o micofenolato mofetil; no obstante, el régimen de dosis óptima, la frecuencia de retratamiento y la combinación con otros inmunosupresores siguen siendo desconocidos15.
Por otro lado, la HAD asociada con LES es una rara manifestación de la enfermedad que se caracteriza por altas tasas de mortalidad, a pesar incluso de múltiples terapias que incluyen pulsos de corticoesteroides, ciclofosfamida y plasmaféresis, las cuales además implican riesgo de un amplio número de eventos adversos21. En este contexto, el uso de rituximab se ha evaluado solamente en publicaciones de reportes de caso aislados o pequeñas series, en las que tiene lugar luego de una respuesta pobre a la ciclofosfamida o si ocurre recaída. No obstante, su inicio como monoterapia en primera línea probablemente se asocie con desenlaces favorables, a partir de reportes en los que el paciente presenta intolerancia o potencial toxicidad, sobre todo en la pancitopenia y la falla gonadal22.
No existen recomendaciones estandarizadas sobre el uso del rituximab en relación con el efecto que genera en la susceptibilidad a infecciones y la modulación del sistema inmunológico (permanente o transitoria). Por ello, en el 2020 el Programa de Educación de la Sociedad Americana de Hematología propuso: (i) evaluar el estado de inmunización y vacunar frente a microorganismos capsulados; (ii) evaluar la infección por hepatitis B con antígeno de superficie (AgsHB) y anticuerpos contra el núcleo (anti-HBc); (iii) documentar niveles de inmunoglobulinas y subconjuntos de células B, con seguimiento regular (en promedio cada seis meses)23. Las anteriores recomendaciones surgen en el contexto del uso de rituximab en trastornos hematológicas no malignos (tablas 1 y 2).
Medicamentos y dosis de inducción5,10,12,17
| Medicamentos en inducción | |
|---|---|
| Metilprednisolona | 500-1.000mg/d por 3 a 5 días. Pasar en 30 minutos |
| Ciclofosfamida | 15mg/kg/pulso (reducir en >60 años y enfermedad renal)- Intravenoso 0,5 a 1g/m2 mensual por 6 a 9 dosis- Oral 1-2mg/kg/dMESNA: 20% de la dosis de CYC en horas 0, 4 y 8 (total de 60% de CYC) |
| Rituximab | - 375mg/m2/sem por 4 semanas- 1.000mg IV semana 0 y 2 |
| Plasmaféresis | 60ml/kg cada sesión (total 3 a 5 sesiones) |
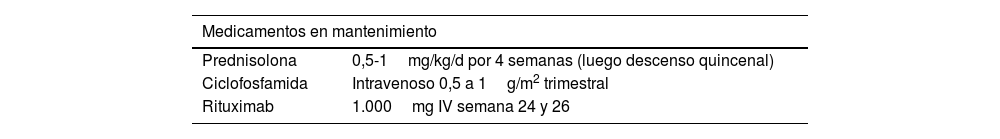
Medicamentos y dosis de mantenimiento5,10,12,17
| Medicamentos en mantenimiento | |
|---|---|
| Prednisolona | 0,5-1mg/kg/d por 4 semanas (luego descenso quincenal) |
| Ciclofosfamida | Intravenoso 0,5 a 1g/m2 trimestral |
| Rituximab | 1.000mg IV semana 24 y 26 |
De acuerdo con la revisión actual, no existen estudios clínicos aleatorizados sobre la evaluación de desenlaces renales y de mortalidad en el contexto de un SPR relacionado con LES, que es una patología de baja prevalencia pero con una alta tasa de morbilidad y un desenlace fatal. A pesar de ello, la evidencia extraída de estudios en HAD y nefritis lúpica como manifestaciones independientes de la actividad del LES parece favorecer a la ciclofosfamida como terapia de inducción, debido al impacto evidenciado en mortalidad y los desenlaces organoespecíficos, particularmente en su asociación con pulsos de corticoesteroide.
Otras terapias, como el rituximab, carecen de evidencia clínica y su utilización se basa en reportes y series de casos en los que aparentemente podría conllevar desenlaces similares a los observados con ciclofosfamida, resaltando su mejor perfil de seguridad. La baja prevalencia de esta condición limita la reproducción en estudios clínicos aleatorizados y por ello se la considera una terapia de segunda línea en relación con refractariedad o recaída, así como en caso de contraindicaciones para uso de ciclofosfamida. Esto pone en evidencia la necesidad de profundizar en investigaciones que en un futuro próximo permitan evaluar la eficacia y los desenlaces para este anticuerpo monoclonal.
Con respecto a la plasmaféresis, hasta el momento no existe evidencia que justifique su uso en el escenario de LES, dado que los estudios disponibles a la fecha para el manejo de nefritis lúpica no han mostrado resultados que impacten en mortalidad ni desenlaces organoespecíficos, y aunque parece que puede ser útil como método de ahorro de esteroides, esta evidencia solo es aplicable en las vasculitis asociadas con ANCA.
ConclusionesEs de vital importancia diagnosticar oportunamente el curso clínico del SPR en los pacientes con LES, considerando que esta patología es una verdadera emergencia para el médico tratante. Una vez identificada la sospecha diagnóstica, se debe garantizar sin retraso el inicio del tratamiento, eligiendo la estrategia terapéutica menos mórbida y con mayor o igual impacto en mortalidad que permita reducir el riesgo de progresión a insuficiencia respiratoria aguda grave y/o falla renal, e incluso la muerte. Así mismo, es importante conocer el manejo de las complicaciones que se pueden generar, debido a los efectos adversos a los que se enfrenta el paciente y que previamente a su administración deben serle informados con detalle.
Las tasas de remisión de la enfermedad son mayores del 90% con los protocolos actuales y existen terapias efectivas de segunda línea para aquellos casos que no la alcanzan. El tratamiento universal del SPR relacionado con LES incluye el uso de corticoides intravenosos en dosis altas. En un 55% ha sido usada la ciclofosfamida intravenosa y en un 31% la plasmaféresis. El hecho de que la ciclofosfamida se considere el tratamiento de primera línea parece estar asociado con una mayor supervivencia, mientras que la plasmaféresis no parece influir en su resultado; por el momento, debe considerarse como terapia de elección, en espera de evidencia que soporte con mayor peso la implementación de otras terapias prometedoras, asociadas aparentemente con un menor riesgo de eventos adversos.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener conflicto de intereses para la preparación y el envío del presente artículo.