Determinar los factores de riesgo y la asociación entre el índice de masa corporal (IMC) y enfermedad pulmonar intersticial difusa (EPID) en pacientes con esclerosis sistémica.
MétodosEstudio transversal, correlacional, con muestra no probabilística constituida por pacientes consecutivos con esclerosis sistémica que acudieron al Servicio de Reumatología del Hospital Universitario de Caracas durante el período abril-septiembre de 2018. Se realizó evaluación clínica, paraclínica, mediciones antropométricas, pruebas de función pulmonar y tomografía de tórax de alta resolución.
ResultadosDe 48 pacientes, el 95,8% fueron del sexo femenino, con mayor prevalencia de esclerosis sistémica limitada (64,6%). Un peso bajo (IMC<18,5 kg/m2) fue un factor de riesgo de EPID (OR 4,60; IC 95% 1,12-18,86). El IMC se relacionó de forma directamente proporcional con la capacidad vital forzada sin alcanzar significación estadística (CC 0,23; p=0,1180), sin embargo, otros predictores de EPID fueron: la esclerosis sistémica difusa (OR 6,91; IC 95% 1,78-26,85), el índice modificado de Rodnan (mRSS) (OR 1,25; IC 95% 1,04-1,30) y el patrón moteado de anticuerpos antinucleares (OR 5,62; IC 95% 1,33-23,62). El análisis multivariado demostró asociación independiente con EPID de: mRSS (OR 1,34; IC 95% 1,04-1,72) y el patrón moteado de anticuerpos antinucleares (OR 25,99; IC 95% 1,02-16,02). El estudio del IMC durante 10 años (2008-2018) reveló una pérdida de 14,3% (p=0,0021), que fue mayor en comparación con pacientes con artritis reumatoide (p=0,0000), lupus eritematoso sistémico (p=0,0025) e individuos sanos (p=0,0331).
ConclusiónEl IMC y la EPID se correlacionan de forma inversamente proporcional. La edad, un bajo peso corporal, un puntaje alto en mRSS y el patrón moteado de anticuerpos antinucleares fueron factores de riesgo para el desarrollo de EPID en pacientes con esclerosis sistémica. El mRSS podría ser utilizado como herramienta clínica predictiva de EPID en esclerosis sistémica.
To determine the risk factors and the potential relationship between body mass index (BMI) and the development of interstitial lung disease (ILD) in patients with systemic sclerosis.
MethodsA cross-sectional, correlational, study with a non-probabilistic sample was conducted on consecutive patients with scleroderma seen in the Rheumatology Division at Hospital Universitario de Caracas during the period April to September 2018. Patients underwent clinical and laboratory assessments, anthropometric measurements, pulmonary function tests, and high-resolution computed axial tomography scan of the chest.
ResultsOf 48 patients, 95.8% were female, with a high prevalence of limited cutaneous systemic sclerosis (lcSSc) (64.6%). Underweight (BMI <18.5kg/m2) was a risk factor for the development of ILD (OR 4.60; 95% CI 1.12-18.86). There was directly proportional relationship between BMI and forced vital capacity, with no statistical significance (CC 0.23; P=.1180). However, other predictors of ILD included diffuse systemic sclerosis (OR 6.91, 95% CI; 1.78-26.85), modified Rodnan Skin Score (mRSS) (OR 1.25; 95% CI; 1.04-1.30), and a speckled pattern of antinuclear antibody (OR 5.62; 95% CI; 1.33-23.62). Multivariate analysis showed that mRSS (OR 1.34; 95% CI; 1.04-1.72) and the presence of a speckled antinuclear antibody (OR 25.99; 95% CI; 1.02-16.02) were independent predictors of ILD. The percentage of BMI lost in a period of time of 2008-2018 was 14.3% (P=.0021), which was higher than rheumatoid arthritis (P=.0000), systemic lupus erythematosus (P=.0025), and healthy patients (P=.0331).
ConclusionBMI and ILD are inversely correlated. Age, underweight, higher mRSS, and speckled pattern of antinuclear antibody were risk factors for development of ILD in patients with systemic sclerosis. The mRSS could be used as a clinical predictive tool for ILD in systemic sclerosis.
La esclerosis sistémica es una enfermedad inflamatoria autoinmune sistémica, caracterizada por fibrosis en piel y órganos que puede conducir a diversos niveles de gravedad en sistemas como el tracto digestivo, pulmonar, cardíaco y renal. Si bien el sello clínico característico es la fibrosis de piel, es el daño de órganos vitales lo que disminuye la expectativa y calidad de vida de los pacientes1,2. El compromiso pulmonar en esclerosis sistémica puede alcanzar hasta el 80% de los casos y es uno de los principales componentes de morbimortalidad en esta enfermedad3,4.
La patogenia del proceso fibrótico es aún objeto de estudio. Investigaciones recientes resaltan el papel del adipocito y su sustitución por miofibroblastos en modelos múridos experimentales de esclerosis sistémica5–8. Estos estudios señalan al miofibroblasto como el principal inductor fibrogénico al promover una excesiva acumulación de colágeno fibrilar y otras proteínas de matriz extracelular en la dermis. Su origen en el tejido fibrótico podría explicarse por un proceso denominado transición adipocito-miofibroblasto, observado en el modelo múrido de esclerosis sistémica inducido por bleomicina, en el cual adipocitos identificados con un fluorocromo como marcador sufrieron un proceso de diferenciación hacia miofibroblastos cuando estuvieron bajo la influencia del factor de crecimiento transformante β (TGF-β). Los adipocitos perdieron sus características fenotípicas y adquirieron las de fibroblasto, conservando el marcador tras culminar la transición8. Este proceso es favorecido, además, por la pérdida de las propiedades reparadoras y protectoras que ejerce el tejido adiposo sobre la dermis9,10.
La fibrosis pulmonar es una de las principales causas de morbimortalidad en esclerosis sistémica11–13. Esta alteración de la arquitectura del parénquima pulmonar en esclerosis sistémica corresponde a una enfermedad pulmonar intersticial difusa (EPID) y puede estar presente hasta en 80-90% de los pacientes1,3. Algunos estudios de fibrosis pulmonar en modelos múridos también muestran un cambio en el fenotipo de los fibroblastos pulmonares de lipogénico a miogénico durante el proceso de fibrosis14,15. En este proceso está implicado un tipo de fibroblasto identificado en el parénquima pulmonar de roedores denominado lipofibroblasto pulmonar, el cual es responsable de la maduración alveolar y producción del surfactante pulmonar, y que bajo los efectos de mediadores profibróticos como el TGF-β se diferencian hacia miofibroblastos14,16. Este proceso es reversible mediante la acción del receptor activado proliferador del peroxisoma γ (PPARγ, por sus siglas en inglés), el factor responsable de la diferenciación de los adipocitos.
El tejido adiposo blanco dérmico (dWAT, por sus siglas en inglés) es un tejido adiposo particular que se encuentra en la piel; se distingue del tejido adiposo subcutáneo y su pérdida es característica de la esclerosis sistémica en humanos y en modelos múridos experimentales9,17,18. El dWAT posee propiedades reparadoras, renovadoras y angiogénicas sobre la dermis y su depleción precede al inicio de la activación del fibroblasto y su diferenciación a miofibroblasto. Una dieta rica en grasa o la estimulación con PPARγ son responsables de la proliferación de esta fracción del tejido adiposo18,19. En efecto, la regulación negativa de la vía del PPARγ está relacionada con una aceleración de la fibrogénesis y una mayor puntuación en el índice modificado de Rodnan, una herramienta clínica que permite estimar el grado de fibrosis dérmica en esclerosis sistémica20.
La pérdida de peso es un importante predictor de salud y enfermedad en la población general. La prevalencia de desnutrición en pacientes con esclerosis sistémica varía del 15% al 55,7% de los casos21,22 y entre sus causas están implicadas no solo alteraciones en la absorción intestinal, sino también la afección musculoesquelética y los trastornos del humor que disminuyen la motivación para la alimentación. A su vez, los estudios sobre la relación entre índice de masa corporal (IMC) y el desarrollo de neumopatía señalan que un óptimo estado nutricional beneficia el sistema respiratorio y determina un buen pronóstico en el postoperatorio de los pacientes sometidos a trasplante pulmonar23,24. Asimismo, se ha determinado una relación causal entre un IMC bajo y el incremento de mortalidad de causa respiratoria en enfermedades inflamatorias e infecciosas24–26.
La alteración de la homeostasis del tejido adiposo en esclerosis sistémica se traduce en disminución de la masa grasa tegumentaria y aparición de fibrosis pulmonar, que clínicamente se manifiesta con pérdida de peso y síntomas respiratorios, respectivamente. Se desconoce si la reducción del IMC observada en estos pacientes está relacionada con pérdida de masa grasa y esta a su vez con un aumento en la diferenciación de los lipofibroblastos pulmonares hacia miofibroblastos, lo cual podría contribuir al desarrollo de EPID en la esclerosis sistémica.
De acuerdo con datos obtenidos del registro del Centro Nacional de Enfermedades Reumáticas, en Venezuela, se ha estimado la incidencia anual de esclerosis sistémica en un caso por millón de habitantes (datos no publicados). Estos datos podrían subestimar la incidencia real de la enfermedad en nuestro país ya que están basados en datos obtenidos por un solo centro.
Se sabe que hasta un 90% de los pacientes con esclerosis sistémica presentan cambios intersticiales pulmonares de distinto grado, y en un 40 a 75% de ellos se manifiesta con alteraciones en las pruebas de función pulmonar3. Siendo la esclerosis sistémica una enfermedad autoinmune multisistémica que causa EPID con alta frecuencia y a la vez afecta el peso corporal del paciente en proporción directa a la gravedad de la enfermedad, se hace evidente la importancia de estudiar esta posible asociación. Sobre la base de estas consideraciones se plantea el siguiente interrogante: ¿existe una relación entre el IMC y la presencia de EPID en pacientes con esclerosis sistémica?
Para dar respuesta a este interrogante se realizó un trabajo de investigación en pacientes con esclerosis sistémica atendidos en el Servicio de Reumatología del Hospital Clínico Universitario de Caracas, durante el periodo comprendido entre abril y septiembre del 2018.
MétodosSe realizó un estudio de investigación de corte transversal y correlacional. La población estuvo constituida por pacientes con diagnóstico de esclerosis sistémica que acudieron a la consulta externa del Servicio de Reumatología del Hospital Universitario de Caracas entre abril y septiembre de 2018. La muestra fue no probabilística y circunstancial, y se aplicaron los siguientes criterios de inclusión: pacientes con diagnóstico de esclerosis sistémica según los criterios de clasificación del Colegio Americano de Reumatología y de la Liga Europea contra el Reumatismo de 2013, mayores de 18 años, de ambos géneros y que hayan firmado un consentimiento informado. Se excluyeron pacientes con superposición de otras enfermedades autoinmunes, pacientes con alguna de las siguientes enfermedades pulmonares crónicas preexistente: enfisema, asma, enfermedad pulmonar obstructiva crónica, neumoconiosis y sarcoidosis; pacientes con alguna de las siguientes condiciones endocrinas coexistentes: hipertirodismo, hipotirodismo, hipoadrenalismo y diabetes mellitus, y pacientes con patologías oncológicas.
Se realizó una evaluación demográfica y clínica, donde se obtuvieron datos socioeconómicos, examen físico, índices antropométricos, pruebas de función pulmonar, tomografía axial computarizada de alta resolución (TACAR) de tórax y perfil de autoanticuerpos. Los pacientes fueron evaluados por un reumatólogo quien procedió a llenar la ficha de recolección de datos con información socioeconómica, características clínicas de la enfermedad, antropometría y paraclínicos.
Registro de medidas corporales. Se realizó una revisión de las historias clínicas de cada paciente para determinar la evolución del peso, talla e IMC desde el ingreso a la consulta externa del Servicio de Reumatología hasta el momento de la realización del estudio. Para la medición del peso actual se utilizó un estadímetro estándar.
Evaluación del índice modificado de Rodnan(modified Rodnan Skin Score[mRSS]). Se realizó durante el examen físico de los pacientes. Dos reumatólogos con entrenamiento evaluaron los pacientes empleando el mRSS en un cuarto con iluminación adecuada y temperatura controlada. Se evaluó el grosor de piel de 17 áreas corporales distribuidas en cara, tronco y extremidades, mediante la formación de un pliegue cutáneo usando el pulgar e índice. Según los hallazgos se asignó la siguiente puntuación: 0=sin engrosamiento, 1=engrosamiento leve, 2=engrosamiento moderado y 3=engrosamiento severo con incapacidad de formar un pliegue cutáneo20. La evaluación de cada paciente fue recolectada en una ficha de registro y mediante la suma de los puntajes obtenidos en cada área corporal se obtuvo la puntuación total.
Investigación de enfermedad pulmonar. Se realizó mediante el nivel de la capacidad vital forzada (CVF) medida por espirometría, la caminata de 6 min (C6M) y la TACAR de tórax. La espirometría se realizó en un ambiente con temperatura controlada, con un equipo calibrado y sensores ajustados. El paciente fue informado del procedimiento y se indicó evitar la actividad física intensa y no haber fumado antes de la realización de la prueba. El paciente se ubicó en una silla fija con soporte para brazos, sentado, con tronco erguido y la cabeza ligeramente elevada; se utilizaron una boquilla y pinza nasal. Se indicó que realice una inhalación máxima seguida de una exhalación con inicio explosivo y sostenido. Los valores obtenidos fueron registrados en la ficha de recolección de datos.
La C6M se realizó en un área libre de obstáculos con superficie plana delimitada con marcas de inicio y final de una distancia de 30 metros. El paciente acudió en ropa adecuada para ejercicio físico y sin haber realizado alguna actividad física vigorosa 2 h previas a la prueba. Se registró el peso y talla del paciente, valores basales de presión arterial y frecuencia cardíaca en reposo. Se utilizó un cronómetro programado para 6 min, tiempo durante el cual el paciente caminó con opción a detenerse durante el trayecto, si era necesario, para descansar. Las indicaciones para interrumpir la prueba fueron: dolor torácico, disnea intolerable, sudoración, palidez, parestesias, oximetría de pulso menor a 80% o que el paciente lo solicitara. Al completar los 6 min se registró el número de vueltas y metros recorridos27. El valor de referencia para la C6M en pacientes con esclerosis sistémica se estima entre 465 y 480 metros28. Un valor menor a 465 metros se interpretó como prueba alterada. La prueba se realizó en el laboratorio del Servicio de Neumonología del Hospital Universitario de Caracas.
Grupo control. Mediante la historia clínica se registró de forma retrospectiva el IMC de pacientes con enfermedad autoinmune y un grupo control sano. Se conformaron 3 grupos: el primer grupo compuesto por individuos sanos emparejados según edad, sexo y entorno familiar, el segundo grupo conformado por pacientes con lupus eritematoso sistémico (LES) y el tercer grupo integrado por pacientes con artritis reumatoide (AR).
El estudio cumplió con los lineamientos de la Declaración de Helsinki y la aprobación del Comité de Ética del Hospital Universitario de Caracas. Previa inclusión de los pacientes en el estudio se les informó sobre los objetivos del mismo, así como su carácter no intervencionista y no perjudicial, habiéndoseles solicitado la firma de su consentimiento informado previamente.
Análisis estadístico. Se calculó el promedio y la desviación estándar de las variables continuas. Para las variables nominales se calculó la frecuencia y porcentaje. Se empleó la prueba de t de Student para comparar variables cuantitativas con distribución normal y U de Mann-Whitney cuando no mostraron una distribución normal. Las variables categóricas se compararon con la prueba Chi cuadrado o Fisher. Para la comparación de las medias de variables ordinales se empleó análisis de varianza (ANOVA). Las variables dependientes fueron la CVF, medida por espirometría, el valor de la C6M y la TACAR de tórax. La variable independiente fue el IMC. Se tomaron en cuenta las siguientes covariables: edad, género, edad de inicio de la enfermedad, duración de enfermedad, tabaquismo, nivel educativo, estrato socioeconómico, subtipo de esclerosis sistémica, puntuación del mRSS y presencia de anti-Scl70. Mediante análisis de regresión logística univariado se calcularon los odds ratio de las variables independientes. A continuación, se realizó un análisis de regresión logística multivariado de las variables independientes con significación estadística predeterminada empleando la técnica de regresión paso a paso hacia atrás. Se consideró un p valor <0,05 como significativo.
Se determinó la variabilidad interobservador de 2 reumatólogos entrenados que realizaron el cálculo de la puntuación del mRSS, mediante el coeficiente kappa de Cohen (fuerza de la concordancia), el cual se consideró como débil (<0,40), moderado (0,40 – 0,60), bueno (0,60 – 0,80) o excelente (0,80 – 1). Para el análisis estadístico se empleó el software estadístico Stata 12.0 para Windows (StataCorp LP, TX, EE. UU.).
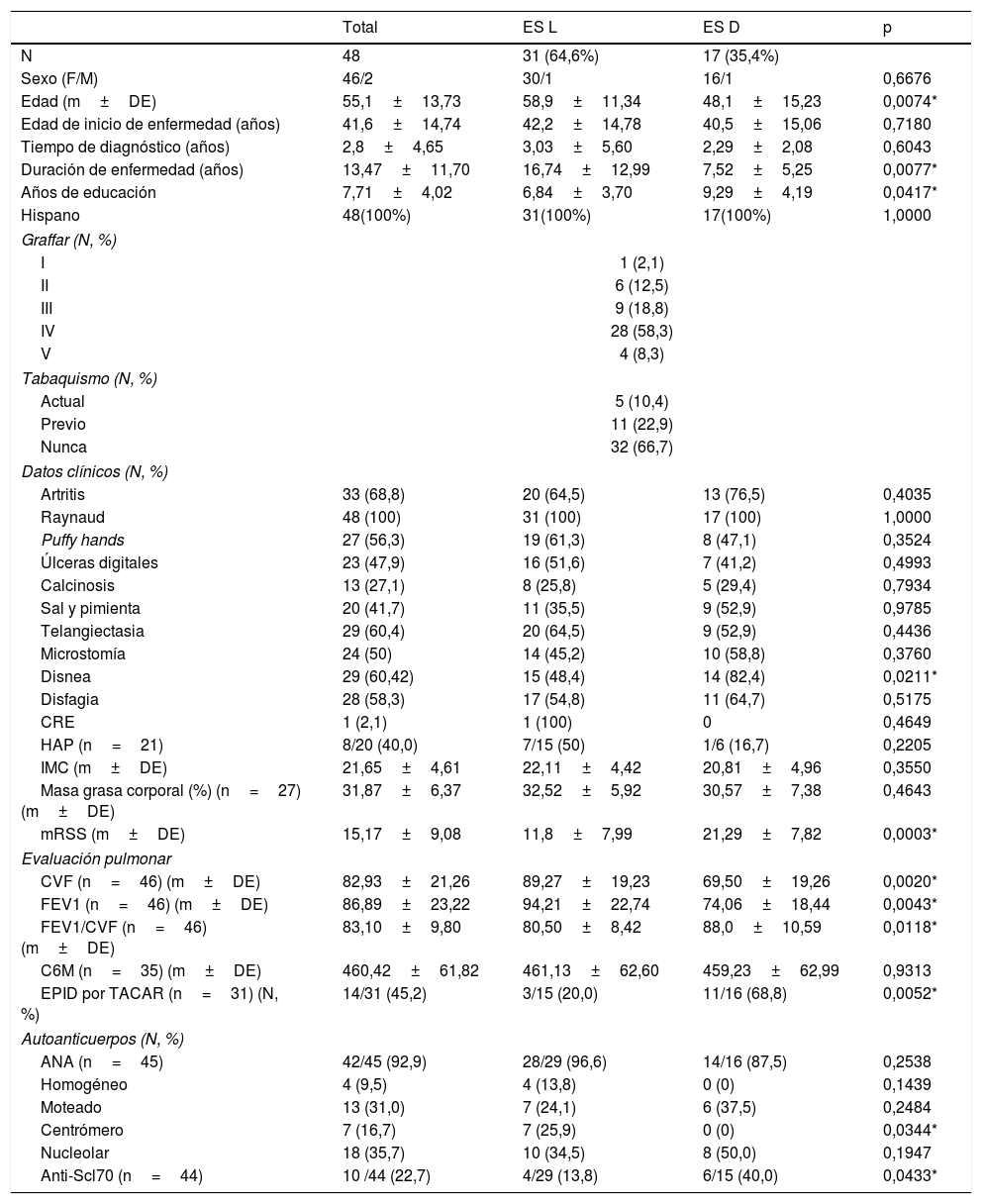
ResultadosHallazgos demográficos y clínicosSe evaluaron 48 pacientes con esclerosis sistémica de los cuales 46 (95,8%) fueron del sexo femenino. La edad promedio fue de 55,1±13,73 años y todos fueron de raza hispana. El subtipo de esclerosis sistémica más prevalente fue el cutáneo limitado (64,6%), con respecto al difuso (35,4%). La media de duración de enfermedad fue de 13,47±11,70 años, siendo significativamente mayor en el grupo limitado (16,74±12,99 vs. 7,52±5,25; p=0,0077). Con respecto al nivel educativo medido en años de educación se registró una media de 7,71±4,02 años, presentando los pacientes con esclerosis sistémica limitada menor tiempo de educación, siendo esa diferencia estadísticamente significativa: 6,84±3,70 vs. 9,29±4,19 (p=0,0417). Al evaluar los pacientes mediante la escala Graffar se constató que el estrato socioeconómico predominante fue el IV (58,3%), seguido del III (18,8%), II (12,5%), V (8,3%) y I (2,1%). Treinta y dos (66,7%) pacientes negaron hábitos tabáquicos, mientras que 11 (22,9%) refirieron tener antecedentes de tabaquismo previo y finalmente 5 (10,4%) eran fumadores al momento del estudio (tabla 1).
Características clínicas y demográficas de los pacientes con esclerosis sistémica
| Total | ES L | ES D | p | |
|---|---|---|---|---|
| N | 48 | 31 (64,6%) | 17 (35,4%) | |
| Sexo (F/M) | 46/2 | 30/1 | 16/1 | 0,6676 |
| Edad (m±DE) | 55,1±13,73 | 58,9±11,34 | 48,1±15,23 | 0,0074* |
| Edad de inicio de enfermedad (años) | 41,6±14,74 | 42,2±14,78 | 40,5±15,06 | 0,7180 |
| Tiempo de diagnóstico (años) | 2,8±4,65 | 3,03±5,60 | 2,29±2,08 | 0,6043 |
| Duración de enfermedad (años) | 13,47±11,70 | 16,74±12,99 | 7,52±5,25 | 0,0077* |
| Años de educación | 7,71±4,02 | 6,84±3,70 | 9,29±4,19 | 0,0417* |
| Hispano | 48(100%) | 31(100%) | 17(100%) | 1,0000 |
| Graffar (N, %) | ||||
| I | 1 (2,1) | |||
| II | 6 (12,5) | |||
| III | 9 (18,8) | |||
| IV | 28 (58,3) | |||
| V | 4 (8,3) | |||
| Tabaquismo (N, %) | ||||
| Actual | 5 (10,4) | |||
| Previo | 11 (22,9) | |||
| Nunca | 32 (66,7) | |||
| Datos clínicos (N, %) | ||||
| Artritis | 33 (68,8) | 20 (64,5) | 13 (76,5) | 0,4035 |
| Raynaud | 48 (100) | 31 (100) | 17 (100) | 1,0000 |
| Puffy hands | 27 (56,3) | 19 (61,3) | 8 (47,1) | 0,3524 |
| Úlceras digitales | 23 (47,9) | 16 (51,6) | 7 (41,2) | 0,4993 |
| Calcinosis | 13 (27,1) | 8 (25,8) | 5 (29,4) | 0,7934 |
| Sal y pimienta | 20 (41,7) | 11 (35,5) | 9 (52,9) | 0,9785 |
| Telangiectasia | 29 (60,4) | 20 (64,5) | 9 (52,9) | 0,4436 |
| Microstomía | 24 (50) | 14 (45,2) | 10 (58,8) | 0,3760 |
| Disnea | 29 (60,42) | 15 (48,4) | 14 (82,4) | 0,0211* |
| Disfagia | 28 (58,3) | 17 (54,8) | 11 (64,7) | 0,5175 |
| CRE | 1 (2,1) | 1 (100) | 0 | 0,4649 |
| HAP (n=21) | 8/20 (40,0) | 7/15 (50) | 1/6 (16,7) | 0,2205 |
| IMC (m±DE) | 21,65±4,61 | 22,11±4,42 | 20,81±4,96 | 0,3550 |
| Masa grasa corporal (%) (n=27)(m±DE) | 31,87±6,37 | 32,52±5,92 | 30,57±7,38 | 0,4643 |
| mRSS (m±DE) | 15,17±9,08 | 11,8±7,99 | 21,29±7,82 | 0,0003* |
| Evaluación pulmonar | ||||
| CVF (n=46) (m±DE) | 82,93±21,26 | 89,27±19,23 | 69,50±19,26 | 0,0020* |
| FEV1 (n=46) (m±DE) | 86,89±23,22 | 94,21±22,74 | 74,06±18,44 | 0,0043* |
| FEV1/CVF (n=46) (m±DE) | 83,10±9,80 | 80,50±8,42 | 88,0±10,59 | 0,0118* |
| C6M (n=35) (m±DE) | 460,42±61,82 | 461,13±62,60 | 459,23±62,99 | 0,9313 |
| EPID por TACAR (n=31) (N, %) | 14/31 (45,2) | 3/15 (20,0) | 11/16 (68,8) | 0,0052* |
| Autoanticuerpos (N, %) | ||||
| ANA (n=45) | 42/45 (92,9) | 28/29 (96,6) | 14/16 (87,5) | 0,2538 |
| Homogéneo | 4 (9,5) | 4 (13,8) | 0 (0) | 0,1439 |
| Moteado | 13 (31,0) | 7 (24,1) | 6 (37,5) | 0,2484 |
| Centrómero | 7 (16,7) | 7 (25,9) | 0 (0) | 0,0344* |
| Nucleolar | 18 (35,7) | 10 (34,5) | 8 (50,0) | 0,1947 |
| Anti-Scl70 (n=44) | 10 /44 (22,7) | 4/29 (13,8) | 6/15 (40,0) | 0,0433* |
Datos presentados en media (± desviación estándar). Para la determinación de diferencias estadísticas entre los grupos se empleó t de Student y Chi cuadrado según corresponda.
ANA: anticuerpos antinucleares detectados por inmunofluorescencia indirecta con sustrato celular HEp-2; Anti-Scl70: anticuerpo antitopoisomerasa por enzimoinmunoanálisis; CRE: crisis renal esclerodérmica; CVF: capacidad vital forzada; C6M: caminata de seis minutos; EPID: enfermedad pulmonar intersticial difusa; ES D: esclerosis sistémica difusa; ES L: esclerosis sistémica limitada; FEV1: volumen espiratorio forzado en el primer segundo; HAP: hipertensión arterial pulmonar; IMC: índice de masa corporal; mRSS: modified Rodnan Skin Score; TACAR: tomografía axial computarizada de alta resolución.
En cuanto al grado de fibrosis de piel, calculado mediante el mRSS, se reveló una media de 15,17±9,08 puntos, con mayor severidad en pacientes con escleroderma difusa: 21,29±7,82 vs. 11,8±7,99, con diferencia estadística significativa (p=0,0003). La variabilidad interobservador del mRSS entre los 2 reumatólogos que evaluaron los pacientes con esclerosis sistémica, se calculó mediante el coeficiente de Kappa que reportó un valor de 0,64 (concordancia buena). El fenómeno de Raynaud estuvo presente en 100% de los pacientes de ambos grupos de esclerosis sistémica. Los signos clínicos más frecuentes en esclerosis sistémica limitada fueron: artritis (64,5%), telangiectasia (64,5%) y edema de manos (puffy hands) (61,3%), mientras que en la esclerosis sistémica difusa predominaron los siguientes: disnea (82,4%), artritis (76,5%) y disfagia (64,7%). La disnea mostró diferencia estadística entre los subtipos de esclerosis sistémica (p=0,0211) (tabla 1).
Los anticuerpos antinucleares (ANA) estuvieron presentes en el 92,9% de los pacientes. Se observó la presencia de anticuerpos antitopoisomerasa I (anti-Scl70) en 22,7% del total de la muestra, 40% en el grupo de esclerosis sistémica difusa y 13,8% en el de escleroderma limitada con significación estadística (p=0,0433). Los anticuerpos anticentrómeros se detectaron en el 16,7% de los pacientes, los cuales en su totalidad pertenecieron al fenotipo limitado, con diferencia estadística significativa con respecto al difuso (p=0,0344) (tabla 1).
Los resultados de la espirometría en la muestra total de pacientes fueron: CVF, 82,93%±21,26 del valor promedio y FEV1: 86,89%±23,22 del valor promedio, respectivamente. Los pacientes con esclerosis sistémica difusa registraron menores niveles de CVF (69,50±19,26 vs. 89,27±19,23) y de FEV1 (74,06±18,44 vs. 94,21±22,74) que los pacientes con escleroderma limitada, observándose una diferencia significativa para ambos parámetros entre los 2 subgrupos (p=0,0020 y p=0,0043, respectivamente). La C6M registró una media de 460,42±61,82 metros. Los pacientes con esclerosis sistémica difusa alcanzaron menos metros recorridos en la C6M (459,23±62,99) en comparación con el grupo de esclerosis sistémica limitada (461,13±62,60), sin embargo, no se registró una diferencia significativa entre ambos. De acuerdo con la evaluación por TACAR de tórax realizada en 31 pacientes, un 45,2% presentaron EPID. De éstos, 11 pacientes pertenecían al grupo de esclerodermia difusa y 3 pacientes al grupo de esclerodermia limitada, lo que representa un 68,8% y 20,0% de cada grupo respectivamente, presentando una diferencia estadísticamente significativa (p=0,0052) (tabla 1).
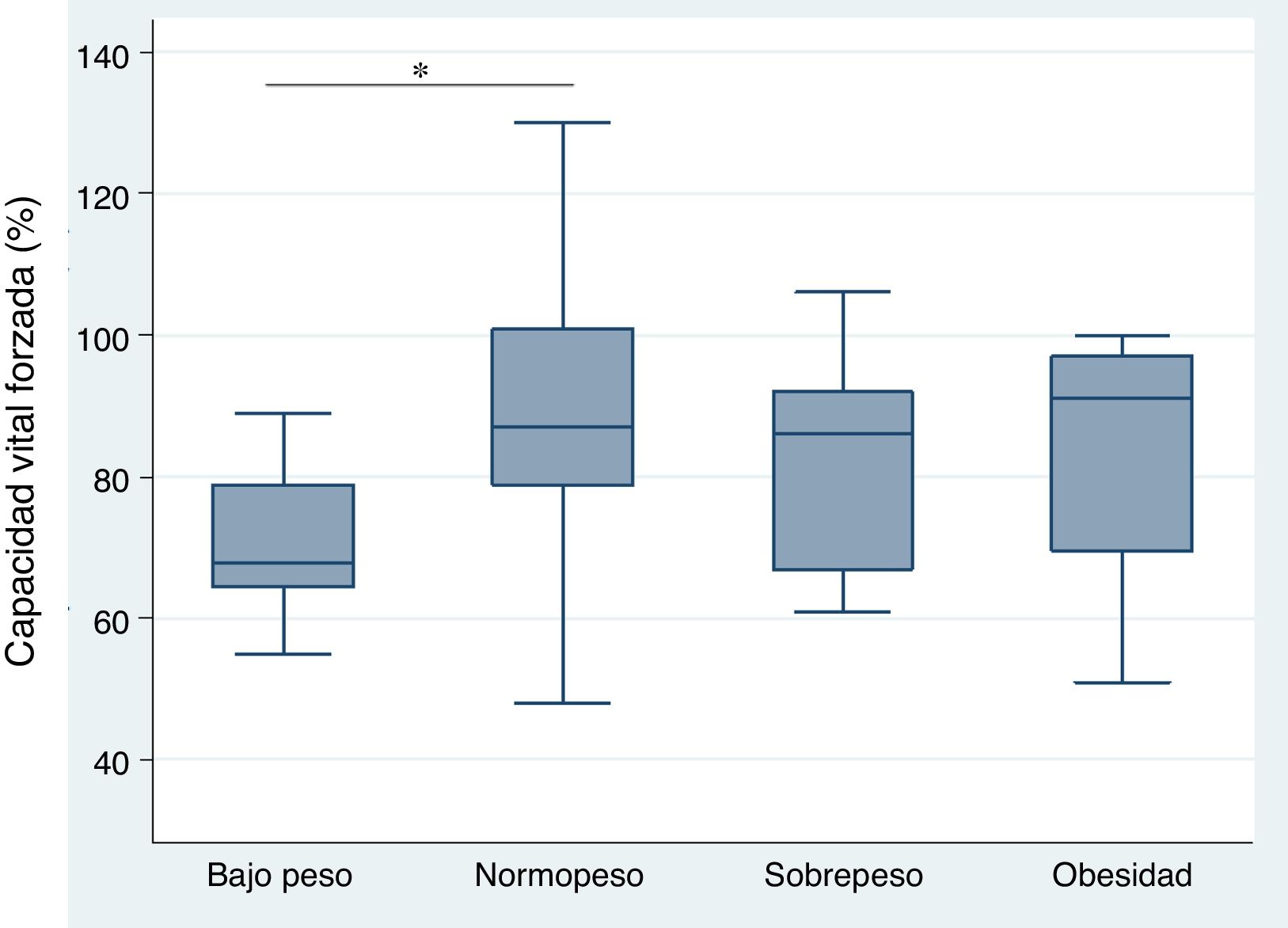
La media del IMC en esclerosis sistémica fue de 21,65±4,61 kg/m2, siendo menor en el subtipo difuso (20,81±4,96 vs. 22,11±4,42) sin registrar diferencia significativa entre los 2 subgrupos (tabla 1). En cuanto al estatus nutricional según el IMC por criterios de la Organización Mundial de la Salud (OMS), un 25% de los pacientes presentaron bajo peso, 56,3% tuvieron peso óptimo, 10,4% se encontraron con sobrepeso y 8,3% reportaron obesidad. El peso bajo se observó en un 16,7% de pacientes con esclerosis sistémica difusa y en 8,33% en el subtipo limitado, con significación estadística (p=0,0082).
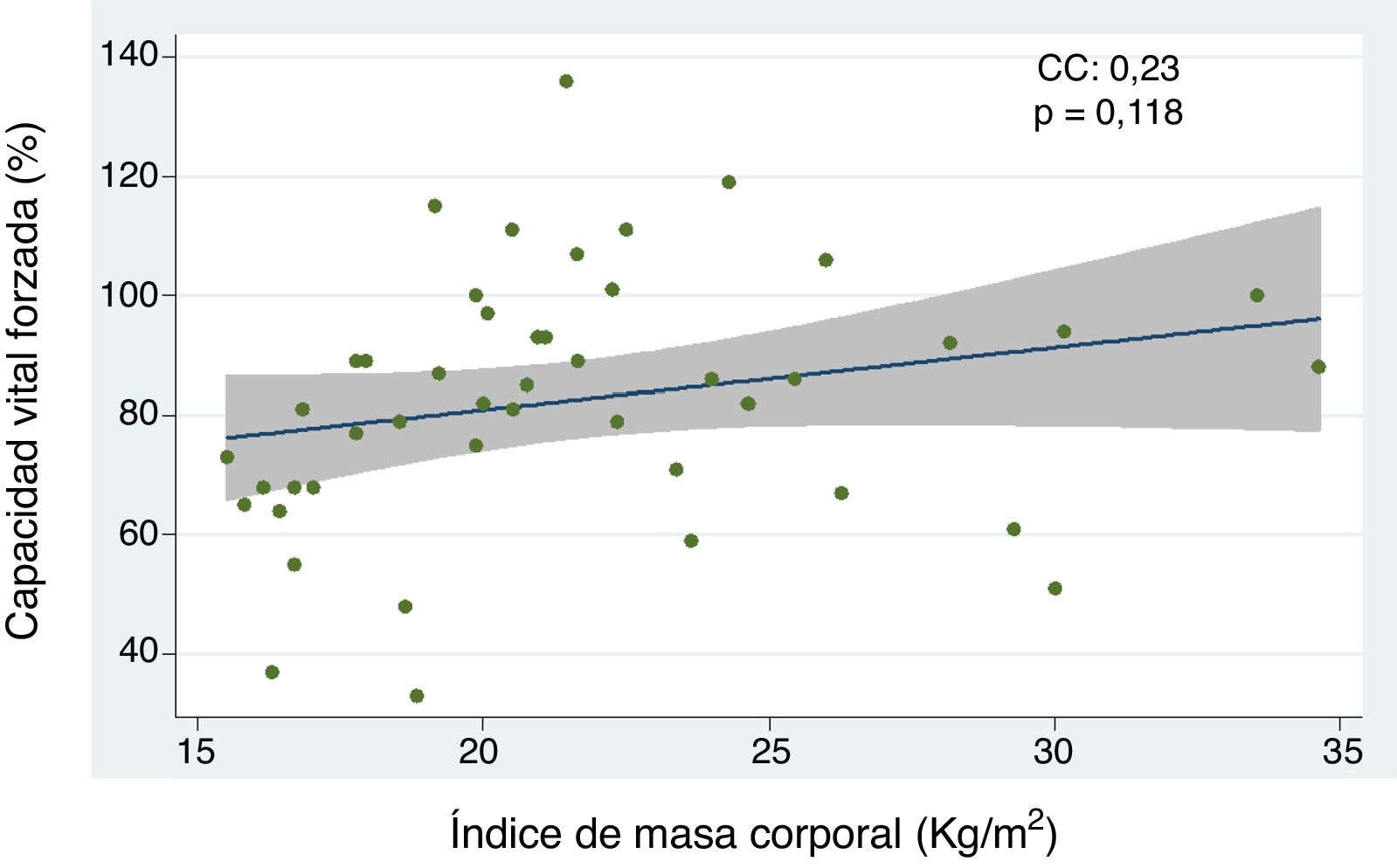
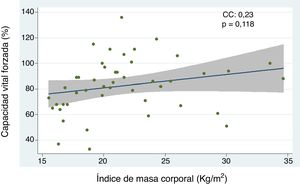
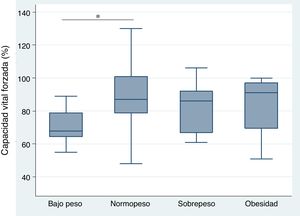
Relación entre el índice de masa corporal y enfermedad pulmonar intersticial con base en la capacidad vital forzada, caminata de seis minutos, y tomografía axial computarizada de alta resolución de tóraxEl análisis de la correlación entre CVF e IMC demostró la tendencia de una relación directamente proporcional (CC=0,23) no alcanzando un valor estadísticamente significativo (p=0,118) (fig. 1). Cuando se evaluó la correlación entre IMC con la C6M y la TACAR de tórax, se observó una relación inversamente proporcional para cada comparación que resultó no significativa en ambos casos (CC=-0,09 y -0,07, p=0,571 y p=0,672, respectivamente). Por otro lado, el análisis del IMC por grupos, según criterios de la OMS, demostró que el grupo de pacientes con peso bajo presentó menores niveles de CVF en comparación con el grupo de peso óptimo, siendo esta diferencia estadísticamente significativa (p=0,046) (fig. 2).
Correlación entre capacidad vital forzada e índice de masa corporal en pacientes con esclerosis sistémica.
CC, coeficiente de correlación. Se empleó análisis de regresión lineal simple para determinar la relación entre las variables. Para el cálculo de la correlación se empleó el coeficiente de Pearson.
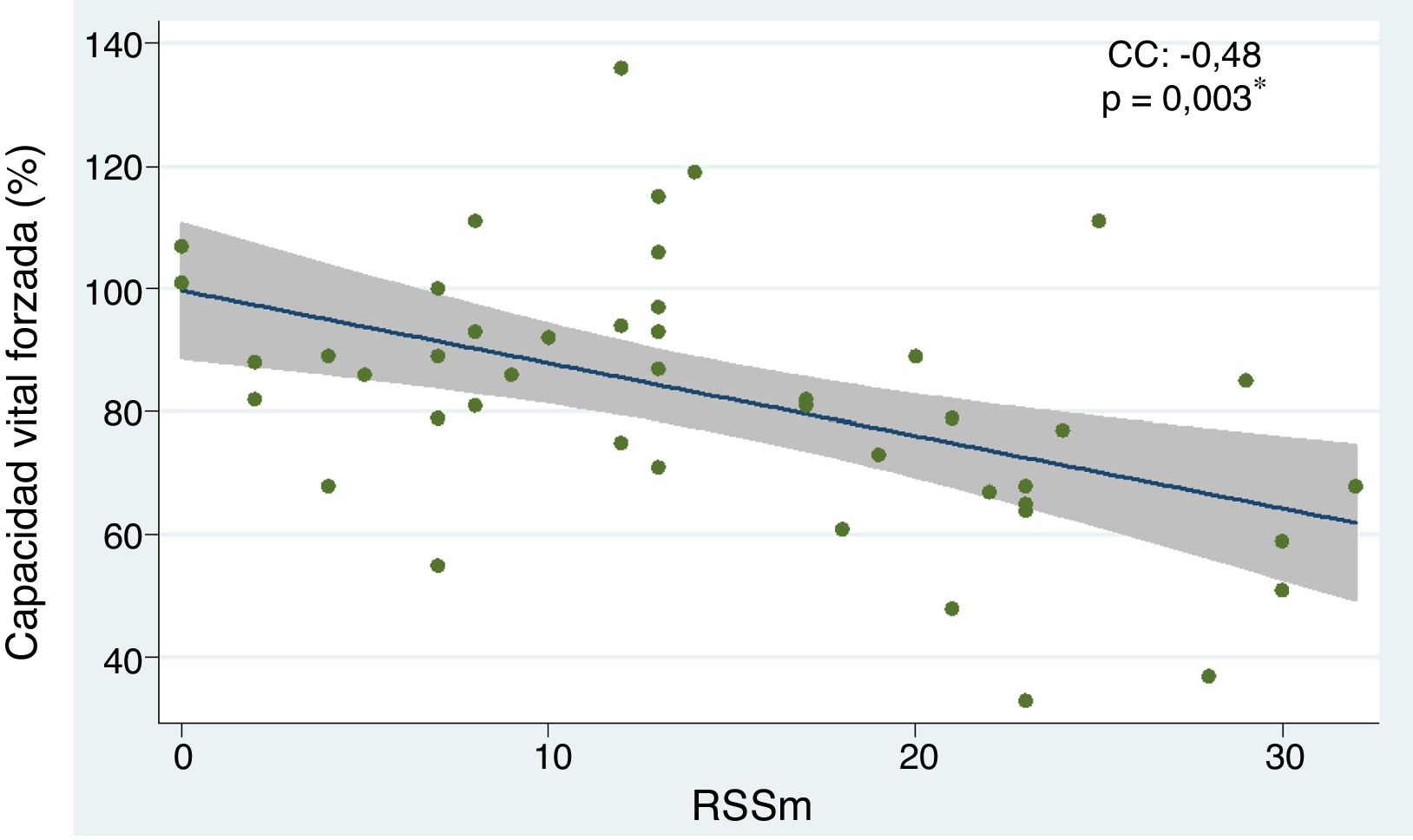
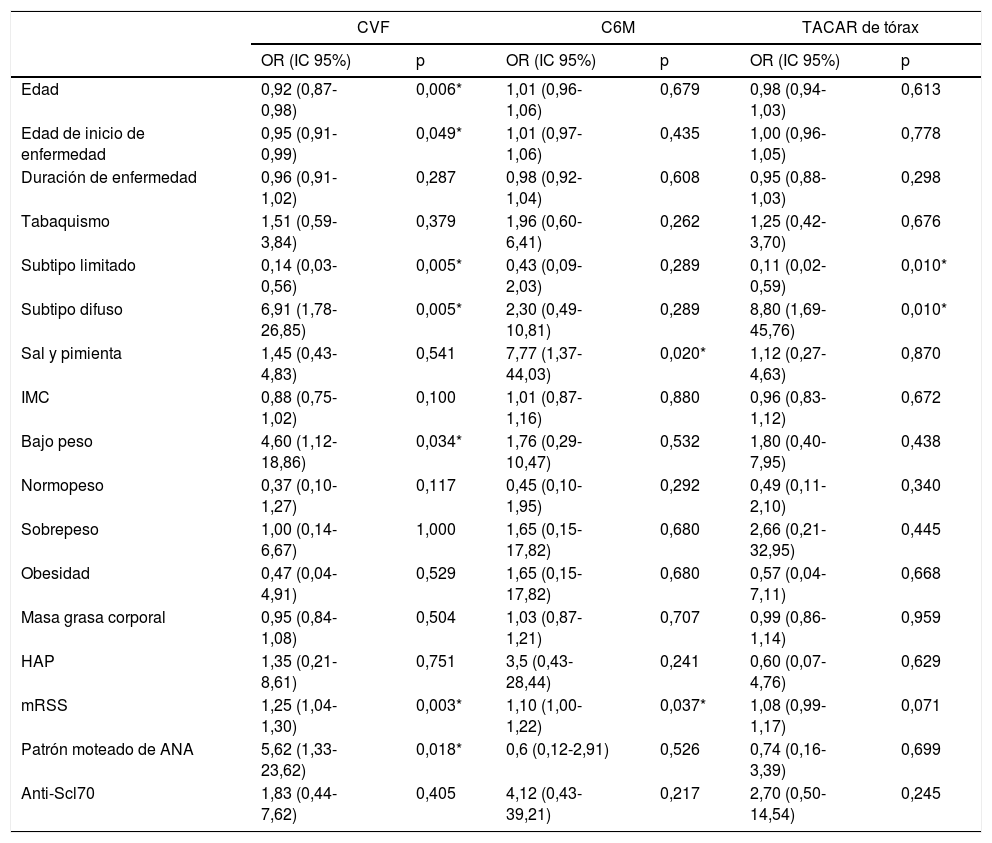
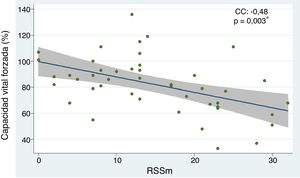
Los predictores independientes de enfermedad pulmonar intersticial con base en la disminución de la CVF fueron: el subtipo de esclerosis sistémica difusa (OR 6,91; IC 95% 1,78-26,85; p=0,005), tener peso bajo (OR 4,60; IC 95% 1,12-18,86; p=0,034), la presencia de ANA con patrón moteado (OR 5,62; IC 95% 1,33-23,62; p=0,018) y la escala del mRSS (OR 1,25; IC 95% 1,04-1,30; p=0,003). Se comportaron como factores protectores la edad (OR 0,92; CI 95% 0,87-0,98; p=0,006), la edad de inicio de la enfermedad (OR 0,95; IC 95% 0,91-0,99; p=0,049), y el subtipo limitado (OR 0,14; IC 95% 0,03-0,56; p=0,005). Cuando se evaluaron los factores de riesgo que alteraron el resultado de la C6M se determinaron como predictores negativos: las lesiones de piel «en sal y pimienta» (OR 7,77; IC 95% 1,37-44,03; p=0,020) y el mRSS (OR 1,10; IC 95% 1,00-1,22; p=0,037). Por su parte, con respecto a la evaluación de la TACAR de tórax, el subtipo difuso se comportó como factor de riesgo de EPID (OR 8,80; IC 95% 1,69-45,76; p=0,010) (tabla 2). El análisis de la correlación entre CVF y mRSS mostró una tendencia inversamente proporcional con significación estadística (CC=-0,48; p=0,003) (fig. 3).
Análisis univariado de predictores de enfermedad pulmonar intersticial difusa en pacientes con esclerosis sistémica
| CVF | C6M | TACAR de tórax | ||||
|---|---|---|---|---|---|---|
| OR (IC 95%) | p | OR (IC 95%) | p | OR (IC 95%) | p | |
| Edad | 0,92 (0,87-0,98) | 0,006* | 1,01 (0,96-1,06) | 0,679 | 0,98 (0,94-1,03) | 0,613 |
| Edad de inicio de enfermedad | 0,95 (0,91-0,99) | 0,049* | 1,01 (0,97-1,06) | 0,435 | 1,00 (0,96-1,05) | 0,778 |
| Duración de enfermedad | 0,96 (0,91-1,02) | 0,287 | 0,98 (0,92-1,04) | 0,608 | 0,95 (0,88-1,03) | 0,298 |
| Tabaquismo | 1,51 (0,59-3,84) | 0,379 | 1,96 (0,60-6,41) | 0,262 | 1,25 (0,42-3,70) | 0,676 |
| Subtipo limitado | 0,14 (0,03-0,56) | 0,005* | 0,43 (0,09-2,03) | 0,289 | 0,11 (0,02-0,59) | 0,010* |
| Subtipo difuso | 6,91 (1,78-26,85) | 0,005* | 2,30 (0,49-10,81) | 0,289 | 8,80 (1,69-45,76) | 0,010* |
| Sal y pimienta | 1,45 (0,43-4,83) | 0,541 | 7,77 (1,37-44,03) | 0,020* | 1,12 (0,27-4,63) | 0,870 |
| IMC | 0,88 (0,75-1,02) | 0,100 | 1,01 (0,87-1,16) | 0,880 | 0,96 (0,83-1,12) | 0,672 |
| Bajo peso | 4,60 (1,12-18,86) | 0,034* | 1,76 (0,29-10,47) | 0,532 | 1,80 (0,40-7,95) | 0,438 |
| Normopeso | 0,37 (0,10-1,27) | 0,117 | 0,45 (0,10-1,95) | 0,292 | 0,49 (0,11-2,10) | 0,340 |
| Sobrepeso | 1,00 (0,14-6,67) | 1,000 | 1,65 (0,15-17,82) | 0,680 | 2,66 (0,21-32,95) | 0,445 |
| Obesidad | 0,47 (0,04-4,91) | 0,529 | 1,65 (0,15-17,82) | 0,680 | 0,57 (0,04-7,11) | 0,668 |
| Masa grasa corporal | 0,95 (0,84-1,08) | 0,504 | 1,03 (0,87-1,21) | 0,707 | 0,99 (0,86-1,14) | 0,959 |
| HAP | 1,35 (0,21-8,61) | 0,751 | 3,5 (0,43-28,44) | 0,241 | 0,60 (0,07-4,76) | 0,629 |
| mRSS | 1,25 (1,04-1,30) | 0,003* | 1,10 (1,00-1,22) | 0,037* | 1,08 (0,99-1,17) | 0,071 |
| Patrón moteado de ANA | 5,62 (1,33-23,62) | 0,018* | 0,6 (0,12-2,91) | 0,526 | 0,74 (0,16-3,39) | 0,699 |
| Anti-Scl70 | 1,83 (0,44-7,62) | 0,405 | 4,12 (0,43-39,21) | 0,217 | 2,70 (0,50-14,54) | 0,245 |
Para el cálculo del OR e intervalo de confianza al 95% se empleó análisis de regresión logística.
ANA: anticuerpos antinucleares; anti-Scl70: anticuerpo antitopoisomerasa; CVF: capacidad vital forzada; C6M: caminata de 6 minutos; HAP: hipertensión arterial pulmonar; IC: intervalo de confianza; IMC: índice de masa corporal; mRSS: modified Rodnan Skin Score; OR: odds ratio; TACAR: tomografía de tórax de alta resolución.
Relación entre capacidad vital forzada y RSSm en pacientes con esclerosis sistémica.
CC, coeficiente de correlación. Se empleó análisis de regresión lineal simple para determinar la relación entre las variables. Para el cálculo de la correlación se empleó el coeficiente de Pearson.
*p<0,05.
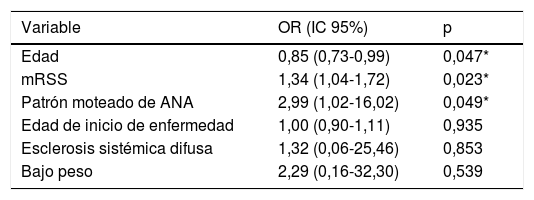
Para el análisis multivariado de predictores de enfermedad pulmonar según la CVF se incluyeron en un modelo las variables que mostraron asociación significativa en el análisis univariado, las cuales fueron: edad, edad de inicio de la enfermedad, subtipo de esclerosis sistémica, bajo peso, mRSS y el patrón moteado de ANA. Se determinó que las variables independientemente asociadas con EPID fueron la edad (OR 0,85; IC 95% 0,73-0,99; p=0,047), la puntuación del mRSS (OR 1,34; IC 95% 1,04-1,72, p=0,023) y el patrón de ANA moteado (OR 25,99; IC 95% 1,02-16,02; p=0,049) (tabla 3).
Análisis multivariado de variables predictoras de enfermedad pulmonar según capacidad vital forzada
| Variable | OR (IC 95%) | p |
|---|---|---|
| Edad | 0,85 (0,73-0,99) | 0,047* |
| mRSS | 1,34 (1,04-1,72) | 0,023* |
| Patrón moteado de ANA | 2,99 (1,02-16,02) | 0,049* |
| Edad de inicio de enfermedad | 1,00 (0,90-1,11) | 0,935 |
| Esclerosis sistémica difusa | 1,32 (0,06-25,46) | 0,853 |
| Bajo peso | 2,29 (0,16-32,30) | 0,539 |
ANA: anticuerpos antinucleares; IC: intervalo de confianza; mRSS: modified Rodnan Skin Score; OR: odds ratio.
Para el análisis se empleó regresión logística multivariada.
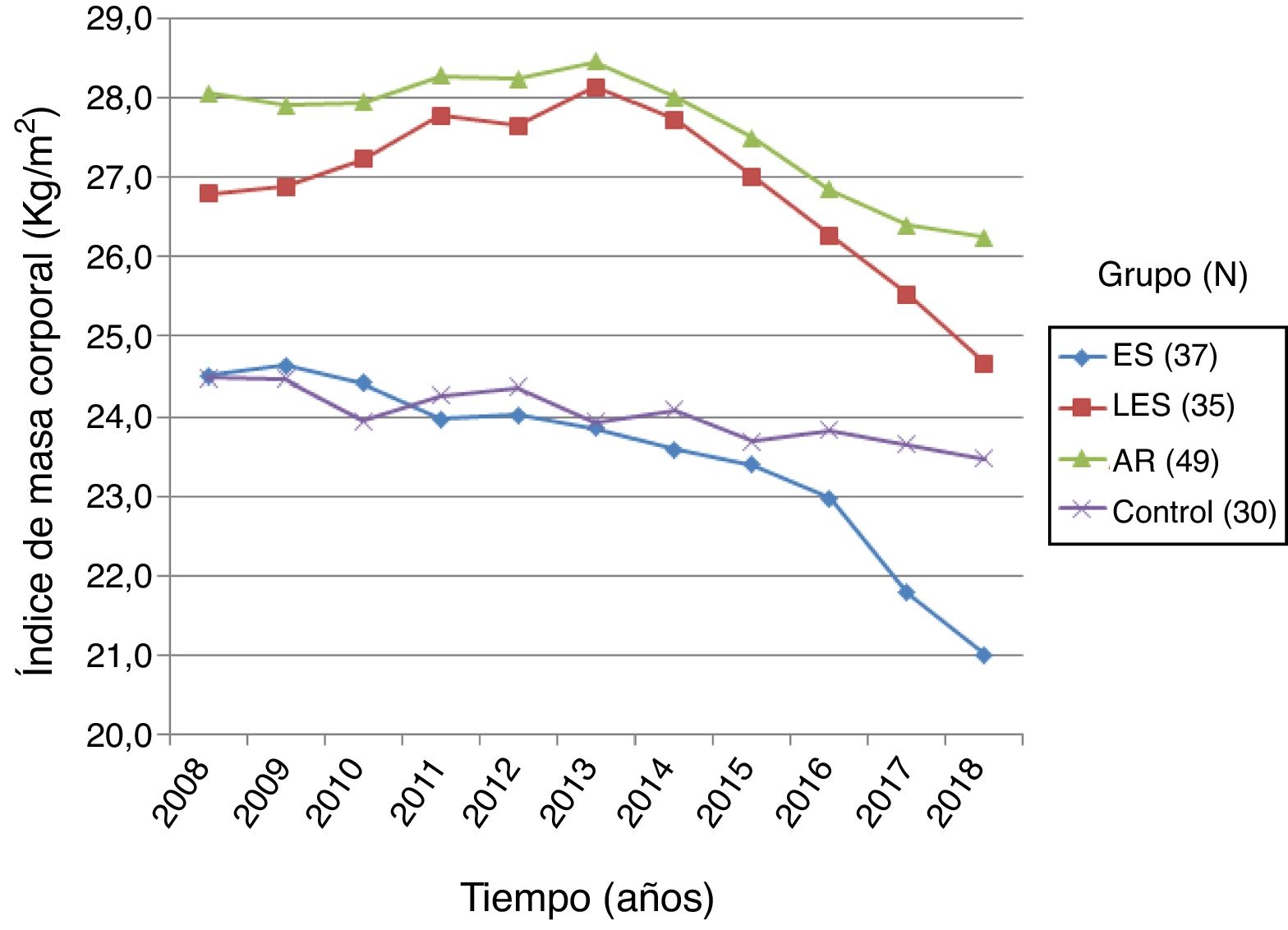
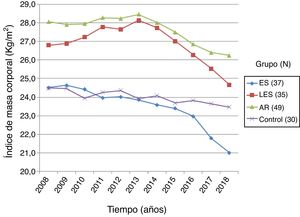
Mediante datos obtenidos de la historia clínica se realizó un registro de la evolución del IMC en los últimos 10 años de pacientes con esclerosis sistémica y controles. El grupo de pacientes con esclerosis sistémica (n=37) presentó un IMC inicial de 24,50±4,65 kg/m2 y un IMC final de 21,00±4,43 kg/m2, demostrando una reducción de IMC de 14,3%, con diferencia estadística significativa (p=0,0000). El grupo de pacientes con AR (n=49) presentó un IMC inicial y final de 28,05±4,58 kg/m2 y 26,23±5,32 kg/m2, respectivamente, con un 6,5% de IMC perdido, siendo estadísticamente significativo (p=0,000). Por su parte, el grupo de pacientes con LES (n=35) presentó un IMC inicial de 26,79±4,94 kg/m2 y un IMC final de 24,65±4,83 kg/m2, con porcentaje de pérdida de IMC de 7,9%, mostrando significación estadística (p=0,0005). Finalmente, el grupo de controles sanos (n=30) tuvo un IMC inicial de 24,47±3,08 kg/m2, y un IMC final de 23,46±3,08 kg/m2; el porcentaje de IMC perdido fue de 4,1%, sin significación estadística (p=0,1327). El análisis de comparación del IMC perdido de los pacientes con esclerosis sistémica respecto a los demás grupos reportó diferencia significativa con LES (p=0,0025), AR (p=0,0000) y el grupo de sujetos sanos (p=0,0331) (fig. 4).
DiscusiónLa esclerosis sistémica es una enfermedad autoinmune que por su baja prevalencia en la población29 ha tenido, aparentemente, menos prioridad en materia de investigación en comparación con otras entidades inflamatorias autoinmunes más frecuentes como el lupus eritematoso sistémico y la AR. Los estudios epidemiológicos existentes de esclerosis sistémica realizados en Latinoamérica señalan también una baja incidencia en el continente30,31. En Venezuela no existen estudios demográficos sobre esta población. No obstante, en años recientes se ha avanzado notablemente en el conocimiento de los diversos mecanismos inmunopatogénicos que contribuyen al desarrollo de la enfermedad32,33, que pueden, por tanto, promover el crecimiento del campo de investigación en esclerosis sistémica.
Según cifras obtenidas del registro del Centro Nacional de Enfermedades Reumáticas en el año 2011, se estimó la incidencia de la esclerosis sistémica en Venezuela en aproximadamente un caso por millón de habitantes (datos no publicados), lo cual seguramente refleja un subregistro ya que son datos obtenidos de un solo centro. Con respecto a las características demográficas, el estudio demostró un predominio del sexo femenino y un inicio de edad de enfermedad similar a la reportada en pacientes caucásicos34,35, que a su vez representa un inicio tardío de la enfermedad con respecto a individuos afroamericanos o con ascendencia africana29,34–36. El nivel educativo de los pacientes en nuestro estudio fue bajo; dos tercios expresaron no tener escolaridad completa, lo que se reflejó en el estatus socioeconómico, donde dos tercios del grupo pertenecieron a los estratos IV y V de la escala Graffar Méndez-Castellanos. Estos hallazgos, similares a los encontrados en otros estudios epidemiológicos37, tienen implicación en cuanto al conocimiento de la enfermedad por parte de los pacientes, la búsqueda temprana de asistencia médica, la adherencia al tratamiento y a asegurar un seguimiento regular por parte del médico38.
Entre las manifestaciones clínicas registradas en los pacientes el fenómeno de Raynaud fue la más frecuente, concordando con lo reportado en estudios clínicos y experimentales en esclerosis sistémica39,40. La prevalencia de este signo y el hecho que precede en años al inicio de las demás manifestaciones clínicas de la enfermedad, resaltan la importancia del daño microvascular endotelial como el evento primario en la patogenia de la enfermedad41,42. En nuestro estudio, la distribución de las diversas características clínicas entre los subtipos de esclerosis sistémica limitada y difusa fue homogénea, exceptuando la disnea, las pruebas de función pulmonar y la puntuación del mRSS, que demostraron mayor compromiso visceral pulmonar y severidad de fibrosis cutánea en la esclerosis sistémica difusa, hecho observado en diversos estudios de cohortes en esclerosis sistémica43. Esto demuestra que los pacientes hispanoamericanos con esclerosis sistémica difusa también presentan disfunción respiratoria, física y, por consiguiente, tendrán una esperanza de vida menor, asociada a este subtipo43–45.
El estudio demostró una correlación directa entre el IMC y la CVF, aunque sin significación estadística. Sin embargo, cuando se analizó el IMC por grupos según criterios de la OMS, se evidenció que un bajo peso (IMC<18,5 kg/m2) se comportó como factor de riesgo para el desarrollo de EPID al observar menores niveles de CVF en este grupo. Es decir, los pacientes desnutridos con esclerosis sistémica presentaron una mayor frecuencia de EPID, comparado con los pacientes que tenían niveles de IMC iguales o mayores a 18,5kg/m2. Este hallazgo es cónsono con el estudio de Caimmi et al.46, en el cual se demostró, además, que la pérdida de masa muscular no estuvo implicada en la alteración de la CVF. Así, si se asume que el componente graso influye de manera directa y quizás en mayor proporción que la masa muscular sobre el valor del IMC, podría explicarse el efecto que tener bajo peso podría tener sobre la propensión al desarrollo de EPID en nuestros pacientes con esclerosis sistémica. Por tanto, el tejido adiposo podría, a través de efectos antifibróticos de mediadores lipídicos como la adiponectina47, representar un factor protector sobre el parénquima pulmonar y, por ende, sobre la función pulmonar9,14. Existen estudios que respaldan la correlación entre este grupo de mediadores y el IMC48,49. De esta forma, las propiedades reparadoras, angiogénicas, antiinflamatorias y de liberación de citoquinas antifibróticas, atribuidas al tejido adiposo17,50, podrían ejercer sus efectos no solo sobre el tegumento, sino probablemente también en las unidades celulares respiratorias14,16,17.
El grado de fibrosis de piel en esclerosis sistémica está relacionado con la severidad de la enfermedad y con un mayor compromiso visceral51. En nuestro estudio se reportó que puntajes elevados del mRSS y el subtipo difuso influyeron negativamente en los niveles de CVF, un importante marcador de EPID y de pronóstico de supervivencia a corto plazo en esclerosis sistémica52. Nuestros resultados, en ese aspecto, son congruentes con otros estudios de la enfermedad53. Además, al ser la esclerosis sistémica una enfermedad sistémica del tejido conectivo, la asociación observada entre bajo peso y CVF, podría explicar una pérdida sustancial de tejido especializado pulmonar por tejido fibrótico no funcional14. Se plantea que, como se ha observado en múridos, este tejido del parénquima pulmonar es de naturaleza lipídica16, y por tanto es susceptible de ser sustituido por miofibroblastos14. Un estudio que mida el índice de masa grasa cutánea y el grado de fibrosis en muestras de tejido pulmonar permitiría examinar esta posible asociación de manera más directa. Adicionalmente, otros resultados del estudio demostraron una pérdida promedio de 14,3% de masa corporal, y esto guardó correlación con baja CVF. La asociación entre la pérdida de masa grasa y el proceso fibrótico ha sido observada en diversos estudios de modelos múridos experimentales de esclerosis sistémica, en los que se observó que la pérdida de tejido adiposo precede a la aparición de fibrosis8,15. En nuestro estudio se demostró que la extensión del compromiso cutáneo medido mediante el mRSS se asoció al desarrollo de EPID. De esta forma, el mRSS podría ser una herramienta clínica que evalúe de forma indirecta el grado de atrofia grasa y su sustitución por tejido fibrótico en el tejido subcutáneo y servir como predictor de afección visceral pulmonar. La reproducibilidad, la consistencia interobservador, la factibilidad y la correlación con otras herramientas como el ultrasonido20, hacen del mRSS un instrumento de gran valor para el pronóstico y seguimiento del paciente.
La C6M debe formar parte de la evaluación integral de los pacientes con esclerosis sistémica54. La C6M evalúa diferentes factores biomecánicos, orgánicos y de composición corporal, lo que le otorga capacidad diagnóstica y predictiva55. En nuestro estudio el IMC influyó negativamente en la cantidad de metros recorridos en la C6M, y aunque la diferencia no fue significativa, los estudios de Sanges et al.56 y Deuschle et al.28 demostraron fortaleza en esta asociación. Esto puede deberse a que en dichos estudios el promedio de edad e IMC fueron mayores y estos factores están asociados a una capacidad física reducida57,58. No obstante, los resultados de la C6M en esclerosis sistémica deben ser interpretados cuidadosamente debido a múltiples factores que pueden modificar el resultado de la prueba56; así, una mayor prevalencia de hipertensión arterial pulmonar, EPID o manifestaciones musculoesqueléticas de diverso grado, se comportarían como factores de confusión. Por otro lado, nuestros resultados señalaron que la severidad de la fibrosis cutánea medida por el mRSS y las lesiones de piel «en sal y pimienta» se relacionaron negativamente con la C6M. Esto se explica por la asociación descrita entre el mRSS y dichas lesiones que traducen severidad de fibrosis y están relacionadas con contracturas articulares59 que pueden dificultar la locomoción.
Existen múltiples factores de riesgo identificados para el desarrollo de EPID en esclerosis sistémica3. En nuestro estudio el mRSS y el patrón moteado de ANA fueron factores de riesgo independientemente asociados con enfermedad pulmonar. Con respecto al mRSS, existen estudios que respaldan su asociación con EPID60,61. De igual forma, Ashmore et al.44 han reportado la relación existente entre ANA con patrón moteado y EPID, lo cual puede responder a que la especificidad antigénica de este tipo de patrón está dirigida en un 20 a 60% contra la topoisomerasa I2,62. Por tanto, en ambos casos, el mRSS y patrón de ANA moteado estarían asociados de forma indirecta con la esclerosis sistémica difusa. Por su parte, la edad de los individuos se mostró como factor protector para el desarrollo de EPID. Esto se debería a que un inicio tardío y una duración mayor de la enfermedad, son características de pacientes con esclerosis sistémica limitada, donde el compromiso pulmonar es menos frecuente53,63.
El grado de pérdida de peso evidenciado en el seguimiento durante un período de 10 años en pacientes con esclerosis sistémica, fue mayor cuando se comparó con otras enfermedades inflamatorias y con un grupo control sano. La mayor pérdida de peso de los pacientes con esclerosis sistémica puede explicarse por la sustitución de masa grasa por tejido fibrótico afectando tegumentos pero también potencialmente otros tejidos viscerales como tracto digestivo comprometiendo la absorción intestinal64. Adicionalmente, los pacientes cursan con atrofia muscular debida al compromiso articular y tegumentario que lleva a contracturas en las extremidades y limitan progresivamente la movilidad del paciente promoviendo a su vez la sarcopenia27. Finalmente, la combinación del daño tegumentario, con sus implicaciones cosméticas, y la afección visceral frecuentemente llevan a trastorno depresivo mayor, distimia y trastornos de ansiedad, comprometiendo más aún la alimentación del paciente64–66. La combinación de estas manifestaciones contribuye a un fenotipo propio de la esclerosis sistémica que la distingue de las demás enfermedades inflamatorias autoinmunes, y que es caracterizado por la consunción de las reservas visibles de tejido graso corporal y que, en casos extremos, puede llevar a la caquexia. En consecuencia, los estudios recientes basados en la estimulación de la proliferación del tejido graso6,14,19,67,68, el bloqueo de la transición adipocito-miofibroblasto6,7,15,69 y las terapias en las que se emplea el trasplante de tejido graso70–72, han abierto un campo potencial de investigación para el desarrollo de nuevas terapias en la enfermedad.
Nuestros resultados deben considerarse como preliminares debido al tamaño pequeño de la muestra, a ser resultados de un solo centro, a tener un sesgo hacia los pacientes con menor nivel socioeconómico y a la ausencia de estudios histológicos de piel y pulmón. Sus ventajas incluyen el tratarse de una población homogénea desde el punto de vista racial y el ser, hasta nuestro conocimiento, el primer estudio de esta naturaleza hecho en el país y posiblemente en América Latina.
ConclusiónEl estudio sugiere que la edad, un bajo peso, índice alto en el mRSS y el patrón moteado de ANA son factores de riesgo para el desarrollo de EPID en pacientes con esclerosis sistémica, y puede estar condicionado por la notable consunción de tejido adiposo y la sustitución del mismo por tejido fibrótico tanto en piel como a nivel pulmonar. La extensión de la fibrosis cutánea que presentan los pacientes con esclerosis sistémica difusa y, en consecuencia, la mayor puntuación del mRSS también son predictores de EPID. El mRSS es una herramienta clínica con capacidad predictiva de afección visceral pulmonar en esclerosis sistémica. Es preciso determinar en estudios multicéntricos, con mayor número de pacientes el papel de la masa grasa corporal en la patogenia de la esclerosis sistémica mediante estudios de composición corporal específicos y su correlación con el desarrollo de la afección pulmonar en la esclerosis sistémica. Este conocimiento permitirá la monitorización de la evolución de la enfermedad usando el IMC y el índice de composición grasa como predictores de afección pulmonar en nuestros pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.