La esclerosis sistémica (ES) es una enfermedad mediada por el sistema inmunitario, caracterizada por vasculopatía de pequeños vasos y disfunción de los fibroblastos, que da lugar a una mayor producción de matriz extracelular. La enfermedad pulmonar intersticial representa una de las complicaciones más comunes, ya que afecta a cerca del 70% de los pacientes con ES.
ObjetivoEvaluar la efectividad de los tratamientos farmacológicos disponibles para la enfermedad pulmonar intersticial asociada a la esclerosis sistémica (EPI-ES) basándonos en las pruebas de función pulmonar y los hallazgos radiológicos.
Materiales y métodosSe llevó a cabo una revisión sistemática de la literatura y un metaanálisis. Se hizo una búsqueda exhaustiva de literatura en EMBASE, MEDLINE PubMed y Cochrane (CENTRAL) con el fin de recopilar los estudios publicados entre enero de 2015 y el 31 de julio de 2019. Los resultados primarios fueron la capacidad vital forzada (CVF), la capacidad de difusión del monóxido de carbono (diffusing capacity of the lungs for carbon monoxide, DLCO), y los hallazgos de la tomografía computarizada de alta resolución (TCAR). Se incluyeron los estudios que utilizaron medicamentos para el tratamiento de la EPI-ES, incluyendo ciclofosfamida (CYC), micofenolato de mofetilo (MMF), nintedanib, pirfenidona o rituximab (RTX). Las medidas de efecto se calcularon con base en los datos disponibles, y se hizo un metaanálisis con estos resultados.
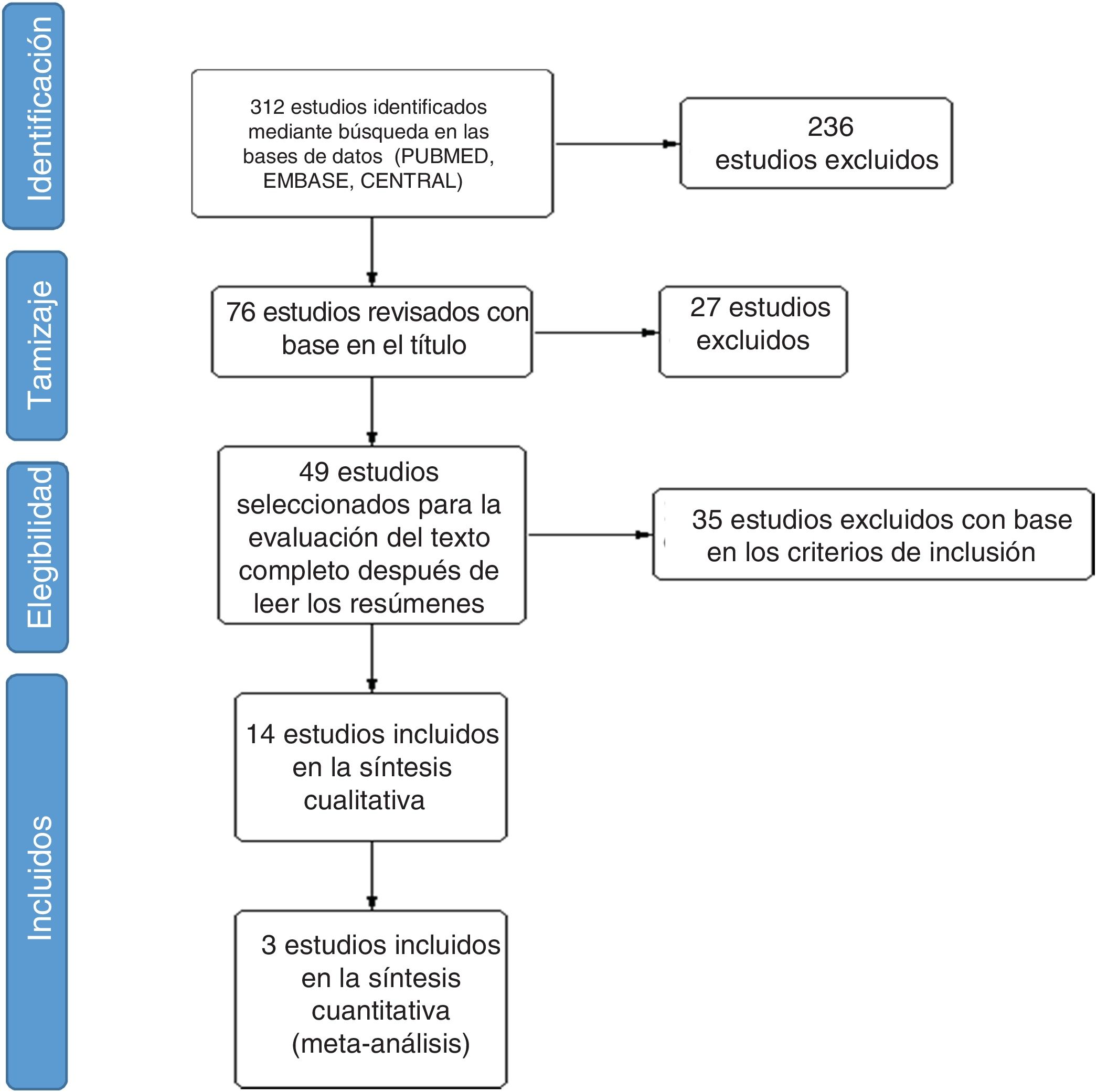
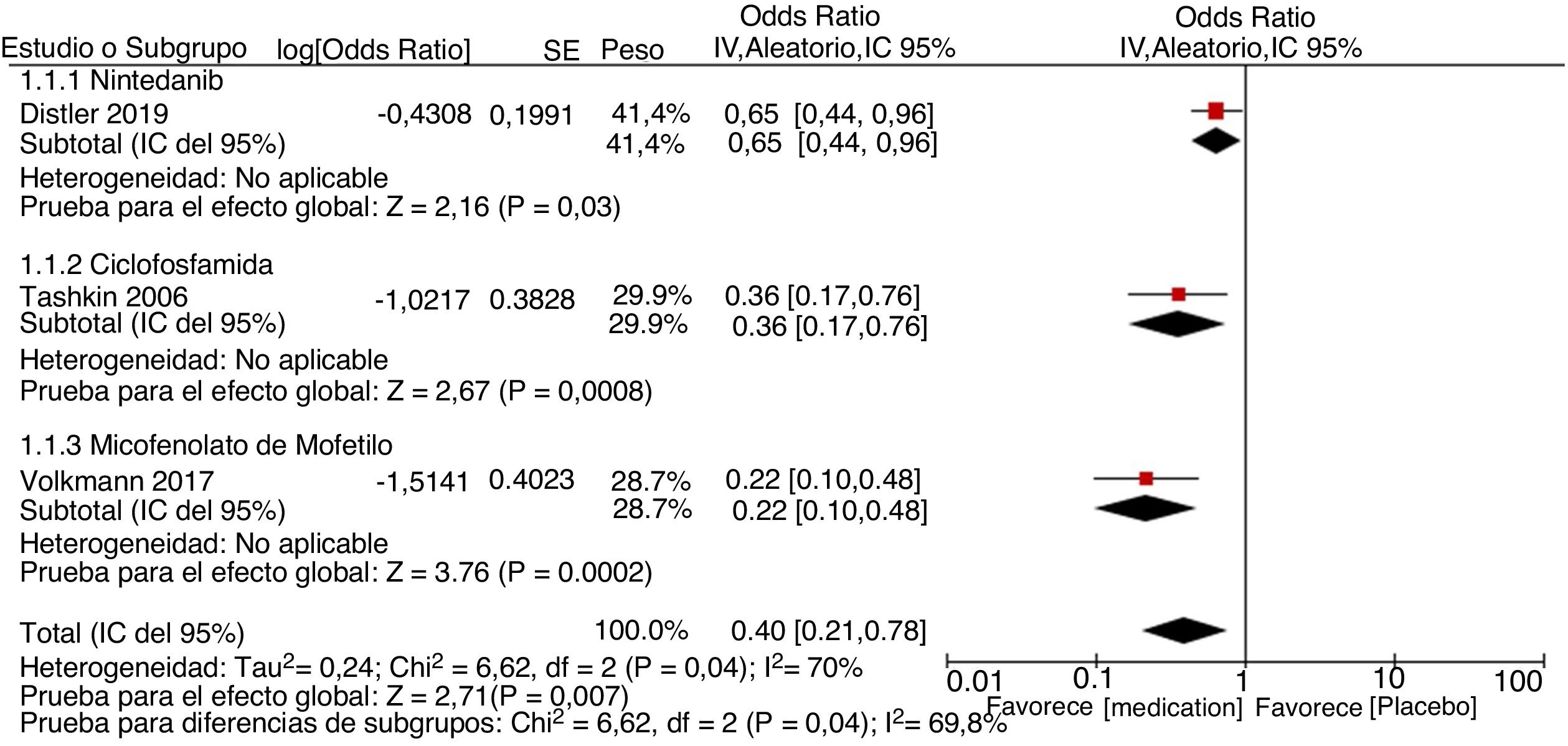
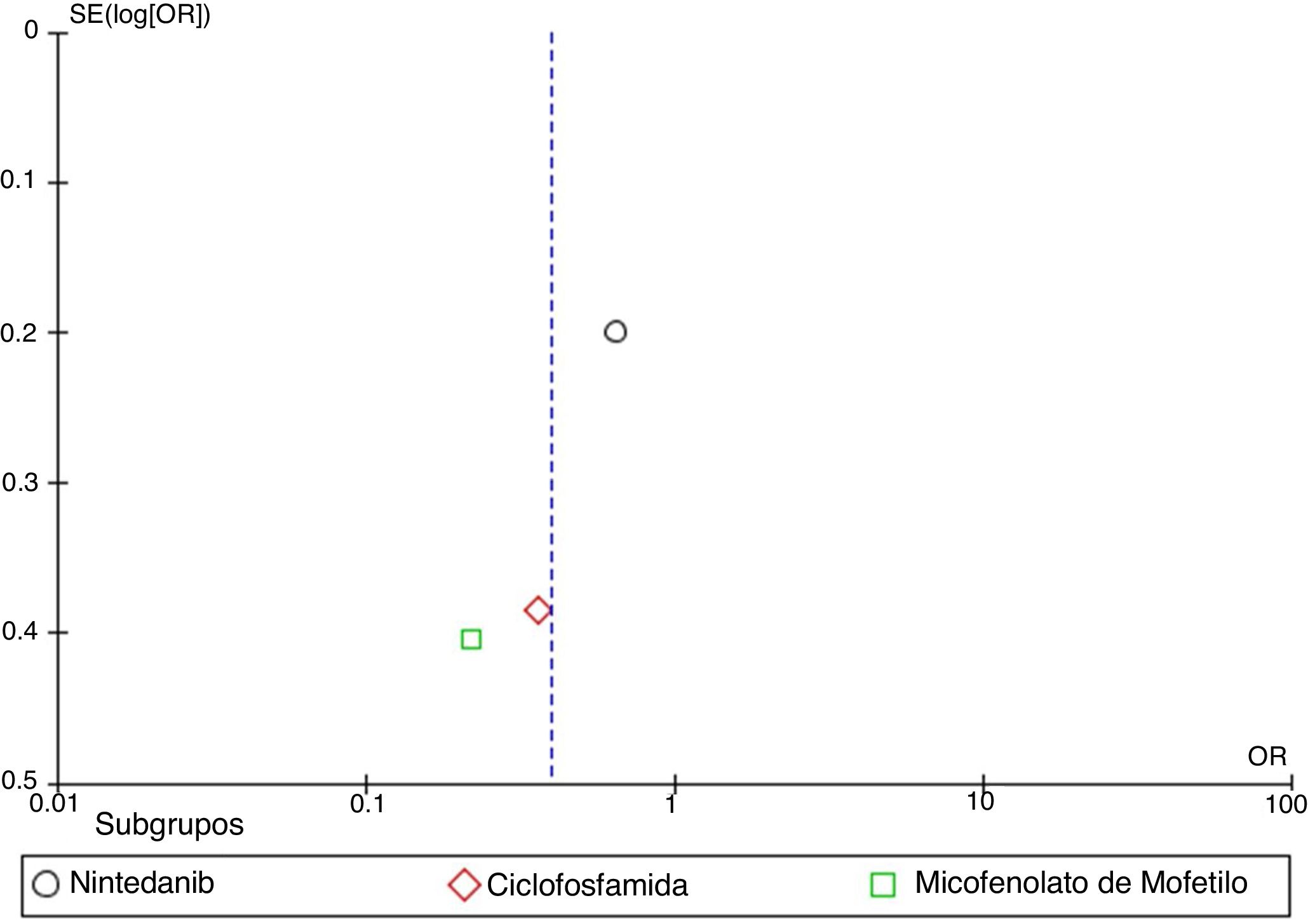
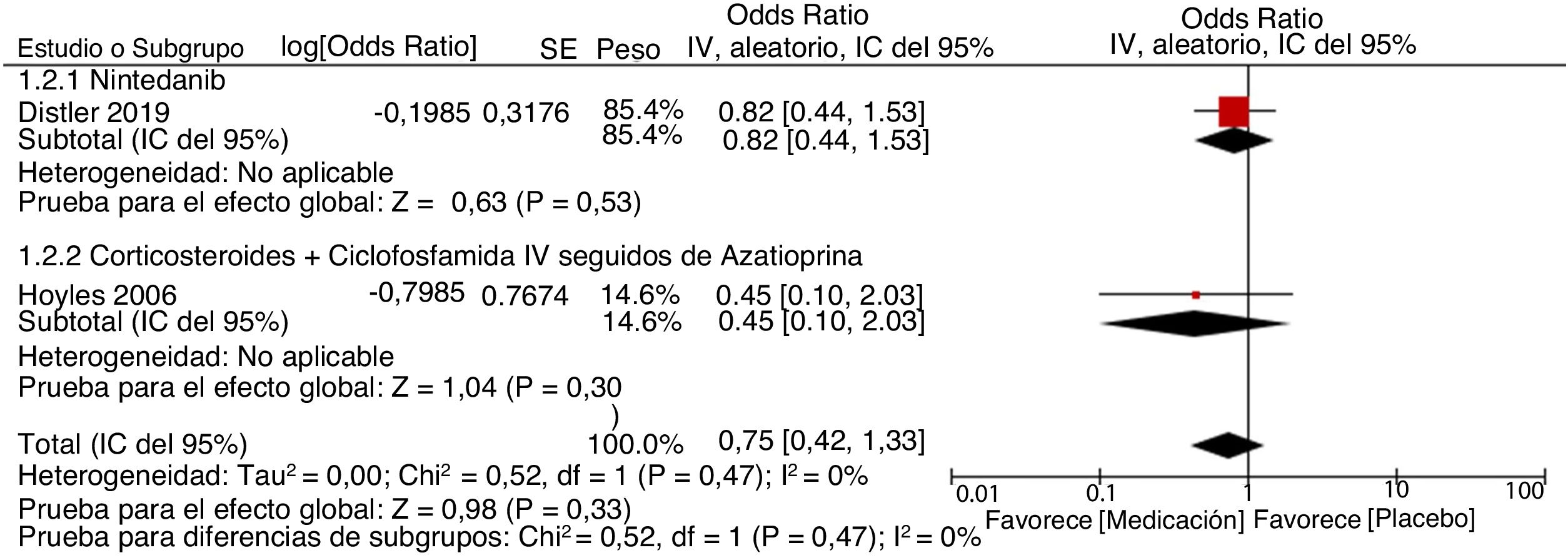
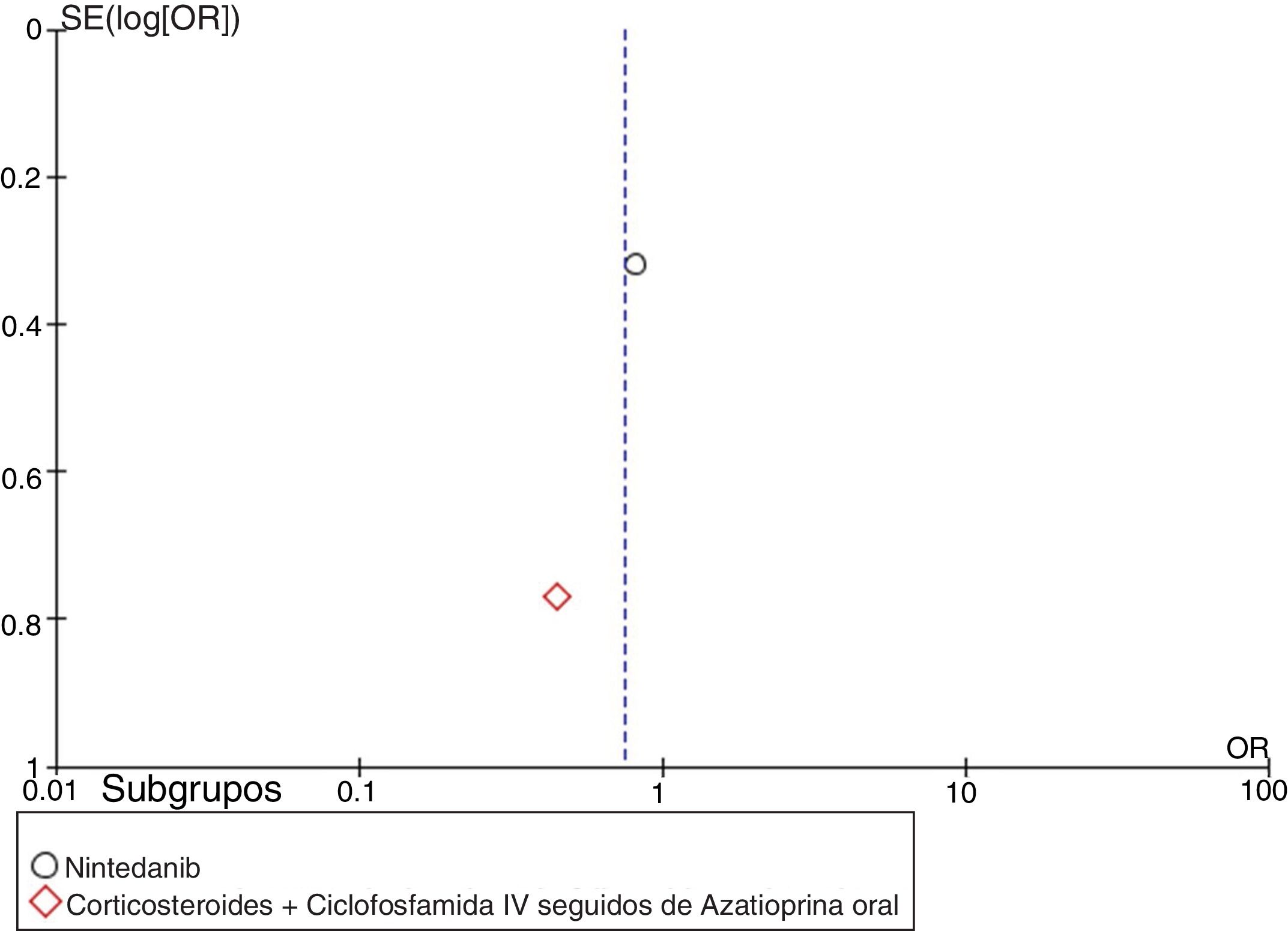
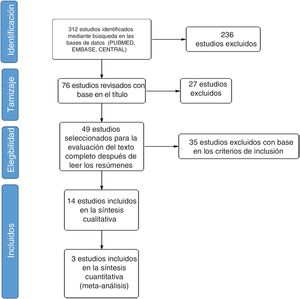
ResultadosEncontramos un total de 312 estudios. Después de leer los resúmenes, se seleccionaron 49 estudios para la evaluación del texto completo. Finalmente, se seleccionaron 14 estudios para incluirlos en la revisión final. Se identificaron dos metaanálisis, ocho ensayos clínicos, tres cohortes retrospectivas y un estudio de casos y controles anidado. La evidencia disponible respalda el uso de CYC y MMF como las mejores opciones para el tratamiento de la EPI-ES, siendo el MMF la opción preferida basada en un mejor perfil de seguridad. Otros medicamentos como RTX, pirfenidona y nintedanib muestran potencial como alternativas a la CYC. La calidad global de la evidencia disponible es adecuada ya que parte de estudios por lo general bien diseñados. El metaanálisis se realizó evaluando una disminución > 5% o > 10% de la CVF al comparar los agentes farmacológicos vs. placebo. Los resultados muestran que el uso de agentes farmacológicos se asocia negativamente con el empeoramiento de la CVF. Sin embargo, la alta heterogeneidad limita el número de estudios utilizados durante el análisis cuantitativo, afectando los resultados generales.
ConclusionesLas terapias inmunosupresoras, especialmente la CYC y el MMF, siguen siendo la piedra angular del tratamiento de la EPI-ES, ya que la mayoría de la evidencia muestra una mejoría o una progresión lenta de las pruebas de función pulmonar al usarlas. Sin embargo, se requiere más evidencia con respecto al uso de agentes farmacológicos alternativos, en busca de una mejora de la calidad de vida de estos pacientes.
Systemic sclerosis (SSc) is an immune-mediated disease characterized by small vessel vasculopathy and fibroblast dysfunction that leads to increased production of extracellular matrix. Interstitial lung disease represents one of the most common complications, by affecting almost 70% of patients with SSc.
ObjectiveTo evaluate the effectiveness of the pharmacological treatments available for systemic sclerosis-associated interstitial lung disease (SSc-ILD) based on pulmonary function tests and radiologic findings.
Materials and methodsA systematic literature review and meta-analysis were conducted. A thorough literature search was made in EMBASE, MEDLINE PubMed, and Cochrane (CENTRAL) to collect studies published between January 2015 and July 31 of 2019. The primary outcomes were forced vital capacity (FVC), diffusion capacity of carbon monoxide (DLCO), and high-resolution computed tomography (HR-CT) findings. Studies using medications for the treatment of SSc-ILD including cyclophosphamide (CYC), mycophenolate mofetil (MMF), nintedanib, pirfenidone, or rituximab (RTX) were included. Effect measures were calculated based on available data, and a meta-analysis was made with these results.
ResultsWe found a total of 312 studies. Forty nine studies were selected for full-text assessment after reading the abstracts. Finally, 14 studies were selected to be included in the final review. Two meta-analyses, eight clinical trials, three retrospective cohorts, and one nested case–control study were identified. The available evidence supports the use of CYC and MMF as the best options for the treatment of SSc-ILD, with MMF being the preferred option based on a better safety profile. Other medications such as RTX, pirfenidone, and nintedanib show potential as alternatives to CYC. The overall quality of evidence available is adequate based on generally well-designed studies. Meta-analysis was done by assessing > 5% or > 10% decrease of FVC when comparing pharmacological agents vs. placebo. Results show that the use of pharmacological agents is negatively associated with the worsening of FVC. However, high heterogeneity limits the number of studies used during quantitative analysis, affecting the overall results.
ConclusionsImmunosuppressive therapies remain as the cornerstone of treatment of SSc-ILD, as most evidence show improvement or slow progression of pulmonary function tests by using them, especially CYC and MMF. However, more evidence is required regarding the use of alternative pharmacological agents, in search of an improvement in the quality of life of these patients.
La esclerosis sistémica (ES) es una enfermedad reumática mediada por el sistema inmunitario, en la que aún se desconoce el evento desencadenante1. La fisiopatología de la enfermedad se caracteriza por el desarrollo de vasculopatía de pequeños vasos, producción de autoanticuerpos y una respuesta inmune humoral, así como una disfunción de los fibroblastos que da lugar a un aumento de la producción de matriz extracelular2. La ES temprana se caracteriza por una disfunción microvascular y una respuesta autoinmune3,4, que asociadas con un mecanismo de reparación aberrante del tejido conectivo, dan lugar al desarrollo de fibrosis que puede comprometer varios sistemas de órganos tales como la piel, el tracto gastrointestinal, el sistema renal y el sistema respiratorio1,5.
Ésta es una enfermedad rara con una prevalencia de 3-24 casos por cada 100.000 personas, siendo más frecuente en Norteamérica y en Australia, en comparación con Europa6. Los datos encontrados en las poblaciones colombianas son bastante equiparables, encontrando así estimaciones que reportan una prevalencia del 0,02% en la población general y de 23,7 casos por 100.000 habitantes7,8. Es más común en las mujeres (relación 3-8:1)9. El compromiso multisistémico se asocia con una mayor morbimortalidad10, y la mortalidad está relacionada especialmente con el desarrollo de enfermedad pulmonar intersticial secundaria a la esclerosis sistémica (EPI-ES) e hipertensión pulmonar. Estas afecciones se asocian con el 60% de las muertes de los pacientes con ES11,12.
Basándose en las características clínicas, la ES se puede clasificar como: 1) limitada, 2) difusa, y 3) sine esclerodermia La ES limitada se asocia con compromiso cutáneo por debajo de los codos y las rodillas, sin afectar el tronco. La ES difusa se asocia con un compromiso cutáneo que incluye las extremidades proximales y el tronco. Finalmente, la sine esclerodermia no se asocia con compromiso cutáneo y es la más difícil de diagnosticar1, afortunadamente, solo representa el 3% de los casos13.
La caracterización de los subtipos de la enfermedad es importante para evaluar el riesgo de compromiso pulmonar. Por ejemplo, la ES difusa presenta el mayor riesgo de desarrollar EPI-ES12. Además, se han descrito predictores serológicos para el desarrollo de EPI-ES, como la presencia de anticuerpos anti-SCL-70 y altos títulos de anticuerpos antinucleares (ANA) con un patrón nucleolar14.
En el 2013, el Colegio Americano de Reumatología (ACR) y la Liga Europea Contra el Reumatismo (EULAR) desarrollaron una declaración conjunta con los criterios de clasificación de la ES actualizados15, con el fin de unificar los aspectos clínicos y de laboratorio. Estos criterios incluyen el engrosamiento de la piel, lesiones en las yemas de los dedos, fenómeno de Raynaud, capilares anormales en el lecho ungueal, telangiectasias, compromiso pulmonar (hipertensión pulmonar y/o enfermedad pulmonar intersticial), y expresión de anticuerpos anticentrómero, anti-SCL-70, y anti-RNA polimerasa iii15; cada criterio representa un puntaje, y si el puntaje total es de 9 o más, el paciente es clasificado con un diagnóstico definitivo de ES.
Una vez diagnosticada la enfermedad, y considerando el compromiso orgánico específico que podría presentarse en sus etapas iniciales, el procedimiento se enfoca en la identificación de este posible daño orgánico y en iniciar un tratamiento temprano para mejorar la morbimortalidad10,16. Este tamizaje se basa en la búsqueda de hipertensión pulmonar, fibrosis pulmonar, y alteraciones cardíacas, renales y gastrointestinales. Para evaluar el compromiso pulmonar se deben realizar los siguientes procedimientos: ecocardiograma y pruebas de función pulmonar (incluyendo la espirometría, la capacidad de difusión del monóxido de carbono [DLCO], y la prueba de caminata de seis minutos). No obstante, el hecho de usar únicamente las pruebas de función pulmonar proporciona una baja sensibilidad para detectar la EPI-ES16. El uso de la tomografía computarizada de alta resolución (TCAR) ha mostrado un mejor desempeño cuando se utiliza como prueba de tamizaje16,17. Según lo informado por el consenso europeo, basado en la evidencia más reciente sobre la identificación y el manejo de la EPI-ES, se establece, entre otras observaciones acordadas, que todos los pacientes con ES (especialmente si presentan uno o más factores de riesgo) deben ser evaluados para detectar la EPI-ES mediante TCAR, considerándola como la herramienta más confiable para su diagnóstico. Más aún, se afirma que las pruebas de función pulmonar (tales como la espirometría y la DLCO) apoyan los procesos tanto de tamizaje como de diagnóstico y se deben realizar para garantizar un parámetro basal18.
Enfermedad pulmonar intersticial en la esclerosis sistémicaLa fibrosis pulmonar representa una complicación frecuente asociada con la ES, ya que se presenta en aproximadamente el 75% de los pacientes19 y forma parte de los criterios menores de clasificación de la enfermedad15. Las manifestaciones clínicas incluyen tos seca y/o disnea, pero también puede ser asintomática. El examen físico se caracteriza por una auscultación pulmonar con crepitaciones de tipo velcro, pero en las etapas avanzadas de la enfermedad se puede presentar cianosis y signos de insuficiencia cardíaca derecha19,20.
En la fisiopatología de la enfermedad, la presencia del complejo mayor de histocompatibilidad DR3 y DR52, y la presencia de anti-topoisomerasa i19 cobraron importancia, ya que reflejan el desarrollo de una respuesta inflamatoria en el pulmón, en la cual las células T, específicamente las Th2, liberan citocinas tales como IL-4 e IL-13, estimulando la proliferación de fibroblastos y la síntesis de colágeno21. En este proceso también intervienen las células B, que son hiperactivas y sobreexpresan el CD-19, el cual está implicado en la producción de autoanticuerpos y en la fibrosis a través de la producción de IL-6 y TGF-β, que inducen la síntesis de la matriz extracelular, y también inhiben la degradación del colágeno21,22. También está la presencia de autoanticuerpos contra el factor de crecimiento derivado de plaquetas (PDGF), que aumenta la producción de especies reactivas de oxígeno, la expresión del gen del colágeno i, y la conversión de los fibroblastos en miofibroblastos19.
En el año 2002, la Sociedad Torácica Americana y la Sociedad Respiratoria Europea (ATS/ERS) clasificaron la enfermedad pulmonar intersticial de acuerdo a los hallazgos radiológicos e histológicos en: neumonía intersticial usual (NIU), neumonía intersticial no específica (NINE), neumonía intersticial aguda (NIA), neumonía organizada criptogénica (NOC), neumonía intersticial linfoide (NIL), enfermedad pulmonar intersticial asociada a bronquiolitis respiratoria (BR-EPI), y neumonía intersticial descamativa (NID)23,24; sin embargo, cuando la enfermedad pulmonar intersticial se encuentra en una etapa avanzada, es difícil clasificarla19. El tipo de EPI-ES más frecuente es la NINE, que corresponde al 76% de los casos, seguida de la NIU con el 11%20. A pesar de lo anterior, todavía hay casos que quedan completamente fuera de cualquiera de las categorías presentadas y se identifican como enfermedades pulmonares intersticiales no clasificables (EPI no clasificables). Para los pacientes que presentan una EPI no clasificable y tienen características de autoinmunidad, pero que no se ajustan a los criterios específicos de alguna enfermedad del tejido conectivo (ETC) caracterizable, desde el año 2015 la Sociedad Respiratoria Europea/Sociedad Torácica Americana han propuesto una división distinta reconocida como «neumonía intersticial con características autoinmunes» (NICA, o IPAF en inglés) y delimitada por tres dominios centrales: un dominio clínico (síntomas extratorácicos que sugieren una ETC pero por si solos no son suficientes para establecer un diagnóstico), un dominio serológico (autoanticuerpos asociados con ETC, títulos altos de anticuerpos antinucleares (ANA) y factor reumatoide (FR), o ANA en cualquier título con un patrón de tinción centromérico o nucleolar) y un dominio morfológico (patrones radiológicos en la TCAR y características histopatológicas de la biopsia pulmonar). Por lo tanto, las EPI no clasificables, junto con las ETC no clasificables se encuentran dentro de un espectro de variantes indiferenciadas tanto de EPI como de ETC, y otras enfermedades autoinmunes sistémicas25,26.
En la población general, la identificación del tipo de fibrosis pulmonar adquiere importancia ya que define el pronóstico de la enfermedad. La NIU tiene una mortalidad a cinco años del 60-80%27, por el contrario, la NINE tiene un buen pronóstico con una mortalidad a cinco años del 18%28. Sin embargo, Park et al.29 encontraron una mejor supervivencia en la NIU asociada con enfermedades del colágeno, en comparación con la NIU idiopática. Por el contrario, no se encontraron diferencias entre la NINE idiopática y la asociada a enfermedades del colágeno, lo cual confirma que la fibrosis pulmonar asociada con enfermedades reumáticas tiene un mejor pronóstico.
En cuanto a los pacientes con EPI-ES, estudios como el realizado por Okamoto et al.30 encontraron una mortalidad global a ocho años del 34%, identificando un mayor riesgo de mortalidad en los pacientes de 58 años o más (RR 10,6; IC 95% 2,0-194,9; p = 0,005), exacerbaciones agudas (RR 6,1; IC 95% 1,6-20,6; p = 0,0013), y como causa de muerte se observó: infección 33%, exacerbación aguda 33%, y empeoramiento progresivo de la EPI 15%. Al investigar la influencia del patrón de fibrosis pulmonar en la supervivencia, ellos encontraron una mayor mortalidad en la NIU vs. cualquier otro patrón30.
Los predictores de enfermedad severa en la EPI-ES incluyen la etnia afroamericana, el sexo masculino, y una capacidad vital forzada (CVF) ≤ 50% por debajo del valor previsto31. Además, los predictores de mal pronóstico incluyen la CVF, la DLCO (cuanto más bajo es el valor real con respecto al valor previsto, representa un mayor compromiso pulmonar), y el compromiso percibido en la TCAR24,30.
El objetivo de este estudio fue evaluar la efectividad y el nivel de evidencia de los tratamientos farmacológicos disponibles para la EPI-ES basándose en la medición de la prueba de la capacidad de difusión del monóxido de carbono (DLCO), la capacidad vital forzada (CVF) y/o los hallazgos en la tomografía computarizada de alta resolución (TCAR).
Materiales y métodosCriterios de inclusiónTipos de estudiosSe desarrolló una búsqueda sistemática de literatura con el fin de identificar los estudios publicados en inglés, que incluyen metaanálisis, revisiones sistemáticas de la literatura, ensayos clínicos y estudios observacionales, incluyendo estudios de cohortes y de casos y controles.
Tipos de participantesLos estudios debían incluir pacientes de 18 años o más, con un diagnóstico de ES basado en los Criterios de Clasificación ACR/EULAR de 2013 y diagnóstico de enfermedad pulmonar intersticial secundaria a ES.
Tipos de intervencionesEstudios que utilizaron medicamentos aprobados para el tratamiento de la EPI-ES, incluyendo ciclofosfamida, micofenolato de mofetilo, tocilizumab, nintedanib, pirfenidona, rituximab, o fresolimumab.
Tipos de desenlaces medidosLos desenlaces establecidos para esta revisión se basaron en las pruebas de función pulmonar y en los hallazgos radiológicos utilizando la TCAR, que son los principales métodos para el seguimiento de los pacientes con enfermedad pulmonar intersticial.
Los desenlaces primarios evaluados en la revisión incluyen:
- •
Capacidad vital forzada (CVF): es la máxima capacidad de aire que un paciente puede exhalar después de una inspiración máxima. Mide el volumen de aire exhalado en un espirómetro, después de una inspiración máxima. Se reporta como el porcentaje del valor previsto para el paciente.
- •
Prueba de difusión del monóxido de carbono (DLCO): representa la difusión pasiva del monóxido de carbono desde un ambiente con presión parcial alta a otro con una presión parcial más baja. Se mide con la velocidad de difusión del monóxido de carbono desde un alvéolo hasta un capilar por unidad de gradiente de presión (mL/min/mmHg). Se reporta como el porcentaje del valor previsto para el paciente.
- •
Tomografía computarizada de alta resolución (TCAR): es un método que permite el desarrollo de imágenes corporales computarizadas basadas en cortes transversales entre 1 y 1,5 mm utilizando rayos X. Esta imagen diagnóstica se obtiene utilizando una tomografía y reconstruyéndola digitalmente.
Los estudios con las siguientes características no fueron seleccionados para la revisión sistemática:
- •
Pacientes < 18 años de edad
- •
Presencia de otras comorbilidades autoinmunes en los pacientes
- •
Reportes de casos o series de casos
- •
EPI de otras etiologías
Se llevó a cabo una búsqueda sistemática de literatura para recopilar los estudios publicados entre enero del 2015 y el 31 de julio del 2019. La búsqueda se hizo en diferentes bases de datos que incluyen: MEDLINE (PubMed), EMBASE, y el Registro Central Cochrane de Ensayos Aleatorizados Controlados (CENTRAL).
Para establecer la estrategia de búsqueda se utilizaron los operadores booleanos AND, OR, NOT. Los términos que se definieron para la búsqueda incluyeron: interstitial lung disease, systemic sclerosis, scleroderma, antifibrotic agents, pirfenidone, nintedanib, mycophenolate mofetil, cyclophosphamide, rituximab, tocilizumab, fresolizumab, high resolution computer tomography, lung diffusion capacity y forced vital capacity.
Recolección de datos y selección de los estudiosDos investigadores diferentes, quienes aplicaron los mismos términos de búsqueda y estrategias, llevaron a cabo una búsqueda independiente de literatura en bases de datos electrónicas médicas. Cada uno de ellos ejecutó el proceso de selección de los estudios que mejor se ajustaban a los criterios de inclusión definidos previamente. El tamizaje inicial de los estudios se concibió basándose en el título. Luego se aplicó un nuevo filtro mediante la evaluación de los resúmenes de los estudios identificados inicialmente. Finalmente, los que quedaron y fueron útiles para la revisión fueron revisados exhaustivamente, con el fin de escoger los estudios que iban a ser incluidos definitivamente. Se compararon los resultados de cada investigador. En caso de que se presentaran discrepancias en cuanto a la inclusión de un estudio, se llegó a un consenso entre ambos investigadores. Si no se logró un acuerdo, un tercer investigador senior resolvió el asunto.
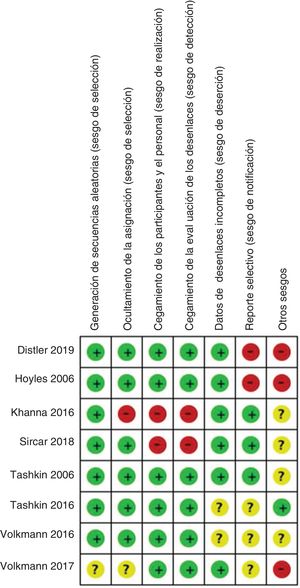
Análisis de los datosCalidad de la evidencia y riesgo de sesgoPara evaluar la calidad metodológica de los estudios y el riesgo de sesgo, se aplicaron varias herramientas y listas de verificación basándose en el diseño del estudio. Para los metaanálisis y las revisiones sistemáticas de literatura se aplicó la herramienta de Evaluación de Múltiples Revisiones Sistemáticas (Assessment of Multiple Systematic Reviews, AMSTAR)32. Para los ensayos clínicos, se evaluó siguiendo las recomendaciones del Manual Cochrane para Revisiones Sistemáticas de Intervenciones33. Para los estudios de cohortes y de casos y controles se aplicó la lista de verificación de la Red Escocesa Intercolegiada de Guías (Scottish Intercollegiate Guidelines Network, SIGN)34.
Medidas del efecto del tratamientoCon base en los desenlaces reportados y en los datos disponibles, se hizo un análisis descriptivo utilizando medidas de tendencia central, dispersión y frecuencia. Las medidas del efecto (riesgo relativo, razón de probabilidades) se calcularon cuando fue posible con la información suministrada en los estudios incluidos.
MetaanálisisCon base en los resultados cuantitativos disponibles y en la homogeneidad de los desenlaces de los estudios incluidos, se desarrolló un metaanálisis. Se construyeron diagramas de bosque (forest plots) para calcular la medición del efecto general de los desenlaces evaluados, utilizando un modelo de efectos mixtos o de efectos aleatorios, dependiendo de la naturaleza de los datos reportados en los estudios seleccionados para el análisis cuantitativo. Para evaluar la heterogeneidad en el metaanálisis se utilizó la prueba I2. Para evaluar el riesgo de sesgo de publicación se construyeron gráficos en embudo (funnel plots). Este proceso se realizó utilizando el software Cochrane Review Manager (RevMan)® versión 5.3 (Copenhague: Centro Nórdico de Colaboración Cochrane, 2014).
ResultadosEncontramos 312 estudios en la búsqueda en diferentes bases de datos. Se extrajeron 58 estudios de MEDLINE PubMed, 134 de Elsevier EMBASE, y 120 estudios de Cochrane CENTRAL. Con el tamizaje inicial basado en el título, se seleccionaron 76 estudios y se excluyeron 236 por no estar relacionados; 49 estudios fueron seleccionados para la evaluación del texto completo después de leer los resúmenes. Por último, se incluyeron 14 estudios en la revisión final (fig. 1).
La descripción de las principales características de los estudios finales incluidos en esta revisión se encuentra resumida en la tabla 1.
Descripción de los estudios incluidos en la revisión sistemática de la literatura
| Estudio | Año de publicación | País | Diseño del estudio | Objetivo | Participantes | Intervenciones | Desenlaces |
|---|---|---|---|---|---|---|---|
| Distler et al.35 | 2019 | Europa (Austria, República Checa, Dinamarca, Finlandia, Francia, Alemania, Grecia, Hungría, Irlanda, Italia, Países Bajos, Noruega, Polonia, Portugal, España, Suecia, Reino Unido) Estados Unidos, Canadá, América del Sur (Argentina, Brasil, Chile), Asia (China, India, Malasia, Japón, Tailandia), Australia | Ensayo clínico doble ciego, aleatorizado, controlado con placebo. | Evaluar la seguridad y la eficacia del nintedanib como tratamiento de la EPI-ES. | Edad: > 18 años. Diagnóstico de ES basado en los criterios de clasificación ACR/EULAR de 2013. Duración de la enfermedad < 7 años. EPI diagnosticada con TCAR al menos 12 meses antes del tamizaje, con fibrosis en el 10% de los pulmones. CVF al menos de 40% del valor previsto. DLCO 30-89% del valor previsto. | Nintedanib (150 mg dos veces al día) o placebo. | Tasa anual de disminución de la CVF, cambio absoluto de la CVF, cambio absoluto de la DLCO, cambio en el mRSS, puntaje SGRQ. |
| Tashkin et al.36 | 2006 | Estados Unidos | Ensayo clínico aleatorizado doble ciego. | Determinar los efectos de la CYC oral sobre la función pulmonar y los síntomas relacionados con la salud en pacientes con evidencia de alveolitis activa y EPI-ES. | Diagnóstico de ES limitada o difusa. Evidencia de alveolitis activa o en el líquido del LBA o en la TCAR. Presencia de opacidades en vidrio esmerilado. Duración de la enfermedad < 7 años. CVF 45-80% del valor previsto. Índice de disnea basal de Mahler grado 2. | CYC oral (dosis inicial: 1 mg/kg/día, aumentada mensualmente hasta 2 mg/kg/día) o placebo. | Todos los desenlaces se midieron después de 12 meses de tratamiento: % de la CVF prevista, CPT, índice de disnea basal de Mahler, puntuación del HAQ, QoL, SF-36. |
| Hoyles et al.37 | 2006 | Reino Unido | Ensayo clínico aleatorizado doble ciego. | Investigar los efectos de la CYC IV seguida de AZA para el tratamiento de la EPI-ES. | 18-75 años de edad. Diagnóstico de ES mediante el cumplimiento de los criterios de clasificación preliminares del ACR de 1980. Presencia de EPI por los hallazgos en la TCAR o en la biopsia pulmonar por toracoscopia. Cumplimiento y asistencia adecuados. | Prednisolona oral 20 mg/día en días alternos y 6 infusiones IV de CYC a una dosis de 600 mg/m2 cada 4 semanas, seguida de AZA 2,5 mg/kg/día como mantenimiento, o placebo. | Cambio en el % de la CVF prevista, cambio en el % de la DLCO prevista. Cambio en el puntaje de disnea. Cambio en la extensión y el patrón de la TCAR después de 1 año de tratamiento. |
| Shenoy et al.38 | 2016 | India | Estudio de cohortes retrospectivo, unicéntrico. | Comparar la eficacia del MMF y la CYC para la mejoría de la función pulmonar en los pacientes con EPI-ES. | Edad > 18 años. Diagnóstico de ES mediante el cumplimiento de los criterios de clasificación ACR/EULAR del 2013. Evidencia de EPI dada por CVF < 80%, y hallazgos en la TCAR. Tratamiento con CYC o MMF en los últimos 3 años. | MMF (dosis inicial de 500 mg/día aumentada hasta una dosis máxima tolerada o 3 g/día) o CYC IV (dosis inicial 600 mg/m2 mensuales durante 6 meses, aumentada hasta 1,2 g según la tolerancia). | % de la CVF prevista medida al inicio del estudio, a los 3 meses, y a los 6 meses. |
| Jordan et al.39 | 2014 | 42 centros EUSTAR. | Estudio de casos y controles anidado, multicéntrico. | Analizar los efectos del RTX en la piel y en la fibrosis pulmonar, y la seguridad en un entorno clínico de la vida real utilizando la cohorte EUSTAR. | Casos: pacientes que reciben RTX en la práctica clínica de rutina. Controles: controles emparejados que no recibieron RTX como tratamiento. Criterios de inclusión: cumplimiento de los criterios de clasificación ACR de 1980 para ES. Evidencia de EPI determinada por 70% de la CVF prevista y los hallazgos de la TCAR. Teniendo al menos un seguimiento. | RTX | Cambio en el % de la CVF prevista desde el inicio del estudio hasta el seguimiento. Cambio en el mRSS desde el inicio del estudio hasta el seguimiento. |
| Van den Hombergh et al.40 | 2018 | Países Bajos | Estudio de cohortes, retrospectivo, abierto. | Analizar si el grado de inflamación, la duración de la ES, el grado de la EPI, o la DLCO basal < 60%, modifican el efecto de la terapia de pulsos con CYC IV sobre la función pulmonar después de 12, 24 y 36 meses, en pacientes con ES-EPI. | Todos los pacientes con EPI-ES que iniciaron terapia de pulsos de CYC IV desde el año 2003. Se definió la EPI como la presencia de opacidades en vidrio esmerilado, panalización o fibrosis pulmonar en la TCAR. | CYC IV (750 mg/m2 mensuales). Algunos pacientes también recibieron MMF después de las infusiones de CYC. Antes del 2013, algunos pacientes recibieron AZA en lugar de MMF después de la CYC. | Se realizaron pruebas de función pulmonar a los 0, 6, 12, 24 y 36 meses de tratamiento. CVF y valores de la DLCO después de 12, 24, y 36 meses. |
| Sircar et al.41 | 2018 | India | Ensayo clínico prospectivo, aleatorizado, abierto. | Evaluar la seguridad y la eficacia de la RTX en comparación con la CYC en el tratamiento de la ES con manifestaciones pulmonares y cutáneas. | Edad: 18-60 años. Diagnóstico de ES difusa mediante el cumplimiento de los criterios de clasificación ACR/EULAR 2013 para ES. Anti Scl-70 positivos. Presencia de EPI determinada por los hallazgos de la TCAR. CVF 45-80% del valor previsto. Máximo 3 años desde el inicio de los síntomas. NYHA clase ii-iii. | RTX (2 pulsos de 1.000 mg en los días 0 y 15, cada 6 meses) o CYC IV (500 mg/m2 mensuales durante 24 semanas, seguida de MMF o AZA). Los pacientes también recibieron prednisolona 10 mg/día, calcio y vitamina D. | % de la CVF prevista a los 24 meses de seguimiento. Cambio absoluto en la CVF después de 6 meses, mRSS a los 6 meses, puntaje de Medsger, aparición reciente o empeoramiento de hipertensión pulmonar existente. |
| Volkmann et al.42 | 2017 | Estados Unidos | Estudio post hoc de ensayos clínicos previos aleatorizados, doble ciego (SLS i y SLS ii). | Comparar el MMF vs. placebo para el tratamiento de la EPI-ES sintomática. | Edad > 18 años. Duración de la enfermedad < 7 años. CVF 40 a 80-85% del valor previsto. DLCO > 40% o 30-39% si no hay HTP. Opacidades en vidrio esmerilado en la TCAR. | MMF (3 g/día en dosis divididas) o placebo. | % de la CVF prevista, % de la DLCO prevista, TDI, mRSS, seguridad. |
| Tashkin et al.43 | 2016 | Estados Unidos | Ensayo clínico controlado, aleatorizado, doble ciego | Comparar la eficacia y la seguridad del MMF vs. CYC oral, seguidos de placebo, en los pacientes con EPI-ES sintomática. | Diagnóstico de ES. Edad 18-75 años. Duración de la enfermedad < 7 años. CVF prevista < 80%, pero > 45% disnea de ejercicio grado 2 o mayor basada en el índice de disnea basal de Mahler. Opacidades en vidrio esmerilado en la TCAR. | MMF (dosis 500 mg-1,5 g BID) durante 24 meses. CYC oral (dosis inicial 50-150 mg, titulada hasta alcanzar la dosis máxima de 1,8-2,3 mg/kg diarios) durante 12 meses seguida de otros 12 meses recibiendo placebo. | Cambio en la CVF como un % del valor normal previsto en 24 meses de seguimiento. Los desenlaces secundarios incluyen el % de la DLCO prevista, y el desarrollo de eventos adversos. |
| Zheng et al.44 | 2019 | China | Metaanálisis en red. | Resumir y evaluar la eficacia relativa y el perfil de seguridad de 6 agentes inmunosupresores para el tratamiento de la EPI-ES. | Estudios que investigan a adultos con diagnóstico de ES o de EPI-ES. Uso de terapias inmunosupresoras con o sin glucocorticoides. Al menos 12 meses recibiendo tratamiento y al menos 12 meses de seguimiento. | CYC, MMF, AZA, MTX por vía oral o IV o combinaciones de los mismos. | Cambio en la CVF como un % del valor normal previsto. % de la DLCO prevista. Eventos adversos. |
| Barnes et al.45 | 2018 | Australia | Metaanálisis | Evaluar la eficacia y los eventos adversos de la CYC en el tratamiento de la EPI-ES. | Ensayos clínicos controlados aleatorizados que investigan a adultos con un diagnóstico de EPI asociada con enfermedades del tejido conectivo (ES, AR, LES, SJ, PM/DM, ETC mixta). Al menos 6 meses recibiendo tratamiento y al menos 12 meses de seguimiento. | CYC oral o IV como monoterapia o concomitantemente con otras terapias inmunomoduladoras, comparada con placebo o MMF. | Cambio en la CVF como un % del valor normal previsto. % de la DLCO prevista. Eventos adversos. Calidad de vida relacionada con la salud. |
| Adler et al.46 | 2018 | Europa (base de datos de EUSTAR). | Estudio observacional retrospectivo. | Analizar el uso actual de los medicamentos inmunosupresores, probar la correlación entre el uso de medicamentos y las pruebas de función pulmonar, y definir tratamientos específicos para características definidas de la enfermedad. | Edad > 18 años. Diagnóstico de ES cumpliendo con los criterios de clasificación ACR de 1980 o ACR/EULAR del 2013. Presencia de EPI basada en los hallazgos de la TCAR y/o de los rayos X de tórax. | Medicamentos inmunosupresores, incluyendo glucocorticoides. CYC, MMF, AZA, MTX, etc. | Características clínicas basales incluyendo la CVF y la DLCO. Evolución de las pruebas de función pulmonar CVF y DLCO (no se suministraron los valores finales. Se presentaron los datos en un gráfico). |
| Khanna et al.47 | 2016 | Canadá, Estados Unidos, Italia | Ensayo clínico aleatorizado, abierto, de fase 2. | Evaluar la seguridad y la tolerabilidad de la pirfenidona en los pacientes con EPI-ES. | Edad 18-75 años. Diagnóstico de ES cumpliendo con los criterios de clasificación ACR de 1980 para ES. Evidencia de EPI basada en los hallazgos de la TCAR dentro de 2 años a partir del inicio del estudio. < 7 años desde el inicio de los síntomas de ES. CVF inicial > 50%, DLCO > 40%. | Pirfenidona: dosis inicial 801 mg/día titulados hasta 2.403 mg/día, titulación en 2 semanas vs. 4 semanas. Uso concomitante de MMF vs. no uso. | Eventos adversos, síntomas gastrointestinales utilizando el cuestionario UCLA SCTC GIT 2.0, % de la CVF prevista, % de la DLCO prevista, desenlaces reportados por el paciente, y mRSS. |
| Volkmann et al.48 | 2016 | Estados Unidos | Ensayo clínico aleatorizado, doble ciego. | Determinar si los cambios en los niveles de CXCL4 pueden predecir mejorías en la función pulmonar en pacientes que reciben MMF o CYC para el tratamiento de la EPI-ES. | Edad: >18-75 años. ES limitada o difusa. EPI activa demostrada mediante un patrón ventilatorio restrictivo (CVF 40-80% del valor previsto). Disnea de ejercicio (índice de disnea basal de Mahler grado 2). Opacidades en vidrio esmerilado en la TCAR. | CYC durante 12 meses seguida de 12 meses de placebo vs. MMF durante 24 meses. | Características clínicas basales incluyendo la CVF, DLCO, niveles de CXCL4. Cambios en la CVF, la DLCO y los niveles de CXCL4 durante 12–24 meses. |
AZA: azatioprina; BID: dos veces al día; CPT: capacidad pulmonar total; CVF: capacidad vital forzada; CYC: ciclofosfamida; DLCO: capacidad de difusión del monóxido de carbono; EPI: enfermedad pulmonar intersticial; EPI-ES: enfermedad pulmonar intersticial asociada a la esclerosis sistémica; EUSTAR: Grupo Europeo de Ensayos e Investigación sobre Esclerodermia; HTP: hipertensión pulmonar; LBA: lavado broncoalveolar; MMF: micofenolato de mofetilo; mRSS: puntaje de piel de Rodnan modificado; MTX: metotrexato; NYHA: puntaje funcional de la New York Heart Association; puntaje SGRQ: capacidad respiratoria de Saint George; RTX: rituximab; TCAR: tomografía computarizada de alta resolución; TDI: índice transicional de disnea; UCLA-SCTC GIT 2.0: Instrumento 2.0 relativo al tracto gastrointestinal del Consorcio de Ensayos Clínicos sobre Esclerodermia de la Universidad de California en Los Ángeles.
El estudio realizado por Distler et al.35 es un ensayo doble ciego, aleatorizado, controlado con placebo, que busca evaluar la seguridad y la efectividad del nintedanib como tratamiento de la EPI-ES. Inicialmente se identificó una aleatorización adecuada, alcanzando una proporción de 1:1 entre el placebo (288 pacientes) y el nintedanib (288 pacientes). Las características clínicas y demográficas de ambos grupos fueron estadísticamente similares entre sí. Todos los datos fueron reportados, incluso si no eran estadísticamente significativos. Se puede ver un sesgo de financiación, ya que fue patrocinado por la compañía farmacéutica Boehringer Ingelheim®. El tratamiento concomitante con micofenolato de mofetilo (MMF) y su influencia en los desenlaces fue identificado como una limitación, considerando que no se tuvo en cuenta para el proceso de aleatorización. En cuanto a los resultados, se puede decir que al final de un seguimiento periódico durante 52 semanas, se identificó una diferencia estadísticamente significativa para el desenlace principal: disminución anual de la CVF con una diferencia de 41,0 mL por año (IC 95% 2,9-79). No se describen diferencias estadísticamente significativas para los criterios de valoración secundarios importantes: cambio absoluto en el puntaje de piel de Rodnan modificado (mRSS) en la semana 52 y cambio absoluto en la calidad de vida para el puntaje total a través del SGRQ (Cuestionario Respiratorio de St. George). Por lo tanto, los investigadores consideran que no hay suficiente evidencia para respaldar al nintedanib como un agente modificador de la enfermedad para la EPI-ES, ya que no influye en otras complicaciones de la enfermedad.
Tashkin et al.36 publicaron un ensayo clínico doble ciego, aleatorizado, controlado con placebo que busca describir la efectividad y la seguridad de la ciclofosfamida oral (CYC) sobre la función pulmonar y los síntomas relacionados con la salud en los pacientes con alveolitis activa y EPI-ES. Ciento cuarenta y cinco pacientes completaron al menos seis meses de tratamiento y fueron incluidos en el análisis. La principal limitación es la alta tasa de pérdidas: solamente 54 y 55 pacientes completaron el estudio en el grupo de la CYC y en el grupo del placebo, respectivamente. Sin embargo, se explican las pérdidas en el seguimiento. Los resultados después de 12 meses de seguimiento muestran un efecto discreto, pero estadísticamente significativo, sobre los cambios en la CVF, con una diferencia media absoluta del 2,53% (IC 95% 0,28-4,79%; p < 0,03) a favor de la CYC en el análisis primario, que incluyó únicamente la CVF basal, y del 2,97% (IC 95% 0,75-5,19%; p = 0,009) en el análisis secundario cuando se incluyó la CVF basal y el peor puntaje para fibrosis en la TAC de alta resolución. Se presentaron datos adicionales a favor de la CYC: una diferencia notable (pero no estadísticamente significativa debido al IC) en la capacidad pulmonar total (CPT) con una diferencia absoluta en el porcentaje del valor previsto del 4,09% (IC 95% 0,49-7,65%; p = 0,026), una mejoría clínicamente significativa en el Índice de Disnea de Mahler (+1,4 ± 0,23), en contraste con el empeoramiento en el grupo del placebo (−1,5 ± 0,43) (p < 0,001 con el uso de un modelo de covarianza) al igual que en el puntaje de discapacidad del HAQ con una diferencia de −0,16% (IC 95% −0,28 a −0,04; p = 0,009) con respecto al grupo placebo y en los dominios de vitalidad (7,99; IC 95% 2,18-13,8; p = 0,007) y salud transicional (−0,66; IC 95% −1,02 a −0,30; p = 0,003) del SF-36 (calidad de vida). En cuanto a los puntajes para el grosor de la piel, ellos también describieron una diferencia de −3,06 a favor de la CYC (IC 95% −3,54 a −0,52; p = 0,008) en 85 pacientes con enfermedad difusa. No se identificaron efectos significativos en la medición del intercambio gaseoso en la DLCO o en la capacidad de difusión ajustada al volumen alveolar (DL:AV). El número de pacientes con eventos adversos graves durante el año de seguimiento fue mayor en el grupo de la CYC que en el grupo de placebo (20 vs. 16) aunque los datos no se consideran estadísticamente significativos. En relación con los eventos adversos no graves, los únicos estadísticamente significativos fueron leucopenia y neutropenia en el grupo de la CYC (p < 0,05). Sobre esta base, se presenta la CYC como un tratamiento potencial para la EPI-ES al mejorar significativamente la disnea, la funcionalidad, la calidad de vida y el grosor de la piel con un perfil de seguridad favorable en un contexto de riesgo-beneficio. Finalmente, debe tenerse en cuenta que en el momento de la publicación no se encontraron estudios prospectivos aleatorizados que evaluaran la efectividad y la seguridad de la CYC para los pacientes con esta enfermedad.
El estudio realizado por Hoyles et al.37 es un ensayo multicéntrico, prospectivo, aleatorizado, doble ciego, que busca evaluar los efectos de la terapia intravenosa con corticoides y CYC, seguidos de azatioprina (AZA) oral para la EPI-ES. Inicialmente se evaluaron en total 152 pacientes, de los cuales 45 cumplieron con los criterios de inclusión y fueron aleatorizados. Solo el 62% de los pacientes (15 del grupo de tratamiento activo y 13 del grupo de placebo) completaron un año bajo las condiciones del estudio, sin embargo, se explicaron las pérdidas. Las características clínicas y demográficas basales fueron similares, a excepción del intervalo entre el momento del diagnóstico y la aleatorización: un promedio de 33 meses en el grupo de tratamiento activo y de 66 meses en el grupo de placebo. Se menciona la asociación económica entre los autores y la compañía farmacéutica Actelion®. La financiación no está esclarecida explícitamente y no está claro si existen conflictos económicos relacionados. La principal limitación fue el tamaño pequeño de la muestra, así como el subconjunto de pacientes seleccionados que se encontraban en una fase relativamente estable de la enfermedad. Del mismo modo, no se especificaron los criterios utilizados para categorizar un evento adverso, como transitorio o como grave. Además, no se muestra la frecuencia de eventos adversos transitorios en el grupo del placebo. La respuesta al desenlace primario (cambio en la CVF en el grupo de tratamiento activo vs. el grupo placebo) mostró una tendencia hacia la significación estadística (p = 0,08), sin alcanzarla. En el grupo de tratamiento activo se muestra una mejoría del 4,19% en la CVF prevista (IC 95% −0,57 a 8,95). En cuanto a los demás desenlaces evaluados (DLCO, CPT, VEF1, puntaje de disnea, y mejoría en la TCAR seriada), no se identificaron diferencias estadísticamente significativas. Se dice que los eventos adversos graves se presentaron en tasas similares en los dos grupos, aunque no se presentan las definiciones operativas apropiadas para verificar esta afirmación. Una vez señaladas las limitaciones y los resultados, se propone como discusión que la tendencia hacia la mejoría de los desenlaces estudiados es intuitivamente mayor que una tendencia hacia el empeoramiento. Del mismo modo, ellos indican que sus resultados son consistentes con los de otros estudios en el mismo contexto, aunque difieren en su significación estadística debido al pequeño tamaño de la muestra. Si bien no proporcionan pruebas contundentes, ellos postulan lo que se describe como una opción de tratamiento.
Shenoy et al.38 desarrollaron un estudio de cohortes retrospectivo en un solo centro, cuyo objetivo era describir la eficacia y la comparabilidad entre el uso de CYC y MMF para el tratamiento de la EPI-ES; recolectando retrospectivamente datos de los tres últimos años de pacientes con EPI-ES que fueron tratados en un centro clínico en la India mediante la administración intravenosa de CYC y MMF basada en un protocolo. El grupo de la CYC tuvo 23 pacientes y el grupo del MMF tuvo 34 pacientes. Al ser un estudio retrospectivo, no se tienen en cuenta las posibles pérdidas de pacientes. Se presentan tanto los datos estadísticamente significativos como los que no lo son, aunque no se suministran intervalos de confianza (IC). Las limitaciones identificadas fueron la falta de un brazo de control para aquellos que no fueron tratados y de un período de seguimiento más prolongado. Después de un seguimiento durante seis meses, la CVF promedio aumentó al 55,99 ± 13,47% del valor basal de 53,44 ± 13,69% en el grupo del MMF (p = 0,003) y al 53,09 ± 14,93% del valor basal de 48,74 ± 15,67% en el grupo de la CYC (p = 0,003). El aumento promedio del porcentaje de la CVF fue del 10,84 ± 13,81% en el grupo de la CYC y del 6,07 ± 11,92% en el grupo del MMF. De manera similar, el cambio en la CVF a los seis meses entre el grupo de la CYC y el grupo del MMF no fue estadísticamente significativo (p = 0,232). Se presentan los porcentajes de aumento, disminución y ningún cambio de la CVF, siendo respectivamente del 68,57%, 28,57% y 2,85% en el grupo de la CYC y del 78,26%, 17,39% y 4,35% en el grupo del MMF. El tratamiento fue bien tolerado en ambos grupos, con solo nueve casos de infección del tracto respiratorio inferior en el grupo de la CYC y cuatro casos en el grupo del MMF. En resumen, se propone que tanto la CYC como el MMF son igualmente efectivos para preservar la función pulmonar de los pacientes con EPI-ES, ya que no solo la estabilizan, sino que también la aumentan en la mayoría de los pacientes, con un perfil de seguridad muy bueno. Finalmente, los autores respaldan el uso de estos dos medicamentos y señalan que el MMF puede ser una mejor opción debido a la toxicidad a largo plazo de la CYC.
El estudio realizado por Jordan et al.39 es un estudio multicéntrico de casos y controles anidados en una cohorte (Cohorte del Grupo Europeo de Ensayos e Investigación en Esclerodermia [European Scleroderma Essay and Research Group, EUSTAR]). El objetivo fue analizar los efectos del rituximab (RTX) sobre la piel y la fibrosis pulmonar y su seguridad en un entorno clínico de la vida real. El emparejamiento y la selección de los pacientes de control de la cohorte se llevó a cabo considerando los siguientes criterios: mRSS, CVF, duración del seguimiento, subtipo de ES, duración de la enfermedad, cotratamiento inmunosupresor, y aquellos que no fueron tratados con RTX. Todos los pacientes aceptaron formar parte de la cohorte EUSTAR, y se incluyeron 63 pacientes. No se adoptaron las medidas necesarias para evitar que el conocimiento de la exposición primaria influyera en la determinación de los casos, ya que estuvo basado en las decisiones de los médicos. La propensión a la confusión en cuanto a la indicación de recibir tratamiento (en este caso RTX) de acuerdo a la severidad de la enfermedad fue identificada como una limitación y como un sesgo de selección potencial. Tampoco se excluyó el efecto clínico de la aplicación de metilprednisolona durante la aplicación del RTX, sin embargo, se aclara que no se encontraron diferencias con los pacientes que no la recibieron (aunque no se presentan los datos). No se presentan los IC, y se aclara que algunos de los datos fueron recopilados retrospectivamente. En cuanto a los pacientes con EPI-ES, se identificaron nueve casos. La mediana de la duración de la enfermedad fue de seis años. El porcentaje de la CVF prevista se mantuvo estable (60,6 ± 2,4 vs. 61,3 ± 4,1%; p = 0,5) después de un seguimiento durante seis meses en los pacientes que recibieron RTX. Los controles emparejados mostraron una disminución del % de la CVF prevista en el seguimiento. Cuando se comparó el cambio absoluto en el % de la CVF prevista, se observaron diferencias significativas entre los pacientes que recibieron RTX y los controles emparejados (0,8 ± 2,2 vs. −4,8 ± 1,7; p = 0,01). La DLCO mejoró en forma moderada (41,1 ± 2,8 vs. 44,8 ± 2,7%; p = 0,03) en los pacientes tratados con RTX, aunque la diferencia con el grupo de control no fue estadísticamente significativa (3,7 ± 1,4 vs. 6,2 ± 6,2; p = 0,9). En cuanto al perfil de seguridad, solo se describieron efectos adversos en el grupo del RTX, siendo las náuseas y las infecciones los más frecuentes en el 25% y el 21% de los pacientes, respectivamente. A pesar de las limitaciones del diseño del estudio, el RTX, de acuerdo a su farmacodinamia y a la fisiopatología de la enfermedad, es un potente agente antifibrinolítico con un perfil de seguridad aceptable en los pacientes con ES. Los autores invitan a ampliar la evidencia en este sentido con futuros ensayos aleatorizados controlados.
Van den Hombergh et al.40 publicaron un estudio de cohortes retrospectivo, abierto, observacional a largo plazo que incluye la recopilación prospectiva de datos y el análisis por intención de tratar. El estudio busca evaluar si la terapia con pulsos de CYC puede ser más efectiva en la fase inflamatoria de la enfermedad y tiene en cuenta los siguientes modificadores del efecto: duración de la enfermedad, más opacidad en vidrio esmerilado que fibrosis, el grado de la EPI, y una DLCO > 60% al inicio del estudio. Los pacientes fueron seleccionados retrospectivamente de un centro clínico holandés donde, desde el 2003, el protocolo establecía el tratamiento de primera línea con CYC. Se presentan las características de los pacientes incluidos, pero no está del todo claro si existen algunos criterios de exclusión adicionales al hecho de no contar con una TCAR o una prueba de función pulmonar al inicio del estudio y de los pacientes no tratados con CYC. No hay un grupo comparador establecido, aunque los resultados se analizan de acuerdo con las diferencias entre los modificadores del efecto. Un total de 44 (58,6%) de los 75 pacientes seleccionados inicialmente completaron 12 ciclos de CYC, sin embargo, se explican los motivos de las pérdidas. El tratamiento concomitante con otros fármacos tales como el MMF (51 pacientes [68%]) se identifica como una limitación (desde el año 2013 se incluyó como estándar de tratamiento de seguimiento en el centro clínico). Se concluye que el tratamiento con CYC implica la estabilización de la función pulmonar en los pacientes con EPI-ES durante tres años (tiempo de seguimiento), sin que esta respuesta al tratamiento tenga mucho que ver con el hecho de recibirlo o no durante la fase inflamatoria de la enfermedad. El 54,7% de los pacientes se mantuvieron estables (cambio en la CVF < 10% y en la DLCO < 15%), 26,7% empeoraron (disminución > 10% de la CVF o > 15% en la DLCO) y 18,7% mejoraron (aumento de la CVF > 10% o un aumento de la DLCO > 15% en comparación con el valor inicial) (p = 0,008). También se pretendió identificar un subgrupo de pacientes cuyas características los hacían buenos respondedores; sin embargo, esto no fue posible. El único modificador del efecto que influyó en el desenlace fue la corta duración de la enfermedad, aunque esto puede ser secundario a la menor pérdida de CVF en el grupo de los malos respondedores. Los investigadores explican su fracaso debido a la falta de un método más objetivo (o un estándar de oro) para medir el grado de inflamación de la EPI.
Sircar et al.41 publicaron un ensayo prospectivo, aleatorizado, abierto, controlado, de grupos paralelos que busca evaluar la seguridad y eficacia del RTX en comparación con la CYC en el tratamiento de los pacientes con ES temprana. Una vez determinados los criterios de inclusión y exclusión, se reclutaron 64 pacientes. Solo se produjeron cuatro pérdidas, las cuales fueron explicadas claramente. Entre las limitaciones y la validez del estudio se identifica la inclusión de pacientes pertenecientes a un solo grupo étnico, ya que se hizo en la India. Del mismo modo, el hecho de ser de etiqueta abierta favorece el sesgo de detección y el sesgo del observador. En comparación con otros ensayos previos, el presente estudio se diferencia por incluir pacientes más jóvenes (promedio de edad de 36 años) con un tiempo de enfermedad más corto (pacientes en etapa temprana determinada por una duración media de la enfermedad de 22 meses), con ES cutánea difusa y positividad para anti Scl-70. En cuanto a los desenlaces, se reporta una mejoría del porcentaje de la CVF prevista a los seis meses en los pacientes que recibieron RTX (de 61,30 al inicio del estudio a 67,52 al final del mismo; p = 0,002) en comparación con aquellos que recibieron CYC (descenso del 59,25 al inicio del estudio a 58,06 al finalizar los seis meses; p = 0,496), estableciendo así una diferencia de medias estadísticamente significativa a favor del RTX de 9,46 (CI 95% 3,01-15,90; p = 0,003). Se puede ver un comportamiento similar en los desenlaces secundarios analizados a los seis meses: la mRSS mejoró significativamente en los pacientes tratados con RTX (de 21,77 al inicio a 12,10 al final) en contraste con los pacientes tratados con CYC (de 23,893 al inicio a 18,33 al final del estudio), la prueba de caminata de seis minutos (+49,97 m en el grupo del RTX vs. +13,24 m en el grupo de la CYC) y la escala de severidad de Medsger (−3,66 en el grupo del RTX vs. −3,64 en el grupo de la CYC) también mejoraron (todos los valores p < 0,001). En cuanto al perfil de seguridad, el número total de eventos adversos fue menor en el grupo del RTX (30%, 9/30) que en el grupo de la CYC (70%, 21/30) (p = 0,02) y solo se presentaron eventos adversos importantes en el grupo de la CYC. Una vez mencionadas las limitaciones y los sesgos, se presentaron datos estadísticamente significativos que posicionan al RTX como una alternativa segura y eficaz para el tratamiento de los pacientes con ES cutánea difusa y positividad para anti-Scl-70.
Volkmann et al.42 realizaron un análisis post hoc derivado de los ensayos i y ii del Scleroderma Lung Study (SLS). El objetivo de este estudio fue comparar los resultados de los pacientes asignados al MMF (del estudio SLS ii) y de los pacientes asignados al placebo (del estudio SLS i). El ensayo SLS i fue diseñado para comparar el uso de la CYC (titulada hasta 2 mg/kg) vs. placebo para el tratamiento de la EPI-ES. En este estudio, 162 pacientes fueron asignados aleatoriamente para recibir alguna de las dos alternativas de tratamiento durante un año. Se incluyó un año adicional de seguimiento sin tratamiento. El ensayo SLS ii fue diseñado para comparar el uso de CYC vs. MMF para el tratamiento de la EPI-ES. Un total de 142 pacientes fueron aleatorizados para recibir ya sea MMF durante dos años de seguimiento o CYC oral durante un año, seguidos de un año adicional recibiendo placebo. Se aplicó un diseño de doble simulación para mantener el carácter doble ciego. Para el estudio real, 69 pacientes fueron inscritos en el grupo del MMF y 79 pacientes en el grupo del placebo. Las características basales fueron similares entre los grupos. Los resultados a través un análisis de modelo conjunto muestran que el tratamiento con MMF se asoció con una mejoría del porcentaje de la CVF prevista después de 24 meses de seguimiento. Las mejorías fueron más significativas durante los primeros 3 a 12 meses de tratamiento, en comparación con el placebo que presentó una disminución de la CVF durante el mismo período. Con base en la estrategia por intención de tratar, se calculó que el 64,4% de los pacientes presentaron alguna mejoría después de 12 meses de seguimiento y el 71% de los pacientes la presentaron después de 24 meses de seguimiento. La mejoría absoluta que presentaron los pacientes después de 24 meses de seguimiento fue > 5% de la CVF prevista. Los datos de los pacientes que completaron el estudio muestran un mayor porcentaje de pacientes que presentan alguna mejoría después de 24 meses de seguimiento (75,5%). Otro hallazgo fue el hecho de que los pacientes con una mayor CVF inicial prevista presentaron mejorías después de 24 meses de seguimiento. Considerando las mejorías en la medición de la DLCO, ellos encontraron que el tratamiento con MMF se asoció con un mayor porcentaje de la DLCO prevista durante los 24 meses de seguimiento (p < 0,001). Durante los primeros tres a 12 meses, los pacientes del grupo del MMF presentaron mejorías, mientras que los del grupo placebo mostraron disminuciones significativas. En conclusión, la evidencia respalda el uso de MMF para el tratamiento de la EPI-ES sintomática, en lo que respecta a mejoras de la función pulmonar en comparación con placebo. Este estudio presenta ciertas limitaciones, ya que se hizo basándose en datos de ensayos previos que se realizaron en diferentes períodos. Existe un riesgo poco claro de sesgo de selección, considerando que los ensayos originales asignaron al azar a los participantes, pero el actual no pudo hacerlo para controlar adecuadamente las variables externas no medidas que pudieran afectar los resultados.
El estudio realizado por Tashkin et al.43 es un ensayo clínico multicéntrico aleatorizado controlado, doble ciego en grupos paralelos (SLS ii), cuyo objetivo fue comparar la eficacia y la seguridad del MMF vs. la CYC en pacientes con EPI-ES sintomática. Los pacientes fueron asignados aleatoriamente utilizando un diseño doble ciego de doble simulación para recibir MMF durante 24 meses, o CYC oral durante 12 meses, seguidos por otros 12 meses recibiendo placebo. Se aplicó una distribución de frecuencias post hoc para los participantes a quienes se les realizó una medición a los 24 meses de seguimiento y presentaron cambios en la CVF con el fin de tener una mejor comprensión de la frecuencia y la magnitud de los cambios individuales en la función pulmonar. Para manejar los datos faltantes se aplicó un análisis por intención de tratar. En total, 142 pacientes fueron elegibles inicialmente; sin embargo, finalmente solo se incluyeron 126 pacientes en el análisis primario ya que no todos los pacientes alcanzaron resultados basales aceptables en la TCAR. De estos pacientes, 63 recibieron MMF y 63 CYC. La evolución del porcentaje de la CVF prevista no difirió entre los grupos de tratamiento durante los 24 meses de seguimiento. Cada grupo mostró mejorías en el porcentaje de la CVF prevista, y las mejorías más importantes fueron reportadas a los 21 meses. A los 24 meses de seguimiento, la mejoría fue del 2,19% para el MMF, y del 2,88% para el grupo de la CYC. El 71,7% de los pacientes que recibieron MMF, y el 64,7% de los pacientes que recibieron CYC tuvieron valores mejorados y no se identificaron diferencias estadísticas. En cuanto a los eventos adversos, más pacientes del grupo de la CYC desarrollaron leucopenia. Se registró trombocitopenia únicamente en el grupo de la CYC. No se identificaron diferencias relacionadas con el desarrollo de anemia o neumonía. Ellos concluyeron que el tratamiento de la EPI-ES con MMF durante dos años o con CYC durante un año se asoció con mejoría significativa de la función pulmonar. No se encontraron diferencias significativas con respecto a la eficacia; sin embargo, el uso del MMF presentó menor toxicidad y mejor tolerancia. Las limitaciones que pudieron ser identificadas fueron la pérdida de seguimiento debida a retiros prematuros, así como la exclusión de pacientes al inicio del estudio para la evaluación del análisis primario. Además, el uso de la CYC oral sola se puede considerar una limitación.
Zheng et al.44 desarrollaron un metaanálisis en red cuyo objetivo era resumir y evaluar la eficacia relativa y el perfil de seguridad de seis terapias inmunosupresoras que incluyen CYC, MMF, AZA, metotrexato (MTX), CYC + AZA, y CYC + MMF, en pacientes con EPI-ES. Ellos identificaron ensayos clínicos aleatorizados, estudios de cohortes y de casos y controles publicados hasta el 31 de julio del 2018 en PubMed, EMBASE, y Cochrane CENTRAL. Además, se incluyeron estudios con el uso concomitante de glucocorticoides. Las terapias inmunosupresoras se deben administrar al menos durante 12 meses, y el tiempo mínimo de seguimiento fue de 12 meses. Ellos desarrollaron un metaanálisis tradicional por parejas para comparar directamente las diferentes terapias, y un metaanálisis en red con un modelo de efectos aleatorios para calcular los IC, las diferencias de medias y las razones de probabilidad para los desenlaces. Se identificaron en total 1.369 estudios a través de búsquedas en las bases de datos y en registros adicionales. Finalmente se incluyeron 10 estudios en el metaanálisis con información de 939 pacientes. En relación con el cambio en el porcentaje de la CVF prevista, ellos identificaron que el uso de CYC (1,6; IC 95% 1,3-1,9) y CYC + AZA (2,7; IC 95% 0,04-5,37) pudo evitar el deterioro de la CVF después de 12 meses de seguimiento, mientras que los demás agentes inmunosupresores no mostraron una eficacia significativa. La monoterapia con AZA fue la opción que tuvo la peor efectividad en cuanto a la reducción del deterioro de la CVF. Considerando el cambio en el porcentaje de la DLCO prevista, ellos observaron que el MMF tenía la mayor probabilidad de reducir el deterioro de la DLCO, en comparación con el resto de las terapias; sin embargo, no se alcanzó una significación estadística. El uso del MTX se asoció con más eventos adversos, en contraste con el uso de AZT, que exhibió menos, en comparación con los otros medicamentos. Sin embargo, las diferencias no fueron estadísticamente significativas. Ellos concluyeron que, aunque no hay ensayos clínicos aleatorizados de alta calidad, la evidencia disponible muestra que la CYC + AZA y el MMF son las mejores opciones de tratamiento para los pacientes con EPI-ES, basándose en la reducción del deterioro de la CVF, y la mejoría de la DLCO, respectivamente. Después de aplicar la lista de verificación de AMSTAR para evaluar la calidad del estudio, se obtuvo un puntaje de ocho, que indica que este metaanálisis es de buena calidad. Entre las debilidades identificadas está el hecho de que los autores no incluyeron datos no publicados (literatura gris) o literatura publicada en idiomas diferentes al inglés. Adicionalmente, no se suministró una lista completa de los estudios incluidos y excluidos.
Barnes et al.45 publicaron una revisión sistemática de la literatura Cochrane y un metaanálisis sobre la eficacia y la seguridad de la CYC para el tratamiento de la EPI asociada a ETC. Ellos incluyeron ensayos clínicos controlados aleatorizados que evaluaron la EPI asociada a ETC. Las ETC asociadas fueron: ES, artritis reumatoide (AR), polimiositis/dermatomiositis, síndrome de Sjogren, lupus eritematoso sistémico (LES) y ETC mixtas. Los estudios compararon la CYC oral o intravenosa utilizada individualmente o con otro medicamento inmunomodulador durante al menos seis meses, y períodos de seguimiento de 12 meses, frente a cualquier tratamiento que no contiene ciclofosfamida. Los efectos del tratamiento se calcularon sobre la base de las diferencias de medias y los IC del 95% para los datos continuos, y de las diferencias de riesgo o razones de probabilidad para los datos dicotómicos cuando fue posible. Para el análisis cuantitativo agrupado se desarrolló un metaanálisis. Ellos identificaron 1.149 estudios en la búsqueda inicial, y 39 estudios fueron seleccionados para la revisión del texto completo. Finalmente, se incluyeron cuatro estudios para el metaanálisis. Tres estudios que incluyeron únicamente pacientes con EPI-ES, y uno de ellos que incluyó pacientes con ES, AR, polimiositis/dermatomiositis y LES. Cada estudio tenía diferentes protocolos de tratamiento, ya que algunos de ellos incluyeron otros medicamentos tales como prednisona, AZA, o MMF. Los grupos de comparación entre el placebo y el MMF variaron. En cuanto a la eficacia de la CYC vs. placebo, ellos encontraron que la diferencia de medias en el porcentaje de la CVF prevista post, tratamiento fue de 2,83 (IC 95% 0,8-4,87; p = 0,006) a favor de la CYC. En cuanto al porcentaje de la DLCO prevista post-tratamiento, la diferencia de medias fue de 1,68 (IC 95% −4,37 a 1,02; p = 0,22) pero no fue estadísticamente significativa. Al comparar la eficacia de la CYC vs. el MMF, ellos encontraron que no se observaron diferencias significativas respecto al porcentaje de la CVF prevista después de 12 meses de tratamiento, o después de finalizado el estudio (diferencia promedio −0,68, IC 95% −5,44 a 4,08; p = 0,78). No se observaron diferencias significativas entre la CYC vs. el MMF o el placebo para los cambios en el porcentaje de la DLCO prevista, sin embargo, hubo heterogeneidad. Con base en estos resultados, los autores concluyeron que con el uso de CYC se asoció un pequeño beneficio en comparación con el placebo en cuanto al porcentaje de la CVF prevista después del tratamiento. Sin embargo, no se pudieron hacer recomendaciones claras ya que el número de estudios disponibles fue limitado y su calidad era baja. Este estudio se evaluó mediante la aplicación de la Lista de Verificación AMSTAR, con un resultado de 11 puntos, que indica que es de alta calidad en cuanto a sus características metodológicas.
El estudio realizado por Adler et al.46 es un análisis descriptivo retrospectivo de la base de datos EUSTAR, que tuvo como objetivo analizar las tendencias actuales del uso de fármacos inmunosupresores, la correlación entre el uso de fármacos y las pruebas de función pulmonar, y establecer tratamientos específicos para características definidas de la enfermedad en los pacientes con EPI-ES. Se recolectaron datos entre el 2004 y el 6 de mayo del 2014. La progresión de la función pulmonar durante el tratamiento se evaluó mediante un análisis de regresión lineal del cambio en la CVF y la DLCO desde el inicio del tratamiento hasta el final del seguimiento. Los regímenes inmunosupresores utilizados fueron evaluados calculando los efectos aditivos y multiplicativos de fármacos individuales en un grupo. Se incluyeron datos de los resultados de 3.778 pacientes, y el 71% de los pacientes utilizaron terapias inmunosupresoras. La edad y la duración de la enfermedad fueron mayores en los pacientes que nunca utilizaron terapias inmunosupresoras. El compromiso cutáneo fue mayor en quienes alguna vez habían utilizado un medicamento, ya que tenían puntajes de Rodnan modificado más altos y presentaron ES difusa con mayor frecuencia. La DLCO y la CVF iniciales fueron más altas en los pacientes que nunca recibieron medicación comparados con aquellos que alguna vez la utilizaron (DLCO 67,4 ± 19,8 vs. 59,9 ± 20, p < 0,001) (CVF 94,9 ± 20,9 vs. 84,4 ± 21,5, p < 0,001). Se observó una historia de compromiso orgánico y una peor clase funcional según la clasificación de la NYHA en los pacientes que alguna vez habían recibido medicación. Los anticuerpos anticentrómero fueron más frecuentes en los pacientes que nunca recibieron inmunosupresión, mientras que el anticuerpo SCL-70 fue común en los pacientes que alguna vez recibieron medicación. En general, a los pacientes con enfermedad más severa y activa se les administraron agentes inmunosupresores, siendo los glucocorticoides los utilizados con mayor frecuencia (58,8%) seguidos de la CYC (19,1%). Los pacientes que recibieron CYC y MMF presentaron los peores valores iniciales de CVF y DLCO. Considerando la evolución de la función pulmonar, había datos disponibles en el 73,6% de los pacientes. El uso de CYC y MMF tuvo un efecto aditivo negativo en los pacientes con enfermedad pulmonar severa. Después de hacer ajustes para confusores potenciales, el uso de glucocorticoides y MMF presentó efectos multiplicativos sobre la evolución de la función pulmonar, mientras que la CYC presentó efectos aditivos hacia valores iniciales de DLCO y CVF más bajos. Ningún medicamento específico pareció ser superior a los demás en cuanto a la evolución de la función pulmonar. En los pacientes con una CVF inicial adecuada (> 75%), el uso de glucocorticoides se asoció con una reducción de la tasa de deterioro. El estudio concluye que las características iniciales de los pacientes desempeñan un papel importante en la selección de la medicación adecuada, con un claro beneficio de la detección precoz de cambios en la función pulmonar y el uso temprano de agentes inmunosupresores. Sin embargo, no se pueden dar recomendaciones específicas, ya que estas observaciones fueron tomadas de datos retrospectivos en los que los cambios en los patrones de prescripción y la información sobre la decisión de cambiar la medicación no estaban disponibles, lo que representa un posible factor de confusión que limita el alcance del estudio. Otra limitación es que los autores no informaron los valores de los cambios en la CVF o en la DLCO, ni la CVF o la DLCO absolutas al final del seguimiento, con el fin de tener datos cuantitativos que respalden las observaciones. Los únicos datos se suministraron en forma de gráficos.
El estudio de Khanna47 es un ensayo clínico abierto internacional multicéntrico aleatorizado en fase ii, cuyo objetivo era evaluar la seguridad y la tolerabilidad de la pirfenidona administrada a los pacientes con EPI-ES. Se permitió el uso previo de CYC o MMF por vía oral, si recibieron una dosis estable durante > 3 meses antes del inicio del estudio. Los pacientes recibieron pirfenidona (cápsulas de 275 mg) a una dosis inicial de 801 mg/día. Los pacientes fueron asignados aleatoriamente a una titulación de dos semanas o de cuatro semanas en una secuencia de 1:1. La aleatorización se llevó a cabo con un sistema de bloques preparado por el patrocinador. Se inscribieron en total 63 pacientes, que fueron asignados aleatoriamente a una titulación de dos semanas o de cuatro semanas. En general, no se observaron diferencias en las características basales, a excepción de una mayor proporción de pacientes con ES limitada en el grupo de titulación de dos semanas, y parámetros de función pulmonar ligeramente mejores en el grupo de titulación de cuatro semanas. El 88,9% de los pacientes completaron el estudio, y el 96,8% de los pacientes experimentaron al menos un evento adverso (los más frecuentes fueron náuseas, cefalea y fatiga). Los eventos adversos fueron más frecuentes en el grupo de titulación de dos semanas. Además, los pacientes que recibieron pirfenidona más MMF presentaron menos eventos adversos graves y menor cumplimiento, comparados con los que recibieron pirfenidona sola. En relación con los resultados de la función pulmonar, no se observaron cambios significativos entre los grupos de titulación de dos y cuatro semanas. El cambio en la CVF con respecto al valor inicial fue similar en ambos grupos (−0,6, SD 8,91 vs. −0,6, SD 5,9), sin embargo, se identificaron diferencias entre los que recibieron MMF vs. aquellos que no lo recibieron, favoreciendo el uso concomitante del MMF para una mejoría de la CVF (sin MMF −0,3, SD 9,5 vs. MMF 0,6, SD 5,82). Se podrían hacer observaciones similares con respecto al cambio en la DLCO prevista. Los autores concluyeron que la pirfenidona tiene una tolerabilidad aceptable, con tasas más bajas de eventos adversos con el régimen de titulación de cuatro semanas. Ellos afirmaron que no se pudieron sacar conclusiones reales con los datos en cuanto a la respuesta al tratamiento porque el diseño no pretendía evaluar la eficacia de los medicamentos utilizados. Considerando la calidad del estudio, existe un bajo riesgo de sesgo de selección basado en un proceso de aleatorización adecuado; sin embargo, este se ve afectado por la falta de ocultación de la asignación. Además, no se utilizaron estrategias de cegamiento, debido a que el objetivo del estudio es evaluar el perfil de seguridad.
El estudio final evaluado fue publicado por Volkmann et al.48, y su objetivo fue valorar la asociación de los niveles de quimiocina CXCL4 con la extensión de la EPI, y determinar si los cambios en los niveles de CXCL4 pueden predecir una mejoría en las pruebas de función pulmonar en los pacientes que reciben MMF o CYC para el tratamiento de la EPI-ES. Estudios previos han demostrado que el CXCL4 puede estar asociado con el proceso de perpetuación de la actividad profibrótica en el contexto de la EPI-ES, ya que se han registrado niveles más altos de esta quimiocina en los pacientes con EPI-ES, en comparación con aquellos con ES sin compromiso pulmonar. Este estudio se realizó en participantes del ensayo SLS ii. Se incluyeron controles sanos con el fin de tener una comparación adecuada del CXCL4 basal. Se obtuvieron muestras de plasma de los pacientes con EPI-ES al inicio del estudio, después de 12 meses, y después de 24 meses de seguimiento. A los controles sanos solo se les tomaron muestras de plasma al inicio del estudio. Para comparar las variables continuas se utilizó la prueba «t» para dos muestras y para las variables categóricas se utilizó la prueba χ2. Se calcularon las correlaciones de Pearson para analizar la relación entre los niveles de CXCL4 y la extensión basal de la EPI (medida mediante la CVF y la DLCO), y para la relación entre los cambios en los niveles de CXCL4 y los cambios en la CVF y la DLCO desde el inicio del estudio hasta los 12 meses de seguimiento. Finalmente, se desarrolló un modelo de efectos mixtos para evaluar la evolución de la CVF y los cambios en los niveles de CXCL4 medidos cada tres meses, entre los 12 y los 24 meses de seguimiento. Se incluyeron en total 136 pacientes (71 que recibieron CYC, y 65 que recibieron MMF) y 67 controles sanos. Como era de esperar, los niveles basales de CXCL4 fueron más altos en los pacientes con EPI-ES, comparados con los controles sanos. No se identificaron diferencias importantes en los niveles de CXCL4 entre los grupos de tratamiento. No se identificaron correlaciones entre los niveles basales de CXCL4 y la extensión de las variables de la EPI (CPT, CVF, DLCO). En cuanto a los niveles de CXCL4, hubo una correlación negativa entre los cambios en los niveles de CXCL4 (desde el inicio hasta los 12 meses), y los cambios en los niveles de CVF (desde el inicio hasta los 18 meses, y los 24 meses). Los resultados del modelo de efectos mixtos muestran que el cambio en los niveles de CXCL4 desde el inicio del estudio hasta los 12 meses se asoció con la evolución de los niveles de CVF desde los 12 hasta los 24 meses de seguimiento, después de controlar para el grupo de tratamiento la extensión basal de la EPI, y la CVF basal. Este estudio proporciona evidencia del potencial de la medición de CXCL4 como biomarcador para predecir la respuesta a la terapia inmunosupresora (CYC y MMF) para el tratamiento de la EPI-ES. Los autores explican las pérdidas en el seguimiento y el manejo de los datos de estos pacientes, condicionando así un bajo riesgo de sesgo de deserción. No obstante, ellos afirman en la discusión que la pérdida de seguimiento afecta el poder estadístico de sus resultados.
Los resultados asociados con los desenlaces primarios definidos para esta revisión se encuentran resumidos en la tabla 2. Cabe señalar que hubo una heterogeneidad importante en cuanto a los desenlaces. Varias secciones de la tabla no presentan datos, ya que estos faltaban en los manuscritos evaluados.
Resumen de los resultados de los estudios incluidos en la revisión. También de los resultados del cálculo de las medidas del efecto basado en la disminución del % de la CVF previstai
| Estudio | Tiempo de seguimiento | Intervención | Comparación | Edad promedio | Número de participantes | % de la CVF prevista | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Intervención | Comparación | Intervención | Comparación | Intervención | Comparación | ||||||||
| Previa (SD o IC 95%)h | Post (SD o IC 95%)h | Cambio (SD o IC 95%)h | Previa (SD) | Post (SD) | Cambio (SD o IC del 95%)h | ||||||||
| Distler et al.35 | 13 meses | Nintedanib | Placebo | 54,6 ± 11,8 | 53,4 ± 12,6 | 288 | 288 | 72,4 ± 16,8 | −1,4 ± 0,4 | 72,7 ± 16,6 | −2,6 ± 0,4 | ||
| Tashkin et al.31 | 24 meses (se tomaron los datos postintervención después de 12 meses de tratamiento) | CYC | Placebo | 48,2 ± 1,4 | 47,5 ± 1,4 | 79 | 79 | 67,6 ± 1,3 | 66,6 ± 1,7 | −1 ± 0,92 | 68,3 ± 1,5 | 65,6 ± 1,6 | −2,6 ± 0,9 |
| Hoyles et al.37 | 12 meses | PDN + CYC seguidas de AZA | Placebo | 55 (mediana de la edad) | 22 | 23 | 80,1 ± 10,3 | 82,5 ± 11,3 | 81 ± 18,8 | 78 ± 21,6 | |||
| Shenoy et al.38 | 6 meses | MMF | CYC | 45,24 ± 13,87 | 46 ± 10,34 | 34 | 23 | 53,44 ± 13,69 | 55,99 ± 13,47 | 6,07 ± 11,92b | 48,74 ± 15,67 | 53,09 ± 14,93 | 10,84 ± 13,81b |
| Jordan et al.39 | 6 meses (mediana de tiempo) | RTX | Controles emparejados sin tratamiento con RTX | 9 | 60,6 ± 2,4 | 61,3 ± 4,1 | 0,8 ± 2,2 | −4,8 ± 1,7 | |||||
| Van den Hombergh et al.40 | 36 meses | CYC | N/A | 58 ± 11 | 75 | 86 (72-97) | 12 meses: 87 (77-99)24 meses: 91 (70-103)36 meses: 90 (72-103) | 12 meses: 2,0 (−0,7-4,7)24 meses: 2.0 (−2,3-6,2)36 meses: 1,0 (−5,5-7,5) | |||||
| Sircar et al.41 | 6 meses | RTX | CYC | 34,67 ± 8,13 | 36,5 ± 9,73 | 30 | 30 | 66,5 ± 11,28 | 67,52 ± 13,59 | 59,25 ± 12,96 | 58,06 ± 11,23 | ||
| Volkmann et al.37 | 24 meses | MMF | Placebo | 52,6 ± 9,7 | 48,1 ± 12,4 | 69 | 79 | 66,5 ± 8,3 | 68,6 ± 13 | ||||
| Tashkin et al.38 | 24 meses | MMF | CYC | 52,6 ± 9,7 | 52 ± 9,8 | 63 | 63 | 66,5 ± 8,3 | 2,19 (0,53-3,84) | 66,5 ± 9,9 | 2,88 (1,19-4,58) | ||
| Barnes et al.45 | 12 meses | CYC | Placebo | 182a | |||||||||
| CYC | MMF | 149 | |||||||||||
| Adler et al.46 | 10 años | Medicamentos inmunosupresores | N/A | 54 ± 13 | 59 ± 13,6 | 2681 | 1097 | 84,4 ± 21,5 | 94,9 ± 20,9 | ||||
| Khanna et al.47 | 11 meses | Pirfenidona (titulación de 2 semanas) | Pirfenidona (titulación de 4 semanas) | 49,3 ± 12,08 | 51,9 ± 12,52 | 32 | 31 | 72,8 ± 14,39 | 71,4 ± 15,14 | −0,6 ± 8,91 | 79,4 ± 13,32 | 78,7 ± 13,6 | −0,6 ± 5,9 |
| Pirfenidona más MMF | Pirfenidona sola | 40 | 23 | 74,5 ± 14,19 | 75 ± 15,13 | 0,6 ± 5,82 | 78,7 ± 13,99 | 75,5 ± 14,26 | −0,3 ± 9,5 | ||||
| Estudio | % de la DLCO prevista | Medición del efecto | Hallazgos en la TCAR | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Intervención | Comparación | OR disminución de la CVF (IC 95%)i | MD% de la CVF prevista (IC 95%) | MD% de la DLCO prevista (IC 95%) | Intervención | Comparación | ||||||
| Previo (SD o IC 95%)h | Post (SD o IC 95%)h | Cambio (SD o IC 95%)h | Previo (SD) | Post (SD) | Cambio (SD o IC 95%)h | > 5% | > 10% | |||||
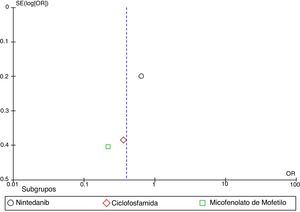
| Distler et al.35 | 52,9 ± 15,1 | −3,21 ± 0,54 | 53,2 ± 15,1 | −2,77 ± 0,54 | 0,65 (0,44-0,96) | 0,82 (0,44-1,52) | ||||||
| Tashkin et al.31 | 47,2 ± 1,6 | 42,8 ± 1,7 | −4,2 ± 1,16 | 47,9 ± 1,7 | 44,3 ± 2,1 | −3,5 ± 1,0 | 0,36 (0,17-0,78) | |||||
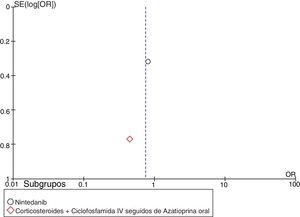
| Hoyles et al.37 | 52,9 ± 11,5 | 49,6 ± 10,7 | 55 ± 12,9 | 51,8 ± 14,9 | 0,45 (0,10-2,07) | 4,19 (0,57-8,95)c | No se reportaron diferencias significativas | 40%d | 20%d | |||
| Shenoy et al.38 | 1,65 (0,46-5,94) | |||||||||||
| Jordan et al.39 | 41,1 ± 2,8 | 44,8 ± 2,7 | 3,7 ± 1,4 | 6.2 ± 6.2 | 3,16 (1-10,03) | |||||||
| Van den Hombergh et al.40 | 42 (32-56) | 12 meses: 45 (36-58)24 meses: 43 (35-57)36 meses: 43 (36-61) | 12 meses: − 0,5 (−2,8-1,7)24 meses: 0,3 (−3-3,5)36 meses: 1,6 (−2,5-5,7) | |||||||||
| Sircar et al.41 | 1,16 (0,4-3,35) | 9,46 (3,01-15,9) | ||||||||||
| Volkmann et al.37 | 54 ± 11,1 | 46,2 ± 13,3 | 0,22 (0,1-0,5) | 27,2 ± 13,2e | 35,3 ± 16,9e | |||||||
| Tashkin et al.38 | 54 ± 11,1 | −0,4 (−2,81–2,01) | 54,1 ± 14,1 | −2,14 (−4,59–0,31) | 0,64 (0,29-1,43) | 0,95 (−41-2,2)f | 1,84 (−5,16-1,46)f | |||||
| Barnes et al.45 | 2,83 (0,8-4,87) | −1,66 (−4,39-1,07) | ||||||||||
| 0,82 (3,95–2,31) | −1,41 (−10,4-7,58) | |||||||||||
| Adler et al.46 | 59,9 ± 20 | 67,4 ± 19,8 | 45,5%g | 30,3%g | ||||||||
| Khanna et al.47 | 59,3 ± 14,36 | 60.6 ± 19,12 | 0,7 ± 9,57 | 60,1 ± 18,64 | 63.4 ± 18,12 | 3,2 ± 10 | ||||||
| 61,4 ± 17,26 | 64,7 ± 19,8 | 3,2 ± 10,85 | 56,8 ± 14,92 | 57 ± 14,96 | 0,2 ± 7,12 | |||||||
AZA: azatioprina; CVF: capacidad vital forzada; CYC: ciclofosfamida; DLCO: capacidad de difusión del monóxido de carbono; IC 95%: intervalo de confianza del 95%; MD: diferencia de medias; MMF: micofenolato de mofetilo; PDN: prednisolona; RTX: rituximab; SD: desviación estándar; TCAR: tomografía computarizada de alta resolución.
En cuanto a la calidad de los ensayos clínicos que fueron calificados siguiendo las recomendaciones del Manual Cochrane de Revisiones Sistemáticas (figs. 2 y 3), hay un riesgo bajo de sesgo de selección y realización, considerando que la mayoría de los estudios utilizaron un método de aleatorización adecuado y las asignaciones fueron descritas con claridad (bajo riesgo al menos en el 75% de los casos). Además, hubo un riesgo bajo de sesgo de realización y detección, considerando que seis de ocho estudios fueron doble ciego. Dos ensayos clínicos fueron abiertos, lo cual aumentó el riesgo de sesgo. En relación con el sesgo de deserción, la mayoría de los estudios describen la pérdida de pacientes durante el seguimiento, y el tratamiento estadístico que se les dio a los datos faltantes, lo que da lugar a un bajo riesgo de sesgo. En el caso del sesgo de notificación, existe un riesgo de moderado a alto de que esté presente, ya que algunos estudios no describieron adecuadamente el papel de los patrocinadores que pueden influir en la publicación de ciertos datos. Basándose en esto, se podría considerar que la calidad general de los ensayos clínicos incluidos es de moderada a alta.
La evaluación de la calidad de las cohortes se hizo utilizando la lista de verificación SIGN (tabla 3). Los estudios desarrollaron una pregunta de investigación apropiada. Los participantes de cada grupo fueron seleccionados de poblaciones comparables. No se suministró información sobre el número de pacientes a quienes se les pidió que participaran, ya que se trataba de cohortes retrospectivas. Uno de los estudios comparó los desenlaces entre los participantes y aquellos pacientes que se perdieron durante el seguimiento. En ambos estudios se definieron claramente los desenlaces, y se suministró evidencia respecto a los métodos que se utilizaron para medirlos. Como eran estudios retrospectivos, no fue posible el cegamiento. Durante el análisis se consideraron los principales confusores potenciales. Solo uno de ellos reportó IC.
Evaluación de la calidad de la evidencia de los estudios de cohortes utilizando la lista de verificación SIGN
| Herramienta de evaluación crítica SIGN para la lectura de la evidencia en estudios de cohortes | Estudio | ||
|---|---|---|---|
| Shenoy et al. | Van den Hombergh et al. | ||
| ¿El estudio aborda una pregunta apropiada y claramente enfocada? | Sí | Sí | |
| Selección de los sujetos | Los dos grupos que están siendo estudiados son seleccionados de poblaciones de origen que son comparables en todos los aspectos, a excepción del factor que se está investigando. | Sí | No aplica |
| El estudio indica cuántas de las personas a quienes se les pidió que tomaran parte en él lo hicieron, en cada uno de los grupos que están siendo estudiados. | No aplica | No aplica | |
| La probabilidad de que algunos sujetos elegibles pudieran tener el desenlace en el momento de la inscripción se evalúa y se tiene en cuenta en el análisis. | No aplica | No aplica | |
| ¿Qué porcentaje de individuos o grupos reclutados en cada brazo del estudio se retiró antes de que terminara el estudio? | No aplica | No aplica | |
| Se hizo una comparación por estado de exposición entre todos los participantes y los que se perdieron en el seguimiento. | No aplica | Sí | |
| Evaluación | Los desenlaces están claramente definidos. | Sí | Sí |
| La evaluación del desenlace se hace cegada al estado de exposición. | No aplica | No aplica | |
| Cuando no fue posible el cegamiento, hay algún reconocimiento de que el conocimiento del estado de exposición podría haber influido en la evaluación del desenlace. | Sí | Sí | |
| La medición de la evaluación de la exposición es confiable. | Sí | Sí | |
| Se utiliza la evidencia de otras fuentes para demostrar que el método de evaluación de los desenlaces es válido y confiable. | Sí | Sí | |
| El nivel de exposición o el factor pronóstico se evalúan más de una vez. | No aplica | Sí | |
| Factores de confusión | Se identifican los principales confusores potenciales y se tienen en cuenta en el diseño y el análisis. | Sí | Sí |
| Análisis estadístico | ¿Se han suministrado intervalos de confianza? | No | Sí |
La evaluación de la calidad del estudio de casos y controles también se llevó a cabo mediante la aplicación de la lista de verificación SIGN de la tabla 4. En general, éste es un estudio de alta calidad considerando que aborda una pregunta de investigación apropiada, los casos y controles se reclutaron de poblaciones comparables, y se aplicaron los mismos criterios de inclusión y exclusión. No se suministró información respecto al número de pacientes a quienes se les pidió que participaran, y no se hizo una comparación entre los participantes y los no participantes. Los casos y controles se definieron claramente en el diseño. La exposición se midió de una manera estándar confiable, y durante el análisis se consideraron las variables de confusión. No se presentaron IC en el manuscrito.
Evaluación de la calidad de la evidencia de los estudios de casos y controles utilizando la lista de verificación SIGN
| Herramienta de evaluación crítica SIGN para la lectura de la evidencia en estudios de casos y controles | Estudio | |
|---|---|---|
| Jordan et al. | ||
| ¿El estudio aborda una pregunta apropiada y claramente enfocada? | Sí | |
| Selección de los sujetos | ¿Los casos y controles se toman de poblaciones comparables (a excepción del factor que se está investigando)? | Sí |
| ¿Se utilizan los mismos criterios de inclusión tanto para los casos como para los controles? | Sí | |
| ¿Qué porcentaje de cada grupo (casos y controles) participó en el estudio? | No hay información disponible | |
| ¿Se hizo una comparación entre los participantes y los no participantes para establecer sus similitudes y diferencias? | No | |
| ¿Los casos están claramente definidos y diferenciados de los controles? | Sí | |
| ¿Está claramente establecido que los controles no son casos? | Sí | |
| Evaluación | ¿Se adoptaron medidas para evitar que el conocimiento de la exposición primaria influya en la comprobación del caso? | No |
| ¿Se mide la exposición de una manera estándar, válida y confiable? | Sí | |
| Factores de confusión | ¿Se identifican los principales confusores potenciales y se tienen en cuenta en el diseño y el análisis? | Sí |
| Análisis estadístico | ¿Se presentan los intervalos de confianza? | No |
Para desarrollar el análisis cuantitativo, se definió que las mediciones del efecto se iban a calcular basándose en el desenlace reportado con mayor frecuencia en los estudios incluidos en esta revisión, que en este caso fue el porcentaje de la CVF prevista. Los desenlaces de efectividad se basaron en el empeoramiento calculado del porcentaje de la CVF prevista. Se aplicaron dos categorías: disminución de la CVF > 5%, o disminución de la CVF > 10%. La medida de efecto seleccionada en este caso fue el cálculo de la razón de probabilidad (OR) para lograr una disminución de la CVF > 5% o > 10%, dependiendo de los datos disponibles en cada estudio incluido. El OR se calculó comparando los resultados de la medicación de intervención con la comparación (medicación o placebo). Dada la heterogeneidad de los datos reportados en los estudios, y la diversidad de los diseños de los estudios (ensayos clínicos, cohortes, estudios de casos y controles, metaanálisis), el cálculo del OR no fue posible en todos los casos. En la tabla 2 se presentan los resultados de las mediciones del efecto calculadas.
Con base en los resultados finales de las mediciones del efecto, se consideró la posibilidad de realizar un metaanálisis. Después de un consenso entre los autores, se decidió que el análisis se centraría en evaluar el efecto de los tratamientos farmacológicos vs. placebo, para el desarrollo de una disminución de la CVF > 5% o > 10%. Dadas las características de los datos, se aplicó un modelo de efectos aleatorios para el proceso.
Para el desenlace de la disminución de la CVF > 5% al comparar el tratamiento farmacológico vs. placebo, se seleccionaron tres estudios. El estudio realizado por Distler et al.35 comparó el nintendanib vs. placebo, con un resultado a favor de un empeoramiento de los valores de la CVF con el placebo (OR 0,65; IC 95% 0,44-0,96). Los datos de la CYC vs. placebo se tomaron de los datos reportados por Tashkin36, y los resultados mostraron que la CYC se asoció negativamente con una disminución de la CVF > 5% (OR 0,36; IC 95% 0,17-0,76). Volkmann et al.42 reportaron datos que comparan el MMF vs. placebo, y la medición del efecto favorece de nuevo al placebo para una disminución > 5% de la CVF (OR 0,22; IC 95% 0,1-0,48). Con estos datos se construyó un diagrama de bosque (fig. 4), que muestra claramente que la evidencia respalda el uso de fármacos vs. placebo para evitar un empeoramiento de la función pulmonar en los pacientes con EPI-ES, específicamente la CVF. El resultado global fue OR 0,4 (IC 95% 0,21-0,78), lo que indica que la probabilidad de presentar una disminución de la CVF > 5% es 0,4 veces mayor en los pacientes que reciben agentes farmacológicos en comparación con el placebo. El MMF fue el medicamento que menos se asoció con el desenlace. Los estudios utilizados presentan una gran heterogeneidad, que es sustentada por un I2 = 70%. Los resultados fueron estadísticamente significativos considerando un valor de p = 0,007 para el efecto global.
El gráfico en embudo resultante de los estudios incluidos que analiza el desenlace de la disminución de la CVF > 5% se encuentra en la fig. 5. El gráfico muestra que el ensayo del nintedanib vs. placebo presentó el mayor tamaño de muestra y es el más cercano al efecto global esperado. Los estudios que evalúan la CYC y el MMF muestran un tamaño de muestra inferior, pero aún se acercan al efecto esperado. Puede haber un bajo riesgo de sesgo de publicación.
El segundo desenlace evaluado fue la disminución de la CVF > 10%. Siguiendo el proceso descrito anteriormente, se seleccionaron dos estudios para el metaanálisis, con base en el resultado de la medición del efecto (fig. 6). De nuevo se seleccionó el estudio de Distler et al.35, que comparó el nintedanib vs. placebo, y los resultados fueron un OR a favor de que el nintedanib está asociado negativamente a una reducción de la CVF > 10%; sin embargo, los resultados no fueron significativos (OR 0,82; IC 95% 0,44-1,53). Hoyles et al. compararon la prednisona oral + CYC seguidas de AZA vs. Placebo, y los resultados mostraron de nuevo una asociación negativa entre el régimen farmacológico, comparado con el placebo; sin embargo, no se obtuvo una diferencia significativa (OR 0,45; IC 95% 0,10-2,03). Como se esperaba, los resultados agrupados no mostraron diferencias estadísticas en los estudios incluidos (OR 0,75; IC 95% 0,42-1,33). No se detectó heterogeneidad entre los estudios, basándose en I2 = 0%. Los resultados no fueron estadísticamente significativos para el efecto global (p = 0,33).
En la figura 7 se presenta el gráfico en embudo para este desenlace. De nuevo, el ensayo del nintedanib presenta el mayor tamaño de muestra y es el que conduce a una medición efectiva del desenlace. El estudio realizado por Hoyles et al. presenta un tamaño de la muestra significativamente menor; sin embargo, se mantiene cercano al eje del embudo. Puede existir un sesgo de publicación en este estudio final, ya que la gráfica lo muestra lejos de la línea de ningún efecto, cuando el comportamiento esperado debería ser al contrario.
DiscusiónLa EPI sigue siendo una situación desafiante en los pacientes con ES, considerando que es una de las complicaciones más frecuentes de la enfermedad. Dada la naturaleza de esta afección fibrótica, su tratamiento representa una gran dificultad, ya que las opciones terapéuticas disponibles para tratar de controlar la progresión de la enfermedad son limitadas. Sobre la base de este escenario, esta revisión sistemática de la literatura tuvo como objetivo evaluar la efectividad de diferentes agentes farmacológicos para el tratamiento de los pacientes con EPI-ES. La mayoría de los estudios disponibles son ensayos clínicos que evalúan varios agentes inmunosupresores como la CYC y el MMF, en comparación con placebo u otros regímenes terapéuticos. El propósito en la mayoría de ellos fue evaluar la evidencia objetiva de detención de la progresión de la enfermedad o incluso de la mejoría de la función pulmonar, que generalmente se expresaron en términos de cambios en el porcentaje de la CVF prevista.
La CYC fue el agente farmacológico utilizado con mayor frecuencia en los ensayos, especialmente la presentación parenteral para cumplir con el régimen de pulsos mensuales durante la etapa de inducción. Todos los estudios que comparan la CYC con placebo muestran mejorías en la función pulmonar, el grosor de la piel y la calidad de vida de los pacientes. Las mejorías fueron sustentadas por cambios en el porcentaje de la CVF prevista, mientras que los cambios en el porcentaje de la DLCO prevista no fueron significativos. Un estudio presenta evidencia del uso de CYC seguida de AZA como tratamiento alternativo, que también parece ser beneficioso para la mejoría de la función pulmonar en comparación con el placebo. Sin embargo, una de las dudas más recurrentes sobre el uso de la CYC es el perfil de eventos adversos asociados a su uso. Esa fue la razón por la que se han estudiado otras alternativas farmacológicas.
El MMF es un medicamento que se utiliza con frecuencia como alternativa a la CYC para el tratamiento de estos pacientes. Los estudios evaluados muestran evidencias de que el MMF no presenta diferencias significativas al compararlo con la CYC en cuanto a la efectividad para el tratamiento de la EPI-ES. Sin embargo, este medicamento es mejor tolerado y se asocia con menos toxicidad en comparación con la CYC. Representa una alternativa de tratamiento más segura durante la inducción y el mantenimiento. Como se esperaba, los estudios que comparan el MMF vs. placebo también están a favor del MMF en cuanto a mejorías en el porcentaje de la CVF prevista.
Otro medicamento alternativo que ha sido estudiado es el RTX. La evidencia disponible muestra que el RTX también se asocia con una estabilización e incluso mejoría de las pruebas de función pulmonar (% de la CVF prevista sobre la DLCO). Al compararlo con la CYC, el RTX parece inducir una mejor respuesta funcional que la CYC, y se asoció con menos eventos adversos. Parece que funciona en forma adecuada en los pacientes con ES difusa y anticuerpos anti Scl-70 positivos. Como es de esperar, la inmunosupresión que aumenta el riesgo de infecciones representa la mayor alarma con respecto al uso de este medicamento.
Recientemente, múltiples agentes antifibróticos que se utilizan en la EPI han sido estudiados para su aplicación en los pacientes con EPI-ES. En esta revisión, el nintedanib parece reducir y retrasar la progresión de la enfermedad medida mediante una reducción del porcentaje de la CVF prevista. Sin embargo, no tiene ningún efecto sobre otras manifestaciones asociadas con la ES. Se necesita más evidencia sobre el uso de este medicamento para poder definir una recomendación clara. Otro agente antifibrótico que se ha estudiado es la pirfenidona. La evidencia encontrada durante esta revisión se centró en la evaluación de la seguridad y la tolerabilidad de este medicamento en los pacientes con EPI-ES. Se suministraron datos preliminares relacionados con la función pulmonar, que muestran que el uso concomitante de pirfenidona con MMF se asoció con una mejoría de la función pulmonar, en comparación con la pirfenidona sola. Sin embargo, el diseño del estudio no permite el desarrollo de recomendaciones. No obstante, el medicamento muestra un perfil de seguridad y tolerabilidad adecuado, lo que debería incentivar la realización de futuros estudios con la pirfenidona, para evaluar específicamente su efectividad.
Durante la búsqueda se encontró información adicional además de la efectividad del tratamiento específico. En la actualidad, los únicos métodos disponibles para el seguimiento de la respuesta al tratamiento en los pacientes con EPI-ES se basan en la medición periódica de las pruebas de función pulmonar, la TCAR y la evaluación funcional a través de cuestionarios estándar validados. Los esfuerzos recientes están dirigidos a la identificación de biomarcadores potenciales que puedan ayudar en el seguimiento de pacientes sin necesidad de intervenciones invasivas o de alto costo. Volkmann et al.48 aportaron alguna evidencia sobre el uso de los niveles de quimiocina CXCL4 como un biomarcador de respuesta durante el tratamiento de la EPI-ES. Ellos mostraron reducciones significativas en los niveles de CXCL4 en los pacientes que recibieron CYC o MMF durante 12 meses o más, y estas se asociaron inversamente con mejoras en el porcentaje de los niveles de CVF previstos. Se requieren más estudios para evaluar este biomarcador potencial.
Respecto a la calidad general de los estudios encontrados durante esta revisión, se podría considerar que la mayoría de ellos son de alta calidad, teniendo en cuenta que ocho estudios fueron ensayos clínicos de calidad moderada a alta (basados en la evaluación de sesgos), y dos metaanálisis de alta calidad (una revisión Cochrane, y un metaanálisis en red). Solo se incluyeron cuatro estudios observacionales, la mayoría de los cuales lograron una buena calidad de evidencia basada en el diseño metodológico. Aunque la evidencia presentada en esta revisión tiene una calidad general adecuada, todavía hay una cantidad limitada de estudios basados en este tema.
Este estudio representa una revisión actualizada de la evidencia disponible sobre la efectividad de diferentes agentes farmacológicos utilizados para el tratamiento de la EPI-ES. Incluso si anteriormente se publicaron revisiones sistemáticas de la literatura, éstas se centraron en medicamentos individuales o no se incluyeron estudios más recientes en las mismas. Además, la inclusión de agentes antifibróticos y tratamientos biológicos como el RTX le aporta un beneficio a este estudio. Sin embargo, también existieron limitaciones. La exclusión de resúmenes de reuniones y series de casos pudo haber reducido el alcance de otros agentes farmacológicos nuevos utilizados en estos pacientes. Además, la cantidad limitada de estudios y la heterogeneidad de los desenlaces y las comparaciones no permitieron el desarrollo de un metaanálisis de alta calidad, lo que redujo la opción de proponer recomendaciones a partir de este ejercicio.
ConclusiónLa EPI representa una de las complicaciones más frecuentes que presentan los pacientes con EPI-ES. Las estrategias farmacológicas para el tratamiento de esta afección se basan especialmente en el uso de agentes inmunosupresores, siendo la CYC y el MMF los más utilizados; este último es la opción preferida debido a un mejor perfil de seguridad. Se están estudiando otros medicamentos como alternativas, incluyendo el RTX y agentes antifibróticos como el nintedanib o la pirfenidona. La evidencia sigue siendo limitada en este tema, y se requieren más investigaciones futuras para desarrollar recomendaciones sólidas para el tratamiento.
FinanciaciónEsta investigación no recibió ninguna subvención específica de agencias de fianciación en los sectores público, comercial o sin fines de lucro.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.