Special Issue: Reumatología en época COVID
More infoLa colchicina es ampliamente utilizada en enfermedades inflamatorias como la gota y la fiebre mediterránea familiar. Debido a su capacidad inmunomoduladora, podría tener un papel importante en el tratamiento de la COVID-19.
ObjetivoExplorar la evidencia médica publicada hasta el 28 de diciembre del 2020, acerca de la eficacia y la seguridad de la colchicina en el tratamiento de pacientes con infección confirmada por SARS-CoV-2.
Material y métodosRevisión exploratoria de la literatura que incluyó PubMed y Scopus. Se tuvieron en cuenta registros de ensayos clínicos y publicaciones con datos empíricos (estudios observacionales y experimentales) en inglés y español.
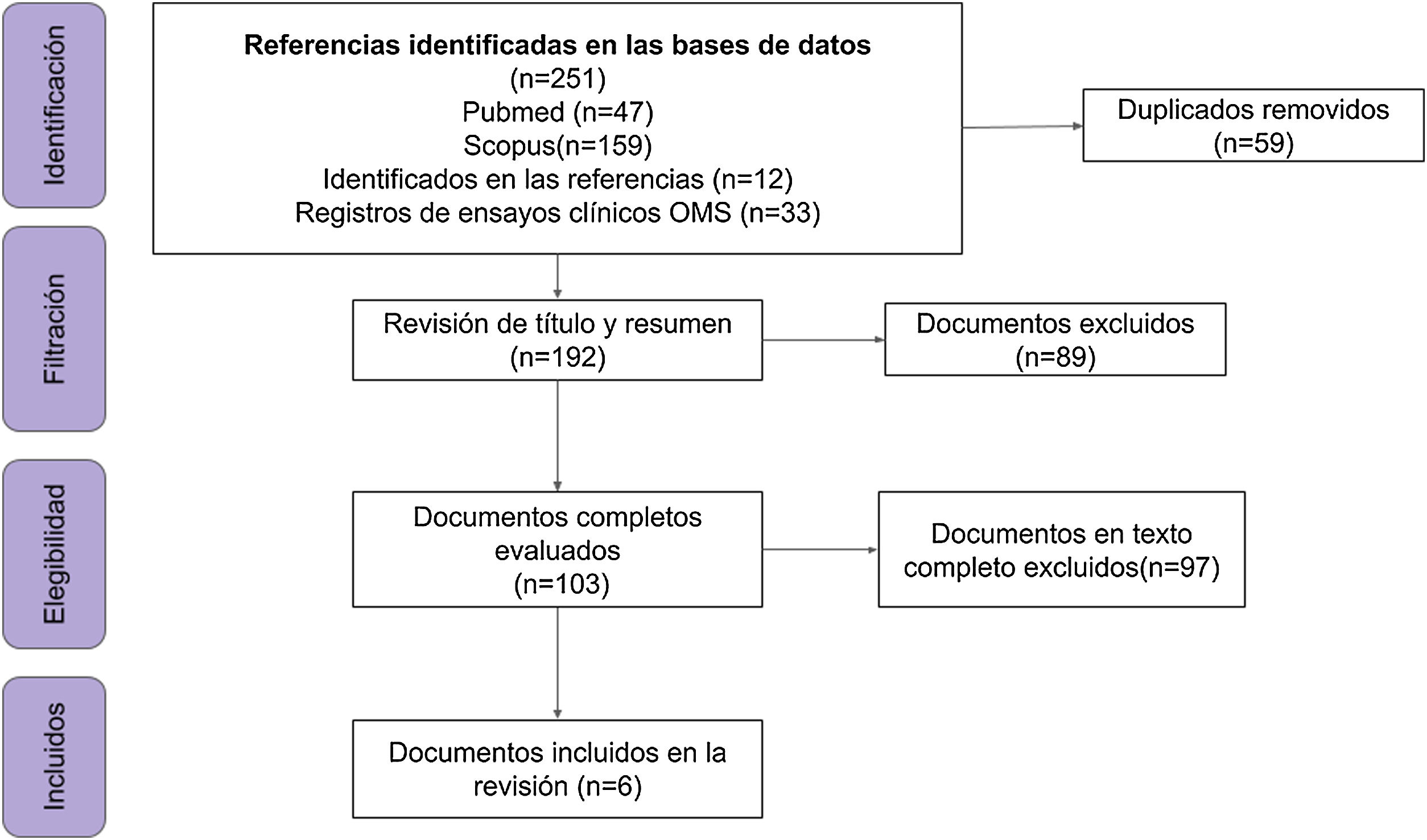
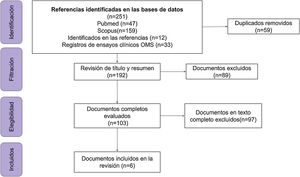
ResultadosSe encontraron 33 ensayos clínicos y 6 publicaciones empíricas: estudios de cohorte prospectivos (n=2) y retrospectiva (n=2), ensayo clínico aleatorizado (n=1) y estudio casos y controles (n=1). La suma de los participantes en los ensayos es de 46.324 individuos, el 73% (24/33) de los estudios recluta a la población de estudio y el 51% (17/33) son fase 3.
ConclusionesUn ensayo clínico respalda la disminución en marcadores inflamatorios pronósticos y el tiempo de estancia hospitalaria en la infección por SARS-CoV-2. Los ensayos clínicos en desarrollo ayudarán a esclarecer la eficacia y la seguridad de la colchicina para el manejo de pacientes con COVID-19.
Colchicine is widely used to treat inflammatory diseases such as gout and Mediterranean fever. Due to its immunomodulatory capacity, it could play an important role in the treatment of COVID-19.
ObjectiveTo explore the current available medical evidence, published until 28 December 2020, regarding the efficacy and safety of colchicine in the treatment of patients with confirmed SARS-CoV-2 infection.
Material and methodsScoping review of the literature that included PubMed and Scopus. Records of clinical trials and publications with empirical data (observational and experimental studies) in English and Spanish were included.
ResultsA total of 33 clinical trials and 6 publications were found: prospective (n=2) and retrospective (n=2) cohort studies, randomised clinical trials (n=1) and case-control studies (n=1). The total number of participants in the trials is 46,324 individuals, 73% (24/33) of the studies are recruiting participants and 51% (17/33) are phase 3 studies.
ConclusionsOne clinical trial reports a decrease in prognostic inflammatory markers and length of hospital stay in SARS-CoV-2 infection. The ongoing clinical trials will clarify the efficacy and safety of colchicine for the management of patients with COVID-19.
En diciembre del 2019 en Wuhan, China, se reportó el primer caso de un nuevo coronavirus (SARS-CoV-2), causante de la actual pandemia por la enfermedad por coronavirus 2019 (COVID-19)1. Alrededor del 80% de los pacientes con COVID-19 son asintomáticos y el curso de la enfermedad es generalmente autolimitado2. Pese a ello, aproximadamente el 20% de los pacientes infectados presenta una enfermedad grave o crítica, causada por una activación excesiva del sistema inmunitario o «tormenta de citocinas» y daño multiorgánico, que afecta principalmente el pulmón con síndrome de dificultad respiratoria agudo (SDRA)3. Se ha reportado un incremento en citocinas proinflamatorias como la interleucina-6 (IL-6) y el factor de necrosis tumoral alfa (TNF-a). De la misma manera, la activación del inflamasoma NLRP3 mediado por las interleucina-18 y 1β (IL-18/IL-1β) desempeña un papel vital en la patogénesis de la enfermedad grave en pacientes con COVID-194,5.
La clasificación actual de severidad de la COVID-19 se divide en: a) pacientes asintomáticos; b) infección leve, presentando principalmente tos seca, astenia, adinamia, mialgias, odinofagia, entre otros, sin signos clínicos de neumonía; c) enfermedad severa, que se asocia con signos clínicos de neumonía (fiebre, tos, disnea, taquipnea), frecuencia respiratoria ≥ 30/min, saturación de oxígeno en sangre ≤ 93%, PaO2/FiO2 ≤ 300 o infiltrados pulmonares; y, por último, enfermedad crítica d), la cual se manifiesta con insuficiencia respiratoria, choque séptico o falla multiorgánica6.
En la actualidad, los tratamientos antivirales (hidroxicloroquina, lopinavir e interferón) no han logrado demostrar resultados positivos en términos de mortalidad, inicio de la ventilación o duración de la estancia hospitalaria en pacientes con COVID-197. Únicamente el remdesivir ha demostrado acelerar el tiempo de mejoría clínica en adultos hospitalizados con COVID-19 severo8. Por otro lado, diversas reacciones adversas graves a los tratamientos antivirales disminuyen la capacidad de determinar su eficacia en los ensayos clínicos controlados, debido a la suspensión de estos9. Resulta necesario entonces explorar medicamentos con mecanismos de acción alternativos como la colchicina, la cual tendría un rol en el control de la respuesta inmune no controlada o tormenta de citocinas10. De la misma manera, existe la necesidad de buscar medicamentos de fácil acceso, costoefectivos y con seguridad conocida, entre ellos la colchicina. En esta revisión se explora la evidencia médica disponible acerca de la eficacia y la seguridad de la colchicina en pacientes con infección confirmada por SARS-CoV-2.
Material y métodosSe implementó una revisión sistemática exploratoria siguiendo los pasos propuestos por Arksey y O'Malley11 y revisados por Levac12: a) identificación de la pregunta de investigación; b) identificación de estudios relevantes; c) selección de estudios; d) extracción de datos; e) síntesis e informe de resultados. El 28 de diciembre del 2020 se realizó una búsqueda sistemática de la evidencia médica disponible en las bases de datos PubMed y Scopus. Adicionalmente, se incluyeron registros de ensayos clínicos de 18 bases de datos de la Plataforma de Registros Internacionales de Ensayos Clínicos de la Organización Mundial de la Salud (OMS)13, la cual cumple con estándares internacionales de calidad y accesibilidad (Anexo, archivo suplementario 1).
La revisión buscó responder a la pregunta: ¿cuál es el estado actual de la literatura científica sobre la eficacia y seguridad de la colchicina en la COVID-19? Se emplearon términos de búsqueda y operadores booleanos de acuerdo con los requisitos de cada base de datos (Anexo, archivo suplementario 1). Los criterios de inclusión fueron: a) idioma de la publicación es español o inglés; b) publicaciones con datos empíricos (estudios observacionales y experimentales) o registros de ensayos clínicos; c) documentos que exploraran la eficacia o seguridad de la colchicina en pacientes con diagnóstico de COVID-19 o SARS-CoV-2. Se excluyeron publicaciones teóricas (revisiones narrativas, comentarios, editoriales y cartas al editor).
Los resultados se exponen siguiendo dos categorías: a) un resumen de las características (autores, tipo de estudio, objetivo, fecha de publicación, revista, país de los autores, ocurrencia y hallazgos principales (tabla 1); y b) una síntesis narrativa de los resultados. Se siguió la extensión PRISMA para reportar revisiones sistemáticas exploratorias (PRISMA-ScR)14, Anexo, disponible en el archivo suplementario 2.
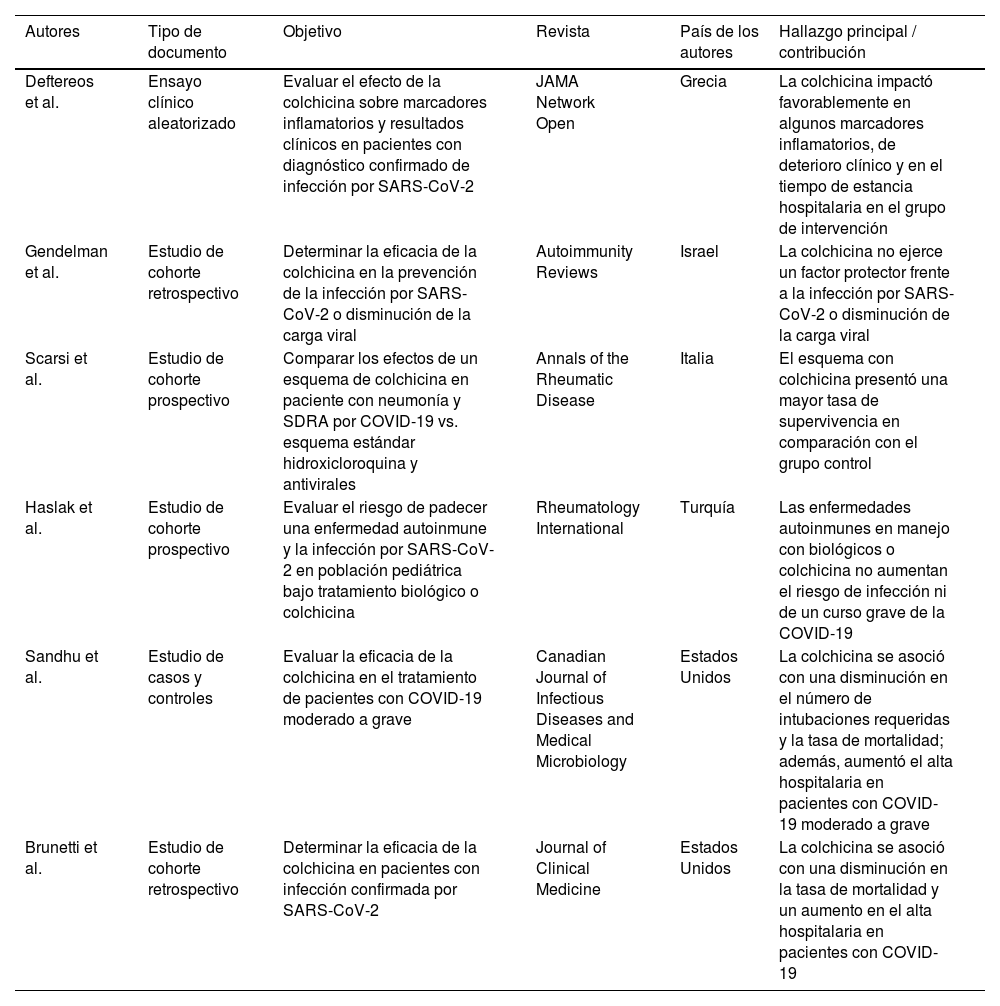
Características de las publicaciones que exploran la eficacia y la seguridad de la colchicina en la COVID-19
| Autores | Tipo de documento | Objetivo | Revista | País de los autores | Hallazgo principal / contribución |
|---|---|---|---|---|---|
| Deftereos et al. | Ensayo clínico aleatorizado | Evaluar el efecto de la colchicina sobre marcadores inflamatorios y resultados clínicos en pacientes con diagnóstico confirmado de infección por SARS-CoV-2 | JAMA Network Open | Grecia | La colchicina impactó favorablemente en algunos marcadores inflamatorios, de deterioro clínico y en el tiempo de estancia hospitalaria en el grupo de intervención |
| Gendelman et al. | Estudio de cohorte retrospectivo | Determinar la eficacia de la colchicina en la prevención de la infección por SARS-CoV-2 o disminución de la carga viral | Autoimmunity Reviews | Israel | La colchicina no ejerce un factor protector frente a la infección por SARS-CoV-2 o disminución de la carga viral |
| Scarsi et al. | Estudio de cohorte prospectivo | Comparar los efectos de un esquema de colchicina en paciente con neumonía y SDRA por COVID-19 vs. esquema estándar hidroxicloroquina y antivirales | Annals of the Rheumatic Disease | Italia | El esquema con colchicina presentó una mayor tasa de supervivencia en comparación con el grupo control |
| Haslak et al. | Estudio de cohorte prospectivo | Evaluar el riesgo de padecer una enfermedad autoinmune y la infección por SARS-CoV-2 en población pediátrica bajo tratamiento biológico o colchicina | Rheumatology International | Turquía | Las enfermedades autoinmunes en manejo con biológicos o colchicina no aumentan el riesgo de infección ni de un curso grave de la COVID-19 |
| Sandhu et al. | Estudio de casos y controles | Evaluar la eficacia de la colchicina en el tratamiento de pacientes con COVID-19 moderado a grave | Canadian Journal of Infectious Diseases and Medical Microbiology | Estados Unidos | La colchicina se asoció con una disminución en el número de intubaciones requeridas y la tasa de mortalidad; además, aumentó el alta hospitalaria en pacientes con COVID-19 moderado a grave |
| Brunetti et al. | Estudio de cohorte retrospectivo | Determinar la eficacia de la colchicina en pacientes con infección confirmada por SARS-CoV-2 | Journal of Clinical Medicine | Estados Unidos | La colchicina se asoció con una disminución en la tasa de mortalidad y un aumento en el alta hospitalaria en pacientes con COVID-19 |
SDRA: síndrome de dificultad respiratoria aguda.
Se incluyeron 6 documentos y 33 registros de ensayos clínicos (n=39) (fig. 1 y Anexo, archivo suplementario 3).
Síntesis de los hallazgos de las publicaciones incluidas en la revisiónSe encontraron estudios de cohorte prospectivos (n=2) y retrospectivos (n=2), un ensayo clínico aleatorizado (n=1) y un estudio de casos y controles (n=1). Los países de origen de los autores fueron Italia (n=2), Estados Unidos (n=2), Turquía (n=1), Grecia (n=1) e Israel (n=1). En la tabla 1 se describen los hallazgos principales de cada uno de los documentos incluidos en la revisión.
Ensayos clínicosDeftereos et al.15 publicaron un ensayo clínico abierto y aleatorizado (GRECCO-19), que incluyó 105 pacientes hospitalizados con diagnóstico confirmado de COVID-19. El grupo de intervención recibió una dosis de carga de 1,5mg de colchicina seguida de 0,5mg, en caso de no presentarse reacciones adversas gastrointestinales. La dosis de mantenimiento fue de 0,5mg cada 12 h hasta el alta hospitalaria, o un máximo de 21 días. Los investigadores reportaron una estancia hospitalaria media de 12 días en el grupo de colchicina y 13 días en el grupo de control p=0,91. El dímero D en plasma fue significativamente menor en el grupo de colchicina (0,76μg/ml) comparado con el grupo de control (0,92μg/ml) p=0,04. Además, la curva de supervivencia acumulada de 10 días sin eventos adversos fue del 97% en el grupo de intervención. Los niveles de proteína C reactiva (PCR) y troponina cardíaca de alta sensibilidad fueron estadísticamente similares en ambos grupos.
Scarsi et al.16 administraron 1mg al día de colchicina (reducido a 0,5mg/día, en caso de diarrea grave) a 122 pacientes con diagnóstico confirmado de COVID-19. En el grupo control, 142 pacientes afectados por neumonía COVID-19 fueron tratados con hidroxicloroquina, lopinavir+ritonavir, dexametasona y antibióticos. Se observaron niveles séricos de proteína C reactiva/ferritina y la relación PaO 2/FiO 2 menor en el grupo control. Por el contrario, se reportó una mejor supervivencia p=0,001 y un menor riesgo de muerte (HR=0,151, IC 95%: 0,062-0,368) en el grupo de intervención. Los autores concluyeron que, debido a sus propiedades antiinflamatorias, los resultados respaldan el uso de la colchicina en pacientes hospitalizados con neumonía COVID-19 y SDRA.
Estudios observacionalesGendelman et al.17 realizaron un estudio de cohorte retrospectivo con el fin de determinar si el uso de hidroxicloroquina o colchicina disminuye el riesgo de infección por el nuevo coronavirus. A tal efecto, incluyeron una muestra de 14.520 sujetos durante el periodo del 23 de febrero al 31 de marzo del 2020, e identificaron un total de 1317 (9,07%) sujetos positivos para SARS-CoV-2. De estos pacientes, el 0,53%, p=0,817, utilizaba colchicina y el 0,23%, p=0,877, utilizaba hidroxicloroquina previamente a la infección. Los autores reportaron que la colchicina no brindó protección contra la COVID-19.
A su vez, Sandhu et al.18 llevaron a cabo un estudio de cohorte comparativo prospectivo de pacientes con un diagnóstico confirmado de infección por SARS-CoV-2 mediante transcriptasa reversa-reacción en cadena de la polimerasa en tiempo real (RT-PCR, por sus siglas en inglés). En el grupo de los casos, la dosis de colchicina fue de 0,6mg cada 12 h durante 3 días, seguido de 0,6mg cada 24 h durante 12 días. Se excluyeron los pacientes que recibieron tocilizumab, lamivudina o dolutegravir y plasma de convalecencia en ambos grupos. En el grupo que recibió colchicina se observó una menor mortalidad (49,1% vs. 72,9%), p=0,002; un menor porcentaje de ventilación invasiva (52,8% vs. 73,6%), p=0,006; y una mayor tasa de egresos hospitalarios (50,9% vs. 27,1%), p=0,002. Estos resultados son similares a los encontrados por Brunetti et al.19 en un estudio de cohorte retrospectivo. Los investigadores reportaron una mayor tasa de egreso hospitalario (OR 5,0; IC 95%: 1,25-20,1), p=0,023, y una menor tasa de mortalidad (OR 0,20; IC 95%: 0,05-0,80), p=0,023, en la población que recibió colchicina.
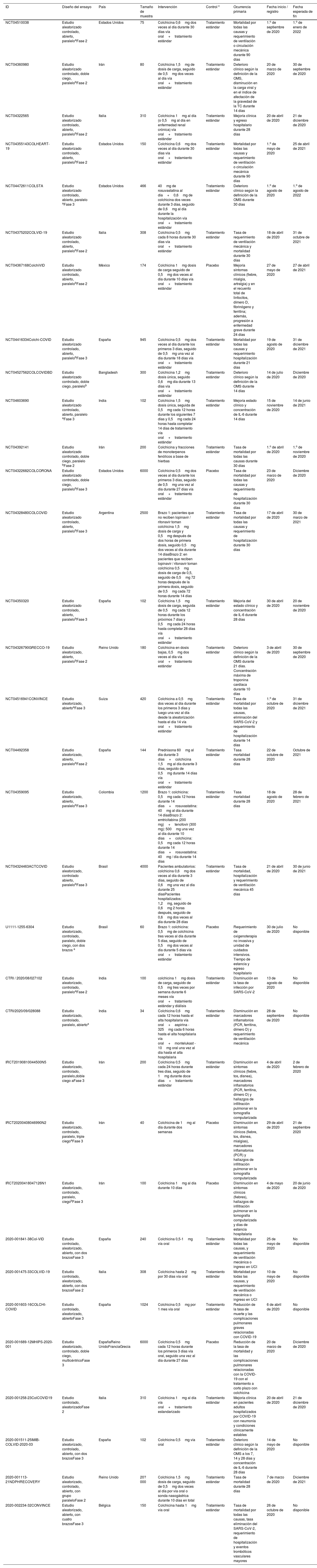
Registros de ensayos clínicos que exploran la eficacia y la seguridad de la colchicinaSe encontraron 33 ensayos clínicos registrados en U. S. National Library of Medicine (n=19), EU Clinical Trials Register (n=8), Iranian Registry of Clinical Trials (n=3), Clinical Trials Registry - India (n=2) y Brazilian Clinical Trials Registry (n=1). La suma de los participantes en los ensayos es de 46.324 individuos. Uno de los ensayos con la mayor población objeto de estudio es el COLCORONA (NCT04322682), el cual explora la eficacia y la seguridad de la colchicina o placebo (proporción de asignación 1:1) en 6.000 pacientes adultos con diagnóstico de COVID-19, evaluando la tasa de mortalidad y requerimiento de hospitalización. El grupo intervención recibió colchicina 0,5mg dos veces al día durante los primeros tres días y luego una vez al día durante los últimos 27 días. El 73% (24/33) de las investigaciones recluta a la población de estudio, el 39% (13/33) son estudios que se encuentran en fase 2, en tanto que el 51% (17/33) se encuentra en fase 3. Las características de estos ensayos clínicos se describen en la tabla 2.
Características de los ensayos clínicos que exploran la efectividad y la seguridad de la colchicina en la COVID-19
| ID | Diseño del ensayo | País | Tamaño de muestra | Intervención | Control c | Ocurrencia primaria | Fecha inicio / registro | Fecha esperada de fin |
|---|---|---|---|---|---|---|---|---|
| NCT04510038 | Estudio aleatorizado controlado, abierto, paraleloaFase 2 | Estados Unidos | 75 | Colchicina 0,6mg dos veces al día durante 30 días vía oral+tratamiento estándar | Tratamiento estándar | Mortalidad por todas las causas y requerimiento de ventilación o circulación mecánica durante 90 días | 1.o de septiembre de 2020 | 1.o de enero de 2022 |
| NCT04360980 | Estudio aleatorizado controlado, doble ciego, paralelobFase 2 | Irán | 80 | Colchicina 1,5mg de dosis de carga, seguido de 0,5mg dos veces al día vía oral+tratamiento estándar | Tratamiento estándar | Deterioro clínico según la definición de la OMS, disminución en la carga viral y en el índice de afectación de la gravedad de la TC durante 14 días | 20 de marzo de 2020 | 30 de septiembre de 2020 |
| NCT04322565 | Estudio aleatorizado controlado, abierto, paralelobFase 2 | Italia | 310 | Colchicina 1mg al día (o 0,5mg al día en enfermedad renal crónica) vía oral+tratamiento estándar | Tratamiento estándar | Mejoría clínica y egreso hospitalario durante 28 días | 20 de abril de 2020 | 21 de diciembre de 2020 |
| NCT04355143COLHEART-19 | Estudio aleatorizado controlado, abierto, paralelobFase 2 | Estados Unidos | 150 | Colchicina 0,6mg dos veces al día durante 30 días vía oral+tratamiento estándar | Tratamiento estándar | Mortalidad por todas las causas y requerimiento de ventilación o circulación mecánica durante 90 días | 1.o de mayo de 2020 | 25 de abril de 2021 |
| NCT04472611COLSTA | Estudio aleatorizado controlado, abierto, paralelo aFase 3 | Estados Unidos | 466 | 40mg de rosuvastatina al día+0,6mg de colchicina dos veces durante 3 días, seguido de 0,6mg al día durante la hospitalización vía oral+tratamiento estándar | Tratamiento estándar | Deterioro clínico según la definición de la OMS durante 30 días | 1.o de agosto de 2020 | 1.o de agosto de 2022 |
| NCT04375202COLVID-19 | Estudio aleatorizado controlado, abierto, paralelobFase 2 | Italia | 308 | Colchicina 0,5mg cada 8 horas durante 30 días vía oral+tratamiento estándar | Tratamiento estándar | Tasa de requerimiento de ventilación mecánica y mortalidad durante 30 días | 18 de abril de 2020 | 31 de octubre de 2021 |
| NCT04367168ColchiVID | Estudio aleatorizado controlado, abierto, paralelobFase 2 | México | 174 | Colchicina 1mg dosis de carga seguido de 0,5mg dos veces al día durante 10 días vía oral+tratamiento estándar | Placebo | Mejoría síntomas clínicos (fiebre, mialgia, artralgia) y en el recuento total de linfocitos, dímero D, fibrinógeno y ferritina; además, progresión a enfermedad grave durante 24 días | 27 de mayo de 2020 | 27 de abril de 2021 |
| NCT04416334Colchi-COVID | Estudio aleatorizado controlado, abierto, paralelobFase 3 | España | 945 | Colchicina 0,5mg dos veces al día durante los primeros 3 días, seguido de 0,5mg una vez al día durante 18 días vía oral+tratamiento estándar | Tratamiento estándar | Mortalidad por todas las causas y requerimiento hospitalización durante 21 días | 19 de agosto de 2020 | 31 de diciembre de 2021 |
| NCT04527562COLCOVIDBD | Estudio aleatorizado controlado, doble ciego, paralelob | Bangladesh | 300 | Colchicina 1,2mg dosis única, seguido 0,6mg día durante 13 días vía oral+tratamiento estándar | Tratamiento estándar | Deterioro clínico según la definición de la OMS durante 14 días | 14 de julio de 2020 | Diciembre de 2020 |
| NCT04603690 | Estudio aleatorizado controlado, abierto, paralelo aFase 3 | India | 102 | Colchicina 1,5mg dosis única, seguida de 0,5mg cada 12 horas durante los siguientes 7 días y 0,5mg cada 24 horas hasta completar 14 días de tratamiento vía oral+tratamiento estándar | Tratamiento estándar | Mejoría estado clínico y concentración de IL-6 durante 14 días | 15 de noviembre de 2020 | 14 de junio de 2021 |
| NCT04392141 | Estudio aleatorizado controlado, doble ciego, paralelo bFase 2 | Irán | 200 | Colchicina y fracciones de monoterpenos fenólicos a base de hierbas | Tratamiento estándar | Tasa de mortalidad por todas las causas durante 30 días | 1.o de abril de 2020 | 1.o de noviembre de 2020 |
| NCT04322682COLCORONA | Estudio aleatorizado controlado, doble ciego, paralelobFase 3 | Estados Unidos | 6000 | Colchicina 0,5mg dos veces al día durante los primeros 3 días, seguido de 0,5mg una vez al día durante 27 días vía oral+tratamiento estándar | Placebo | Tasa de mortalidad por todas las causas y requerimiento de hospitalización durante 30 días | 23 de marzo de 2020 | Diciembre de 2020 |
| NCT04328480COLCOVID | Estudio aleatorizado controlado, abierto, paralelobFase 3 | Argentina | 2500 | Brazo 1: pacientes que no reciben lopinavir / ritonavir toman colchicina 1,5mg dosis de carga y 0,5mg después de dos horas de primera dosis, seguido 0,5mg dos veces al día durante 14 díasBrazo 2: en pacientes que reciben lopinavir / ritonavir toman colchicina 0,5mg dosis de carga de 0,5, seguido de 0,5mg 72 horas después de la primera dosis, seguido de 0,5mg cada 72 horas durante 14 días | Tratamiento estándar | Tasa de mortalidad por todas las causas y requerimiento de hospitalización durante 30 días | 17 de abril de 2020 | 30 de marzo de 2021 |
| NCT04350320 | Estudio aleatorizado controlado, abierto, paralelobFase 3 | España | 102 | Colchicina 1,5mg dosis de carga, seguida de 0,5mg cada 12 horas durante los próximos 7 días y 0,5mg cada 24 horas hasta completar 28 días vía oral+tratamiento estándar | Tratamiento estándar | Mejoría del estado clínico y concentración de IL-6 durante 28 días | 30 de abril de 2020 | 20 de noviembre de 2020 |
| NCT04326790GRECCO-19 | Estudio aleatorizado, abierto, paralelobFase 2 | Reino Unido | 180 | Colchicina en dosis bajas, 0,5mg dos veces al día vía oral+tratamiento estándar | Tratamiento estándar | Deterioro clínico según la definición de la OMS durante 21 días. Concentración máxima de troponina cardíaca durante 10 días | 3 de abril de 2020 | 30 de septiembre de 2020 |
| NCT04516941CONVINCE | Estudio aleatorizado, abiertoaFase 3 | Suiza | 420 | Colchicina a 0,5mg dos veces al día durante los primeros 3 días y luego una vez al día desde la aleatorización hasta el día 14 vía oral+tratamiento estándar | Tratamiento estándar | Tasa de mortalidad por todas las causas, eliminación del SARS-CoV-2 y requerimiento de hospitalización durante 14 días | 1.o de octubre de 2020 | 31 de diciembre de 2021 |
| NCT04492358 | Estudio aleatorizado, abierto, paralelobFase 2 | España | 144 | Prednisona 60mg al día durante 3 días+colchicina 1,5mg al día durante 3 días, seguido de 0,5mg durante 14 días vía oral+tratamiento estándar | Tratamiento estándar | Tasa mortalidad durante 28 días | 22 de octubre de 2020 | Octubre de 2021 |
| NCT04359095 | Estudio aleatorizado, abierto, paralelobFase 3 | Colombia | 1200 | Brazo 1: colchicina: 0,5mg cada 12 horas durante 14 días+rosuvastatina: 40mg al día durante 14 díasBrazo 2: emtricitabina (200 mg)+tenofovir (300 mg): 500mg una vez al día durante 10 días+colchicina: 0,5mg cada 12 horas durante 14 días+rosuvastatina: 40mg / día durante 14 días | Tratamiento estándar | Tasa mortalidad durante 28 días | 18 de agosto de 2020 | 28 de febrero de 2021 |
| NCT04324463ACTCOVID | Estudio aleatorizado, controlado abierto, paralelobFase 3 | Brasil | 4000 | Pacientes ambulatorios: colchicina 0,6mg dos veces al día durante 3 días, seguido de 0,6mg una vez al día durante 25 díasPacientes hospitalizados: 1,2mg, seguido de 0,6mg 2 horas después, seguido de 0,6mg dos veces al día durante 28 días | Tratamiento estándar | Tasa de mortalidad, hospitalización y requerimiento de ventilación mecánica 45 días | 21 de abril de 2020 | 30 de junio de 2021 |
| U1111-1255-6304 | Estudio aleatorizado, controlado, paralelo, doble ciego, con dos brazos a | Brasil | 60 | Brazo 1: colchicina: 0,5mg de colchicina tres veces al día durante 5 días, seguido de 0,5mg dos veces al día durante 5 días vía oral+tratamiento estándar | Placebo | Requerimiento de oxigenoterapia no invasiva y unidad de cuidados intensivos. Tiempo de estancia y egreso hospitalario | 30 de julio de 2020 | No disponible |
| CTRI / 2020/08/027102 | Estudio aleatorizado, controlado, paraleloaFase 2 | India | 100 | colchicina 1mg dosis de carga, seguido de 0,5mg tres veces por semana durante 6 meses vía oral+tratamiento estándar y diálisis | Tratamiento estándar | Disminución en la tasa de infección por SARS-CoV-2 | 13 de agosto de 2020 | No disponible |
| CTRI/2020/09/028088 | Estudio aleatorizado, controlado, paralelo, abiertoa | India | 34 | Colchicina 0,6mg cada 12 horas hasta el alta hospitalaria vía oral+aspirina - 325mg cada 6 horas hasta el alta hospitalaria vía oral+montelukast - 10mg oral una vez al día hasta el alta hospitalaria | Tratamiento estándar | Disminución en marcadores inflamatorios (PCR, ferritina, dímero D) y requerimiento de ventilación mecánica | 28 de septiembre de 2020 | No disponible |
| IRCT20190810044500N5 | Estudio aleatorizado, controlado, paralelo,doble ciego aFase 3 | Irán | 200 | Colchicina 0,5mg cada 24 horas durante tres días, seguido de 1mg durante doce días+tratamiento estándar | Tratamiento estándar | Disminución en síntomas clínicos (fiebre, tos, disnea), marcadores inflamatorios (PCR, ferritina, dímero D) y hallazgos de infiltración pulmonar en la tomografía computarizada | 4 de abril de 2020 | 2 de febrero de 2020 |
| IRCT20200408046990N2 | Estudio aleatorizado, controlado, paralelo, triple ciegoaFase 3 | Irán | 40 | Colchicina de 1mg al día durante dos semanas | Placebo | Disminución en síntomas clínicos (fiebre, tos, disnea, mialgias), marcadores inflamatorios (PCR) y hallazgos de infiltración pulmonar en la tomografía computarizada | 29 de abril de 2020 | 21 de septiembre 2020 |
| IRCT20200418047126N1 | Estudio aleatorizado, controlado, paralelo, ciegobFase 3 | Irán | 100 | Colchicina 1mg al día durante 10 días | Placebo | Disminución en síntomas clínicos (fiebres), hallazgos de infiltración pulmonar en la tomografía computarizada y días de estancia hospitalaria | 4 de mayo de 2020 | 20 de junio de 2020 |
| 2020-001841-38Col-VID | Estudio controlado, aleatorizado, abierto, con dos brazosFase 3 | España | 240 | Colchicina 0,5-1mg vía oral | Tratamiento estándar | Mortalidad por todas las causas, y requerimiento de ventilación mecánica o ingreso en UCI | 25 de mayo de 2020 | No disponible |
| 2020-001475-33COLVID-19 | Estudio controlado, aleatorizado, abierto, con dos brazosFase 2 | Italia | 308 | Colchicina hasta 2mg por 30 días vía oral | Tratamiento estándar | Mortalidad por todas las causas, y requerimiento de ventilación mecánica o ingreso en UCI | 10 de mayo de 2020 | No disponible |
| 2020-001603-16COLCHI-COVID | Estudio controlado, aleatorizado, abiertoFase 3 | España | 1024 | Colchicina 0,5mg por 1 mes vía oral | Tratamiento estándar | Reducción de la tasa de muerte y las complicaciones pulmonares graves relacionadas con COVID-19 | 6 de abril de 2020 | No disponible |
| 2020-001689-12MHIPS-2020-001 | Estudio aleatorizado, controlado, doble ciego, multicéntricoFase 3 | EspañaReino UnidoFranciaGrecia | 6000 | Colchicina 0,5mg cada 12 horas durante los primeros 3 días vía oral, seguido una vez al día durante 27 días | Placebo | Reducción de la tasa de mortalidad y las complicaciones pulmonares relacionadas con la COVID-19 con el tratamiento a corto plazo con colchicina | 20 de marzo de 2020 | Diciembre de 2020 |
| 2020-001258-23ColCOVID19 | Estudio controlado, aleatorizadoFase 2 | Italia | 310 | Colchicina 1mg al día vía oral+tratamiento estandarizado | Tratamiento estándar | Mejoría clínica en pacientes adultos hospitalizados por COVID-19 con neumonía y condiciones clínicamente estables | 20 de abril de 2020 | 21 de diciembre de 2020 |
| 2020-001511-25IMIB-COLVID-2020-03 | Estudio aleatorizado, controlado, abierto, con dos brazosFase 3 | España | 102 | Colchicina 0,5mg vía oral | Tratamiento estándar | Deterioro clínico según la definición de la OMS a los 7, 14 y 28 días y concentración de IL-6 durante 28 días | 14 de mayo de 2020 | No disponible |
| 2020-001113-21NDPHRECOVERY | Estudio aleatorizado, controlado, abierto, con grupo paraleloFase 2 | Reino Unido | 20?000 | Colchicina 1,5mg dosis de carga, seguido de 0,5mg dos veces al día por vía oral o sonda nasogástrica durante 10 días en total | Tratamiento estándar | Tasa de mortalidad durante 28 días | 7 de marzo de 2020 | Diciembre de 2021 |
| 2020-002234-32CONVINCE | Estudio aleatorizado, abierto, con cuatro brazosFase 3 | Bélgica | 150 | Colchicina hasta 1mg vía oral | Tratamiento estándar | Tasa de mortalidad por todas las causas, tasa eliminación del SARS-CoV-2, requerimiento de hospitalización y eventos trombóticos vasculares mayores | 26 de octubre de 2020 | No disponible |
OMS: Organización Mundial de la Salud.
Ocho ensayos clínicos utilizan una dosis carga entre 1 y 1,5mg (CTRI / 2020/08/027102 - NCT0432446 - NCT04350320 - NCT04328480 - NCT04603690 - NCT04527562 - NCT04367168 - 2020-001113-21). Dos ensayos clínicos utilizan una dosis de 40mg de rosuvastatina en conjunto con colchicina (NCT04472611 - NCT04359095). Un ensayo clínico fase 2 (NCT04392141) utiliza la colchicina en conjunto con fracciones de monoterpenos fenólicos a base de hierbas. Con respecto al grupo control, el 82% (27/33) de los estudios usará manejo médico estándar recomendado para la COVID-19, mientras que el 18% (5/33) usará placebo.
Las ocurrencias primarias encontradas incluyen tasa de mortalidad, requerimiento de ventilación mecánica, duración de síntomas clínicos (fiebre, tos y disnea) y estancia hospitalaria, resolución de inflamación en tomografía de tórax y disminución de marcadores de inflamación (PCR, ferritina, IL-6, dímero-D).
SeguridadEl perfil de riesgo-beneficio fue favorable en las publicaciones incluidas en esta revisión. El efecto adverso más frecuentemente reportado por Deftereos et al. fue la diarrea aguda, la cual se reporta en 25 pacientes del grupo de intervención y 9 pacientes del grupo control (p=0,003). Sin embargo, los investigadores reportaron un curso autolimitado de esta reacción adversa y una tasa del 3,6% de suspensión del fármaco15.
DiscusiónEsta revisión exploratoria encontró estudios experimentales y observacionales que reportan una reducción de las tasas de mortalidad, ventilación mecánica y tiempo de estancia hospitalaria en pacientes con COVID-19 que recibieron colchicina. Los estudios sugieren la capacidad del medicamento de modular la respuesta inflamatoria, la tormenta de citocinas y la activación del inflamasoma, factores determinantes en la fisiopatología, el curso clínico y los resultados clínicos de los pacientes infectados con SARS-CoV-2. Aunque los resultados no han sido divulgados oficialmente, una nota de prensa del estudio COLCORONA publicada en enero del 2021 reportó que la administración de colchicina disminuye la tasa de hospitalización y mortalidad por COVID-1920.
La colchicina ha sido ampliamente utilizada para enfermedades autoinmunes e inflamatorias como la gota, la fiebre mediterránea familiar, la miocarditis y la pericarditis, entre otras patologías21,22. Por otro lado, se han reportado series de casos en pacientes con miocarditis por virus de Epstein-Barr y citomegalovirus que demuestran propiedades inmunomoduladoras y antivirales de la colchicina en dosis bajas (0,5mg), con beneficios sobre la supervivencia general23. En las infecciones virales, un importante componente del sistema inmunitario innato es el inflamasoma, expresado por monocitos y macrófagos24–26. El inflamasoma interrumpe el transporte de mitocondrias mediado por microtúbulos al retículo endoplásmico, donde se ensambla el complejo NLRP3l, lo que contribuye a la reducción de citocinas proinflamatorias o «tormenta de citocinas» (IL-1β, IL-18 e IL-6), cruciales en la patogenia de las microangiopatías trombóticas y el SDRA asociados con la COVID-19. Además, debido a su capacidad antifibrótica y antiproliferativa, la colchicina disminuiría la rotura celular no controlada del epitelio pulmonar y posterior SDRA26, y esto sugiere mecanismos que apoyan el potencial efecto protector de la colchicina frente a la mortalidad en la enfermedad grave y crítica27–32.
Un reciente estudio clínico aleatorizado controlado analizó los efectos de la colchicina en población con obesidad (IMC ≥ 30kg/m2) y síndrome metabólico, y encontró una regulación de moléculas inflamatorias o mediadores del sistema inmunitario innato (por ejemplo, la alfa 1-antiquimotripsina, mieloperoxidasa, C5a y ciclooxigenasa-2)33. Debido a que la obesidad y la diabetes mellitus son factores de riesgo para la enfermedad grave por COVID-192,17, se deben seguir investigando las diferentes vías antiinflamatorias, inmunomoduladoras y cardioprotectores de la colchicina con el fin de generar esquemas terapéuticos que disminuyan la mortalidad.
La lesión miocárdica asociada con el SARS-CoV-2 también contribuye a la mortalidad por COVID-19, incluso en ausencia de enfermedad cardiovascular preexistente. La tormenta de citocinas, la disfunción endotelial y el aumento de la actividad simpática promueven la isquemia miocárdica, la pericarditis y la miocarditis34. Debido a que es limitada la literatura médica sobre el tratamiento con colchicina de los casos con COVID-19 que desarrollan manifestaciones cardiovasculares26,28,29, es necesario conocer los resultados de los diversos estudios clínicos aleatorizados en fases iniciales de la enfermedad en pacientes no hospitalizados, así como el impacto sobre la mortalidad y la reducción en la necesidad de ventilación mecánica en pacientes hospitalizados35,36.
En general, la colchicina es un medicamento bien tolerado, su eliminación se da mediante el transporte por la glicoproteína P, expresada en hepatocitos y túbulos renales proximales, y una cantidad menor es metabolizada por el citocromo CYP3A421,26. En el perfil de riesgo-beneficio los efectos adversos fueron leves y autolimitados, debido principalmente a alteraciones gastrointestinales (dolor abdominal, náuseas, vómitos y diarrea)15–19,37. Algunos estudios cuestionan el uso de colchicina en el tratamiento de pacientes graves o críticos, puesto que aumentaría la entrada del virus, la carga viral y el riesgo de «tormentas de citocinas», factores asociados con peores desenlaces, como SDRA y muerte38. Sin embargo, la literatura médica actual determina que el riesgo de desarrollar insuficiencia respiratoria después del tratamiento con colchicina se encuentra asociado con la administración de dosis supraterapéuticas38,39, siendo poco probable desarrollar SDRA con dosis terapéuticas óptimas y ajustando estas mismas en pacientes con insuficiencia renal. La toxicidad medicamentosa por colchicina es rara, y generalmente se asocia con sobredosis, lo cual causa detención de la mitosis celular y disfunción multiorgánica40. Los estudios reportados en nuestra revisión informaron reacciones adversas leves y autolimitadas como la diarrea aguda.
Resulta importante seguir investigando el papel de la colchicina en el tratamiento de pacientes con COVID-19. La mayoría de los registros de ensayos clínicos encontrados en esta revisión son aleatorizados, y evalúan los efectos de la colchicina en combinación con el tratamiento estándar o protocolizado para la COVID-19 en el grupo intervención. El brazo experimental en la mayoría de los estudios incluye un régimen de colchicina oral con dosis de carga y mantenimiento. Las ocurrencias o resultados primarios evaluarán la condición clínica (de acuerdo con la escala ordinal semicuantitativa sugerida por la OMS), la mortalidad por todas las causas, la necesidad de ventilación mecánica invasiva/unidad de cuidados intensivos, la duración de la estancia hospitalaria y el cambio en los marcadores pronósticos.
LimitacionesÚnicamente se utilizaron dos bases, PubMed/MEDLINE y Scopus, con publicaciones teóricas en inglés y español. Una limitante importante es el número relativamente pequeño de participantes en los estudios clínicos ya publicados y en desarrollo, que impide extrapolar los resultados y detectar diferencias en reacciones adversas no conocidas. Las revisiones exploratorias no incluyen una evaluación de la calidad de la evidencia, consecuente con el amplio material temático de la pregunta de investigación11,12. Es necesario esperar los resultados de los estudios clínicos en desarrollo, con el fin de mejorar la calidad de la evidencia existente y establecer, en la medida de lo posible, esquemas terapéuticos que impacten en las complicaciones y mortalidad de la enfermedad.
ConclusionesEsta revisión exploró la eficacia y la seguridad de la colchicina en pacientes con COVID-19. Si bien, se conocen diversos mecanismos de acción antivirales e inmunomoduladores benéficos ante la hiperinflamación y la liberación de citocinas características de esta infección, únicamente se encontró un ensayo clínico que respaldara la disminución en marcadores inflamatorios pronósticos y el tiempo de estancia hospitalaria. Estudios de cohorte prospectivo y retrospectivo demostraron una mayor tasa de egreso hospitalario y una menor tasa de mortalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.