El mepolizumab (MPZ) es una opción terapéutica para la granulomatosis eosinofílica con poliangeítis (GEP). Sin embargo, la evidencia sobre su eficacia, efectividad y seguridad es limitada. Nuestros resultados incluyeron 17 artículos de texto completo que evalúan el uso de MPZ en pacientes con diagnóstico de GEP. Un total de 47% (8/17) de los documentos eran reportes de caso, 18% (3/17) estudios de cohorte retrospectiva, 12% (2/17) ensayos clínicos y 6% correspondió a cohorte prospectiva (1/17), ambispectiva (1/17), serie de casos (1/17) y estudio piloto (1/17). La dosis de MPZ utilizada con mayor frecuencia fue de 300 mg/mes, descrita en 59% (10/17) de los manuscritos incluidos. La disminución en el puntaje del Birmingham Vasculitis Activity Score (BVAS), la reducción de la dosis de corticoides y la modulación en el número de eosinófilos en sangre fueron las variables más empleadas para determinar el efecto clínico en los sujetos. Finalmente, se incluyeron 10 registros de ensayos clínicos que describen el diseño, la conducción y la administración de los estudios en curso. El uso del MPZ en personas con GEP muestra una reducción en el puntaje del BVAS, ahorro de corticoides orales y modulación de la hipereosinofilia en sangre. Los eventos adversos descritos fueron leves y moderados en la totalidad de los trabajos incluidos.
Mepolizumab (MPZ) is a therapeutic option for eosinophilic granulomatosis with polyangiitis (EGPA). However, the evidence on its efficacy, effectiveness, and safety is limited. Our results included 17 full-text articles evaluating the use of MPZ in patients diagnosed with EGPA, 47% (8/17) of the documents were case reports, 18% (3/17) retrospective cohort studies, 12% (2/17) clinical trials, and 6% corresponded to a prospective cohort (1/17), ambispective cohort (1/17), case series (1/17), and pilot study (1/17). The most frequently used dose of MPZ was 300 mg/month, described in 59% (10/17) of the included manuscripts. The decrease in the Birmingham Vasculitis Activity Score (BVAS), reduction in the dose of corticosteroids, and modulation in the number of eosinophils in the blood were the variables most used to determine the clinical effect in patients. Finally, 10 clinical trial records were included describing the design, conduct, and administration of the ongoing studies. The use of MPZ in patients with EGPA shows a reduction in the BVAS, saving oral corticosteroids and modulating blood hypereosinophilia. The adverse events described were mild and moderate in all the included studies.
La granulomatosis eosinofílica con poliangeítis (GEP) es una vasculitis de vasos pequeños a medianos asociada con anticuerpos anticitoplasma de neutrófilos, cuya incidencia anual se estima entre 0,5 y 4,2 casos por millón de personas, junto a una prevalencia de entre dos y 38 casos por millón de personas1,2. Se trata de una enfermedad sistémica con manifestaciones clínicas descrita en tres fases: una etapa prodrómica representada por asma, rinitis alérgica y sinusitis; una segunda mediada por eosinófilos y caracterizada por infiltrados pulmonares, miocardiopatía y síntomas gastrointestinales1,3; y una tercera con síntomas relacionados con púrpura palpable, glomerulonefritis y mononeuritis múltiple, lo que genera finalmente daño tisular inmunomediado crónico y responsable de un número importante de recaídas en pacientes con la enfermedad en tratamiento3,4.
El tratamiento de la GEP debe guiarse según el riesgo de mortalidad y los efectos adversos asociados, iniciando con una combinación de inmunosupresores y corticoides4. La baja incidencia de la enfermedad, así como la ausencia de claridad sobre la fisiopatología y variabilidad en los fenotipos fisiopatológicos, conllevan una alta tasa de fracaso o refractariedad terapéutica2,4. Existen estudios que analizan nuevos esquemas de tratamiento, con desenlaces clínicos favorables y una menor tasa de efectos adversos, en comparación con los enfoques convencionales, como la terapia con anticuerpos monoclonales humanizados con omalizumab5, rituximab6 o mepolizumab (MPZ)7, entre otros8.
El MPZ es un anticuerpo monoclonal humanizado que se une con gran afinidad a la cadena α de la interleucina-5 (IL-5), evitando así que esta interactúe con el receptor de IL-5, alfa (IL-5Rα) presente en la membrana de los eosinófilos, lo que impide la activación de las vías de señalización involucradas en la patogénesis de esta enfermedad9,10. La IL-5 es considerada una importante diana terapéutica para la eosinofilia de difícil manejo, ya que tiene un rol indispensable en la maduración, el reclutamiento, la activación, la proliferación y la supervivencia de los eosinófilos11. Bettiol et al.7 describieron la respuesta al tratamiento entre los tres y los 24 meses después del inicio de MPZ, con una reducción en el puntaje del Birmingham Vasculitis Activity Score (BVAS), una disminución de la dosis de corticoide y una modulación del número de eosinófilos. Al ser una molécula con sitio de unión muy específico y de alta afinidad, supone una alternativa farmacológica eficaz y segura7,12. En la actualidad, es limitada la evidencia que reúne información médica disponible sobre los desenlaces clínicos en pacientes con esta vasculitis de vasos pequeños a medianos y los anticuerpos monoclonales humanizados, principalmente el MPZ7–12. Por ende, el objetivo de esta revisión es describir la eficacia, la efectividad y la seguridad del MPZ en sujetos con diagnóstico de GEP.
MétodosEsta revisión exploratoria sistemática se realizó de acuerdo con los pasos descritos por Arksey et al.13 y modificados posteriormente por Levac et al.14: identificar la pregunta de investigación, buscar los documentos más relacionados con esta, escoger los artículos, extraer los datos y reportar los resultados. La revisión respondió al siguiente cuestionamiento: ¿cómo describir la evidencia médica disponible sobre la eficacia, la efectividad y la seguridad del uso de MPZ en pacientes con GEP?
Criterios de elegibilidadSe incluyeron ensayos clínicos y estudios observacionales analíticos y descriptivos, en los cuales se explora el uso del MPZ en pacientes con GEP, sin límite de tiempo, en inglés o en español. Además, se añadieron registros de ensayos clínicos que estén en la fase de reclutamiento o análisis de los datos, próximos a la publicación de evidencia. Se excluyeron manuscritos con datos teóricos, como revisiones narrativas o sistemáticas, entre otros.
Estrategia de búsqueda y fuentes de informaciónEn esta búsqueda se incluyó el motor de búsqueda PubMed/Medline y la base de datos Scopus, por medio de operadores booleanos y palabras clave, de acuerdo con el sistema de datos. La última actualización fue el primero de octubre del 2023. La estrategia de búsqueda se describe en el archivo suplementario 1 (Anexo). Se incluyeron registros de estudios de 17 bases de datos de la Plataforma de Registros Internacionales de Ensayos Clínicos de la Organización Mundial de la Salud (OMS) que evalúan el uso del MPZ en pacientes con GEP (archivo suplementario 2 [Anexo])15.
Selección de estudios y extracción de datosSe utilizó la aplicación web Rayyan16, de acceso gratuito, para escoger de forma independiente los resúmenes de las publicaciones candidatas, con su consiguiente discusión y consenso para la inclusión de documentos por parte de dos de los autores (JO, IP). Posteriormente, un tercer revisor experto en el tema discernió sobre un manuscrito en duda para la inclusión o exclusión final. Además, se realizó la extracción de la información en una tabla. Durante este proceso, se condujeron varios encuentros para efectuar ajustes y modificaciones a estos formatos. Finalmente, la recolección de la información fue elaborada como se muestra a continuación.
Síntesis y presentación de los resultadosLos resultados de esta revisión exploratoria se presentan con base en las categorías propuestas por Grudniewicz et al.17: i) un resumen de las características y la distribución de los documentos incluidos, y (ii) una síntesis narrativa de los resultados. Durante la construcción de este documento se utilizó la extensión de la declaración Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA) para el reporte de revisiones sistemáticas exploratorias (PRISMA-ScR) (archivo suplementario 3 [Anexo])18.
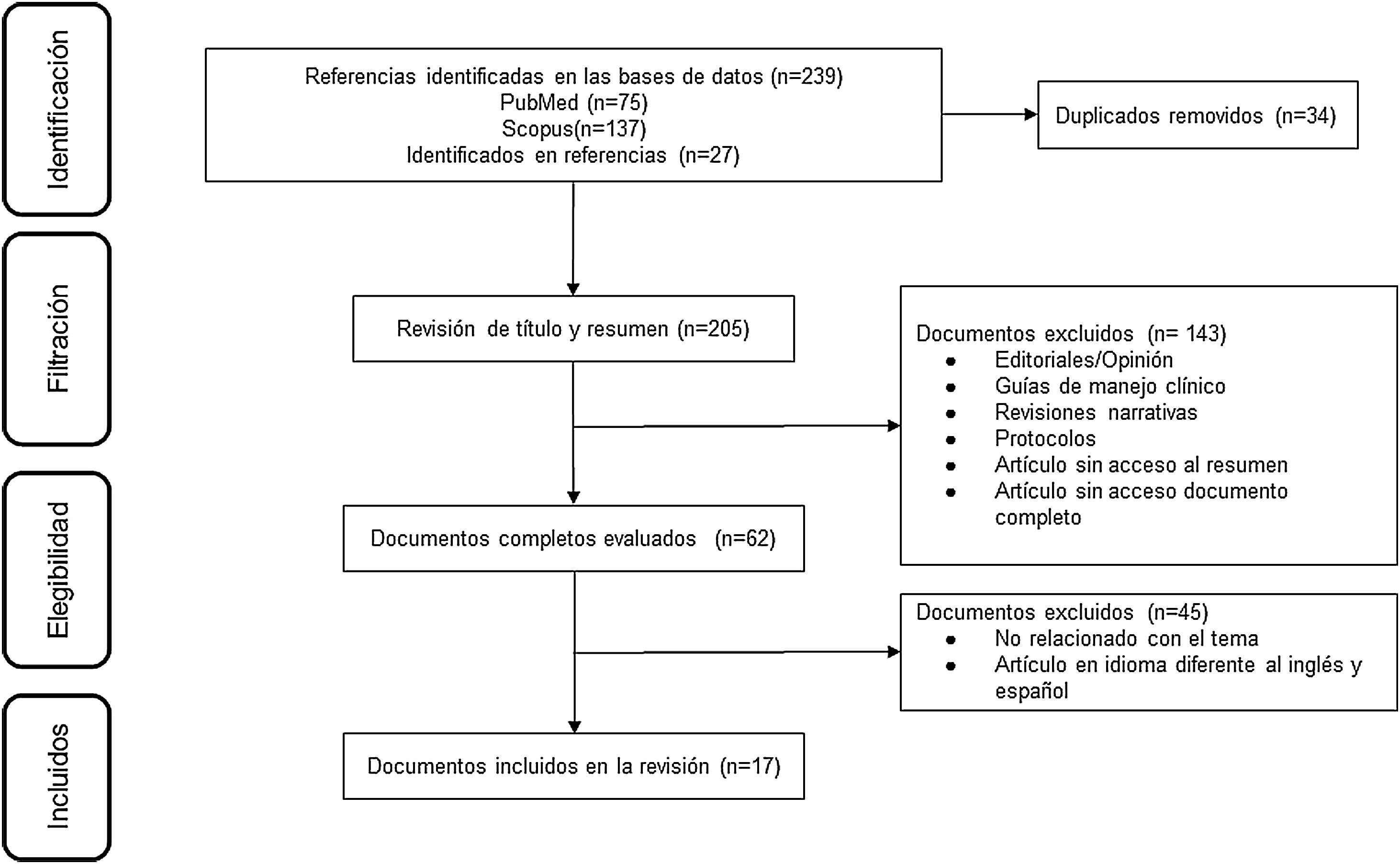
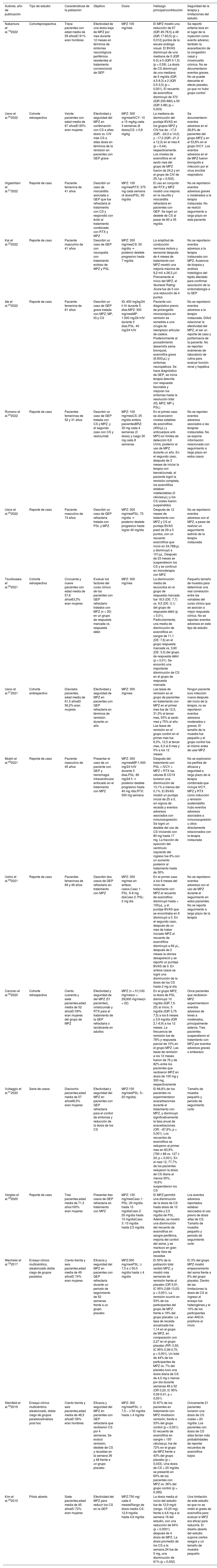
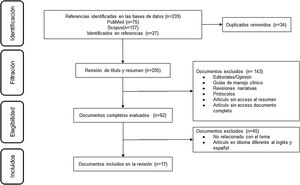
ResultadosDe 223 documentos identificados en las estrategias de búsqueda, se incluyeron 17 artículos de texto completo que evalúan el uso del MPZ en pacientes con diagnóstico de GEP (fig. 1). Un total de 47% (8/17) de los documentos eran reportes de caso, 18% (3/17) estudios de cohorte retrospectiva, 12% (2/17) ensayos clínicos y 6% correspondió a cohorte prospectiva (1/17), cohorte ambispectiva (1/17), serie de casos (1/17) y estudio piloto (1/17) (tabla 1). La dosis del MPZ utilizada con mayor frecuencia fue de 300 mg/mes, descrita en 59% (10/17) de los manuscritos incluidos. La disminución en el puntaje del BVAS, la reducción de la dosis de corticoides y la modulación en el número de eosinófilos en sangre fueron las variables más empleadas para determinar el efecto clínico en los sujetos. Finalmente, se incluyeron 10 registros de ensayos clínicos que describen el diseño, la conducción y la administración de los estudios en curso (tabla 2).
Característica de las publicaciones incluidas
| Autores, año de publicación | Tipo de estudio | Características de la población | Objetivo | Dosis | Hallazgo principal/contribución | Seguridad de la terapia y limitaciones del estudio |
|---|---|---|---|---|---|---|
| Nakamura et al.192022 | Cohorteprospectiva | Trece pacientes con edad media de 59 añosEl 91% eran hombres | Efectividad de una dosis baja de MPZ por mes durante 12 meses en términos de síntomas neurológicos periféricos resistentes al tratamiento convencional de GEP | MPZ 100 mg/mes | El MPZ mostró una reducción de 67 (IQR 49-78,5) a 48 (IQR 17-63,5) (p < 0,012) puntos de la escala análoga visual. El BVAS disminuyó de una mediana de 0 (IQR 0-2) a 0 (IQR 0-1,5) (p < 0,59). La dosis de CS disminuyó de una mediana de 5 mg/día (IQR 4,5-8,3) a 2 (IQR 0,5-3,5) (p < 0,001). El recuento de eosinófilos disminuyó de 370 (IQR 200-880) a 50 (IQR 3-88) (p < 0,003) | Se reportó eritema leve en el lugar de la inyección como evento adverso; también la exacerbación de la congestión nasal y rinosinusitis crónica. No se documentaron eventos graves. No se puede descartar el efecto placebo, ya que no hubo grupo control |
| Ueno et al.202022 | Cohorte retrospectiva | Veinte pacientes con edad media de 67 añosEl 65% eran mujeres | Efectividad y seguridad del MPZ en combinación con CS a altas dosis vs. CIV más CS a altas dosis en términos de la remisión en pacientes con GEP grave | MPZ: 300 mg/mesIVCY: 10 a 15 mg/kg cada 3 semanas (6 dosis)CS: ≥ 0,8 mg/kg | La mediana de disminución del puntaje BVAS en los grupos MPZ y CIV fue de −17,0 (IQR: −24,0 a 14,0) y −17,0 (IQR:−21,0 a 12,3) en el mes 6 (p = 0,44), respectivamente. Los niveles de eosinófilos en el sexto mes del grupo de MPZ fueron de 24,2 y en el grupo de CIV de 25,1(p = 0,002). | Se documentaron eventos adversos en el 28,6% de pacientes del grupo MPZ y en el 53,8% en el grupo IVCY. Los eventos adversos en el de MPZ fueron bronquitis e infección por el virus sincitial respiratorio |
| Higashitani et al.212022 | Reporte de caso | Paciente femenina de 41 años | Describir un caso de miocarditis asociada a GEP que fue refractaria al tratamiento con CS y respondió con éxito al tratamiento combinado con RTX y MPZ | MPZ: 100 mg/mesRTX: 375 mg cada semana (4 dosis)PSL: 60 mg/día | El uso en conjunto del RTX y MPZ mostró una mejoría en la neuritis y miocarditis refractaria en pacientes con GEP. Se logró un destete de CS al pasar de 60 a 35 mg/día | No se reportaron eventos adversos graves o moderados a la terapia instaurada. No se realizó seguimiento a largo plazo en esta paciente |
| Kai et al.222022 | Reporte de caso | Paciente masculino de 41 años | Describir un caso de GEP con neuropatía con tratamiento exitoso de MPZ y PSL | MPZ: 300 mg/mesCS: 50 mg/día → posterior destete progresivo hasta 7 mg/día | La amplitud de conducción nerviosa motora y sensorial después de 4 meses de tratamiento con MPZ mostró una mejoría máxima de 9,2 mV a 28,3 μV. Previamente al inicio del MPZ, el Numeral Rating Score fue de 5 con una reducción de 4 puntos | No se reportaron eventos adversos a la terapia instaurada con MPZ. Ausencia de biopsia y análisis histológico del tejido afectado para confirmar asociación de la sintomatología a la GEP |
| Ide et al.232022 | Reporte de caso | Paciente femenina de 61 años | Describir un caso de GEP grave tratada con MPZ, MP, IG y CS | IG: 400 mg/kg/24 h IV durante 5 días.MPZ: 300 mg/mesMP: 1.000 mg/24 h/IV durante 3 días.PSL: 40 mg/24 h/IV | Paciente con diagnóstico previo de poliangeítis microscópica en remisión es sometida a una cirugía de reemplazo articular de cadera. Posteriormente al procedimiento desarrolla asma bronquial, eosinofilia grave (8.500/μL) y síntomas neuropáticos. Se hace diagnóstico de GEP, se inicia terapia descrita con respuesta favorable y mejoran los síntomas hasta la resolución total (IG, MPZ, MP y PSL) | No se reportaron eventos adversos a la terapia instaurada. Difícil relacionar la efectividad del MPZ, al ser un reporte de caso y polifarmacia de la paciente. No se reportan exámenes de laboratorio de rutina para evaluar función renal y hepática |
| Romano et al.242022 | Reporte de caso | Pacientes femeninas de 52 y 31 años | Describir un caso de GEP tratada con CS y MPZ, y el segundo caso con CS y reslizumab | MPZ: 100 mg/mesCS: 25 mg/día ambos pacientesBRZ: 30 mg cada 4 semanas (3 dosis) y luego 30 mg cada 8 semanas | En el primer caso se alcanzaron niveles estables de eosinófilos (450/μL) y anticuerpos anti-MPO en límites de detección 6,8 UI/mL posterior al uso de MPZ durante un año. En el segundo caso, después de 3 meses de iniciar la terapia con benralizumab, el paciente logró la remisión completa, los eosinófilos estaban indetectables (0 células/μL) y los CS orales fueron suspendidos | No se reportan eventos adversos asociados a las terapias instauradas. No se expone información relacionada con seguimiento a largo plazo en estos casos |
| Ueno et al.252022 | Reporte de caso | Paciente masculino de 74 años | Describir un caso de GEP refractaria tratada con PSL y MPZ | MPZ: 300 mg/mesPSL: 70 mg/día → posterior destete progresivo hasta lograr 40 mg/día | Después de 12 meses de tratamiento con MPZ y CS el puntaje BVAS pasó de 29 a 0 puntos, con un recuento eosinófilos que inició en 24,768/μL y disminuyó a 101/μL. Después de 23 meses se suspendieron los CS y se continuó en monoterapia con MPZ | No se reportaron eventos adversos con el MPZ, a pesar de realizar un seguimiento estricto de la terapia instaurada |
| Tsurikisawa et al.262021 | Cohorte retrospectiva | Cincuenta y nueve pacientes con edad media de 57,6 años63,3% eran mujeres | Evaluar los factores del curso clínico de los pacientes con GEP refractario tratados con MPZ (n = 30) en un grupo de respuesta marcada vs. respuesta débil | MPZ: 300 mg/mes | La disminución media de leucocitos en el grupo de respuesta marcada fue 18,5 (DE: 7,7) vs. 9,5 (DE: 3,1) del grupo de respuesta débil (p < 0,01). Particularmente, una media de disminución de eosinófilos en sangre de 11,1 (DE: 7,6) en el grupo respuesta marcada vs. 3,60 (DE: 3,3) del grupo de respuesta débil (p < 0,01). Se encontró una importante disminución de CS en el grupo de respuesta marcada | Pequeño tamaño de muestra para determinar una real correlación entre las variables del curso clínico que se asocian a mejor respuesta clínica. No se reportan eventos adversos en este tipo de estudio |
| Ueno et al.272021 | Cohorte ambispectivo | Dieciséis pacientes, edad media de 61,5 añosEl 56,2% eran mujeres | Efectividad y seguridad de MPZ en pacientes con GEP refractaria en términos de remisión durante un año | MPZ: 300 mg/mes | Las tasas de remisión en el grupo de pacientes en tratamiento con MPZ en el primer mes fue de 12,5, 31,3% al tercer mes, 50% al sexto mes y 75% al año. Las tasas de remisión en el grupo control en el primer mes fue 6,3%, 12,5 al tercer mes, 6,3 al 6 mes y 0% a los 12 meses | Ningún paciente tuvo infección nueva después del inicio de la terapia, no se reportaron eventos adversos moderados o graves. El tamaño de la muestra fue pequeño y el grupo control fue el mismo antes de usar MPZ |
| Mutoh et al.282021 | Reporte de caso | Paciente masculino de 45 años | Presentar el caso de un paciente con GEP y hemorragia intraventricular enfocado en el tratamiento con MPZ | MPZ: 300 mg/mesMP:1.000 mg/24 h/IV durante 3 días.PSL: 80 mg/24 h → posterior destete progresivo hasta 40 mg /día.RTX: 500 mg semana | Después del tratamiento con PSL + IVCY + MPZ + RTX las células B CD19 tuvieron una disminución de 13,1% a menos del 0,1%. El BVAS mostró un puntaje inicial de 25 a 0, sin signos de recaída y eventos adversos asociados con inmunosupresión. Se logró un destete del uso de CS iniciando con 80 mg hasta 17 mg. La fracción de eyección del ventrículo izquierdo del ingreso fue 8% con un aumento posterior al tratamiento hasta de 30% | No se exploraron los perfiles de eficacia y seguridad a largo plazo de la terapia combinada que incluye IVCY, MPZ y RTX como inducción y remisión sostenidaNo hubo eventos adversos asociados a inmunosupresión u otros directamente relacionados con la terapia instaurada |
| Ushio et al.292021 | Reporte de caso | Pacientes femeninas de 69 y 49 años | Describir dos casos de GEP refractario en tratamiento con MPZ | MPZ: 300 mg/mes en ambos casos.Caso 1: PSL: 6-8 mg díaCaso 2: PSL: 2 mg día | En el primer caso a los 6 meses del inicio de tratamiento con MPZ el recuento de eosinófilos disminuyó hasta < 100/μL, y el puntaje BVAS que se encontraba en 6 disminuyó a 0. En el segundo caso, después de un mes de haber iniciado MPZ el recuento de eosinófilos disminuyó a 69 μL, después de 2 meses la otorrea desapareció y se reportó un puntaje BVAS de 0. En ambos casos se logró una disminución de la dosis de los CS hasta 2 mg al día | No se reportaron eventos adversos con el uso de MPZ durante el seguimiento en estos pacientes. No se reporta seguimiento a largo plazo de la terapia |
| Canzian et al.302020 | Cohorte retrospectiva | Ciento cuarenta y siete pacientes,edad media de 52 añosEl 59% eran mujeres del grupo de MPZ | Efectividad y seguridad de del MPZ (51 pacientes), omalizumab y RTX para el tratamiento de la GEP refractaria o recidivante en adultos | MPZ (n = 51)100 mg/mes(n = 29)300 mg/mes(n = 22) | En el grupo MPZ, la dosis de PSL disminuyó 10 mg/día (IQR 7,5-25) al inicio, 5 mg/día (IQR 3,75-7,5) a los 6 meses y 3,9 mg/día (IQR 2,1-6,9) a los 12 meses. La frecuencia de remisión fue de 78% y respuesta parcial de 10% en el grupo MPZ. Las tasas de remisión a los 12 meses fueron de 76 y de 82% entre los pacientes que recibieron MPZ en dosis de 100 mg y 300 mg, respectivamente | Once pacientes que recibieron MPZ experimentaron eventos adversos de leves a moderados, principalmente astenia. Tres pacientes suspendieron el tratamiento con MPZ por eventos adversos graves o embarazo |
| Vultaggio et al.312020 | Serie de casos | Dieciocho pacientes,edad media de 57 años66,5% eran mujeres | Efectividad y seguridad del MPZ en pacientes con GEP refractaria para el control de síntomas y reducción de la dosis de los CS | MPZ:100 mg/mesPSL: 5–20 mg/día) | El 66,6% de los pacientes no experimentaron exacerbaciones durante el tratamiento con MPZ, y disminuyó significativamente la tasa anual de exacerbaciones (OR: −87,6%; p < 0,001). Los recuentos de eosinófilos se redujeron al primer mes en 83,9% (790 ± 88 vs. 127 ± 24; p < 0,001). En el mes 12, 77,7% de los pacientes redujeron la dosis de CS diaria al menos 50%, 16,6% suspendieron los CS | Tamaño de muestra pequeño y periodo de seguimiento corto |
| Vergles et al.322020 | Reporte de caso | Tres pacientes,edad media de 71,3 años100% eran mujeres | Presentar tres casos de GEP refractaria en tratamiento con MPZ | MPZ: 100 mg/mesCaso 1: PSL: 20 mg/día hasta 10 mg/díaCaso 2: 20 mg/día hasta 10 mg/díaCaso 3: 10 mg/día hasta 2,5 mg/día | El MPZ permitió una disminución de la dosis de CS hasta dosis de 10 mg/día y 2,5 mg/día de PSL. Además, se mostró una disminución del recuento de eosinófilos en sangre periférica, mejoría del control del asma, y se mantuvo en gran parte libre de recaídas | Los eventos adversos reportados estaban asociados al uso previo de dosis altas de CS. Tamaño de muestra pequeño y periodo de seguimiento corto |
| Wechsler et al.332017 | Ensayo clínico multicéntrico, aleatorizado doble ciego de grupos paralelos | Ciento treinta y seis pacientes,edad media de 49 añosEl 74% eran mujeres | Eficacia y seguridad del MPZ en pacientes con GEP refractaria durante un periodo de seguimiento de 52 semanas frente a un grupo placebo | MPZ:300 mg/mesPSL: ≥ 7,5 a ≤ 50,0 mg/día hasta ≤ 4 mg/día | El 50% de la población total recibió MPZ, y mostró más semanas de remisión frente al placebo (OR 5,91, IC 95% 2,68-13,03; p < 0,001). La remisión ocurrió en 53% de los participantes del grupo de MPZ frente a 19% del grupo placebo. La tasa de recaída anualizada fue 1,14 en el grupo de MPZ, en comparación con 2,27 en el grupo placebo (RR: 0,50, IC 95% 0,36-0,70; p < 0,001). Un total de 44% de los participantes de MPZ vs. 7% del placebo tuvo una dosis diaria de CS de 4,0 mg o menos por día durante semanas 48 a 52 (OR 0,20, IC 95% 0,09-0,41; p < 0,001) | El 3% del grupo MPZ mostró empeoramiento del asma frente a 6% del grupo placebo. Dentro de las limitaciones la dosis de CS al ingreso al ensayo fue heterogénea y el 10% de los participantes eran ANCA- positivos al inicio |
| Steinfeld et al.342019 | Ensayo clínico multicéntrico aleatorizado, doble ciego de grupos paralelosAnálisis post hoc | Ciento treinta y seis pacientes,edad media de 48,5 añosEl 56% eran hombres | Eficacia y seguridad del MPZ en pacientes con GEP refractaria que recibieron CS por 4 semanas. Se evaluó remisión, destete de CS y recaídas en la semana 36 y 48 frente a un grupo placebo | MPZ: 300 mg/mesPSL: ≥ 7,5 – ≤ 50 mg/día hasta ≤ 4 mg/día | El 87% de los pacientes en tratamiento con MPZ mostraron remisión, frente a 53% del grupo control (p < 0,001). El recuento de eosinófilos en sangre < 150 células/μL fue de 72% en el grupo de MPZ frente a 43% del grupo placebo (p = 0,033). Una dosis de CS > 20 mg/día se presentó en 60% de los pacientes con MPZ vs. 36% del grupo control (p = 0,395) | Únicamente 21 pacientes tuvieron una dosis de CS orales > 20 mg/día. Los pacientes con dosis de CS altas tenían más probabilidades de reportar recuentos de eosinófilos bajos |
| Kim et al.352010 | Piloto abierto | Siete pacientes,edad media de 45 añosEl 72% eran mujeres | Efectividad del MPZ para reducir los CS en la GEP | MPZ:750 mg/ cada 4 mesesRango de dosis media CS: 12,9 mg/día hasta 4,6 mg/día | La dosis media al inicio del estudio fue de 12,9 mg/d (rango, 10-20 mg). frente a 4,6 mg a la semana 16 del estudio, con una reducción de 64% (p < 0,0001) después de 4 dosis de MPZ. La dosis promedio de los CS a la semana 24 fue de 5 mg, una disminución de 61% (p < 0,002) | Una limitación de este estudio es que no se midió el grado de eosinofilia para evaluar si MPZ era eficaz para reducirla. El diseño abierto del estudio supone ciertos sesgos y un tamaño de muestra pequeño |
ANCA: anticuerpos anticitoplasma de neutrófilos; BRZ: benralizumab; BVAS: Birmingham Vasculitis Activity Score; CIV: ciclofosfamida endovenosa; CS: corticoides; DE: desviación estándar; GEP: poliangeítis granulomatosa eosinofílica; IC: intervalo de confianza; IG: Inmunoglobulina; MPO: mieloperoxidasa; IQR: rango intercuartil; IV: intravenoso; IVCY: ciclofosfamida intravenosa; MP: metilprednisolona; MPZ: mepolizumab; OR: odds ratio; PSL: prednisolona; RR: riesgo relativo; RTX: rituximab; SC: vía subcutánea.
Características de los registros de ensayos clínicos incluidos
| ID | Diseño del ensayo | País | Tamaño de muestra | Intervención | Control | Objetivo primario | Fecha inicio/ registro | Fecha esperada de fin |
|---|---|---|---|---|---|---|---|---|
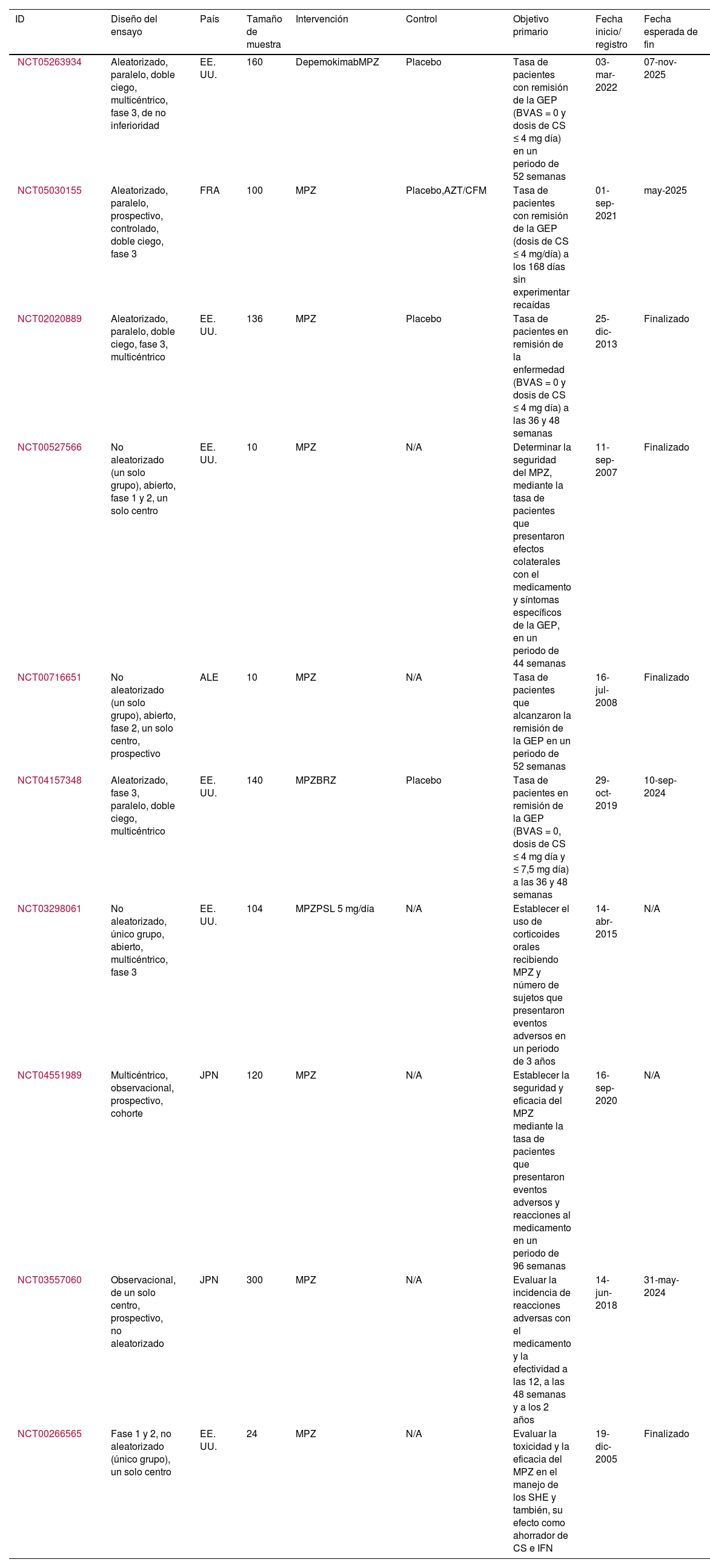
| NCT05263934 | Aleatorizado, paralelo, doble ciego, multicéntrico, fase 3, de no inferioridad | EE. UU. | 160 | DepemokimabMPZ | Placebo | Tasa de pacientes con remisión de la GEP (BVAS = 0 y dosis de CS ≤ 4 mg día) en un periodo de 52 semanas | 03-mar-2022 | 07-nov-2025 |
| NCT05030155 | Aleatorizado, paralelo, prospectivo, controlado, doble ciego, fase 3 | FRA | 100 | MPZ | Placebo,AZT/CFM | Tasa de pacientes con remisión de la GEP (dosis de CS ≤ 4 mg/día) a los 168 días sin experimentar recaídas | 01-sep-2021 | may-2025 |
| NCT02020889 | Aleatorizado, paralelo, doble ciego, fase 3, multicéntrico | EE. UU. | 136 | MPZ | Placebo | Tasa de pacientes en remisión de la enfermedad (BVAS = 0 y dosis de CS ≤ 4 mg día) a las 36 y 48 semanas | 25-dic-2013 | Finalizado |
| NCT00527566 | No aleatorizado (un solo grupo), abierto, fase 1 y 2, un solo centro | EE. UU. | 10 | MPZ | N/A | Determinar la seguridad del MPZ, mediante la tasa de pacientes que presentaron efectos colaterales con el medicamento y síntomas específicos de la GEP, en un periodo de 44 semanas | 11-sep-2007 | Finalizado |
| NCT00716651 | No aleatorizado (un solo grupo), abierto, fase 2, un solo centro, prospectivo | ALE | 10 | MPZ | N/A | Tasa de pacientes que alcanzaron la remisión de la GEP en un periodo de 52 semanas | 16-jul-2008 | Finalizado |
| NCT04157348 | Aleatorizado, fase 3, paralelo, doble ciego, multicéntrico | EE. UU. | 140 | MPZBRZ | Placebo | Tasa de pacientes en remisión de la GEP (BVAS = 0, dosis de CS ≤ 4 mg día y ≤ 7,5 mg día) a las 36 y 48 semanas | 29-oct-2019 | 10-sep-2024 |
| NCT03298061 | No aleatorizado, único grupo, abierto, multicéntrico, fase 3 | EE. UU. | 104 | MPZPSL 5 mg/día | N/A | Establecer el uso de corticoides orales recibiendo MPZ y número de sujetos que presentaron eventos adversos en un periodo de 3 años | 14-abr-2015 | N/A |
| NCT04551989 | Multicéntrico, observacional, prospectivo, cohorte | JPN | 120 | MPZ | N/A | Establecer la seguridad y eficacia del MPZ mediante la tasa de pacientes que presentaron eventos adversos y reacciones al medicamento en un periodo de 96 semanas | 16-sep-2020 | N/A |
| NCT03557060 | Observacional, de un solo centro, prospectivo, no aleatorizado | JPN | 300 | MPZ | N/A | Evaluar la incidencia de reacciones adversas con el medicamento y la efectividad a las 12, a las 48 semanas y a los 2 años | 14-jun-2018 | 31-may-2024 |
| NCT00266565 | Fase 1 y 2, no aleatorizado (único grupo), un solo centro | EE. UU. | 24 | MPZ | N/A | Evaluar la toxicidad y la eficacia del MPZ en el manejo de los SHE y también, su efecto como ahorrador de CS e IFN | 19-dic-2005 | Finalizado |
ALE: Alemania; AZT: azatioprina; BRZ: benralizumab; BVAS: Birmingham Vasculitis Activity Score; CFM: ciclofosfamida; CS: corticoides; EE.UU: Estados Unidos; FRA: Francia; GEP: poliangeítis granulomatosa eosinofílica; IFN: interferón; JPN: Japón; MPZ: mepolizumab; PSL: prednisolona; SHE: síndromes hipereosinofílicos.
Wechsler et al.33 evaluaron la eficacia y la seguridad de MPZ en 136 pacientes, 68 en el grupo de intervención y 68 en el de placebo. El objetivo primario fue lograr una remisión definida por una puntuación del BVAS de 0 y la administración de prednisolona o prednisona ≤ 4 mg durante un periodo de 52 semanas. En el grupo de MPZ se mostró una remisión acumulada de 28% de los sujetos vs. 3% del grupo de placebo. Un total de 33% de los 79 pacientes en tratamiento con MPZ y un recuento absoluto de eosinófilos ≥ 150 células/mm3 exhibieron una mayor proporción de remisión frente al grupo control (33 vs. 0%). En el de intervención se observó una dosis promedio más baja de prednisolona o prednisona durante las semanas 48 a 52 vs. el grupo placebo (odds ratio [OR] 0,20; intervalo de confianza [IC] 95% 0,09-0,41; p < 0,001).
Steinfeld et al.34 hicieron un análisis post hoc de un ensayo clínico en pacientes con GEP en tratamiento con MPZ que no lograron la remisión establecida por el protocolo publicado por Wechsler33. Este análisis secundario fue un ensayo clínico aleatorizado doble ciego multicéntrico que evaluó la eficacia del MPZ en 136 sujetos con GEP, de los cuales 68 fueron asignados al grupo de intervención y los demás al de control bajo placebo. Los participantes debían tener diagnóstico de GEP refractaria al menos seis meses antes y estar recibiendo una dosis estable oral de corticoides (prednisolona o prednisona: ≥ 7,5-≤ 50 mg/día), con o sin tratamiento de terapia inmunosupresora durante ≤ 4 semanas antes de la inscripción en el estudio. Se definió como remisión de la enfermedad un puntaje del BVAS de 0, más una dosis de corticoides orales ≤ 4 mg/día. Del grupo de tratamiento con MPZ, el 59% (36/68) logró remisión de la enfermedad, comparado con el 19% (13/68) de quienes recibieron placebo (p < 0,001). Adicionalmente, el 57% (39/68) del grupo de intervención alcanzó una reducción del corticoide oral ≥ 50%, en comparación con el 21% (14/68) del de control (p < 0,001). La proporción de personas sin recaídas fue 26% mayor en el grupo con MPZ frente al de placebo (44 vs. 18%; p = 0,001).
Estudios observacionalesCanzian et al.30 describieron la efectividad y la seguridad en 147 pacientes con diagnóstico de GEP, 63 de los cuales recibieron rituximab, 51 MPZ y 33 omalizumab, en términos de reducción en el puntaje del BVAS y dosis de corticoides orales. El grupo MPZ mostró una mediana de reducción de la dosis de corticoides de 5 mg/día (rango intercuartílico [IQR] 3,75-7,5) a los seis meses y 3,9 mg/día (IQR 2,1-6,9) a los 12 meses. El puntaje inicial del BVAS fue de 2 (1-5), con una mediana de reducción de 0 puntos (IQR 0-0,5) a los seis meses. En el grupo de MPZ, las tasas de remisión fueron de 76% con dosis de 100 mg y de 82% con dosis de 300 mg a los 12 meses. De los pacientes en tratamiento con MPZ, 6% lo suspendieron debido a eventos adversos o embarazo. Al compararlos con los otros dos medicamentos, los pacientes en terapia con rituximab tuvieron un puntaje inicial en el BVAS de 8,5 (IQR: 5-13), con una reducción a un punto (0-4,5) a los seis meses y 0 (0-2) a los 12 meses. La dosis de prednisona disminuyó de 20 (IQR: 15-37,5) a 7,5 (IQR: 5-10) mg/día a los seis y 12 meses de seguimiento.
Tsurikisawa et al.26 analizaron la efectividad del MPZ en 30 pacientes en términos de reducción en el puntaje del BVAS. En el estudio se estructuraron dos grupos: sujetos con efecto marcado (n = 20), los cuales mostraron una disminución de la dosis diaria de corticosteroides, o se prolongó el intervalo entre los tratamientos con inmunoglobulina intravenosa, y un grupo con efecto débil (n = 10), en el que no se logró disminuir la dosis de inmunomoduladores. Las personas con un efecto marcado presentaron un puntaje inicial del BVAS de 33,5 (desviación estándar [DE] 8,3) con una reducción a 8,1 puntos (DE 4,2) en la última valoración médica después del inicio del MPZ. En los pacientes con un efecto débil, el puntaje inicial del BVAS fue de 32,2 (DE 6,6), con uno final de 14,0 (DE 4,9) puntos.
Registros de ensayos clínicos de la Organización Mundial de la Salud que evalúan el mepolizumabSe encontraron 10 ensayos clínicos registrados en United States National Library of Medicine con un total de 1.104 pacientes (tabla 2). El objetivo primario de estos estudios es determinar la eficacia y la seguridad del MPZ, para lo cual evalúan la tasa de sujetos que lograron la remisión de la enfermedad y el número de los que presentaron reacciones adversas al medicamento, en un periodo de tiempo establecido por cada estudio. En términos generales, se definió la remisión de la GEP como la presencia de un puntaje del BVAS igual a 0 y dosis de corticoides orales ≤ 4 mg/día. Sin embargo, en el ensayo Mandara (https://clinicaltrials.gov/study/NCT04157348) la remisión clínica también se aceptó a partir de dosis de corticoides orales ≤ 7,5 mg/día. En la actualidad se encuentran activos seis estudios, de los cuales dos (https://clinicaltrials.gov/study/NCT05263934 y https://clinicaltrials.gov/study/NCT05030155) continúan en la fase de reclutamiento de pacientes.
Seguridad y limitaciones de los documentos incluidosLos eventos adversos reportados luego de la administración de MPZ fueron eritema en el lugar de la inyección, exacerbación de la congestión nasal, astenia e infecciones de la vía aérea como infección por virus sincitial respiratorio (tabla 1). No se documentaron eventos adversos graves en ningún manuscrito incluido. Únicamente dos estudios fueron ensayos clínicos, el 88% (15/17) fueron estudios observacionales con limitaciones propias de esta metodología como tamaños de muestra pequeños y periodos de seguimiento cortos. En las publicaciones añadidas en la revisión no se encontraron análisis sobre costos del MPZ.
DiscusiónEn este manuscrito se hizo una revisión exploratoria sobre el impacto clínico del MPZ en pacientes con diagnóstico de GEP, la cual mostró resultados favorables en términos de modulación de la actividad de la enfermedad junto a un buen perfil de seguridad19–35. El BVAS mostró una reducción del puntaje consistente en la mayoría de los documentos incluidos; la dosis de corticoides inicial logró disminuir después del inicio del MPZ, y el número de eosinófilos en sangre fue un marcador biológico utilizado ampliamente para estimar el grado de modulación de la enfermedad19–35. Los eventos adversos descritos fueron leves y moderados en la totalidad de los estudios incluidos. Sin embargo, consecuentemente con la metodología de tipo observacional empleada en la mayoría de los trabajos, se presentó una limitación en la interpretación y la extrapolación de los resultados19–32,35.
La información obtenida de los ensayos clínicos incluidos fue resultado de una evaluación inicial realizada por Wechsler33 y un análisis post hoc llevado a cabo por Steinfeld dos años después34; este último permitió completar la información de los pacientes con GEP recurrente o refractaria que no lograron la remisión definida. Los resultados obtenidos en ambas publicaciones permitieron ratificar la eficacia y la seguridad del MPZ en términos de reducción de la dosis de corticoides, mejora del compromiso sistémico estimado por el puntaje BVAS y ausencia de recaídas33,34. Cabe resaltar que en los ensayos clínicos no se describe la costoeficacia del MPZ en comparación con el placebo u otros tratamientos disponibles, por lo cual es útil hacer nuevas investigaciones que contrasten estas terapias disponibles para la GEP en el ámbito de la economía de la salud.
La evaluación clínica de la actividad de la GEP de manera objetiva es un reto para los reumatólogos, y a menudo se utilizan puntajes de gravedad o marcadores de inflamación36. El BVAS es una herramienta validada para evaluar la actividad de la enfermedad en pacientes con diferentes tipos de vasculitis activas por medio de una medición objetiva de nueve sistemas de órganos que capturan un amplio espectro de manifestaciones clínicas37,38. Los estudios que determinan el rendimiento diagnóstico del BVAS muestran análisis de curvas-Receiver Operating Characteristic-curve (ROC) aceptables de 0,60 (IC 95% 0,54-0,65), datos no consistentes para predecir la mortalidad a uno (curvas-ROC 0,49) y cinco años (curvas-ROC 0,56)39. La estimación de la gravedad de la enfermedad en el momento del diagnóstico y en el seguimiento clínico por medio del BVAS ha sido ampliamente evaluada en ensayos clínicos y estudios observacionales para guiar el enfoque terapéutico en función de las manifestaciones locales y sistémicas40. Además, la relación entre la actividad inicial de la GEP y el posterior riesgo de mortalidad puede variar en los estudios disponibles, debido a la eficacia, la efectividad y la seguridad del enfoque terapéutico adoptado en la metodología de los trabajos19–32,35.
La GEP refractaria se define como la persistencia o el incremento de la actividad de la enfermedad después de haber recibido —por lo menos por cuatro semanas— un tratamiento óptimo para la remisión36,41. Antes de determinar que la GEP es refractaria se debe asegurar el diagnóstico primario de GEP, descartar otras enfermedades orgánicas como neoplasias o procesos infecciosos concomitantes y evaluar la adherencia del paciente a la terapia36,41, además de determinar si los signos o los síntomas se deben a la activación de la enfermedad o a un daño crónico irreversible en un órgano específico asociado a la vasculitis u otras entidades concomitantes36,41. El tratamiento de elección para la inducción de la remisión y el mantenimiento de la GEP debe basarse en la gravedad de las manifestaciones clínicas y en el pronóstico evaluado con Five Factor Score42,41. Las guías de práctica clínica recomiendan el uso de MPZ en combinación con corticoides para la GEP reincidente refractaria no grave y como manejo de mantenimiento en pacientes con predominio de síntomas respiratorios que tengan dosis diarias de corticoides ≥ 7,5 mg, con el fin de reducir su dosis efectiva y los efectos deletéreos36,41.
La recaída de la GEP se define como la recurrencia de signos y síntomas atribuidos a la actividad de la enfermedad después de un periodo de remisión, junto a la necesidad de incrementar la dosis de corticoides e inicio, o bien el aumento de la dosis de otro inmunosupresor36,41. Asimismo, es importante diferenciar las recaídas sistémicas de las exacerbaciones aisladas del asma o de los síntomas rinosinusales, ya que tendrán otro enfoque terapéutico36,41. Por otro lado, el uso en conjunto de dos anticuerpos monoclonales junto a la terapia convencional puede lograr que disminuyan las dosis altas de corticoides, siendo el rituximab y el MPZ los que presentan mayor evidencia medica disponible21,43,44.
La GEP se caracteriza por la presencia de signos y síntomas cuya expresión varía en cada paciente; el tratamiento se supedita a las características de presentación específica44. El American College of Rheumatology recomienda los corticoides orales como primera línea y en casos refractarios se indica la titulación de estos con el fin de lograr la remisión a dosis óptimas y seguras para los sujetos con GEP42,36,45. Sin embargo, un alto porcentaje de ellos no alcanzan la remisión, junto a un escenario de eventos adversos por dosis elevadas de corticoides, por lo cual la combinación de anticuerpos monoclonales con dosis estables de corticoides es una opción prometedora para la enfermedad de difícil control y la reducción constante de las dosis de estos últimos, sin afectar la remisión clínica ni aumentar el número de recaídas36,45.
Los biomarcadores utilizados para diferenciar la actividad de la GEP de otros padecimientos sistémicos son limitados. La eosinofilia periférica puede corresponder a la actividad de la GEP, principalmente en la atopia con asma46,47. Sin embargo, enfermedades eosinofílicas y vasculíticas pueden generar confusión al momento de estratificar el grado de compromiso sistémico y el estado inflamatorio46,47. Debido a ello, descartar tratamientos u otras enfermedades que generen un estado hipereosinofílico, como el síndrome de reacción de sensibilidad a medicamentos con eosinofilia y síntomas sistémicos (DRESS), neoplasias mieloides, linfoides con eosinofilia, infecciones por helmintos (Strongyloides stercoralis), entre otras, es indispensable para un adecuado uso clínico de los eosinófilos en sangre como biomarcadores3,36,46–48. En general, estos son ampliamente empleados como un marcador de respuesta al tratamiento con anticuerpos monoclonales en pacientes con GEP, pero, de acuerdo con lo mencionado, su interpretación adecuada está sujeta a otras enfermedades y condiciones propias del sujeto que el reumatólogo debe conocer.
Entre los otros anti-IL-5 se describen el benralizumab y el reslizumab, con características farmacocinéticas/farmacodinámicas similares a las del MPZ, y ensayos clínicos que muestran eficacia y seguridad en términos de disminución del uso de corticoides orales y actividad de la enfermedad49,50. Sin embargo, la información disponible sobre estas alternativas es sustancialmente limitada si se compara con el MPZ, e incluso sin datos que contrasten desenlaces entre los anti-IL-5. El registro de ensayo clínico Mandara-NCT04157348 se encuentra en reclutamiento de pacientes, con el fin de distinguir la eficacia y la seguridad del benralizumab en comparación con el MPZ. En la actualidad, la evidencia en países de América del Sur es escasa, lo cual limita la extrapolación e interpretación de resultados en esta población, lo cual hace necesario que se realicen nuevos estudios clínicos en esta región.
Los anticuerpos monoclonales son medicamentos en rápida expansión y utilización debido a su eficacia, efectividad y seguridad para el tratamiento de enfermedades con un componente inmunomediado importante, entre ellas la GEP51. Los eventos adversos descritos con mayor frecuencia son las reacciones de hipersensibilidad, malestar general, cefalea y mareos, cuya gravedad generalmente es leve y moderada51,52. Una revisión de la base de datos de la Administración de Alimentos y Medicamentos (FDA) mostró 104 casos notificados de anafilaxia con MPZ, y un índice de probabilidad de informe de anafilaxia de 4,65 (IC 95% 3,85-5,65)53. Por otro lado, las infecciones se estiman entre 4 y 7% en pacientes que recibieron MPZ, entre ellos por el virus del herpes zoster52. La polifarmacia junto a la metodología establecida en los estudios encontrados limita la asociación de eventos adversos con el MPZ en sujetos con GEP.
Una de las principales limitaciones es la ausencia del análisis de la calidad de la evidencia de los estudios incluidos en la revisión sistemática exploratoria, de conformidad con lo sugerido por la guía PRISMA-ScR y por Arksey et al.13,14,18. Las estrategias de búsqueda se desarrollaron con el acompañamiento de un bibliotecólogo experto, para aumentar su sensibilidad, especificidad y reproducibilidad de la información, y se utilizaron para un motor de búsqueda y una base de datos, ambas con gran cantidad de información correspondiente al tema. Los idiomas, únicamente inglés y español, constituyen una limitación para la recolección de la evidencia disponible.
Asimismo, el elevado número de artículos de tipo observacional es una fuerte limitación en los resultados de esta revisión, debido al pequeño tamaño de la muestra y el corto periodo de seguimiento clínico descrito en los estudios19–32,35. Cabe resaltar que los ensayos clínicos incluidos en esta revisión comparaban MPZ con placebo, y la mayoría de los estudios observacionales los contrastaron únicamente con la terapia estándar, lo cual limita la extrapolación de sus resultados e introduce sesgos en su interpretación si se equipara con otros biológicos19–35. Para la evidencia médica actual en pacientes con GEP, la extrapolación de estos resultados requiere continuar el reclutamiento activo de sujetos en los registros clínicos descritos en la plataforma de la OMS15, junto con la estructuración de nuevos protocolos y ensayos clínicos que amplíen el número de personas analizadas, la diversidad de variables consideradas y el tiempo de seguimiento clínico.
ConclusiónEl uso del MPZ en pacientes con GEP muestra una reducción en el puntaje del BVAS, ahorro de corticoides orales y modulación de la hipereosinofilia en sangre. Los eventos adversos descritos fueron leves y moderados en la totalidad de los estudios incluidos. La obtención y la extrapolación de nuevos resultados clínicos requiere continuar el reclutamiento y la aleatorización de sujetos con la enfermedad en tratamiento con MPZ durante un mayor periodo de seguimiento clínico. La estructuración de nuevos protocolos y ensayos clínicos que amplíen el número de personas analizadas, la diversidad de variables consideradas y el tiempo de seguimiento clínico es necesaria para la extrapolación e interpretación de resultados en diferentes poblaciones y áreas geográficas.
FinanciaciónEste trabajo recibió financiación por parte de la Universidad de La Sabana.
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses.
A la Universidad de La Sabana.