El lupus eritematoso sistémico (LES) es una enfermedad autoinmune compleja, en cuya fisiopatología destaca la hiperactividad de las células B. En esta entidad, el factor activador de células B (BAFF) está relacionado con la pérdida de la tolerancia inmunológica; además, concentraciones altas de dicho factor se han asociado con la progresión de la enfermedad. Se desconoce de qué manera las terapias de inducción con ciclofosfamida (CFM) o micofenolato (MMF) modulan los niveles de BAFF.
ObjetivoDeterminar de qué manera las terapias de inducción modulan las concentraciones séricas de BAFF.
Materiales y métodosSe realizó un estudio observacional analítico con 20 pacientes con LES de dos instituciones entre los años 2020 y 2022, en tanto que la información clínica y de laboratorio se obtuvo de las historias clínicas. La medición de los niveles séricos de BAFF se llevó a cabo mediante un kit de ensayo inmunoenzimático (ELISA) y los análisis estadísticos con GraphPad Prism versión 9 (San Diego, California, EE. UU.).
ResultadosSe incluyeron 20 pacientes con diagnóstico de LES, 18 de ellos en tratamiento con CFM y dos con MMF, nueve sujetos en inicio y 11 en tres a seis meses. La mediana de BAFF en aquellos con LES fue 902,2 pg/mL, en tanto que, en controles sanos, fue de 379,7 pg/mL; las diferencias fueron estadísticamente significativas (p=0,0003). También se encontraron variaciones en los niveles séricos de BAFF entre los pacientes tratados con antimaláricos (AMA) (p=0,0465) y una correlación inversa con los valores de creatinina y dosis de prednisolona.
ConclusionesLos niveles de BAFF se ven afectados durante la terapia de inducción, se observa una reducción inicial y la recuperación posterior en tres a seis meses. Nuestros resultados sugieren que la cloroquina (CQ) y dosis altas de prednisolona mantienen más bajos los niveles séricos de BAFF.
Systemic lupus erythematosus (SLE) is a complex autoimmune disease in which B cell hyperactivity plays a key role in its pathophysiology. In this disease, the B cell activating factor (BAFF) is implicated in the loss of immunological tolerance, and high concentrations of this factor have been linked to disease progression. It is unknown how induction therapies with cyclophosphamide (CFM) or mycophenolate (MMF) modulate BAFF levels.
ObjectiveTo determine how induction therapies modulate BAFF concentrations.
Materials and methodsAn analytical observational study was performed with 20 patients with SLE from two institutions between 2020-2022, clinical and laboratory information was obtained from medical records. Measurement of serum BAFF levels was performed using an ELISA kit and statistical analyses with GraphPad Prism version 9.
Results20 patients with a diagnosis of SLE, 18 with CFM and 2 with MMF, were included, nine patients at baseline and eleven at 3-6 months. The median BAFF in SLE patients was 902.2 pg/mL and 379.7 pg/mL in healthy controls, statistically significant differences (p=.0003). BAFF levels were also found to be different among patients treated with antimalarials (p=.0465) and an inverse correlation with creatinine values and prednisolone doses was also observed.
ConclusionsBAFF levels are affected during induction therapy, observing an initial reduction and subsequent recovery at 3-6 months, our results suggest that chloroquine and high doses of prednisolone maintain lower serum BAFF levels.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune multisistémica, con sintomatología variable, crónica, caracterizada por periodos de remisión y exacerbación. En el proceso patológico intervienen múltiples factores genéticos, hormonales y ambientales, además de agentes infecciosos o fármacos que pueden agravar o reactivar la entidad1.
Los linfocitos B desempeñan un importante rol en el desarrollo de las enfermedades autoinmunes, ya que contribuyen a la exacerbación mediante diferentes mecanismos como la producción de autoanticuerpos, la presentación de autoantígenos y la generación de citocinas proinflamatorias2; todos estos eventos están involucrados en el desarrollo de la nefritis lúpica (NL), por lo cual las células B son una de las dianas terapéuticas3.
En el proceso de maduración de los linfocitos B intervienen diferentes moléculas del sistema inmune, las cuales ejercen una acción estimuladora o supresora; estas son principalmente citocinas, como el factor activador de células B (BAFF), que interviene en la maduración, participa en la diferenciación, la supervivencia y la proliferación de linfocitos B, principalmente, mediante interacciones ligando-receptor con el receptor específico BAFF-R y otras moléculas como el activador transmembrana, el modulador del calcio, el ligando de la ciclofilina (TACI) y el antígeno de maduración de células B (BCMA), los cuales actúan también como receptores4.
El aumento en los niveles séricos de la citocina BAFF se ha relacionado con diferentes patologías autoinmunes, entre ellas el LES5. Su alta concentración en el suero de los pacientes se ha asociado con un empeoramiento de la enfermedad, ya que regula la supervivencia y la maduración de los linfocitos B, y, por ende, tiene efecto en la respuesta humoral6,7.
En la actualidad, gracias a que se conoce la importancia de las células B en la patogénesis del LES, se emplean algunos anticuerpos monoclonales dirigidos al control de esta población celular, que han demostrado efectividad en el manejo8–11. Un ejemplo de ellos es el rituximab, un anticuerpo quimérico, dirigido contra el antígeno CD20 de las células B, que una vez unido a su blanco induce la muerte celular mediante diversos mecanismos, como citotoxicidad mediada por células o por anticuerpos, lo que produce una depleción de estos subtipos de células. Su uso en el LES se ha explorado desde el 2002 y se ha encontrado que su efecto es beneficioso incluso en aquellos sujetos con baja respuesta a la terapia convencional. Sin embargo, algunos pacientes que reciben este tratamiento presentan niveles de BAFF persistentemente elevados, que llevan a la perpetuación del estado inflamatorio en el LES, por lo que se ha sugerido adicionar a los esquemas terapéuticos, la inhibición de BAFF, a fin de prevenir las recaídas12.
Desde el 2011, para el tratamiento del LES se aprobó el uso de belimumab, un anticuerpo dirigido específicamente contra el BAFF soluble, el cual, al tener un efecto directo sobre la reducción de los niveles de la citocina, promueve a su vez la disminución de las subpoblaciones de las células B, lo que da lugar a una mejora continua en la actividad de la enfermedad13,14. Nuevas evidencias sugieren que el belimumab puede ser útil en pacientes con NL por inducir remisión o respuesta parcial y evitar la progresión del daño15.
A pesar de los avances que ha tenido la terapia biológica en los últimos años, los esquemas iniciales de manejo suelen emplear inmunosupresores de síntesis química16, los cuales son medicamentos que presentan una efectividad comparable a la de los anticuerpos monoclonales17, pero su uso prevalece puesto que son de más fácil acceso, implican menos costos y, en términos de producción, son más factibles18,19.
La terapia inmunosupresora en la nefritis pretende preservar la función renal y evitar la progresión, y se divide en dos fases: inducción y mantenimiento. En la primera se administran dosis elevadas de inmunosupresores durante seis meses, mientras que en el mantenimiento la dosis se reduce y se emplea por largos periodos20. El micofenolato (MMF) o la ciclofosfamida (CFM), en combinación con corticosteroides en dosis altas, se consideran el tratamiento de elección para la NL, ya que se ha demostrado que mejoran la supervivencia renal a largo plazo. El esquema terapéutico para la fase de inducción se establece teniendo en cuenta la clase de nefritis, la gravedad y las características del paciente. Para las clases III y IV son de elección dosis altas, con pulsos intravenosos mensuales de CFM de 0,5 a 1g/m2 de superficie corporal durante seis meses o MMF a dosis de 2 a 3g cada día durante seis meses. Posteriormente, tras una adecuada respuesta, se recomienda usar MMF o azatioprina para la terapia de mantenimiento21,22.
En el año 2016, Mercado et al. encontraron que los niveles de BAFF en pacientes con LES tratados con diversos fármacos (entre ellos algunos inmunosupresores) presentaban fluctuaciones en las concentraciones de esta citocina a través del tiempo. Aunque estas variaciones no eran uniformes entre ellos, no se estableció una relación entre los niveles de BAFF y el tipo de terapia específica a la cual estaban sometidos23.
Puesto que los niveles de BAFF se relacionan con la actividad de la enfermedad y debido a la disparidad evidenciada entre los estudios que buscan establecer estos niveles en pacientes con la terapia inmunosupresora, específicamente con CFM y MMF, ha surgido la necesidad de evaluar el efecto de estos medicamentos sobre las concentraciones séricas de la molécula y explorar la posible relación de estas con las manifestaciones clínicas de los sujetos. Pocos estudios permiten visualizar el comportamiento de estos a través del tiempo y si su efecto es transitorio o sostenido; además, no se establece una relación clara con una terapia específica17,24,25. El objetivo de este trabajo fue determinar las concentraciones séricas de BAFF, al inicio y durante los seis meses de duración de la terapia de inducción, de tal forma que permita establecer comparaciones entre el comportamiento de BAFF en los diferentes tiempos y con ambos medicamentos.
Materiales y métodosParticipantes del estudioSe llevó a cabo un estudio observacional analítico en Medellín (Colombia), en el que se incluyeron 20 pacientes con diagnóstico de LES, de acuerdo con los criterios dados del American College of Rheumatology (ACR), versión European League Against Rheumatism (EULAR)/ACR 201926, y los parámetros revisados por Tan et al. en 198227. Los criterios de inclusión del estudio comprendían ser mayor de 18 años, tener diagnóstico de nefritis confirmado por biopsia y estar bajo esquema de inducción con MMF o CFM en el periodo 2020-2022 en el Hospital San Vicente Fundación (HSVF) o la Institución Prestadora de Salud (IPS) Artmédica. Las características clínicas y demográficas se obtuvieron mediante la revisión de las historias clínicas. Este estudio fue diseñado siguiendo la Declaración de Helsinki y la legislación colombiana (Ministerio de Salud 008430 de 1993); fue aprobado por el Comité de Ética del Instituto de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia. Cualquier evidencia de infección reciente se consideró un criterio de exclusión. Se incluyeron ocho donantes sanos como control técnico y de referencia de valores de BAFF (sin evidencia de enfermedades autoinmunes, infecciosas, procesos cancerígenos o estado de gestación y no pareados por sexo ni por edad).
Toma y procesamiento de las muestrasTodos los participantes proporcionaron una muestra de sangre, la cual fue tomada siguiendo el protocolo de venopunción28. La sangre se recolectó en dos tubos sin anticoagulante de 6mL, luego se centrifugó (1.500g) a temperatura ambiente durante 10min, y, posteriormente, del sobrenadante se separaron aproximadamente 3mL de suero. La cantidad obtenida se almacenó en viales de 500μL y a -20°C hasta su uso. Las tomas se hicieron en tiempos diferentes de la terapia de inducción: al comienzo y hasta dos meses (T0) y durante la duración de esta, que va de tres a seis meses (T1).
Ensayo inmunoenzimáticoLos niveles de la citocina se determinaron en el suero de los pacientes y los controles utilizando el kit para la detección de BAFF humano de R&D Systems (Minneapolis, MN, EE. UU.)29, de conformidad con las instrucciones del fabricante. Brevemente, las muestras se mantuvieron a temperatura ambiente, luego se diluyeron 1:2 con diluente calibrador RD6Q. Posteriormente, se adicionaron 100μL de Assay Diluent RD1-111 por muestra en los pozos de la microplaca BAFF/B lymphocyte stimulator (Blys) humana, y 50μL de cada muestra para proceder a incubar en agitación durante tres horas a temperatura ambiente. Luego, se añadieron 200μL del conjugado de BAFF/BlyS humano a cada pozo, y se incubó nuevamente durante una hora en las mismas condiciones. Finalmente, se agregaron 200μL del sustrato, se incubó por 30min sin agitación y en oscuridad y se añadieron 50μL de la solución de parada. La lectura de los resultados se llevó a cabo empleando el equipo Multiskan™ GO (Thermo Scientific), a una longitud de onda de 450nm y con corrección a 540nm.
Análisis estadísticoLas características clínicas y los datos sociodemográficos se documentaron empleando estadística descriptiva (medidas de tendencia central y frecuencia). Se evaluó la normalidad de las variables cuantitativas incluidas en el estudio, para lo cual se empleó la prueba de Shapiro Wilk; la significancia estadística entre dos grupos se halló al aplicar la prueba de Mann-Whitney, y se hicieron múltiples comparaciones a partir del análisis de la varianza (ANOVA) para los datos normales y la prueba de Kruskal-Wallis para aquellos no normales. Finalmente, las correlaciones se llevaron a cabo con la prueba de Spearman; se consideraron valores de p<0,05 como estadísticamente significativos. Todos los análisis fueron realizados en el software GraphPad Prism versión 9.0.0 (San Diego, California, EE. UU.).
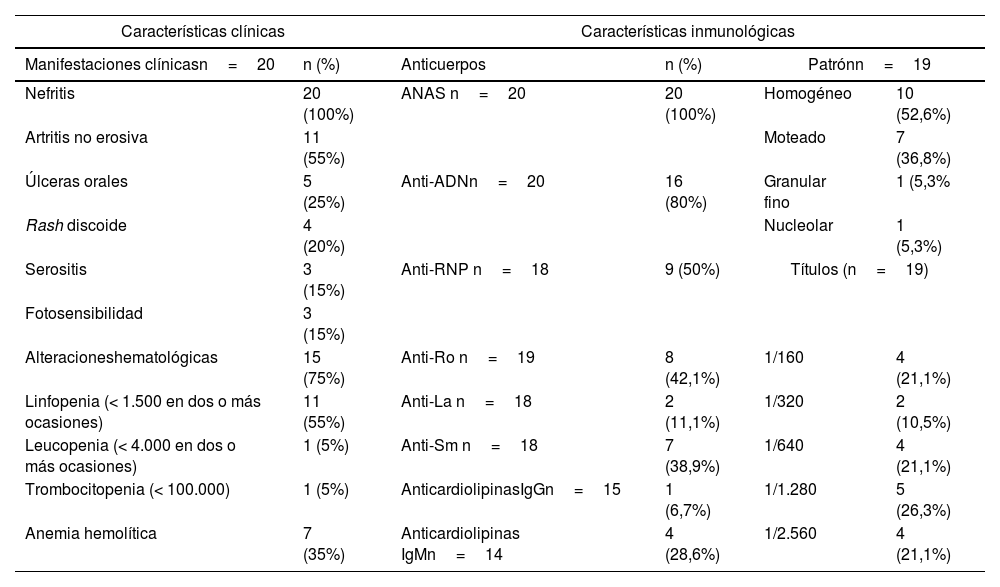
ResultadosCaracterísticas de la poblaciónEn total se incluyeron 20 pacientes con diagnóstico de LES, 18 (90%) mujeres y dos (10%) hombres, cuyas edades oscilaron entre 18 y 68 años, con una media de 37. La etnia fue evaluada por autodenominación, y el 100% del grupo se clasificó como mestizo. La frecuencia de las características clínicas e inmunológicas de los sujetos se resumen en la tabla 1, mientras que los esquemas de tratamiento se muestran en la tabla 2. La manifestación clínica más frecuente fue la artritis no erosiva, en 11 individuos (55%). Un total de 15 (75%) pacientes presentaban alguna alteración hematológica, las más comunes fueron la linfopenia (55%) y la anemia hemolítica (35%). Adicionalmente, se incluyeron ocho donantes sanos, con una media de 29 años (rango 19-59), todas mujeres.
Características clínicas e inmunológicas
| Características clínicas | Características inmunológicas | ||||
|---|---|---|---|---|---|
| Manifestaciones clínicasn=20 | n (%) | Anticuerpos | n (%) | Patrónn=19 | |
| Nefritis | 20 (100%) | ANAS n=20 | 20 (100%) | Homogéneo | 10 (52,6%) |
| Artritis no erosiva | 11 (55%) | Moteado | 7 (36,8%) | ||
| Úlceras orales | 5 (25%) | Anti-ADNn=20 | 16 (80%) | Granular fino | 1 (5,3% |
| Rash discoide | 4 (20%) | Nucleolar | 1 (5,3%) | ||
| Serositis | 3 (15%) | Anti-RNP n=18 | 9 (50%) | Títulos (n=19) | |
| Fotosensibilidad | 3 (15%) | ||||
| Alteracioneshematológicas | 15 (75%) | Anti-Ro n=19 | 8 (42,1%) | 1/160 | 4 (21,1%) |
| Linfopenia (< 1.500 en dos o más ocasiones) | 11 (55%) | Anti-La n=18 | 2 (11,1%) | 1/320 | 2 (10,5%) |
| Leucopenia (< 4.000 en dos o más ocasiones) | 1 (5%) | Anti-Sm n=18 | 7 (38,9%) | 1/640 | 4 (21,1%) |
| Trombocitopenia (< 100.000) | 1 (5%) | AnticardiolipinasIgGn=15 | 1 (6,7%) | 1/1.280 | 5 (26,3%) |
| Anemia hemolítica | 7 (35%) | Anticardiolipinas IgMn=14 | 4 (28,6%) | 1/2.560 | 4 (21,1%) |
ANAS: anticuerpos antinucleares; IgG: inmunoglobulina G; IgM: inmunoglobulina M.
Esquemas de medicamentos
| Medicamentos n (%)* | |
|---|---|
| Micofenolato | 2 (10) |
| Ciclofosfamida | 18 (90) |
| Cloroquina | 9 (45) |
| Hidroxicloroquina | 8 (40) |
| Prednisolona | 19 (95) |
En cuanto a las características inmunológicas, en el 100% de los pacientes se detectaron anticuerpos antinucleares (ANAS), siendo el patrón homogéneo el más frecuente, al presentarse en 10 (52,9%) de los 19 sujetos.
En tres pacientes se encontró poliautoinmunidad: dos con hipotiroidismo y una con dermatomiositis. Adicionalmente, cuatro presentaron anticuerpos antifosfolípidos, pero sin cumplir criterios para el diagnóstico de síndrome.
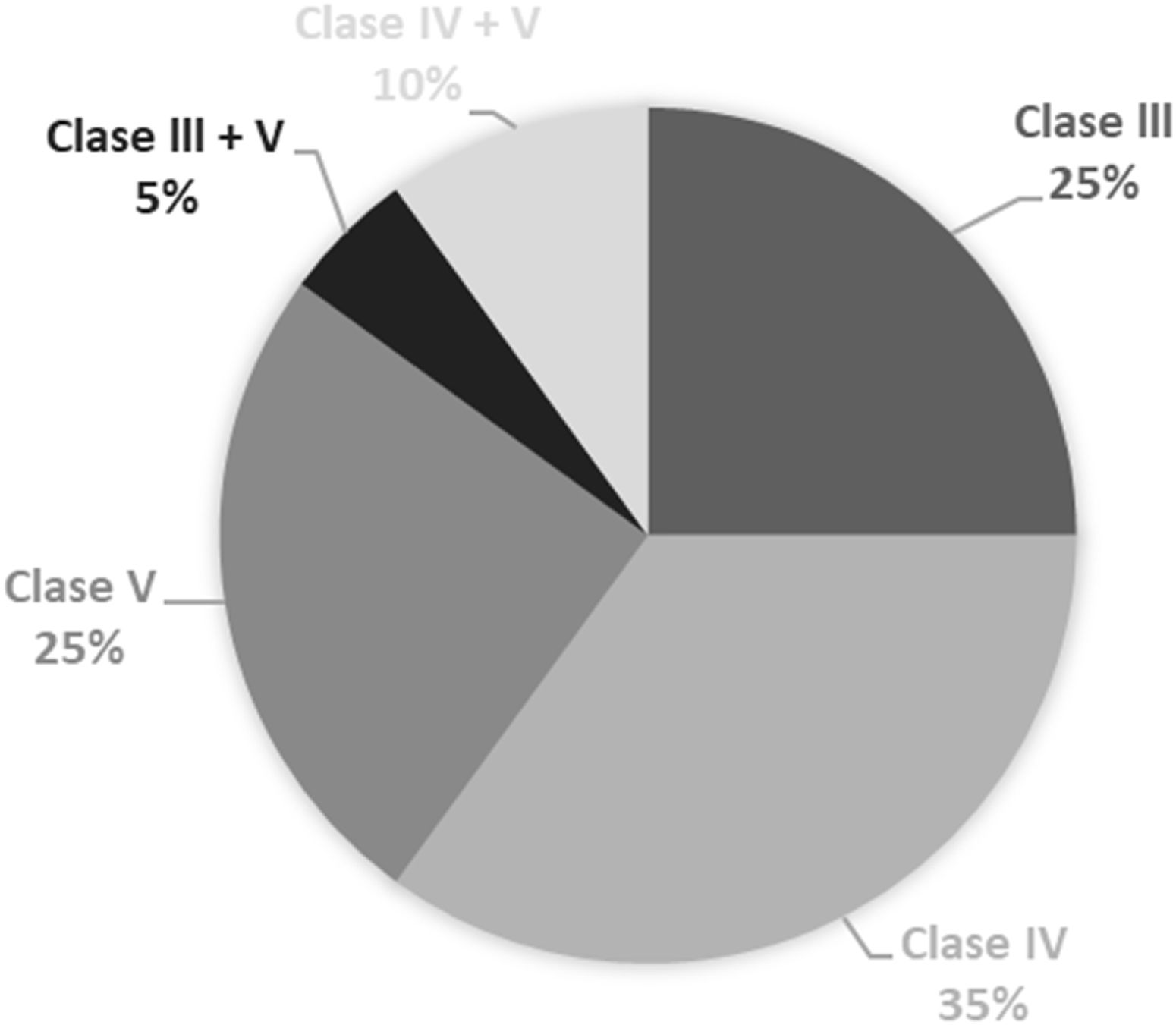
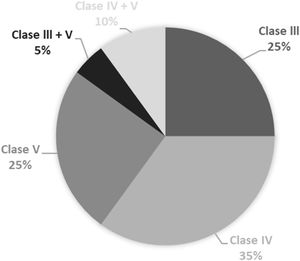
Al recopilar los datos del compromiso renal, se obtuvo que la NL más frecuente fue la clase IV (35%), que se presentó en siete pacientes; las frecuencias de los tipos de NL se resumen en la figura 1.
Con respecto a los esquemas de tratamiento, 18 pacientes estaban en terapia de inducción con CFM y dos con MMF. De estos, nueve se hallaban al inicio de la terapia, es decir, en T0, y 11 en T1. En total se realizaron 23 determinaciones (tres sujetos tuvieron mediciones en dos tiempos).
Recibían dosis de prednisolona el 95% (19) de los pacientes y el 85% algún antimalárico (AMA), cloroquina (CQ) (45%) o hidroxicloroquina (HCQ) (40%); el 15% restante no recibía ninguno.
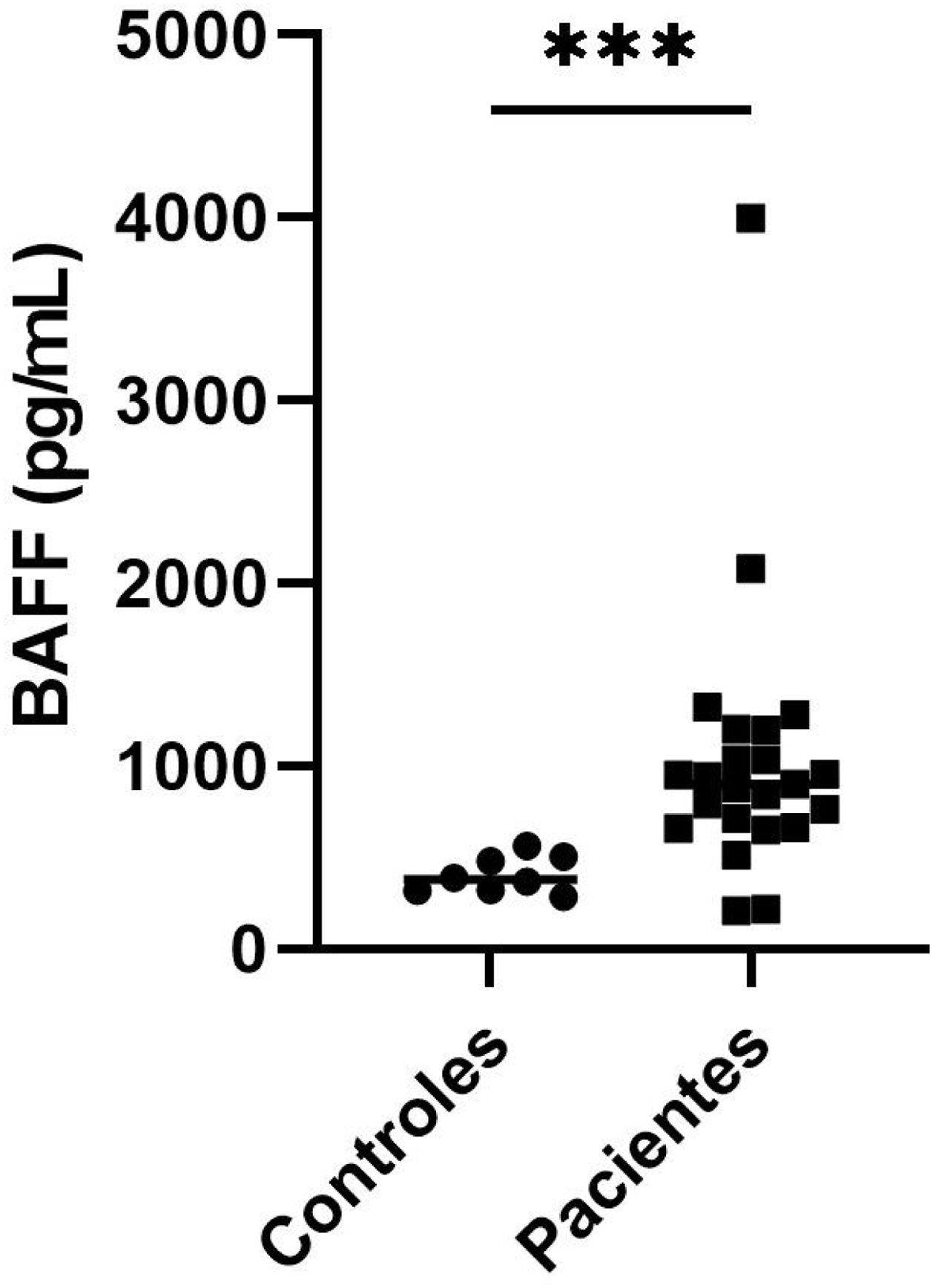
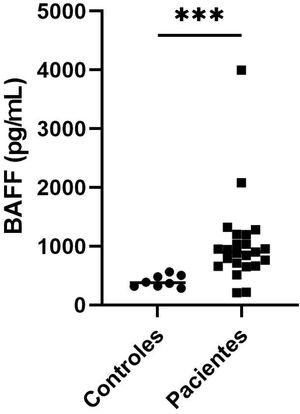
Niveles séricos de factor activador de células BLa determinación del nivel sérico de BAFF en las 23 muestras tuvo una mediana de 902,2 pg/mL, (rango 209,7-3.998), frente a la de controles sanos 379,7 pg/mL, (rango 284,1-565,6), con una diferencia estadísticamente significativa (p=0,0003). En el grupo de los pacientes, uno obtuvo un valor muy elevado de 3.997,6 pg/mL; los resultados se muestran en la figura 2. Las dos pacientes que presentaron los niveles más altos de BAFF tenían títulos elevados de ANAS (1:2.560), además, una de ellas exhibía poliautoinmunidad con concomitancia de dermatomiositis, mientras que la otra refería antecedentes familiares de autoinmunidad.
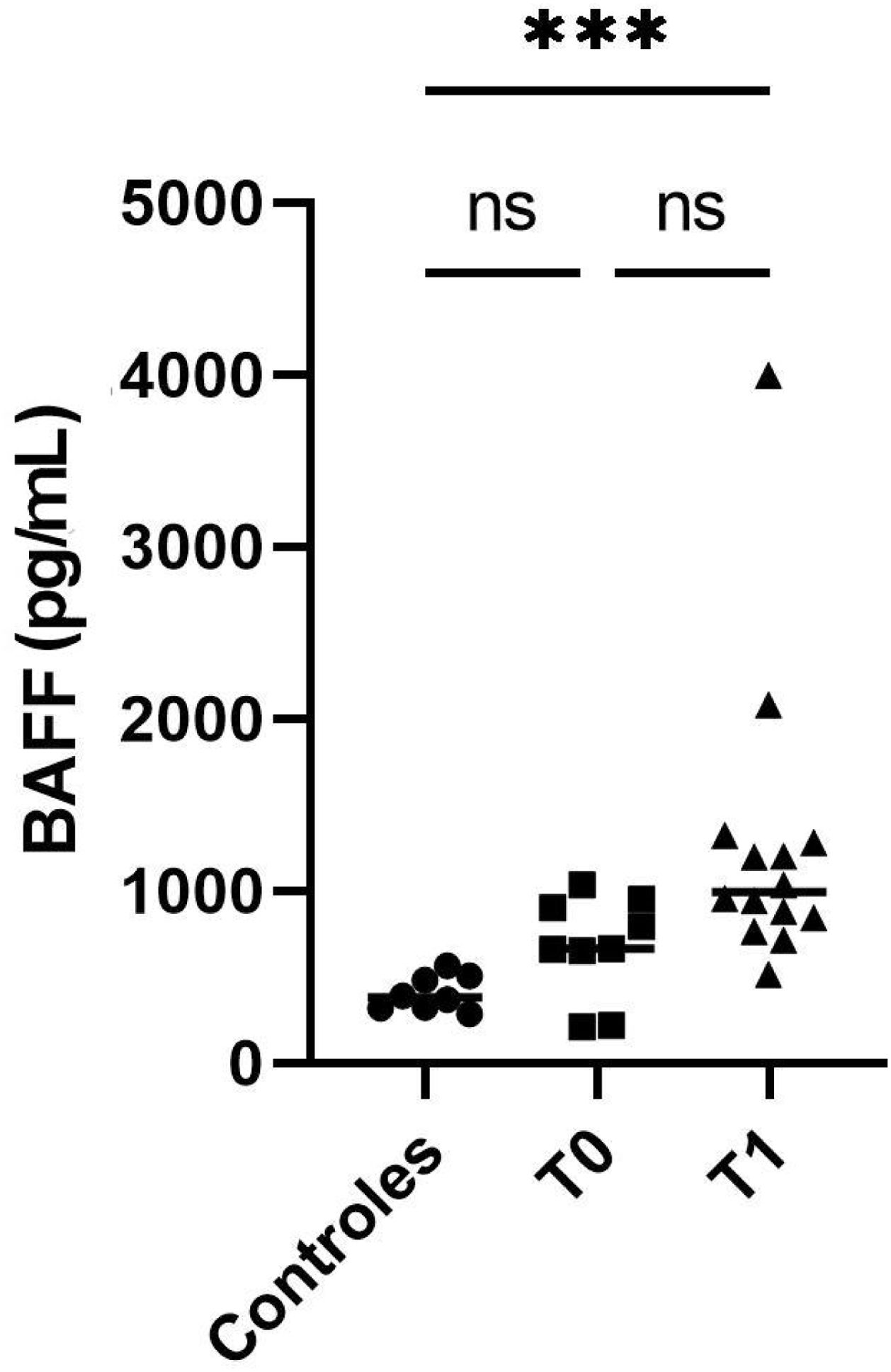
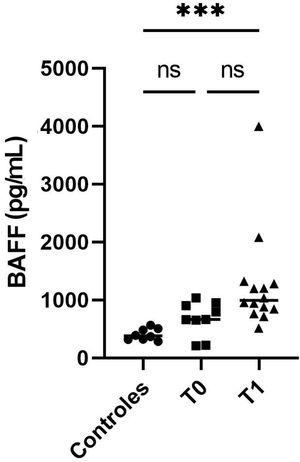
Posteriormente, se evaluó el BAFF en los dos tiempos de la terapia de inducción con MMF o CFM que se definieron (T0, T1), y se obtuvo una mediana de 665,4 pg/mL (rango 209,7-1.035,3) para el T0 y de 995,5 pg/mL (rango 513,8-3.997,7) para el T1; los datos se muestran en la figura 3. Se observaron diferencias estadísticamente significativas únicamente entre controles y el T1 (p=0,0002).
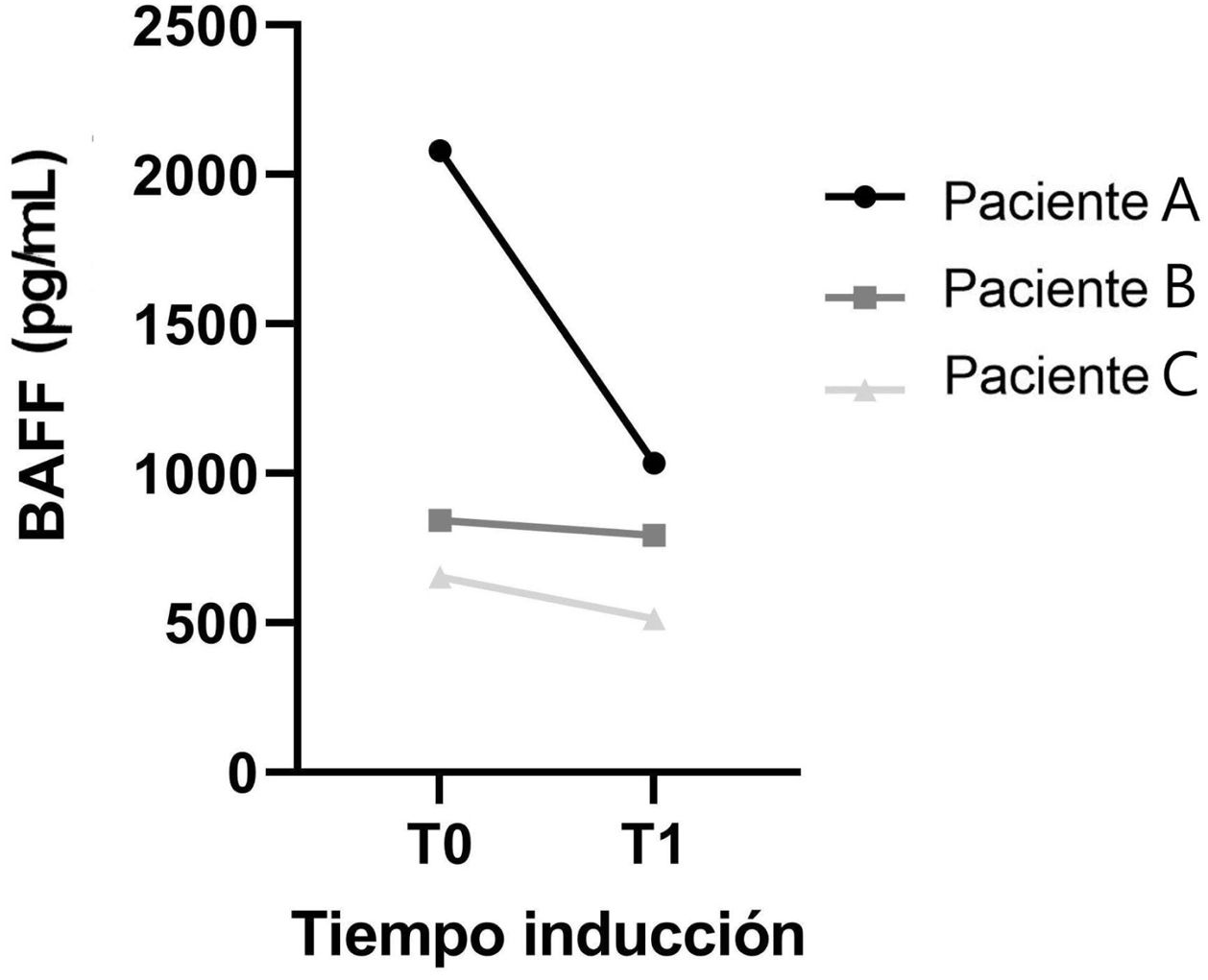
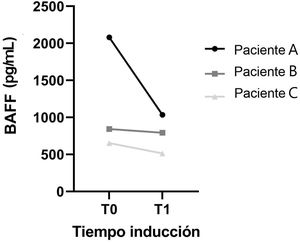
Por otro lado, en tres pacientes se obtuvo una muestra pareada entre T0 y T1, cuyos resultados se plasman en la figura 4. En esta, contrariamente a la tendencia observada en el grupo general, los sujetos evidencian un descenso en los niveles séricos de BAFF entre la primera y la segunda muestra, siendo más notable en el seguimiento del paciente A, con una disminución de 50,22%, seguido por el B (21,24%) y el C (6,08%).
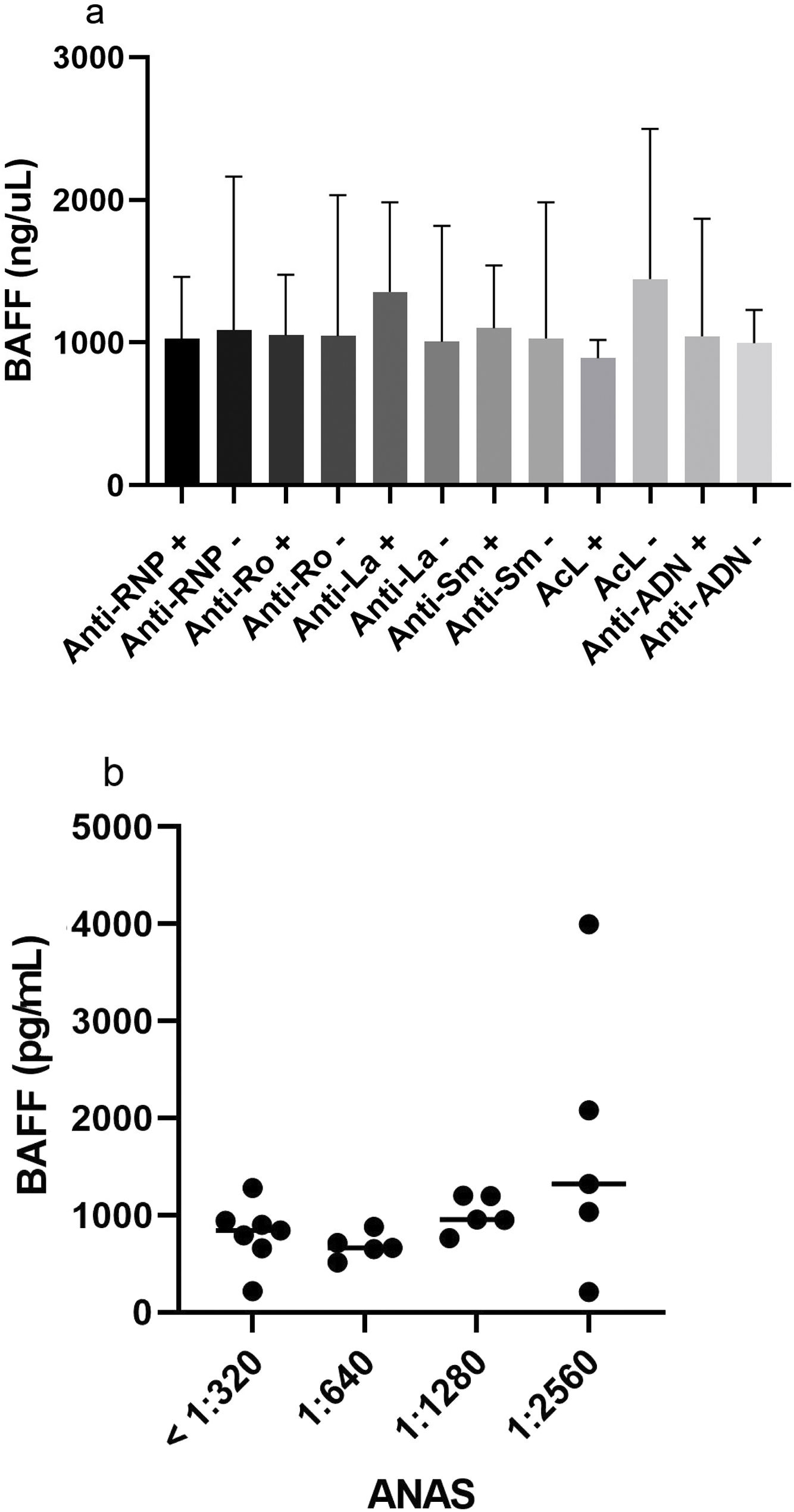
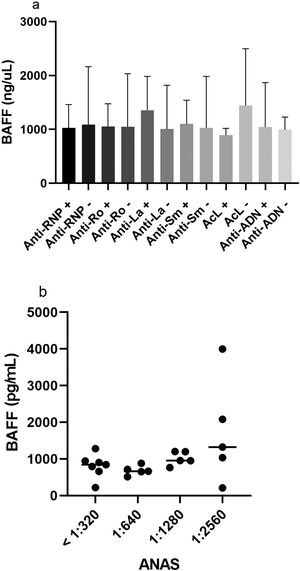
Asociación de los niveles de factor activador de células B con las características inmunológicas de los pacientesSe evaluó la posible asociación entre los niveles séricos de BAFF y cada uno de los anticuerpos caracterizados; los resultados se muestran en la figura 5a. La mediana de los pacientes que presentaron anticuerpos anti-ADN positivos fue de 879,3 pg/mL (rango 209,7-3.788) y la de los negativos fue de 995,5 pg/mL (rango 715,6-1.280).
Con respecto a los demás anticuerpos específicos, se obtuvo una mediana de 955,7 pg/mL (rango 513,8-2.079) en los pacientes con anti-RNP positivos y de 872,7 pg/mL (rango 209,7-3.998) en el caso de los negativos. Tan solo dos sujetos eran positivos para los anticuerpos anti-La; el grupo de los negativos presentó una mediana de BAFF de 872,7 pg/mL (rango 209,7-3.998). Los pacientes anti-Ro, positivos y negativos, tuvieron una mediana de 916,4 pg/mL (rango 661,1-2.079) y 923,5 pg/mL (rango 209,7-3.998), respectivamente. La mediana de los individuos positivos para anticuerpos anti-Sm fue de 995,5 pg/mL (rango 665,4-2.079), mientras que los negativos tenían una de 843,3 pg/mL (rango 209,7–3.998). Por último, para el anticoagulante lúpico se halló una mediana de BAFF de 843,3 pg/mL (rango 792-1.035) en aquellos pacientes positivos para el anticuerpo; en el caso de los negativos la mediana fue de 1.201 pg/mL (rango 715,6 -3.998). No se encontró ninguna asociación estadísticamente significativa entre los niveles de BAFF y la positividad o negatividad de cada uno de los tipos de ANAS.
En los títulos de ANAS se halló una media de 806,2 pg/mL (rango 220,4-1.280) en los niveles de BAFF en el caso de aquellos pacientes que presentaban títulos menores o iguales a 1:320. Las medias para los títulos 1:640 y 1:1.280 fueron de 685,3 pg/mL (rango 513,8-879,3) y 1.015 pg/mL (rango 763,6-1.203), respectivamente. A pesar de que la media más alta se evidenció en títulos de 1:2.560 (1.729 pg/mL, rango 209,7-3.998), no se encontraron diferencias estadísticamente significativas entre cada una de los títulos de anticuerpos y los niveles séricos de BAFF, como se muestra en la figura 5b.
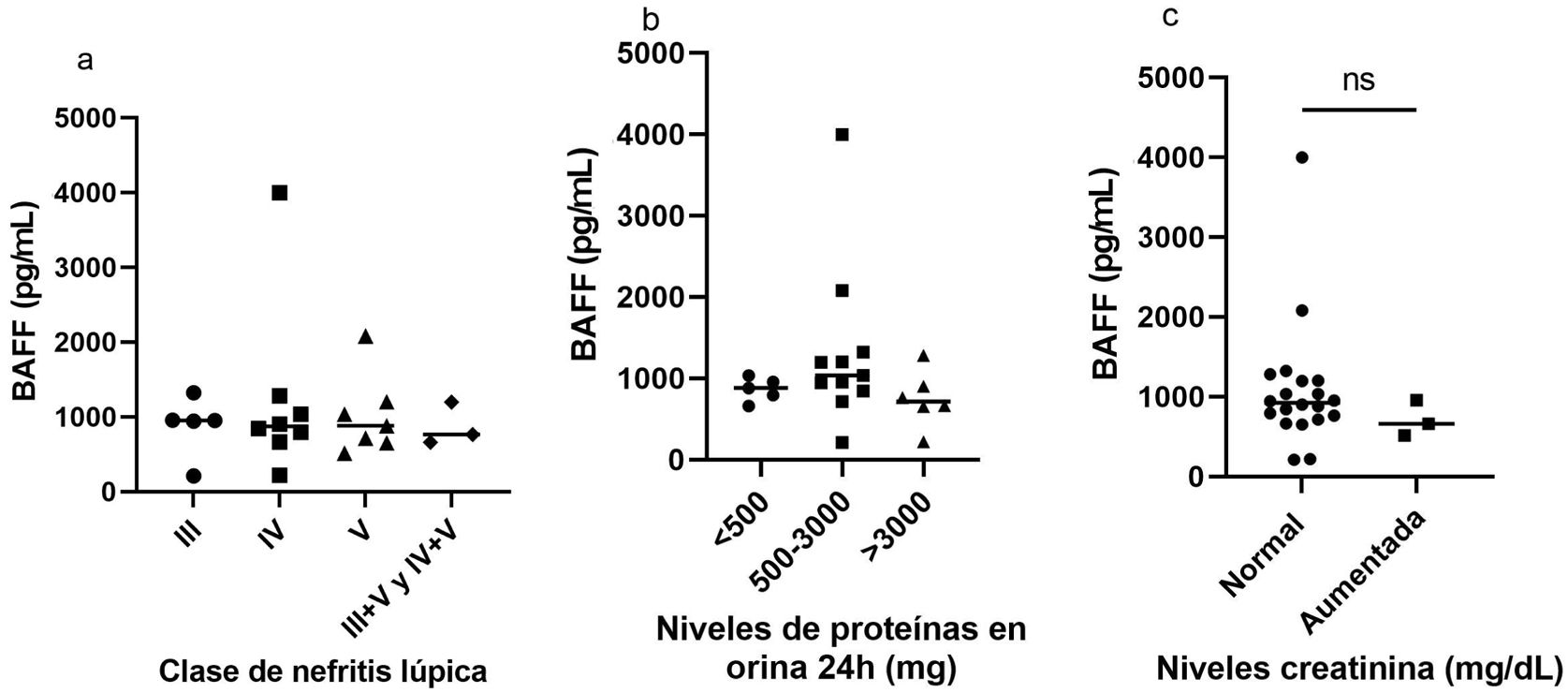
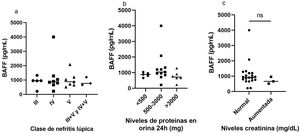
Asociación de los niveles de factor activador de células B y las características del compromiso renalSe evaluaron posibles asociaciones entre los niveles séricos de BAFF y las características del compromiso renal (fig. 6). Con relación a la nefritis, se halló para la clase IV, que fue la más frecuente, una mediana de BAFF de 872,7 pg/mL (220,4 pg/mL-3.998 pg/mL). La mediana para la NL clase V fue de 879,3 pg/mL (rango 513,8-2.079), para la clase III fue 953,5 (rango 209,7-1.113) y finalmente para las clases III+V y IV+V fue de 763,6 (rango 661,1-1.198). No se encontró diferencia significativa en los niveles de BAFF según el tipo de nefritis (fig. 6a).
Con respecto a las proteínas en orina de 24horas, la mediana más alta en los niveles de BAFF (1.035 pg/mL, rango 209,7-220,4) se obtuvo en aquellos pacientes con proteinuria entre 500 y 3.000mg/24h, seguida por la mediana de aquellos con valores menores a 500mg/24h que fue de 879 pg/mL (rango 661,1-1.035). Para cifras de proteínas mayores a 3.000mg/24h, la mediana fue de 714,5 pg/mL (rango 220,4-1.280). Se muestra en la figura 6b que no se encontraron diferencias estadísticamente significativas entre los distintos grados de la proteinuria y los niveles de BAFF.
En cuanto a la creatinina sérica, se consideraron como valores normales aquellos entre 0,7 y 1,3mg/dL para hombres y entre 0,6 y 1,1mg/dL para las mujeres. La mayoría de los pacientes presentaron cifras normales para este paraclínico. La mediana en los niveles de BAFF para el grupo de personas con creatininas normales fue de 923,5 pg/mL (rango 209,7–3.998), para aquellos con niveles aumentados fue de 661,1 pg/mL (rango 513,8- 955,7). Estos datos se muestran en la figura 6c. No hubo diferencia estadísticamente significativa entre los dos grupos.
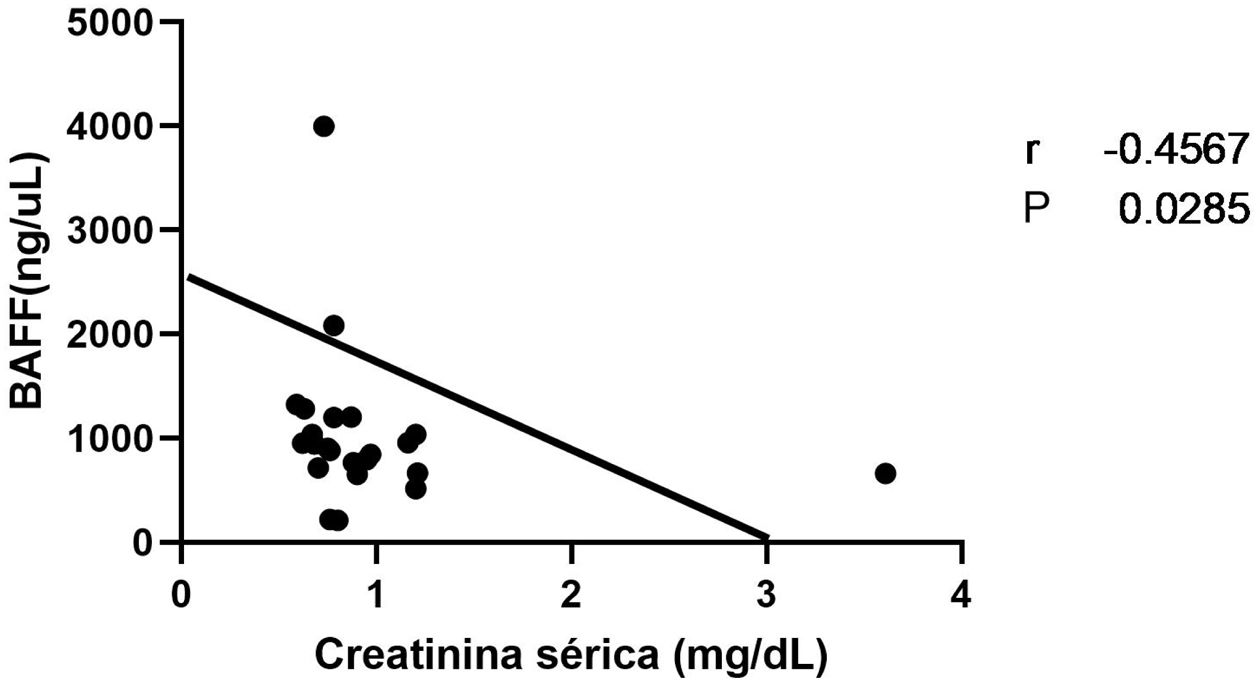
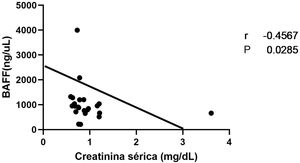
Establecimos correlaciones entre los niveles de proteínas en orina de 24horas y creatinina con las concentraciones de BAFF. Solo para los valores de creatinina sérica, como se muestra en la figura 7, se obtuvo un r -0,456 (p=0,0285), lo cual indica una correlación negativa entre estos parámetros.
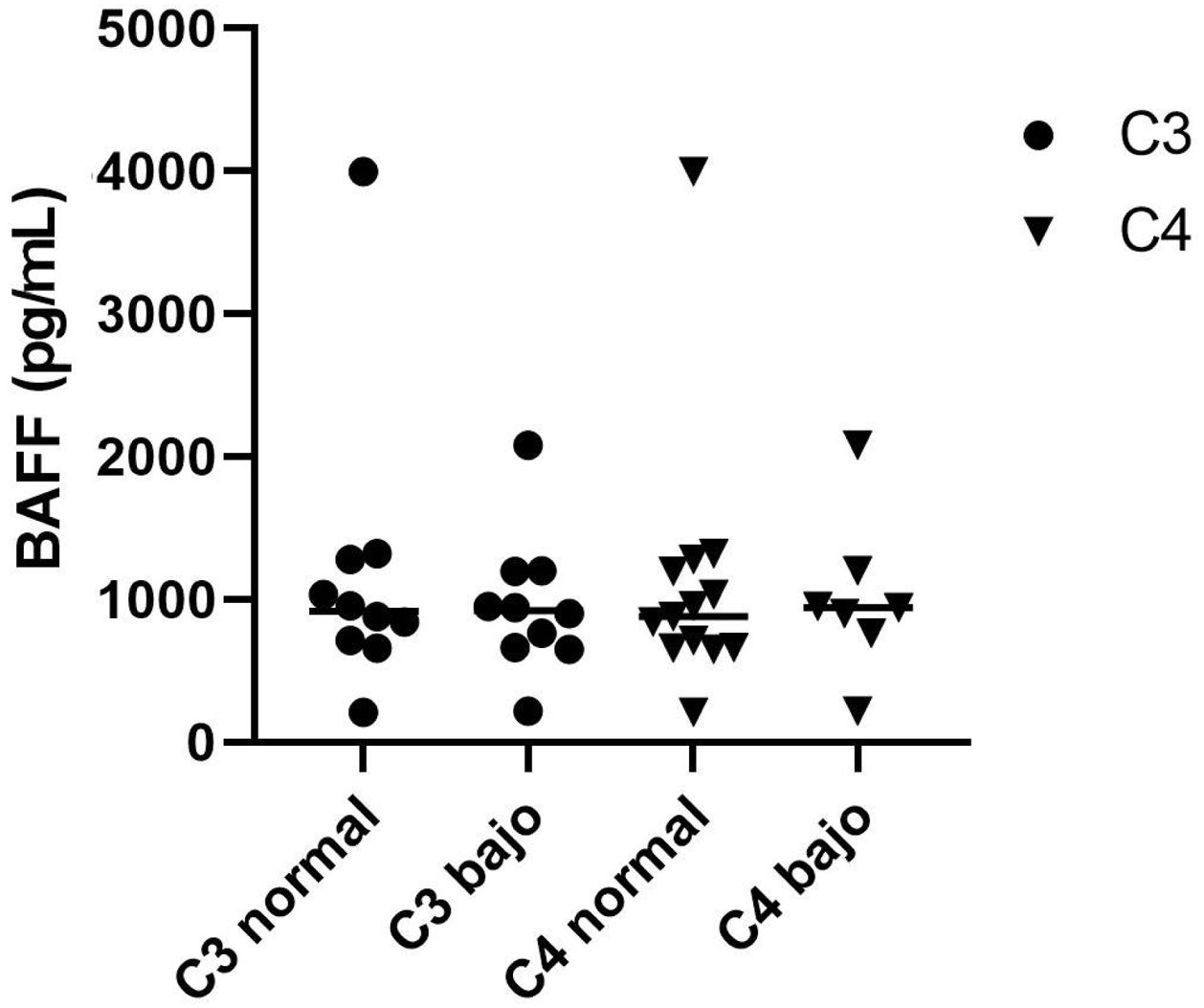
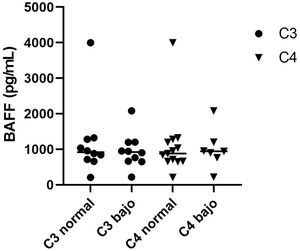
Asociación de los niveles séricos de factor activador de células B y el complementoLos pacientes se clasificaron en grupos de acuerdo con los resultados en los niveles del complemento como bajos (< 88mg/dL para C3 y <15mg/dL para C4) o normales (88-200mg/dL para C3 y 15-45mg/dL para C4). Los sujetos se clasificaron en grupos, según los resultados bajos o normales en los niveles del complemento. En aquellos con concentraciones normales de C3, la mediana de BAFF fue de 917,5 pg/mL (rango 209,7 -3.998) con poca diferencia de lo observado en los pacientes con C3 bajo con niveles de 902,2 pg/mL (rango 220,4 -2.079). Por otro lado, la mediana de BAFF en aquellos con niveles de C4 normal fue de 879,3 pg/mL (rango 209,7-3.998) y de 944,7 pg/mL (rango 220,4-2.079) para personas con niveles de C4 disminuidos. No se encontró ninguna diferencia estadísticamente significativa entre las concentraciones de citocina y el consumo de complemento, ni hallamos ningún tipo de correlación entre los datos. La posible asociación entre los niveles de BAFF y los de las fracciones del complemento C3 y C4, se encuentra en la figura 8.
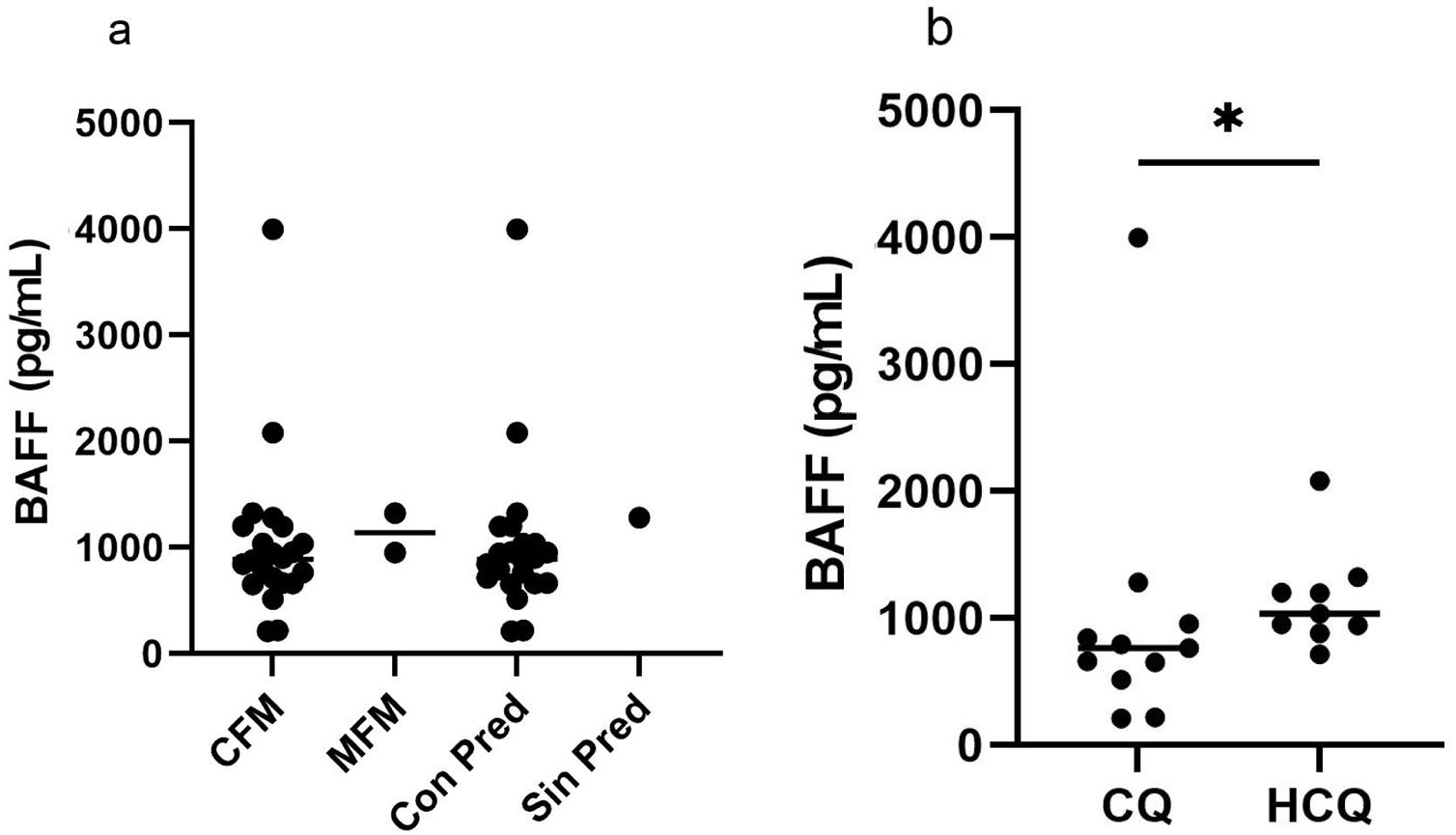
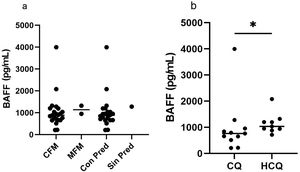
Asociación de los niveles de factor activador de células B y los esquemas de tratamientoSe exploraron los niveles séricos de BAFF con los diferentes esquemas de tratamiento inmunosupresor. Los datos de la figura 9a muestran que el grupo de pacientes con CFM tuvo una mediana de 879,3 pg/mL, (rango 209,7-3.998). Los dos tratados con MMF tenían niveles de BAFF de 953,475 y 1.322,270 pg/mL, respectivamente. Al contrastar los resultados de las cifras de BAFF entre ambas terapias no se halló diferencia estadísticamente significativa.
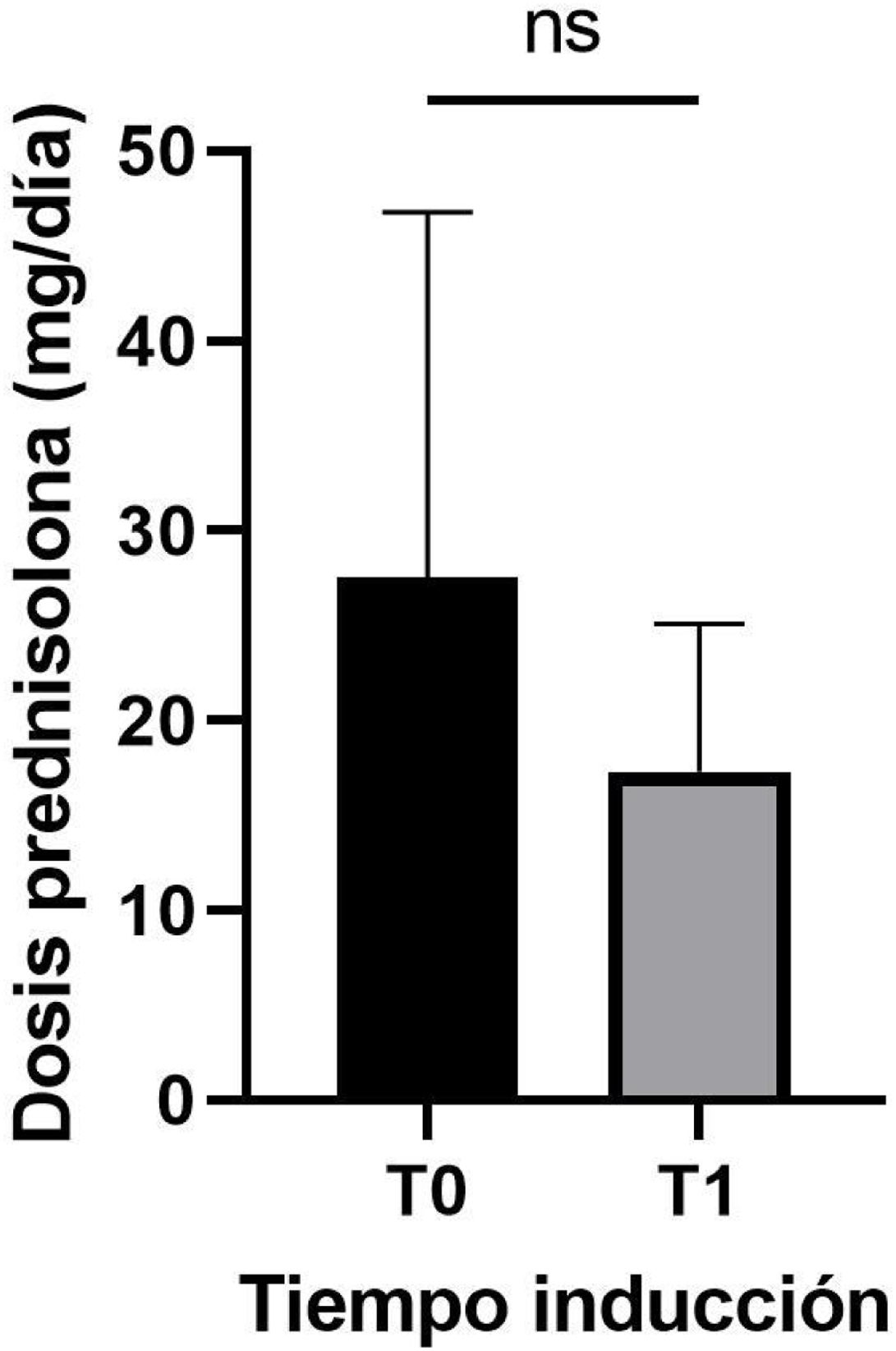
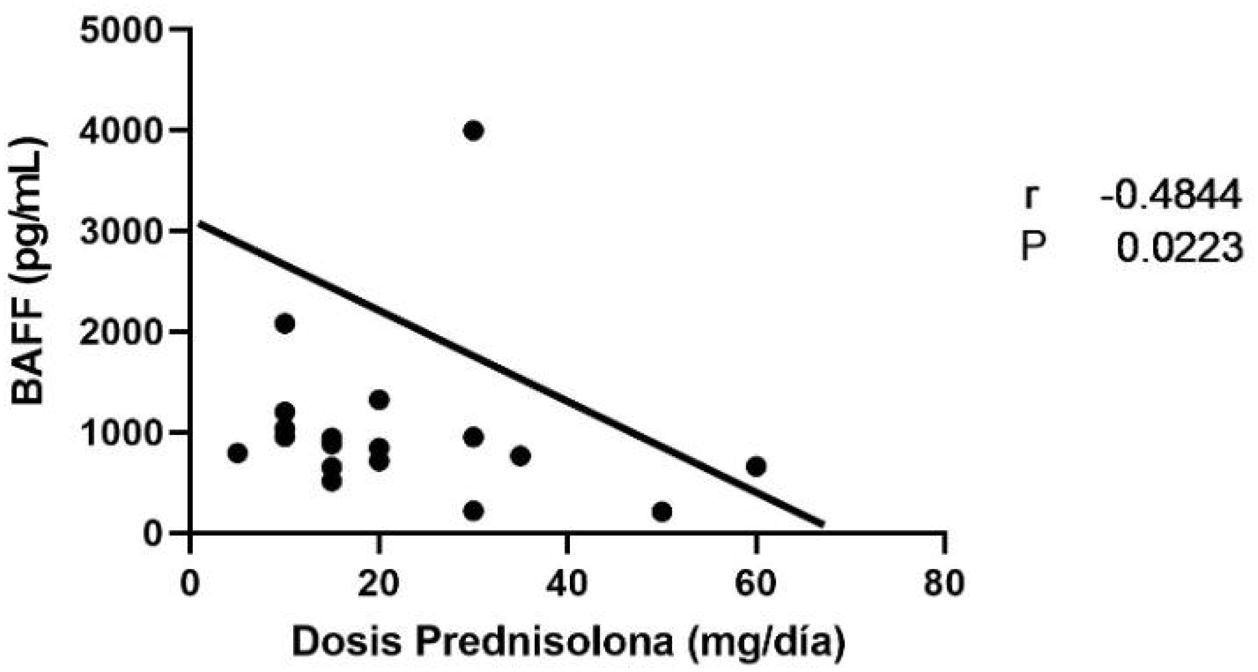
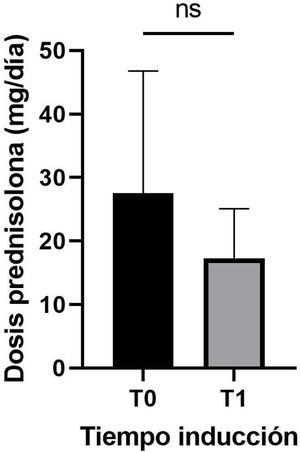
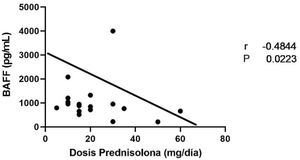
Los datos de las 22 muestras de pacientes que se encontraban recibiendo dosis de prednisolona se muestran en la figura 9a, los niveles de BAFF para este grupo presentaron una mediana de 890,7 pg/mL (rango 209,7–3.998). Al comparar las dosis de prednisolona entre los dos tiempos evaluados (T0, T1), se obtuvo para el T0 una mediana de 25mg/día (rango 5-60) y para el T1, una de 15mg/día (rango 10-35), lo cual se muestra en la figura 10. Adicionalmente, en la figura 11 se encuentra la correlación entre las dosis de prednisolona y los niveles de BAFF, con un r=-0,4844, que indica una correlación negativa entre estas (p=0,0223).
Finalmente, al buscar la asociación entre los niveles de BAFF obtenidos y el tratamiento con CQ y HCQ, se observó una mediana de 763,6 pg/mL (rango 209,7-3.998) en los pacientes tratados con CQ, con respecto a una de 1.035 pg/mL (rango 715,6-2.079) para los sujetos que recibieron HCQ. Se obtuvo una diferencia estadísticamente significativa (p=0,0465); los datos se muestran en la figura 9b.
DiscusiónSe han descrito previamente niveles séricos de BAFF elevados relacionados con el desarrollo de enfermedades autoinmunes como el síndrome de Sjögren primario y la artritis reumatoide30–33, en las cuales la citocina contribuye a la patogénesis de la entidad. De manera similar, varios estudios establecen específicamente la asociación entre las concentraciones altas de BAFF y la actividad del LES34–36, lo que coincide con lo observado en nuestro estudio, en el que hallamos un vínculo entre los niveles de los pacientes estudiados y el diagnóstico de LES, ya que dichos valores fueron significativamente mayores en estos casos, comparados con los controles sanos.
Al evaluar los niveles de la citocina y los esquemas de inmunosupresión no hallamos diferencia entre los pacientes tratados con MMF y los manejados con CFM, sin embargo, es importante tener en cuenta las limitaciones de la muestra, ya que solo dos sujetos se encontraban bajo esquema de tratamiento con MMF. En el 2015, Fassbinder et al. analizaron el efecto del MMF y la CFM sobre algunas características celulares y serológicas de pacientes con LES y hallaron que los recuentos de plasmablastos y células plasmáticas eran significativamente más bajos en los tratados con MMF en comparación con quienes recibían CFM, pero estos últimos tenían recuentos de linfocitos B totales y vírgenes más bajos; sin embargo, en este estudio no se midieron los niveles séricos de BAFF37. Vincent et al., por su parte, hallaron que el BAFF sérico era mucho menor en personas que recibían HCQ, mientras que era significativamente mayor en aquellas que recibían inmunosupresores, incluyendo CFM y MMF, pero no se discriminaron los efectos de cada fármaco por separado38. De manera similar, Hernández et al. encontraron niveles de BAFF más altos en individuos tratados con MMF que en aquellos que no recibían ningún tipo de tratamiento inmunosupresor, no obstante, en este estudio se excluyeron los sujetos con NL grave39.
En nuestro estudio, se logró evidenciar que se obtuvieron niveles séricos de BAFF más altos durante el esquema de inducción en comparación con los controles, sin discriminar la terapia inmunosupresora. Durante el T0, la concentración de BAFF fue considerablemente más alta que en los controles, pero la diferencia más significativa se aprecia con el T1, al concentrarse allí las determinaciones de mayor valor. De manera similar a nuestros resultados, en un estudio realizado en el 2010 se midieron los niveles séricos de BAFF en ratones, y se halló que estos se elevaban significativamente luego de la administración de CFM40. Del mismo modo, Phatak et al. encontraron un aumento significativo luego de los seis meses de la terapia de inducción con CFM en pacientes con NL41. Parodis et al., por su parte, establecieron que en sujetos con NL membranosa hubo un incremento en los niveles séricos de la citocina al emplear CFM, mientras que en aquellos tratados con MMF no se observaron cambios. En el caso de pacientes con nefritis proliferativa, no se objetivó ningún cambio significativo luego del tratamiento42.
En este estudio solo se analizaron los niveles séricos de BAFF, sin embargo, se desconoce el estado de depleción de las células B, aun así, los resultados concuerdan con los hallazgos previos en la literatura, en los cuales hay un aumento de la citocina BAFF luego de un tratamiento que induzca depleción de linfocitos B, como es el caso de la CFM, que fue el esquema en el que se encontraban la mayoría de los pacientes, y que además se administró de forma intravenosa, lo que conlleva una depleción sostenida de células acompañada de una producción reactiva de la citocina42.
Aunque el grupo general de pacientes con LES demuestra un claro aumento en los niveles séricos de BAFF, en los tres seguimientos pareados realizados se resalta una tendencia a la disminución de estos a lo largo del tiempo, por lo cual, teniendo en cuenta la heterogeneidad en el comportamiento de los niveles de BAFF, tal como lo describen Mercado et al. en su estudio, donde en el seguimiento de 32 sujetos se demuestra tal variedad, se señala la relevancia de llevar a cabo un estudio con seguimientos pareados23.
Los medicamentos AMA como la CQ y la HCQ son empleados para el tratamiento de enfermedades inflamatorias crónicas. En el LES, su uso se remonta a los años cincuenta, ya que contribuyen a la reducción de los síntomas de la entidad y tienen pocos efectos secundarios. Evidencias previas han encontrado que, en otros padecimientos, como síndrome de Sjögren primario y artritis reumatoide, los niveles de BAFF disminuyeron significativamente luego de iniciar la terapia con HCQ43. En un estudio del 2019, realizado específicamente en pacientes con LES, se reveló que aquellos que recibían AMA tenían un nivel de BAFF más bajo que aquellos que no estaban bajo este tipo de régimen, sin embargo, no se definió el efecto de cada uno de los AMA por separado39. Lambers et al. observaron que los niveles de BAFF en el LES fueron significativamente más bajos después del tratamiento con HCQ44. Con respecto a la CQ, su uso es restringido debido a que produce más reacciones adversas en comparación con la HCQ, por lo cual la evidencia disponible es limitada45. En un trabajo enfocado en evaluar el efecto directo de la CQ sobre las células B, Ma et al. objetivaron que esta suprimió potentemente la proliferación de los linfocitos B, sin embargo, no se evaluó el efecto sobre los niveles de BAFF46. Uno de los hallazgos más llamativos de nuestro estudio fueron las concentraciones de la citocina en pacientes que recibían CQ, las cuales fueron significativamente más bajas que en aquellos en terapia con HCQ; esto sugiere la necesidad de llevar a cabo más investigaciones que comparen el efecto de los dos AMA que podrían aportar nuevas evidencias útiles para definir mejores esquemas terapéuticos.
Como lo describen Yu et al. en su revisión, teniendo en cuenta la diversidad de los factores que intervienen en la patogenia de la NL, se destacan los procesos proinflamatorios y el daño tisular al riñón, por lo que la elección terapéutica suele ser corticosteroides combinados con inmunosupresores, con el objetivo de preservar la función renal22. En cuanto al efecto de la terapia con esteroides en los niveles de BAFF, específicamente con prednisolona, Hernández et al. destacan que no se encontró que la dosis diaria de este fármaco (en promedio 10,8±8,7mg/día) afectara los niveles séricos de BAFF, resaltan que la medición se realizó en un solo momento y dejan claro que los pacientes recibían el tratamiento estándar para LES al momento de tomar la muestra39. En cuanto a lo descrito por Carter et al., el seguimiento se efectuó durante 18 meses, asociando niveles altos de BAFF con recaídas en diversas manifestaciones clínicas, entre ellas la nefritis, pero declaran que no hay asociación con la reducción de las dosis de corticosteroides y BAFF. Cabe aclarar la variedad de las características de los pacientes incluidos en este estudio47.
Debido a la disparidad de los datos encontrados, de acuerdo con lo hallado en nuestro estudio, se sugiere que la prednisolona podría estar afectando los niveles séricos de BAFF, ya que a dosis altas (mediana 30mg/día) se encuentran valores bajos, en comparación con T1, donde las dosis de corticosteroides son menores, lo cual hace que se establezca una correlación inversamente proporcional.
Con respecto a los niveles de BAFF y otras características de los pacientes, evidencias previas han evaluado la asociación entre los primeros y la presencia de autoanticuerpos. Por primera vez en el 2001, Cheema et al. encontraron una correlación significativa entre la presencia sérica de anti-ADN y altas concentraciones de la citocina en sujetos norteamericanos48. En años posteriores, los siguientes investigadores obtuvieron resultados similares: Mercado et al. establecieron una moderada correlación con los títulos de anti-ADN23 en pacientes mexicanos, en tanto que Ju et al. hallaron que la población china con títulos elevados de anti-ADN tenía una mayor expresión en los niveles del ácido ribonucleico mensajero (ARNm) de BAFF49. McCarthy et al. encontraron además una correlación positiva de los niveles séricos de BAFF con los anticuerpos anti-Sm y los anticuerpos antifosfolípidos en sujetos irlandeses50. Por el contrario, Elbirt et al. no vislumbraron correlación con los títulos de anti-ADN51. Del mismo modo, en el 2022 Sari et al. no hallaron un vínculo entre los valores de BAFF y la positividad para anti-ADN o anti-Sm52. En nuestro estudio tampoco encontramos asociación significativa entre la presencia de autoanticuerpos y los niveles de la citocina, sin embargo, estas diferencias entre estudios pueden deberse a los variados métodos empleados para detectar tanto los anticuerpos anti-ADN como las concentraciones de BAFF y la diversidad del origen de las poblaciones30,51.
Con respecto al compromiso renal, en nuestro estudio no hubo asociación significativa entre los niveles de BAFF y los diferentes tipos de nefritis. Similar a nuestros resultados, en el 2012, Eilertsen et al. no observaron relación entre los hallazgos de la biopsia renal y los valores séricos de BAFF, ni su expresión génica53. Evidencias de años posteriores confirman que no hay correlación de las concentraciones de la citocina con la histopatología renal, ni los índices de actividad o cronicidad41. En cuanto a la proteinuria, tampoco encontramos correlación con los niveles de BAFF, lo que coincide con los resultados de algunos trabajos realizados en años previos52. Varios autores no establecieron una correlación entre BAFF y creatinina, mientras que en nuestro estudio encontramos una correlación negativa entre los valores de creatinina y los niveles séricos de BAFF. Se desconoce el mecanismo por el cual esto podría estar sucediendo, ya que no ha sido descrito previamente en la literatura.
Similar a lo encontrado por Eilertsen, no hallamos ninguna asociación significativa entre BAFF y los niveles de las fracciones del complemento C3 y C453. Por el contrario, Treamtrakanpon et al. encontraron una correlación significativa entre el complemento sérico y las concentraciones de BAFF54. Asimismo, Zollars et al. observaron una correlación positiva entre la expresión elevada del gen BAFF con hipocomplementemia de C3 y C455.
LimitacionesPrincipalmente se derivan del reducido tamaño de muestra, sobre todo de pacientes en terapia con MMF (n=2), por lo que se resalta la necesidad de realizar investigaciones adicionales para evaluar el efecto de este inmunosupresor, y así establecer comparaciones más precisas. Debido a lo anterior, fue necesario limitar el análisis a dos tiempos de estudio, donde T1 abarca un rango muy amplio (dos a seis meses), lo que restringe un análisis más profundo y detallado del comportamiento de los niveles séricos de BAFF durante y al finalizar la terapia de inducción. Del mismo modo, al solo tener tres pacientes con seguimientos pareados, no es posible conocer con certeza la tendencia de BAFF a lo largo del tiempo, lo que reduce la posibilidad de análisis de forma horizontal.
ConclusionesLos niveles séricos de BAFF se ven afectados durante la terapia de inducción, se observa una disminución inicial y la recuperación posterior en el T1, cambio que parece estar más influido por las dosis de esteroides que fueron mayores en el T0 y se reducen en el T1, y no por la dosis de CFM que se mantiene estable durante la terapia de inducción. Para el caso del MMF, nuestros resultados son poco concluyentes debido al pequeño tamaño de la muestra, por lo que se resalta la necesidad de hacer estudios más amplios que permitan analizar mejor el comportamiento de la citocina con este tratamiento. Adicionalmente, sugerimos el desarrollo de investigaciones que incluyan seguimientos pareados a lo largo del tiempo en cohortes más amplias de pacientes, ya que podrían permitir una mejor comprensión del comportamiento de la citocina bajo los diferentes esquemas terapéuticos.
Uno de los resultados más interesantes de nuestro estudio muestra que la administración de CQ y dosis altas de prednisolona mantienen niveles séricos bajos de BAFF. Determinar si estos se reflejan en la actividad de la enfermedad, podría ser de gran utilidad para definir esquemas terapéuticos que lleven a un mejor pronóstico.
Consideraciones éticasEste estudio fue diseñado siguiendo la Declaración de Helsinki y la legislación colombiana (Ministerio de Salud 008430 de 1993). Fue aprobado por el comité de ética del Instituto de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia. A todos los pacientes y a los controles se les solicitó su consentimiento informado para la participación en el estudio.
FinanciaciónLa realización de esta investigación fue patrocinada por la Asociación Colombiana de Reumatología (Asoreuma). Dicha entidad no desempeñó ningún tipo de rol durante el diseño, la recolección, el análisis, la interpretación de los datos o la redacción del proyecto o manuscrito.
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimientos especiales al Grupo de Inmunología Celular e Inmunogenética de la Universidad de Antioquia (GICIG), al Grupo de Reumatología de la Universidad de Antioquia (GRUA), al Hospital Universitario San Vicente Fundación, a la IPS Artmédica, a la Asociación Colombiana de Reumatología (Asoreuma) y, por supuesto, a cada uno de los participantes voluntarios que hicieron posible esta investigación.