La biopsia de glándula salival menor (BGSM) es uno de los principales criterios (no el único) para el diagnóstico del síndrome de Sjögren, y esto tiene que ir en conjunto con la clínica y los niveles de anticuerpos. Diferentes clasificaciones se han desarrollado para evaluar la interpretación de los hallazgos observados en la BGSM y poder categorizar / diagnosticar el síndrome de Sjögren. Esto ha causado que los patólogos y los clínicos tengan una inadecuada interpretación de la BGSM debido a que existe confusión por las diferentes escalas de puntuación que se han implementado a lo largo del tiempo. El presente artículo de revisión tiene como objetivo ilustrar a la comunidad científica, especialmente reumatólogos, cirujanos orales, internistas y patólogos, entre otros, sobre los hallazgos a considerar en la BGSM al momento del reporte por parte del patólogo.
The minor salivary gland biopsy (MSBG) is one of the main criteria (not the only one) for the diagnosis of Sjögren's syndrome, and has to be taken in conjunction with the clinic parameters and the antibodies levels. Different classifications have been developed to evaluate the interpretation of the findings observed in the MSBG and to be able to categorise / diagnose Sjögren's syndrome. This has meant pathologists and clinicians have had an unsuitable interpretation of the MSBG due to the existence of confusion due to the different scoring scales that have been implemented over time. This review article aims to illustrate to the scientific community, especially rheumatologists, oral surgeons, internists, and pathologists, among others, on the findings to be considered in the MSBG when reported by the pathologist.
La biopsia de glándula salival menor (BGSM) es uno de los principales criterios (no el único) para el diagnóstico del síndrome de Sjögren (SS), esto tiene que ir en conjunto con la clínica y los niveles de anticuerpos1. Dentro de los criterios actuales para el diagnóstico del SS el resultado de la biopsia de glándula salival tiene especial importancia, dado que de 4 puntos que se deben cumplir para el diagnóstico, en caso de ser positiva la biopsia, se adjudicarían 3 puntos, por lo cual su realización es necesaria (tabla 1)1.
Criterios de clasificación ACR-EULAR para el diagnóstico del síndrome de Sjögren
| Criterios | Score |
|---|---|
| Glándula salival labial menor con sialoadenitis linfocítica focal y puntaje FS≥1 | 3 |
| Anti-SSA (Ro)+ | 3 |
| Puntuación de tinción ocular≥5 (o puntuación de van Bijsterfeld≥4) en al menos un ojo | 1 |
| Test de Schirmer≤5mm / 5min en al menos un ojo | 1 |
| Flujo total de saliva no estimulada≤0,1ml / min | 1 |
Tabla modificada de Shiboski et al.1.
A lo largo del tiempo diferentes clasificaciones se han desarrollado para evaluar la interpretación de los hallazgos observados en la BGSM y poder categorizar / diagnosticar el SS2–6 (tabla 2). Esto ha causado que los patólogos y los clínicos tengan una inadecuada interpretación de la BGSM debido a que existe confusión por las diferentes escalas de puntuación que se han implementado a lo largo del tiempo. Por tal motivo, grupos de expertos han generado recomendaciones sobre los hallazgos específicos del SS, al igual que los requerimientos para el análisis del tejido. Estas recomendaciones se han enfocado principalmente a la estandarización y guía para el uso de la BGSM en el diagnóstico del SS y en los ensayos clínicos7. El objetivo del presente artículo es ilustrar a la comunidad científica, especialmente reumatólogos, cirujanos orales, internistas y patólogos, entre otros, sobre los hallazgos a considerar en la BGSM al momento del reporte por parte del patólogo.
Clasificaciones utilizadas para evaluar las biopsias de glándula salival menor
| Chisholm y Mason |
| Gado 0: Ninguno |
| Grado 1: Infiltrado escaso |
| Grado 2: Infiltrado moderado |
| Grado 3: 1 foco |
| Grado 4: ≥2 focos |
| Tarpley et al. |
| Clase 0: Normal |
| Clase 1: Infiltrado mínimo. Uno o 2 agregados celulares, compuestos de linfocitos, plasmocitos e histiocitos (cada agregado es similar a un foco) |
| Clase 2: >2 agregados |
| Clase 3: Infiltrado difuso y destrucción parcial de acinos |
| Clase 4: Infiltrado difuso, con o sin fibrosis, y destrucción acinar completa |
| Greenspan et al. (puntaje por focos) |
| 1 foco |
| 2 focos (así hasta 11 focos) |
| ≥12 focos (infiltrado confluyente) |
Tabla modificada de Parra-Medina et al.13.
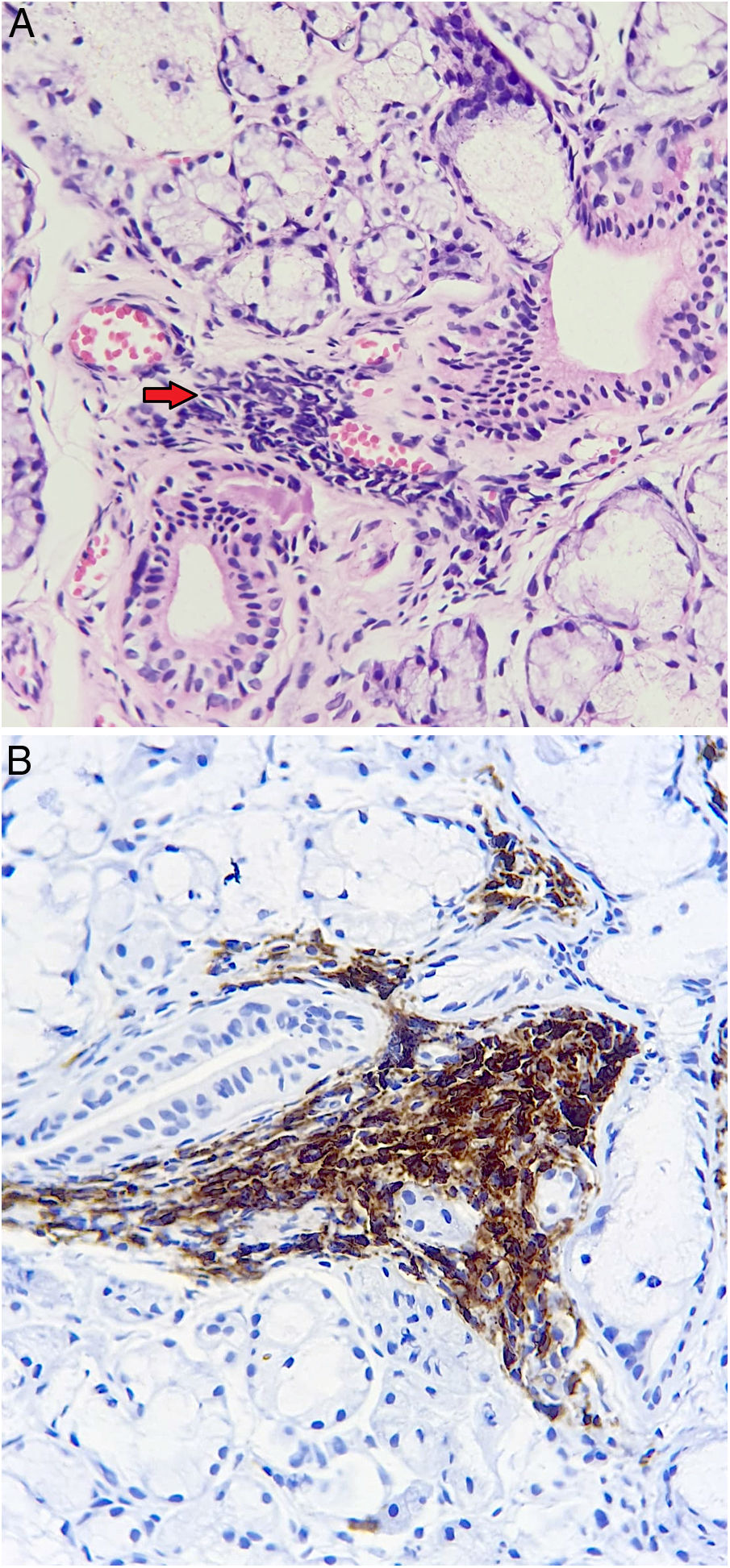
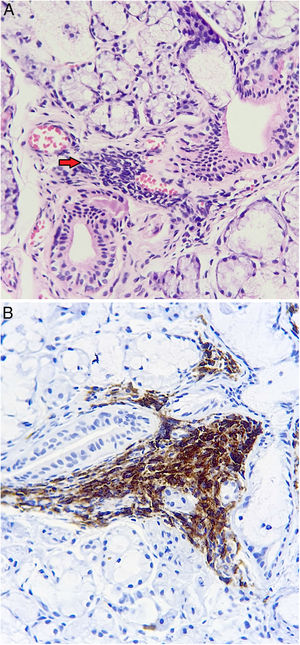
Diferentes clasificaciones se han propuesto para el diagnóstico histopatológico del SS. En 1968 Chisholm y Mason introdujeron un sistema de clasificación de BGSM con 5 grados2, de 0 a 4, basado en la presencia de infiltración linfocítica difusa o focos de linfocitos, y definiendo como focos el acúmulo de 50 o más células mononucleares. Posteriormente, Greenspan y Daniels5,6 agregan el concepto de Score de Foco (FS, por el inglés Focus Score), definiéndolo como el número de focos en un área de 4mm2 de tejido de apariencia normal6,8,9. Actualmente, el hallazgo de un FS≥1 en 4mm2 de tejido glandular es denominado como sialoadenitis linfocítica focal (SLF)10,11 y es el criterio usado por Daniels y Witcher9. La presencia de FS≥1 se considera como la manifestación histológica sugerente de SS, no obstante, también puede encontrarse, aunque en menor frecuencia, en otras enfermedades autoinmunes y en individuos sanos1,12.
Diagnóstico histopatológico de la BGSM en el SSBasado en los hallazgos histopatológicos, el patólogo puede emitir 6 posibilidades diagnósticas (tabla 3). 1. BGSM dentro de los límites normales; 2. SLF; 3. Sialoadenitis crónica no específica (SCNE); 4. Sialoadenitis crónica esclerosante; 5. Inflamación granulomatosa; 6. Linfoma MALT u otro subtipo13. Es de resaltar que la presencia del numeral 2 (SFL) es el principal hallazgo del SS.
Diferentes diagnósticos de la biopsias de glándula salival menor en el contexto del síndrome de Sjögren
| Diagnósticos histopatológicos | Causas |
|---|---|
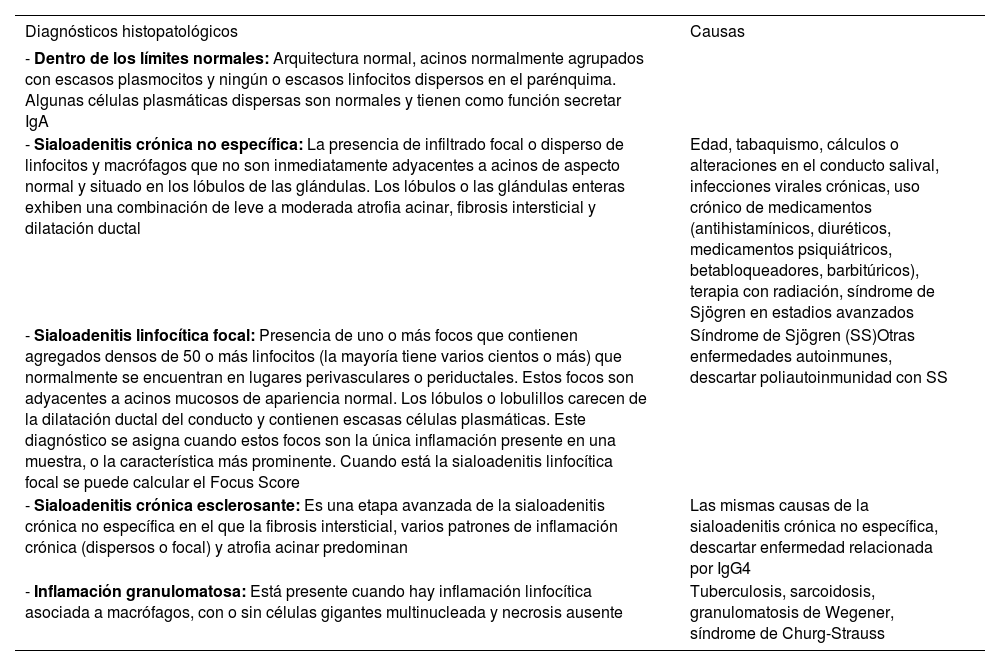
| - Dentro de los límites normales: Arquitectura normal, acinos normalmente agrupados con escasos plasmocitos y ningún o escasos linfocitos dispersos en el parénquima. Algunas células plasmáticas dispersas son normales y tienen como función secretar IgA | |
| - Sialoadenitis crónica no específica: La presencia de infiltrado focal o disperso de linfocitos y macrófagos que no son inmediatamente adyacentes a acinos de aspecto normal y situado en los lóbulos de las glándulas. Los lóbulos o las glándulas enteras exhiben una combinación de leve a moderada atrofia acinar, fibrosis intersticial y dilatación ductal | Edad, tabaquismo, cálculos o alteraciones en el conducto salival, infecciones virales crónicas, uso crónico de medicamentos (antihistamínicos, diuréticos, medicamentos psiquiátricos, betabloqueadores, barbitúricos), terapia con radiación, síndrome de Sjögren en estadios avanzados |
| - Sialoadenitis linfocítica focal: Presencia de uno o más focos que contienen agregados densos de 50 o más linfocitos (la mayoría tiene varios cientos o más) que normalmente se encuentran en lugares perivasculares o periductales. Estos focos son adyacentes a acinos mucosos de apariencia normal. Los lóbulos o lobulillos carecen de la dilatación ductal del conducto y contienen escasas células plasmáticas. Este diagnóstico se asigna cuando estos focos son la única inflamación presente en una muestra, o la característica más prominente. Cuando está la sialoadenitis linfocítica focal se puede calcular el Focus Score | Síndrome de Sjögren (SS)Otras enfermedades autoinmunes, descartar poliautoinmunidad con SS |
| - Sialoadenitis crónica esclerosante: Es una etapa avanzada de la sialoadenitis crónica no específica en el que la fibrosis intersticial, varios patrones de inflamación crónica (dispersos o focal) y atrofia acinar predominan | Las mismas causas de la sialoadenitis crónica no específica, descartar enfermedad relacionada por IgG4 |
| - Inflamación granulomatosa: Está presente cuando hay inflamación linfocítica asociada a macrófagos, con o sin células gigantes multinucleada y necrosis ausente | Tuberculosis, sarcoidosis, granulomatosis de Wegener, síndrome de Churg-Strauss |
Para realizar un diagnóstico histopatológico adecuado es fundamental obtener una biopsia con material suficiente. Se deben obtener como mínimo de 3 a 5 lóbulos de glándula salival menor evaluable (cada lóbulo separado quirúrgicamente)14,15. Acorde con el consenso7 se deben obtener mínimo 4 lóbulos o 6 lóbulos si estos son pequeños (menor a 2mm) o en su defecto en total se debe disponer de 8mm2 para su adecuado análisis.
Para la interpretación de la BGSM, se ha propuesto realizar varios cortes a los bloques de parafina de la muestra para mejorar la sensibilidad del diagnóstico, ya que una sola sección podría sobreestimar o subestimar el FS16. Por lo tanto, recomendamos realizar varios niveles en varias glándulas para evaluar de manera adecuada la totalidad de la muestra, si bien algunos expertos consideran realizar cortes adicionales solo en caso que el primer nivel no sea concluyente7. Morbini et al. demostraron que realizar 2 o más niveles a la biopsia mejora la especificidad en las biopsias con un FS≥1 pero<216. Mientras que otros estudios no han mostrado diferencias en el FS realizando 2 o 3 niveles de 200μm17,18.
La interpretación de FS debe ser realizada adyacente a los acinos de apariencia normal, con lóbulos o lobulillos sin dilatación ductal y que contengan no más de una proporción mínima de células plasmáticas, si bien existe discusión sobre la presencia de estas células, dada su posible participación dentro del curso natural de la enfermedad. El diagnóstico de la SLF se asigna cuando estos focos son la única inflamación presente en una muestra o la característica más prominente. El FS solo se proporciona cuando se realiza un diagnóstico de SLF y número total de focos en la muestra por el área total de la glándula y multiplicando el resultado por 4 (fig. 1), para dar el número de focos por 4mm214. Por encima de un FS de 10, los focos son típicamente confluentes y una puntuación arbitraria de 12 a menudo se aplica5,19. Es de resaltar que un FS≥1 es interpretado como SS en el contexto de los criterios actuales, de la mano de la puntuación de los demás criterios para llegar a un diagnóstico definitivo.
En el contexto de un paciente con SS los hallazgos a evaluar y esperar son los mencionados anteriormente, sin embargo, hay que tener en cuenta diagnósticos diferenciales como sarcoidosis, procesos infecciosos o neoplasias. Otro diagnóstico diferencial que hay que considerar es la enfermedad relacionada con IgG4, la cual se caracteriza a nivel histopatológico por infiltrado linfoplasmocitario; en la glándula salival se ha asociado con formación de folículos linfoides, fibrosis estoriforme y flebitis obliterativa20.
Hallazgos histopatológicos de la BGSM en el SSEn la BGSM se pueden observar los diferentes cambios que suceden en el transcurso de la enfermedad; en las etapas iniciales se destaca la presencia de infiltrado inflamatorio interlobulillar y periductal sin pérdida de la arquitectura. A lo largo del infiltrado inflamatorio crónico se observa alteración de la arquitectura, dado por la reducción del parénquima acinar e hiperplasia ductal5,21,22. También se ha observado aumento de la angiogénesis23 y acumulación de material hialino en la luz de ductos con alteración arquitectural y alrededor de vasos sanguíneos5,21. También se pueden reconocer otros hallazgos como la formación de centros germinales (CG), atrofia acinar, fibrosis intersticial y dilatación ductal; estos hallazgos son relativamente frecuentes y se han asociado con la edad24.
Llamas-Gutiérrez et al.25 examinaron 74 BGSM, 63 con SS y 11 controles, observando diferencias estadísticamente significativas en el FS≥1 (p=0,001), atrofia acinar (p=0,001), linfocitos y células plasmáticas externos del FLS (p=0,02) y fibrosis estromal (p=0,05). Asimismo, se encontraron otras alteraciones histológicas que podrían estar presentes en pacientes con SS como la dilatación ductal (76%), hiperplasia del conducto (52%), infiltración grasa (49%), foco perivascular (32%), lesión linfoepitelial (27%), metaplasia oncocítica (17%), formación de CG (9,5%), y metaplasia ductal (5%). En nuestra experiencia del Hospital Infantil Universitario de San José de Bogotá, en 176 pacientes con sospecha de SS se reconoció que 70 pacientes tenían FS≥1 en 4mm2, de estos el 23% tenía lesión linfoepitelial, el 9% formación de CG, el 61% infiltración grasa, el 9% metaplasia oncocítica, el 14% metaplasia ductal, el 60% dilatación ductal y el 46% atrofia acinar. La presencia de FS≥1 se asoció con lesión linfoepitelial (p=<0,0001) y con linfocitos y células plasmáticas externos del FLS (p=0,033). De estos hallazgos, la edad se asoció estadísticamente con la infiltración grasa (p=0,01), dilatación ductal (p=0,01) y atrofia acinar (p=0,01)26.
Reporte histopatológicoEl reporte de patología se encuentra dividido en 4 apartados (fig. 2), el primero es la identificación del paciente, seguido de los hallazgos macroscópicos, hallazgos microscópicos y por último el diagnóstico definitivo.
En la descripción macroscópica, el patólogo identifica el número de muestras de tejido que se reciben para su valoración; como se comentó previamente se deben obtener como mínimo de 3 a 5 lóbulos de glándula salival menor evaluable (cada lóbulo separado quirúrgicamente)14,15.
En los hallazgos microscópicos se debe enfatizar la presencia de SLF (fig. 3), sin embargo, también se puede reconocer formación de CG y hallazgos de SCNE como atrofia acinar, fibrosis intersticial y dilatación ductal. En algunos casos también se puede reconocer la BGSM sin ninguna alteración morfológica.
En el apartado del diagnóstico se puede consignar uno o varios, dependiendo de los hallazgos encontrados (tabla 3). Para el diagnóstico de SS se debe reconocer la presencia de SLF≥1. En un paciente con SS también se puede observar SLF asociado con hallazgos de SCNE. La presencia de SCNE no descarta ni confirma la presencia de SS, puede ser el estadio final de SS o puede ser secundario a otra entidad (edad, uso de medicamentos, otra enfermedad reumatológica, entre otros). El diagnóstico puede ser descriptivo, principalmente en aquellos casos en que el tejido no cumpla con el mínimo material evaluable, y esto conlleva una difícil interpretación por parte del reumatólogo.
La BGSM como factor pronósticoAdemás de su importancia en el diagnóstico del SS, la BGSM también podría ser útil en el contexto clínico ya que muchos de los hallazgos se han asociado con diferentes manifestaciones clínicas o serológicas27,28.
El principal hallazgo histopatológico para el diagnóstico es el FS, el cual se ha asociado con mayor severidad de queratoconjuntivitis sicca9, niveles de autoanticuerpos (anti-Ro [SSA]) / anti-La [SSB], factor reumatoide, anticuerpos antinucleares) y disminución en el flujo salival no estimulado8,29,30. A mayor FS disminuye el flujo salival no estimulado en el tiempo31. El FS también se ha asociado con el flujo salival estimulado19,31,32 y con la presencia de fibrosis y no de atrofia32. La presencia de FS≥1 ha sido útil para predecir los resultados adversos, tales como manifestaciones extraglandulares y el desarrollo de linfoma33,34. Risselada et al. observaron que el FS≥3 tiene un valor predictivo para el desarrollo de linfomas no Hodgkiniano34.
La presencia de CG se asocia con altos valores de FS34, y al igual que este último es otro hallazgo histopatológico de gran importancia clínica, el cual debe ser reportado por parte del patólogo junto con el FS35, debido a que la presencia de CG se asocia con mayor prevalencia de anticuerpos circulantes anti-Ro (SSA) / anti-La (SSB), factor reumatoide, mayor severidad de la enfermedad, mayor frecuencia de manifestaciones extraglandulares, hipergammaglobulinemia, y aumento de riesgo de linfomas B34,36–38. Por otro lado, la presencia en los pacientes con formación de CG muestra diferentes expresiones del perfil de citoquinas33,39,40.
Otras características histopatológicas con implicaciones clínicas son la infiltración de células linfoides, la atrofia y fibrosis; estas están correlacionadas con la disminución en la secreción del flujo salival32,41, así como la dilatación ductal se ha asociado con cirrosis biliar primaria42. Del mismo modo se ha demostrado un incremento del flujo salival y una disminución del número de focos linfocitarios, secundario al tratamiento con abatacept43.
La BGSM es una fuente importante de información para conocer el proceso patológico que sucede a nivel glandular y ofrece diferentes hallazgos histopatológicos que se han asociado como factor pronóstico en el contexto clínico (manifestaciones extraglandulares, aumento de los niveles de anticuerpos, mayor riesgo de linfoma y severidad de la enfermedad). Sin embargo, hasta el momento no se conoce con exactitud la importancia que puede tener la BGSM en el seguimiento de los pacientes con las diferentes terapias farmacológicas27,28. Tres estudios han evaluado los cambios morfológicos con el uso de tratamiento biológico, 2 estudios con rituximab44,45 y uno con abatacept43. En los 2 estudios con rituximab observaron cambios histopatológicos relevantes. Pijpe et al.44 evaluaron la BGSM antes y después de 12 semanas con el medicamento, observando a nivel histopatológico reducción del infiltrado linfocítico, del número de CG (4 de 5 pacientes), y del número y del tamaño de sialoadenitis linfoepitelial. Carubbi et al.45 también observaron reducción en el FS (89,4% con FS<1) y del número de CG (18 de 19 pacientes) utilizando rituximab durante 120 semanas. Mientras el estudio de Alder et al.43 con abatacept durante 24 semanas no encontró diferencias en el FS, pero sí observaron reducción de linfocitos T FoxP3+ y del número de linfocitos B y T.
ConclusiónLos hallazgos de la BGSM son fundamentales para el diagnóstico y pronóstico del paciente con sospecha de SS, siendo esta uno de los criterios con mayor peso dentro de los criterios internacionales validados para el SS. La recomendación actual es realizar el diagnóstico de SS basado en el FS (fig. 1) teniendo en cuenta lo que se expuso anteriormente, por tal motivo no recomendamos realizar el diagnóstico de SS basado en la clasificación de Chisholm y Mason. En los casos en donde se encuentran agregados linfoides adyacentes a tejido alterado con cambios crónicos (atrofia acinar, fibrosis intersticial o dilatación ductal, sugerentes de SCNE), no se consideran dentro del cálculo del FS, ya que estos hallazgos impiden un cálculo adecuado; dichos hallazgos son frecuentes en la población general, pero también pueden coexistir en el SS (aproximadamente el 15% de los pacientes con anticuerpos anti-SSA/SSB en suero u otras características clínicas del SS mostrarán un patrón de lesión crónica no específica), lo cual ha sido motivo de controversia a nivel científico; si hay sospecha clínica de SS, puede ser útil considerar nueva biopsia para tratar de tomar muestras de lóbulos salivales no atróficos. Por todo lo anterior, la revisión de dichas características microscópicas por parte del clínico, brindarán una guía para evaluar a cada paciente en su contexto individual y así tomar la decisión adecuada.
Es importante unificar la forma de adquisición del tejido por parte de los reumatólogos; si bien no es el objetivo de esta revisión, la variabilidad en la toma del tejido y en su procesamiento inicial, pueden llevar a errores en la interpretación histológica (tabla 4).
Recomendaciones para el procesamiento inicial de la glándula salival menor
| Recomendación general | Manejo cuidadoso de las muestras de tejido para evitar artificios que alteren el análisis histológico. |
| Recomendaciones específicas | |
| Cantidad de lóbulos de glándulas salivales | Se deben obtener como mínimo de 3 a 5 lóbulos de glándula salival menor evaluable (cada lóbulo separado quirúrgicamente). Mínimo deben corresponder a un área de 8mm2 |
| Maniobras a evitar | Se debe evitar maniobras de pinzamiento de las glándulas |
| Manejo inmediato luego de la extracción | Colocar inmediatamente después de la toma en la solución fijadora las glándulas salivales (esto evita lisis que altera el estudio histológico) |
| Solución fijadora a utilizar | Formol tamponado neutro al 10% (PH: 7,2-7,4)Es indispensable tamponar el formol ya que este proceso permite preservar satisfactoriamente la morfologíaEn comunicación con los servicios de patología se puede obtener el mismo para tener disponibilidad en el servicio de reumatología |
| Recipiente a utilizar | El recipiente debe ser de material idealmente plástico o vidrio transparente, permitir la relación anotada de 1: 10 tejido:fijador, evitando tener una relación mayor del líquido fijador (formol tamponado) por tejido. En el caso de las glándulas salivales pueden ser crioviales o tubos que se utilizan para centrifugación de muestras. Si se van utilizar frascos que se usan regularmente para uroanálisis, se debe tener en cuenta la relación de tejido:fijador |
| Tiempo para envío | Las muestras se deben enviar máximo en 24h y durante ese tiempo no requieren estar refrigeradas |
Adicionalmente, recomendamos una adecuada comunicación entre el clínico y el patólogo para obtener una apropiada interpretación sobre el reporte histopatológico. En algunos casos en donde el reumatólogo tenga sospecha de SS y la BGSM sea negativa, se puede considerar realizar relectura de la BGSM con nuevos cortes al bloque de parafina46.
FinanciaciónEste estudio no requirió recursos de financiamiento proporcionados por la Escuela de Medicina de la Fundación Universitaria de Ciencias de la Salud-FUCS y fue aprobado por Comité de Investigaciones de la Escuela de Medicina de la Fundación Universitaria de Ciencias de la Salud-FUCS.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses con respecto al tema y los resultados de este estudio.