Describir los niveles urinarios de moléculas relacionadas con la remoción de células apoptóticas y desencadenamiento de la inflamación, así como citocinas involucradas, en pacientes colombianos con lupus eritematoso sistémico sin y con nefritis lúpica, en comparación con controles sanos.
Materiales y métodosSe tomó una muestra de orina a tres grupos de pacientes: controles sanos (n=7), pacientes con lupus eritematoso sistémico sin nefritis lúpica (n=7) y pacientes con lupus y nefritis lúpica (n=4). La muestra de orina fue recolectada y concentrada por ultrafiltración. Se evaluó por western blot: HMGB1, histona H3, calreticulina (CRT), anexina A1 y CD46, CX3CL1 por ELISA y citocinas como IL-8, IL-6, IL-12p70, TNF-α e IL-1β por citometría de flujo.
ResultadosLa histona H3 se detectó en dos pacientes, uno con lupus eritematoso sistémico sin nefritis lúpica y el otro con lupus eritematoso sistémico y nefritis lúpica. La banda detectada sugiere una modificación postraduccional. No hubo diferencias entre los niveles de HMGB1 y CX3CL1 en los grupos de estudio. CD46, anexina A1 y CRT no se detectaron en nuestras muestras. Al evaluar las citocinas en orina, se observó un incremento de IL-8 en el grupo de pacientes con lupus eritematoso sistémico sin nefritis, en comparación con los controles, en tanto que para la IL-6 se encontró un aumento en pacientes sin nefritis lúpica, en comparación con pacientes con nefritis lúpica. No se hallaron diferencias en los niveles urinarios de las demás citocinas evaluadas (IL-12p70, TNF-α, IL-1β e IL-10).
ConclusiónLos niveles urinarios de histona H3 e IL-8 pueden ser moléculas interesantes para ser evaluadas en un grupo más amplio de pacientes con lupus eritematoso sistémico, mientras que HMGB1 y CX3CL1 no parecen ser útiles. Se requiere evaluar más pacientes para confirmar estos hallazgos.
To describe the urinary levels of molecules related to removing apoptotic cells and triggering inflammation, as well as cytokines involved in Colombian patients with systemic lupus erythematosus without and with lupus nephritis compared to healthy controls.
Materials and methodsUrine samples were taken from three groups of patients: healthy controls (n=7), patients with systemic lupus erythematosus without lupus nephritis (n=7), and patients with lupus and lupus nephritis (n=4). The urine sample was collected and concentrated by ultrafiltration. A western blot evaluated HMGB1, Histone H3, Calreticulin (CRT), Annexin A1 and CD46, CX3CL1 by ELISA and cytokines such as IL-8, IL-6, IL-12p70, TNF-α, and IL-1β by flow cytometry.
ResultsHistone H3 was detected in two patients, one with systemic lupus erythematosus without lupus nephritis and one with systemic lupus erythematosus and lupus nephritis. The detected band suggests a post-translational modification. There were no differences between the levels of HMGB1 and CX3CL1 in the study groups. CD46, Annexin A1, and CRT were not detected in our samples. When evaluating cytokines in urine, an increase in IL-8 was observed in the group of patients with systemic lupus erythematosus without nephritis compared to controls. For IL-6, an increase was found among patients without lupus nephritis when compared with patients with lupus nephritis. No differences were found between the urinary levels of the other cytokines evaluated (IL-12p70, TNF-α, IL-1β, and IL-10).
ConclusionUrinary histone H3 and IL-8 levels may be interesting molecules to be evaluated in more patients with systemic lupus erythematosus, while HMGB1 and CX3CL1 are not useful. Further evaluation of patients is required to confirm these findings.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune que se caracteriza por la producción de autoanticuerpos dirigidos contra antígenos intracelulares. Las características clínicas son heterogéneas y de diferentes grados de severidad. En Colombia, entre el año 2012 y el 2016 se estimó una prevalencia de lupus de 91,9/100.000 sujetos, donde el 79% de los pacientes eran mujeres1. La falta de remoción de las células apoptóticas se ha propuesto como un mecanismo de inducción de la enfermedad2,3, y así la orina se hace atractiva como fuente de estudio de potenciales biomarcadores en una ventana de observación para conocer el estado del paciente. Un marcador biológico se define como un signo físico, celular, bioquímico, molecular o alteración genética, mediante el cual se puede reconocer y medir un proceso biológico normal o anormal4. Algunos marcadores promisorios, pero con estudios no conclusivos, son las variantes de la fracción constante para el receptor inmunoglobulinaG, los cuales desempeñan un papel importante en el aclaramiento inmune y pueden contribuir a mayor susceptibilidad a la enfermedad, en especial en población caucásica; sin embargo, no se ha logrado encontrar asociación clara con riesgo de nefritis lúpica5. Entre otras moléculas que se han encontrado más asociadas con nefritis lúpica se encuentra la quimiocina MCP-1 (proteína quimioatrayente de monocitos)6. Por otro lado, no existe ningún biomarcador validado de la actividad de la enfermedad en pacientes con LES con diversos niveles de actividad al mismo tiempo4.
Recientemente se ha evaluado la deposición de C4d en tejido renal y su concentración en orina y suero de pacientes como un marcador promisorio para nefritis lúpica renal5,7. Sin embargo, se encontró asociación con el CD4d presente en el tejido, lo que dificulta su medición. En otro estudio, en el que se evaluaron los niveles plasmáticos de C4d, se encontró que podría ser un biomarcador para discriminar entre los pacientes de LES con y sin nefritis, y se halló una mayor precisión al evaluar la relación C4d/C4 y relacionándose con la histología7, lo que lo hace atractivo como un biomarcador ideal en este caso, al ser fácil de medir, no estar afectado por la edad, el sexo ni la raza, reflejar la actividad de la enfermedad, detectar precozmente el compromiso y correlacionarse con la histología. La fisiopatología de la nefritis lúpica involucra a varios mediadores como quimiocinas, moléculas de adhesión, autoanticuerpos, citoquinas, complemento y sus productos6. Mediante proteómica en tejido de biopsia renal de pacientes con nefritis lúpica claseIV, se han identificado múltiples marcadores: serotransferrina, citoqueratina 18 y 19, albúmina y anexina A5, alfa-1-antitripsina (A1AT), CKD273 uromodulina, fragmentos de proteína S100-A9, beta-2-microglobulina y glicoproteína alfa-2-HS4,8. Otro marcador, el MiRN-29c, ha sugerido ser un marcador de progresión temprana a fibrosis en nefritis lúpica9; no obstante, dentro de los más estudiados están MCP-1, TWEAK, NGAL, IP10 PGDS6. Recientemente, en pacientes colombianos, se evaluó la utilidad de la transferrina y la ceruloplasmina urinaria para diferenciar a los pacientes con LES sin y con nefritis, y se encontró que ambas moléculas pueden discriminar a los pacientes con nefritis lúpica activa10.
Puesto que la nefritis lúpica es la mayor complicación observada en estos pacientes, en el presente estudio se buscó explorar algunas moléculas relacionadas con la remoción de células apoptóticas y citocinas en orina de pacientes con LES con y sin nefritis lúpica.
Materiales y métodosPacientes y controlesTodos los pacientes y los controles del estudio fueron reclutados en Bogotá (Colombia). Para los pacientes con diagnóstico de LES se seleccionaron mayores de 18años que estuvieran en seguimiento en un hospital de referencia y que cumplieran con los criterios de clasificación SLICC 201211. Se obtuvieron 11 pacientes que cumplían con estos criterios, cuatro de los cuales tenían documentado compromiso renal tipo nefritis lúpica claseIII oIV diagnosticado por medio de biopsia renal, que documentaba según los criterios de clasificación de la International Society of Nephrology/Renal Pathology Society (ISN/RPS) del 200312. Para los controles se escogieron adultos mayores de 18años del mismo sexo y edad de los pacientes, que además fueron evaluados por un médico reumatólogo para descartar presencia de enfermedad autoinmune u otras patologías. Algunos controles fueron usados para más de un paciente. Se evaluó además por uroanálisis que no presentaran proteinuria, hematuria o sedimento activo.
Grupo LES sin nefritis lúpicaCriterios de inclusiónPacientes con LES establecido, seguidos por reumatología en el Hospital Universitario San Ignacio que no presenten proteinuria, hematuria, sedimento activo o insuficiencia renal según valoración clínica y exámenes de laboratorio al momento de la consulta.
Criterios de exclusiónPacientes que no sean adherentes al tratamiento; presencia de bacterias en el sedimento urinario.
Grupo LES con nefritis lúpicaCriterios de inclusiónPacientes con LES y diagnosticados con nefritis lúpica con biopsia renal; pacientes en etapa III y IV instaurada de nefritis lúpica. Una proteinuria por debajo de 500mg/24h se considerará nefritis inactiva, en tanto que por encima de 500mg/24h se considerará activa.
Criterios de exclusiónPacientes que no sean adherentes al tratamiento; pacientes en diálisis; presencia de bacterias en el sedimento urinario.
Grupo controlCriterios de inclusiónVoluntarios adultos que no presenten proteinuria, hematuria, sedimento activo en parcial de orina al momento de la toma de muestra ni manifestaciones clínicas de LES.
Criterios de exclusiónPresencia de bacterias en el sedimento urinario.
Los pacientes fueron valorados en el servicio de hospitalización o consulta externa de reumatología, y a quienes cumplieron criterios y aceptaron participar se les solicitó firma de consentimiento informado; se tomaron datos de la historia clínica de la última evaluación y se recolectó muestra de orina para realizar los análisis en el laboratorio. A todos los pacientes se les hizo una valoración clínica completa y se solicitaron los paraclínicos necesarios para el cálculo del Systemic Lupus Erythematosus Disease Activity Index (SLEDAI)13. Se clasificó igualmente la proteinuria en muestra aislada con la relación proteinuria/creatinuria y/o en orina de 24horas, que se consideró normal si era menor o igual a 150mg/24h, rango subnefrótico 150-3.500 y rango nefrótico >3.500mg. Se consideró sedimento activo la presencia de más de cinco leucocitos por campo, más de dos hematíes o presencia de cilindros. El resto de los datos fueron tomados de la historia clínica para evaluar, entre otras, la presencia de comorbilidades como diabetes e hipertensión arterial (HTA). Este estudio fue aprobado por el comité de ética institucional.
La primera muestra de orina de la mañana fue recolectada y concentrada por ultrafiltración con tubos Amicon® ultra de 15ml, para lo cual se utilizó un cut off de 10KDa. Para esto se tomaron 4ml de orina y luego de ellos los tubos fueron centrifugados a 4,000×g (gravedades), 30min a temperatura ambiente. Finalmente, se recuperó el concentrado en 200μl de buffer fosfato salino con inhibidor de proteasas PMSF (fluoruro de fenilmetilsulfonilo, P2676, Sigma). Se sembraron 25μg de proteína por carril en geles prefabricados (Biorad, 4-20% Ready Gel Tris-HCl gel, 12 well, 20ul #1611177) y se realizó una corrida electroforética SDS- PAGE 10min a 100V (voltios) y 35min a 200V. Una vez terminada la corrida electroforética, las proteínas se transfirieron a una membrana Polyvinylidene difluoride (PVDF) en una cámara húmeda a 0,35A (amperios) por 2h, a temperatura ambiente. El bloqueo de la membrana se realizó con 5% de leche descremada en TBS (Tris-buffer saline, 1706435, Biorad) durante una hora. Posteriormente, la membrana fue incubada con los respectivos anticuerpos de detección durante una hora, a temperatura ambiente; 1:500 de anticuerpo primario policlonal anti-HMGB1 de conejo (MAB1690, cell signaling), 1:1.000 del anticuerpo primario monoclonal antihistona H3 de ratón (MAB9715, cell signaling). Cada membrana se lavó con una solución TBS cinco veces por 5min, y luego se adicionó el respectivo anticuerpo secundario anti-IgG de conejo, 31460 thermofisher (1:5.000) o anti-IgG de ratón, 31430, Thermofisher (1:10.000), conjugados con peroxidasa por una hora a temperatura ambiente y en agitación. Las membranas fueron lavadas cinco veces por 5min y luego se reveló con una solución de luminol (Supersignal™ west dura extended, 34076, Pierce). Finalmente, las membranas se expusieron con una película de rayosX (CL-XPosure™ film, 34093, Thermo Scientific) y fueron reveladas. Se repitió el procedimiento para la CRT (anti-calreticulina, 2891, cell signaling), anexina A1 (anti-anexina A1, 3299, cell signalling) y CD46 (anti-CD46,13241, cell signalling) con la estandarización descrita para cada molécula. La densidad relativa para cada proteína fue calculada usando el software ImageJ.
Elisa de fractalquina (CX3CL1)A partir de la muestra concentrada de orina, se realizó una dilución 1:20 y la fractalquina CX3CL1 se detectó por ELISA, siguiendo las instrucciones del fabricante (Human CX3CL1/Fractalkine Quantikine ELISA Kit, DCX310, R&D systems). Brevemente, sobre la placa ya cubierta con anticuerpo de captura se adicionó la muestra diluida de orina y la respectiva curva estándar de 0 a 10mg/ml, y se incubó por 3h a 4°C. Luego de esto, se hicieron lavados con buffer y se adicionó el anticuerpo de detección acoplado a peroxidasa durante una hora a 4°C. Se repitió el proceso de lavado y el ELISA se reveló con TMB y peróxido de hidrógeno, usando H2SO4 como solución de parada. Se realizó lectura a 450nm en espectrofotómetro ThermoScientific. La determinación de la concentración de fractalquina en la muestra se hizo interpolando los valores de densidad óptica en la curva estándar. El límite de sensibilidad fue de 0,072ng/ml.
Medición de citocinasSe analizaron las concentraciones de IL-8, IL-1β, IL-6, IL-10, TNF-α e IL-12 en las muestras de orina por citometría de flujo, mediante la técnica de microesferas del estuche comercial CBA: Cytometric bead array human inflammation kit (Human Inflammatory Cytokines kit, BD Biosciences, San José, CA), siguiendo el procedimiento establecido por la casa comercial. Se realizó una curva estándar haciendo diluciones seriadas (0-5.000pg/ml). Con posterioridad, cada una de las diluciones y las muestras diluidas se mezclaron con las perlas de captura para cada una de las citoquinas objeto de evaluación. Finalmente, se adicionó el fluorocromo detector. Las muestras fueron adquiridas en el citómetro FACS Aria IIu. La concentración de cada una de las citoquinas se calculó mediante el análisis por el programa FCAP Array, versión Windows (BD, Biosciences). El límite de detección dependió de cada citocina analizada y varió entre 1,9 y 7,2pg/ml.
Análisis estadísticoLos datos fueron analizados usando STATA (14.0) (StataCorp; College Station, TX), en tanto que la normalidad de las variables se probó mediante la prueba Shapiro-Wilk W. Para la comparación entre los grupos se utilizó una prueba no paramétrica de Mann Whitney. Se consideró una significancia estadística <0,05. Se utilizó el programa Graphpad prism 5.0 para la realización de las gráficas y el análisis de los datos.
Consideraciones éticasEl proyecto tuvo en cuenta los apartados de la Declaración de Helsinki y la normatividad colombiana (Resolución 8430 de 1993). Los autores declaran que la investigación realizada en humanos fue avalada por el comité de ética institucional. Asimismo, en este artículo no aparecen datos de los pacientes y todos ellos firmaron consentimiento informado.
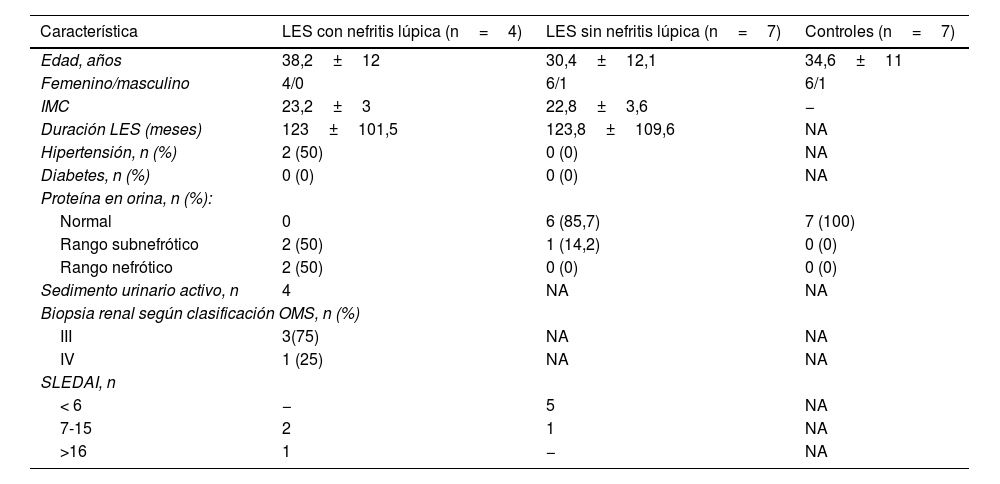
ResultadosCaracterísticas de la población de estudioEn la tabla 1 se muestran las características de la población de estudio. La edad media de los participantes fue de 38años en el grupo del LES con nefritis lúpica y de 30años en el grupo de LES sin nefritis lúpica. La mayoría de los participantes fueron de sexo femenino (90,9%). En el grupo con nefritis lúpica, el 50% de los participantes tenían proteinuria en rango nefrótico, mientras que el 75% de ellos cursaban con diagnóstico de nefritis lúpica claseIII (tabla 1).
Características de la población de estudio
| Característica | LES con nefritis lúpica (n=4) | LES sin nefritis lúpica (n=7) | Controles (n=7) |
|---|---|---|---|
| Edad, años | 38,2±12 | 30,4±12,1 | 34,6±11 |
| Femenino/masculino | 4/0 | 6/1 | 6/1 |
| IMC | 23,2±3 | 22,8±3,6 | − |
| Duración LES (meses) | 123±101,5 | 123,8±109,6 | NA |
| Hipertensión, n (%) | 2 (50) | 0 (0) | NA |
| Diabetes, n (%) | 0 (0) | 0 (0) | NA |
| Proteína en orina, n (%): | |||
| Normal | 0 | 6 (85,7) | 7 (100) |
| Rango subnefrótico | 2 (50) | 1 (14,2) | 0 (0) |
| Rango nefrótico | 2 (50) | 0 (0) | 0 (0) |
| Sedimento urinario activo, n | 4 | NA | NA |
| Biopsia renal según clasificación OMS, n (%) | |||
| III | 3(75) | NA | NA |
| IV | 1 (25) | NA | NA |
| SLEDAI, n | |||
| < 6 | − | 5 | NA |
| 7-15 | 2 | 1 | NA |
| >16 | 1 | − | NA |
Con el fin de evaluar la presencia de moléculas relacionadas con la remoción de células apoptóticas en la orina de los pacientes, se evaluaron HMGB1, CX3CL1, CD46, calreticulina, CRT, histona H3 y anexina A1.
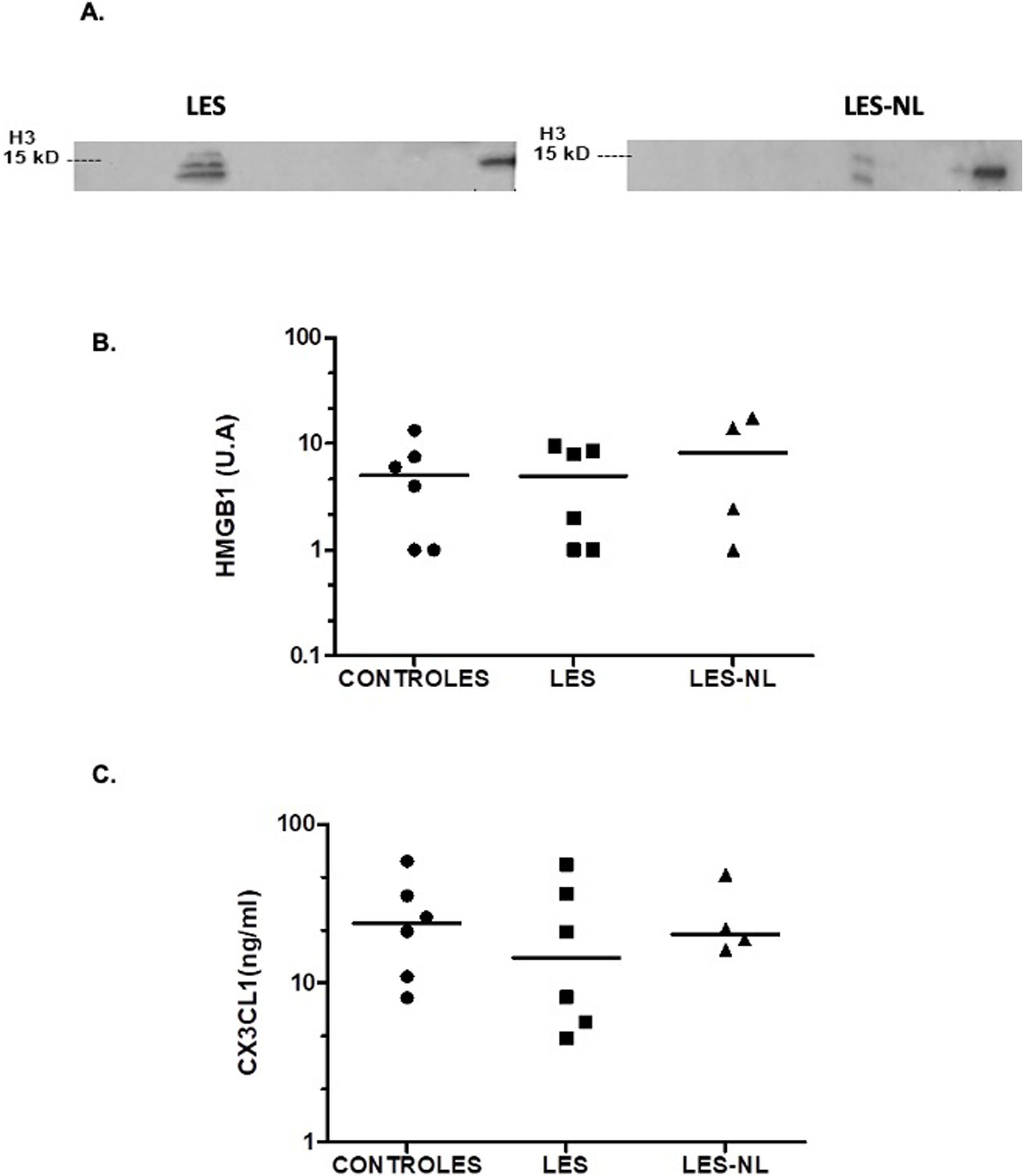
Como puede observarse en la figura 1A, la histona H3 como «señal de peligro» fue detectada en dos pacientes con LES, uno con nefritis lúpica y el otro sin esta entidad. La banda detectada sugiere una modificación postraduccional de la histona. Esta histona H3 no fue detectada en los individuos control de los pacientes. No se encontraron diferencias en los niveles de HMGB1 en los grupos analizados (mediana de expresión 5,01 vs. 8,2 en controles, LES y LES con nefritis, respectivamente, fig. 1B). Para el nivel de CX3CL1 como molécula quimioatractante, fue similar en todos los grupos (mediana de 23,7ng/ml para controles vs. 14,6ng/ml para LES y 20,4ng/ml para LES y nefritis lúpica, fig. 1C). En las muestras de los pacientes y controles evaluados no se detectaron CD46, anexina A1 ni CRT.
Niveles de la histona H3 (A) y HMGB1 (B) detectados por western blot y de CX3CL1 (C) por Elisa.
Círculos negros: controles; cuadrados negros: pacientes con LES sin nefritis lúpica; triángulos negros: pacientes con LES y nefritis lúpica. La línea horizontal representa la mediana. U: unidades arbitrarias.
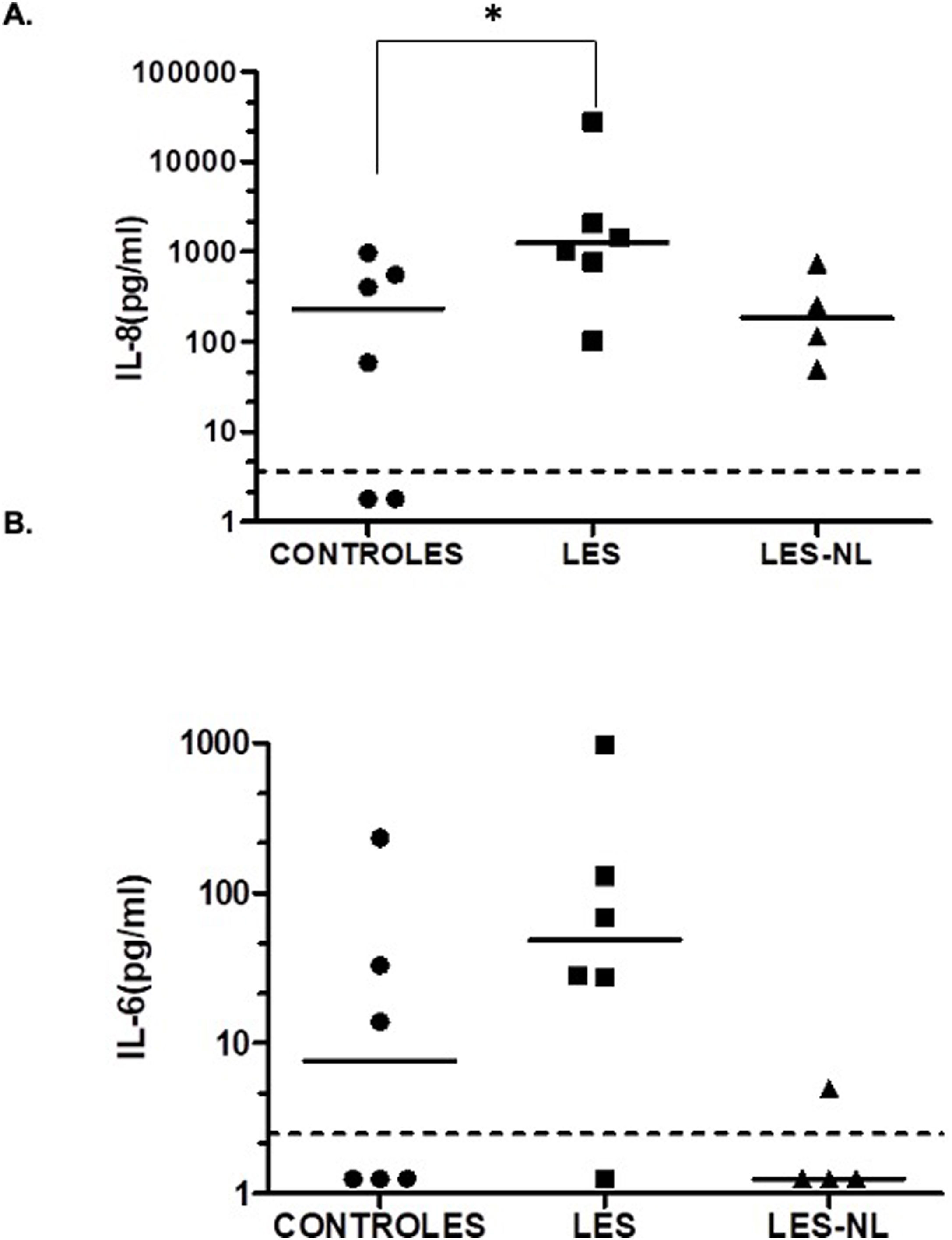
Al evaluar las citocinas en orina, se observó un incremento estadísticamente significativo al comparar niveles de IL-8 en los pacientes con LES sin nefritis lúpica y los controles (mediana de producción de 231,1pg/ml para los controles vs. 1.235,5pg/ml para los pacientes con LES sin nefritis lúpica) (fig. 2A, p˂0,05). No se encontraron diferencias en los niveles de IL-8 de los pacientes con LES y nefritis lúpica al compararlos con los controles (mediana de producción de 231,1pg/ml para los controles vs. 182,1pg/ml para los pacientes con LES y nefritis). Para la IL-6 no se encontraron diferencias significativas entre controles y pacientes; sin embargo, se observó una tendencia al aumento en los pacientes con LES sin nefritis con respecto a los controles (mediana de 48,9pg/ml para LES sin nefritis vs. 7,6pg/ml para los controles). En los pacientes con LES y nefritis se detectaron bajos niveles urinarios de IL-6, mientras que se observó una disminución en los pacientes con LES en comparación con los pacientes con LES y nefritis lúpica (mediana de 1,25pg/ml, fig. 2B). Las demás citocinas evaluadas en orina (TNF-α, IL-10, IL-12p70, IL-1β) se encontraron por debajo del límite de detección en los grupos analizados (dato no mostrado).
Niveles de IL-8 (A) e IL-6 (B) en orina.
Círculos negros: controles; cuadrados negros: pacientes con LES sin nefritis lúpica; triángulos negros: pacientes con LES y nefritis lúpica. La línea horizontal representa la mediana y la línea punteada representa el límite de detección de la prueba. * p˂0,05. Test de Mann Whitney.
En este estudio se encontró la presencia de la histona H3 en dos de los pacientes con lupus, uno con nefritis lúpica y el otro sin nefritis lúpica, y no se observó en ninguno de los controles (fig. 1A). En ambos pacientes se detectó una banda correspondiente a la histona H3 que puede estar presentando una modificación postraduccional de la histona. La liberación de esta histona sugiere que puede estar siendo liberada por cuerpos apoptóticos y causar la inhibición de la captura por parte de los macrófagos, desencadenando con ello el proceso de inflamación14,15. Las histonas son un componente esencial de los nucleosomas eucariotas, que son moléculas con varios papeles importantes en el DNA: pueden ser liberadas de células inflamatorias activadas, células apoptóticas y células necróticas16. Cuando se exponen extracelularmente pueden generar una inhibición en la captación de células apoptóticas por parte de los fagocitos, posiblemente por su unión a la integrina αvβ5, la cual reconoce a moléculas como Gas6 y MFG-E8 que funcionan como puente entre la exposición de fosfatidilserina expuesta en las células apoptóticas para el reconocimiento por los fagocitos y esta integrina17.
En el LES esta molécula puede ser expuesta por células apoptóticas no eficientemente removidas. La histona H3 puede sufrir algunas modificaciones, entre ellas una trimetilación. Este tipo de modificaciones promueven un potencial inmunogénico que, al ser reconocido por células presentadoras de antígeno, pueden ser presentadas a célulasT autorreactivas, y estas a su vez promueven la producción de anticuerpos por parte de las célulasB, lo que conllevará un depósito de inmunocomplejos en diferentes órganos18.
La molécula HMGB1 se ha considerado una molécula tipo «señal de peligro». Cuando esta molécula se libera, participa en la liberación de moléculas proinflamatorias mediante el reconocimiento por los receptores RAGE, TLR2 o TLR4, lo que genera un ambiente inflamatorio y contribuye a desórdenes autoinmunes. Esta molécula puede liberarse de macrófagos activados19, como también de células en necrosis secundaria20; adicionalmente, puede evitar el reconocimiento y la fagocitosis de las células apoptóticas por parte de los macrófagos, mediante la unión con la integrina αvβ3, lo que impide la interacción entre esta integrina y MFG-E8, una opsonina que sirve como puente de unión entre la fosfatidilserina expuesta en las células apoptóticas y la integrina αvβ3. Por otra parte, HMGB1 puede inhibir vías de señalización intracelulares, como la fosforilación de ERK y la activación de Rac-1, que se activan en los macrófagos durante la fagocitosis de las células apoptóticas21. En un estudio que midió los niveles de HMGB1 en orina de pacientes con nefritis lúpica por western blot se comprobó que el aumento de los niveles de esta molécula en orina están correlacionados particularmente con la nefritis lúpica activa y con el puntaje SLEDAI de estos pacientes22. En nuestro estudio no encontramos diferencias en los niveles de HMGB1, lo que puede deberse al tamaño de muestra o al procesamiento de la orina, puesto que en este trabajo fue concentrada por ultrafiltración. Sin embargo, no se puede descartar un papel de esta molécula, pues su estado de oxidorreducción puede determinar su papel inflamatorio23.
La fractalquina (CX3CL1) es una quimiocina sintetizada por células endoteliales que en su forma soluble se adhiere a su receptor (CX3CR1) presente en monocitos, células NK y linfocitosT, lo cual facilita el reclutamiento de estos24; se ha demostrado que participa como una señal quimioatrayente en la remoción de células apoptóticas25. Se ha observado que la expresión de fractalquina en suero de pacientes con LES puede funcionar como marcador de la actividad y severidad de la enfermedad, ya que se han encontrado altas concentraciones de esta en pacientes con LES y con compromiso neuropsiquiátrico; además, su medición en fluido cerebroespinal puede ayudar al diagnóstico de estos pacientes26.
Adicionalmente, se ha descrito que existe una expresión aumentada de fractalquina en pacientes con nefritis lúpica. Un estudio que analizó la expresión de esta molécula mediante inmunohistoquímica de biopsias de pacientes con nefritis lúpica reveló niveles elevados de fractalquina en biopsias renales de pacientes con nefritis lúpica gradosIII yIV27. De manera similar, en un estudio en el que se midieron niveles de fractalquina en orina por ELISA, se encontraron niveles mayores de esta molécula en pacientes con nefritis lúpica proliferativa, en comparación con los pacientes con nefritis lúpica no proliferativa28. En nuestro estudio no se encontraron diferencias en los niveles urinarios de fractalquina entre pacientes y controles.
Como se mencionó anteriormente, la falta de remoción de células apoptóticas conlleva la inducción de la liberación de diferentes citoquinas proinflamatorias, gracias a la liberación de antígenos intracelulares que funcionan como señales inmunogénicas y potenciales activadores de diversas vías de señalización, como NFκβ y MAPK, que terminan en la liberación de dichas citocinas y exacerban la respuesta inmunológica, además del daño en los diferentes órganos implicados. Con respecto a las citocinas, se han observado diferencias en los niveles urinarios de IL-8 en pacientes con LES con y sin nefritis lúpica, así como en controles sanos y en pacientes con LES y nefritis lúpica29. Sin embargo, otro estudio similar reveló que no existen diferencias significativas en pacientes con y sin nefritis lúpica30. En nuestro estudio se encontraron mayores niveles de IL-8 en pacientes con LES sin nefritis, en comparación con los controles, pero dichos niveles cayeron en los pacientes con nefritis lúpica, lo que puede deberse al tratamiento que reciben los pacientes. Se ha reportado que luego del tratamiento con ciclofosfamida, los niveles de IL-8 e IL-6 disminuyen31. En este estudio solo un paciente de LES sin nefritis había recibido dicho tratamiento, por lo cual deben considerarse los efectos de otros medicamentos como glucocorticoides, antimaláricos e inmunosupresores como azatioprina. Los niveles urinarios de IL-6 se han descrito elevados en pacientes con nefritis lúpica y se han correlacionado con niveles altos de anti-dsDNA32; sin embargo, en una investigación reciente no hubo diferencia en pacientes con LES y pacientes ANA positivo, ni en pacientes renales y no renales33. En nuestro estudio no encontramos diferencias entre controles y pacientes, pero al ver los niveles entre los pacientes se observó una tendencia de niveles mayores en los pacientes con LES sin nefritis. Nuestro estudio tiene como principal debilidad el pequeño número de pacientes, por lo cual los datos mostrados deben ser evaluados en estudios con mayor número de pacientes; sin embargo, los resultados presentados muestran que la histona H3 y la IL-8 parecen ser moléculas de interés para el seguimiento en los pacientes con LES: la histona H3, para seguir entendiendo los mecanismos de falla en la remoción de células apoptóticas y su papel como desencadenante del proceso inflamatorio; y la IL-8, debido a que se han hecho pocos estudios y podría ser útil para hacer seguimiento luego del tratamiento. En un estudio en pacientes colombianos con poliautoinmunidad se encontró que la IL-8 en plasma se encuentra elevada en pacientes con poliautoinmunidad asociada a LES y disminuye luego del tratamiento con rituximab34. El papel de estas dos moléculas presentes en orina debe ser confirmado al ampliarse el número de pacientes evaluados.
La necesidad creciente de tener mejores biomarcadores de seguimiento del compromiso renal por LES sigue presente. Por lo anterior, es necesario continuar con la búsqueda, desde la medicina traslacional, de biomarcadores que permitan hacer una mejor aproximación a la nefritis lúpica.
La elevación de la IL-8 evidenciada en nuestro trabajo se correlaciona con estudios previos que han evaluado la posibilidad de ser un biomarcador de daño renal. Esto, sustentado en la elevación más marcada de IL-8 urinaria en pacientes con nefritis lúpica activa. Así mismo, la disminución en los niveles urinarios se ha correlacionado con el tratamiento de la nefritis y apunta a su posible utilización como biomarcador en la práctica clínica35.
Otros marcadores de daño renal que se han descrito incluyen el inductor débil de apoptosis similar al factor de necrosis tumoral (TWEAK), relacionado con la expresión de otros marcadores inflamatorios, que lo hace un potencial biomarcador urinario de daño renal, e incluso puede asociarse con episodios de actividad aguda y respuesta al tratamiento36.
FinanciaciónEste proyecto recibió financiación de la Vicerrectoria de Investigación de la Pontificia Universidad Javeriana (PPTA6433).
Consideraciones éticasToda la investigación fue aprobada por el comité institucional (acta No. 17-2014).
Conflicto de interesesNinguno.