La resección en bloque de metástasis en columna vertebral ha sido objeto de estudio en la literatura médica debido a su impacto en la calidad de vida de los pacientes y su efectividad en el control local de la enfermedad. Este análisis bibliográfico examina los hallazgos y perspectivas de estudios publicados en relación con la resección en bloque de oligometástasis vertebrales. La técnica, que implica la extirpación completa del tumor junto con una porción del hueso circundante, ha demostrado mejorar el control local del tumor, reducir la recurrencia y potencialmente prolongar la supervivencia de los pacientes en comparación con las técnicas convencionales de descompresión y estabilización. Sin embargo, la resección en bloque también presenta riesgos y complicaciones, como la morbilidad quirúrgica y el mayor tiempo de recuperación. La selección adecuada de pacientes, la planificación preoperatoria y el enfoque multidisciplinario son fundamentales para optimizar los resultados. A medida que se desarrollan nuevas técnicas y avances en el tratamiento adyuvante, la resección en bloque de oligometástasis vertebrales sigue siendo un área de interés en la investigación oncológica.
En bloc resection of vertebral metastases has been the subject of study in medical literature due to its impact on patients’ quality of life and effectiveness in local disease control. This bibliographic analysis examines the findings and perspectives of published studies concerning en bloc resection of oligometastases in the spine. The technique, which involves the complete removal of the tumour along with a portion of the surrounding bone, has been shown to improve local tumour control, reduce recurrence, and potentially prolong patient survival compared to conventional decompression and stabilization techniques. However, en bloc resection also presents risks and complications, such as surgical morbidity and extended recovery time. Appropriate patient selection, preoperative planning, and a multidisciplinary approach are essential to optimize outcomes. As new techniques and advances in adjuvant treatment develop, en bloc resection of oligometastases in the spine remains an area of interest in oncological research.
Las metástasis solitarias de columna vertebral son una complicación común en pacientes con cáncer avanzado. El tratamiento de estas lesiones puede incluir diferentes opciones de cirugía, radioterapia, terapia sistémica o una combinación de estas opciones. En particular, la cirugía, radioterapia corporal estereotáctica (SBRT, por sus siglas en inglés) y la resección en bloque son 2 tratamientos comunes para las metástasis solitarias de columna vertebral. Este ensayo revisará la evidencia actual para determinar cuál de estas opciones de tratamiento es la más indicada para los pacientes diagnosticados con metástasis solitarias de columna vertebral.
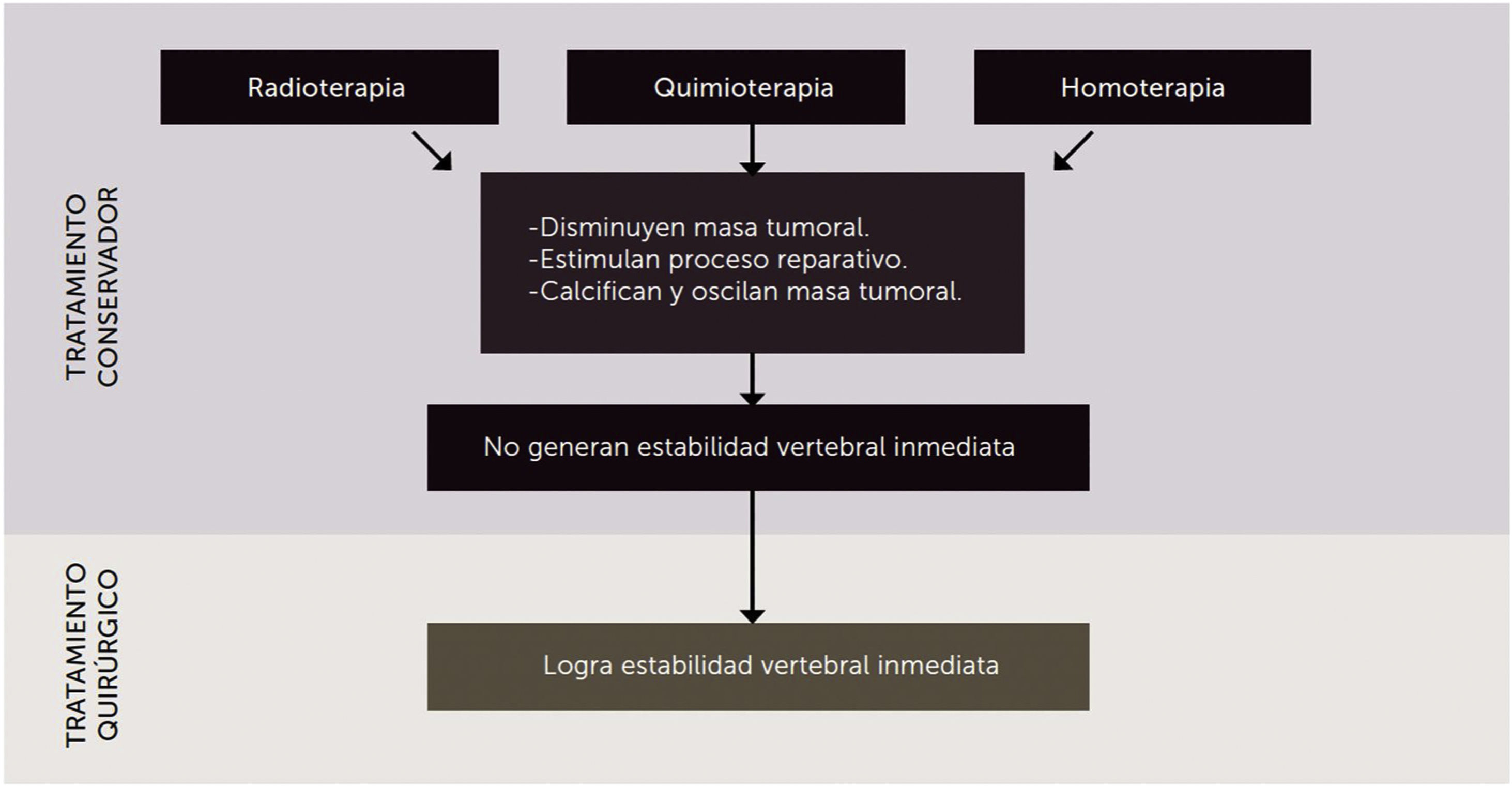
TratamientoLos objetivos del tratamiento de las metástasis vertebrales son calmar el dolor, mejorar o revertir el compromiso neurológico, corregir la inestabilidad y deformidad espinal generada por el colapso vertebral, mejorar la enfermedad en caso de que sea posible con la radioterapia y/o quimioterapia o la cirugía y mejorar la calidad de vida del paciente. Como equipo multidisciplinar que trata a estos pacientes debemos conocer los diferentes tratamientos de los que disponemos:
- •
Esteroides: ayudan a mejorar el compromiso neurológico de instalación aguda, disminuyendo el edema peritumoral, y ayudan al manejo del dolor.
- •
Denosumab: en general los bifosfonatos, y en especial el denosumab, se utilizan para mejorar la suficiencia ósea de los tumores vertebrales; producen calcificación de la masa tumoral y en algunos casos la disminuyen. Previenen la reabsorción ósea osteoclástica y disminuyen el riesgo de fractura.
- •
Radioterapia: terapia ampliamente usada en el tratamiento de las metástasis vertebrales, útil en el alivio del dolor en un 80% de los casos y reducen el volumen tumoral en tumores radiosensibles, de lento crecimiento, sin compromiso neurológico y que no tengan inestabilidad vertebral. La radioterapia convencional paliativa se ve limitada por la incapacidad de verter grandes dosis debido a la toxicidad medular. En este aspecto hay avances significativos y cambios en el paradigma que se han establecido desde la instauración de la radiocirugía estereotáctica (SRS, por sus siglas en inglés)(SBRT), que permite la radiación de grandes dosis de esta, evitando la toxicidad medular, con una probada precisión, y que ha eliminado de clásica diferenciación entre histologías más o menos radiosensibles. La cirugía de separación es importante en este punto; es un procedimiento por el cual se separa el saco dural del tumor unos milímetros, permitiendo la administración de SRS de forma segura1–4.
- •
Quimioterapia: cada vez más específica para células objetivo, permitiendo un tratamiento dirigido y con mejores resultados. Incluye la inmunoterapia, hormonoterapia, etc.
- •
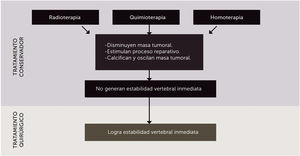
Tratamiento quirúrgico: es el de elección cuando se trata de un dolor intratable, un compromiso neurológico progresivo, un tumor radiorresistente con la radioterapia convencional, inestabilidad espinal, metástasis única o múltiples óseas, mala respuesta a la radioterapia o a la quimioterapia (fig. 1).
Todos los tratamientos de la enfermedad tumoral metastásica se basan en el manejo multidisciplinario e incluyen las diferentes terapias, siendo cada una de ellas fundamentales para ofrecer la mejor alternativa posible al paciente. Hay que tener en cuenta que la cirugía es la única capaz de generar estabilidad vertebral inmediata para aquellos pacientes con compromiso neurológico progresivo o inestabilidad raquídea.
Históricamente, las oligometástasis espinales se han tratado con enfoques quirúrgicos invasivos como es la resección en bloque o radioterapia paliativa convencional de haz externo (EBRT) en dosis bajas, o ambos. Desafortunadamente, la resección en bloque, que se usa para lograr márgenes quirúrgicos claros, tiene como resultado una morbilidad sustancial del paciente con control local, pero sin asegurar un resultado eficiente de la enfermedad general a largo plazo5–7. La EBRT convencional mejora el dolor en un 60% de los casos de los pacientes con metástasis vertebral, con una duración de menos de 4 meses8,9. Según Spratt et al., a medida que aumenta el número de pacientes con cáncer metastásico con supervivencia superior a 3 meses, se hace necesaria una paliación duradera y un control del tumor a largo plazo, por lo que proponen la SRS de columna como una opción terapéutica alternativa10.
Hay escasa literatura para guiar en el manejo de las metástasis vertebrales. Se han desarrollado varios marcos que enfatizan conceptos importantes y puntos de decisión en el manejo de estas metástasis, como es el marco neurológico, oncológico, mecánico y sistémico (NOMS), y la ubicación de la enfermedad en la columna, la inestabilidad mecánica, neurología, oncología, y el estado físico del paciente, el pronóstico y la respuesta al tratamiento previo (LMNOP)]11,12. Todos están destinados a proporcionar principios clave y a orientar a los oncólogos radioterápicos y cirujanos de columna. Estos marcos, por llamarlo de algún modo, a menudo simplifican u omiten detalles importantes que son fundamentales para el tratamiento de pacientes con metástasis vertebrales, un proceso que a menudo lo dirige un oncólogo médico, en lugar de un oncólogo radioterapeuta o un cirujano de columna.
Tratamiento quirúrgicoEl objetivo de la cirugía es estabilizar la columna vertebral mecánicamente inestable, descomprimir la compresión de la médula espinal, eliminar la enfermedad epidural para permitir el tratamiento con SRS y SBRT de la columna, establecer un diagnóstico histológico y proporcionar control local cuando la radioterapia no se puede administrar.
El procedimiento quirúrgico elegido debe tener en cuenta factores como la estabilidad mecánica de la columna, el estado neurológico del paciente, el tratamiento adyuvante previo y las preferencias del paciente. Dado que la radioterapia se usa para tratar de erradicar el tumor, el enfoque quirúrgico debe estar en consonancia temporal, de modo que se debe administrar una radioterapia postoperatoria efectiva.
El tratamiento quirúrgico de la enfermedad metastásica en gran parte no es oncológico, lo que significa que la cirugía por sí sola no erradicará la enfermedad con un control duradero. En una serie de casos13, la tasa de recurrencia local fue del 96% a los 4 años y no hubo diferencia en la supervivencia entre los que se sometieron a una resección en bloque o intralesional. La integración de SRS de la columna vertebral en el proceso de tratamiento estándar representa un cambio de paradigma con respecto a los años anteriores en los que se realizaban cirugías extensas para resecciones macroscópicas totales en un intento de curar a los pacientes con enfermedad metastásica. Estas cirugías invasivas han caído en desuso en instituciones con programas multidisciplinares de columna debido a las altas tasas de complicaciones14. Boriani et al. publicaron en 2016 el uso de la estabilización para tratar las metástasis espinales adaptado a los objetivos generales del tratamiento. Y también insistieron en que estas operaciones no se realizan con frecuencia en el mundo, por lo que es imperativo que se revise la experiencia adquirida en los centros especializados que llevan a cabo estos tratamientos. Hasta le fecha, se han publicado solo unos pocos informes centrados en las complicaciones y los resultados de las resecciones en bloque realizadas en la columna vertebral14–17. Algunos se centran en un área específica de la resección, otros en la propia columna vertebral, mientras que otros abordan complicaciones relacionadas con tratamientos quirúrgicos de varias patologías como el cordoma metastásico y el carcinoma metastásico de tiroides7,18–20.
Otros estudios en la literatura demuestran que le resección en bloque eficaz da como resultado menos recurrencias locales y mejora el pronóstico tanto en las metástasis vertebrales primarias como en las aisladas15,16,21–23, derivadas de carcinoma renal y de tiroides6,20,23.
Resecciones en bloque comparadas con las intralesionales reportan un mejor control local de la recurrencia (un 92,3% frente al 72,2%)21.
Antes de continuar con la exposición de las resecciones en bloque para el tratamiento de las metástasis vertebrales es importante conocer y revisar la terminología24,25:
- -
Escisión intralesional: extirpación fragmentaria del tumor, subcategorizada en:
- ∘
Intracapsular: extirpación incompleta del tumor donde quedan restos macroscópicos o histológicos dentro de la cápsula del tumor.
- ∘
Extracapsular: resección completa de toda la masa tumoral junto con el tejido periférico (3-5mm o más de tejido periférico sano), pero con apertura de la lesión.
- ∘
- -
Resección en bloque: extirpación de toda la masa tumoral, incluido margen de tejido sano que recubre el tumor. Después de la evaluación histopatológica de la resección el espécimen se subclasifica como:
- ∘
Intralesional, si se violó el tumor, provocando así un derrame (una diseminación contaminación) tumoral.
- ∘
Marginal, si una capa delgada del tejido normal cubre el tumor sin rotura de tejido tumoral a través de la cubierta o cápsula.
- ∘
Amplia, si una capa gruesa de tejido sano periférico, una cubierta fibrosa densa (fascia), o una barrera anatómica aún infiltrada (pleura), cubrió completamente el tumor.
- ∘
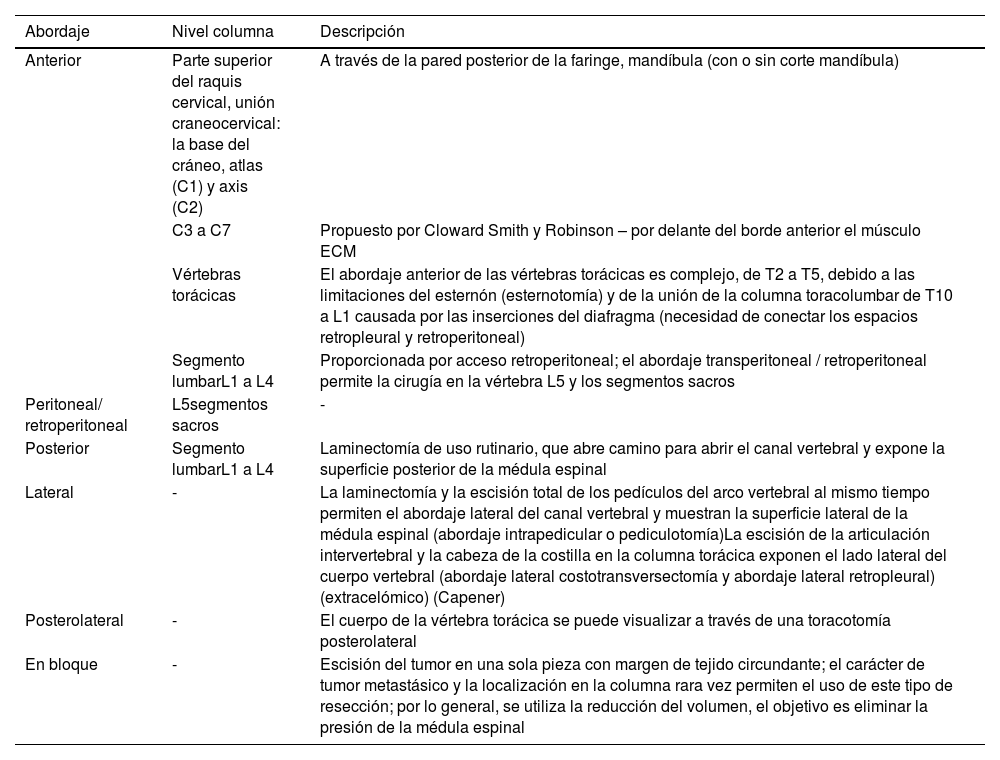
La planificación quirúrgica de la resección en bloque se hace en base a 7 estrategias de abordaje diferentes que se combinan entre sí: anterior, posterior, anterior seguido de posterior, posterior seguido de anterior y posterior, lateral, peritoneal y en bloque26–33 (tabla 1).
Tratamiento quirúrgico, abordaje
| Abordaje | Nivel columna | Descripción |
|---|---|---|
| Anterior | Parte superior del raquis cervical, unión craneocervical: la base del cráneo, atlas (C1) y axis (C2) | A través de la pared posterior de la faringe, mandíbula (con o sin corte mandíbula) |
| C3 a C7 | Propuesto por Cloward Smith y Robinson – por delante del borde anterior el músculo ECM | |
| Vértebras torácicas | El abordaje anterior de las vértebras torácicas es complejo, de T2 a T5, debido a las limitaciones del esternón (esternotomía) y de la unión de la columna toracolumbar de T10 a L1 causada por las inserciones del diafragma (necesidad de conectar los espacios retropleural y retroperitoneal) | |
| Segmento lumbarL1 a L4 | Proporcionada por acceso retroperitoneal; el abordaje transperitoneal / retroperitoneal permite la cirugía en la vértebra L5 y los segmentos sacros | |
| Peritoneal/ retroperitoneal | L5segmentos sacros | - |
| Posterior | Segmento lumbarL1 a L4 | Laminectomía de uso rutinario, que abre camino para abrir el canal vertebral y expone la superficie posterior de la médula espinal |
| Lateral | - | La laminectomía y la escisión total de los pedículos del arco vertebral al mismo tiempo permiten el abordaje lateral del canal vertebral y muestran la superficie lateral de la médula espinal (abordaje intrapedicular o pediculotomía)La escisión de la articulación intervertebral y la cabeza de la costilla en la columna torácica exponen el lado lateral del cuerpo vertebral (abordaje lateral costotransversectomía y abordaje lateral retropleural) (extracelómico) (Capener) |
| Posterolateral | - | El cuerpo de la vértebra torácica se puede visualizar a través de una toracotomía posterolateral |
| En bloque | - | Escisión del tumor en una sola pieza con margen de tejido circundante; el carácter de tumor metastásico y la localización en la columna rara vez permiten el uso de este tipo de resección; por lo general, se utiliza la reducción del volumen, el objetivo es eliminar la presión de la médula espinal |
La planificación preoperatoria se basa en la estadificación de WBB24, Tomita7 y criterios de Enneking25, con el fin de lograr el margen oncológico requerido con la menor morbilidad posible. El pronóstico se puede mejorar con más información, por lo que se deben conocer otros sistemas en la guía de tomas de decisiones quirúrgicas, como son los de Sioutos34, van der Linden35, Bauer36 y Tokuhashi37.
Los parámetros principales, en los que coincide toda la literatura con nivel de evidencia i7,38,39, para estimar el pronóstico son:
- -
La capacidad ambulatoria preoperatoria.
- -
El estado funcional del Karnosfky.
- -
La radioterapia previa.
- -
El tipo de cáncer primario.
- -
La presencia de metástasis extraespinales.
- -
El número de segmentos con metástasis vertebrales.
- -
Presencia de dolor.
- -
El índice de masa corporal.
Los parámetros quirúrgicos para tener en cuenta son:
- –
El control visual, obligatorio para lograr el margen objetivo.
- –
Las estructuras anatómicas importantes deben liberarse o resecarse bajo control visual.
- –
Los abordajes simultáneos combinados se asocian con mayor morbilidad y deben realizarse únicamente cuando sea obligatorio.
- –
La vascularización medular debe ser considerada en resección multisegmentaria.
- –
El sangrado epidural puede convertirse en un problema grave si se subestima.
- –
La extracción de la muestra (lesión/tumor/pieza tumoral) debe planificarse con el mejor enfoque con el fin de evitar tracciones o torsiones de la médula.
Los pasos propuestos para la planificación quirúrgica son:
- -
Estadificación oncológica de los márgenes sugeridos.
- -
Definir las implicaciones funcionales de los márgenes respecto a las características anatómicas.
- -
Revisión de la extensión del tumor.
El diagnóstico y la estadificación se relacionan con la agresividad del tumor. El sistema de estadificación de Boriani et al. WBB en 199724 sugiere el margen quirúrgico preciso. Si el tumor está creciendo en el espacio epidural (capa E), se considera la duramadre como límite del tumor, según la histología del primario se valora su inclusión40. Al planificar el paso, el cirujano de columna debe tener en cuenta que el espacio epidural es extracompartimental, y se esperaría que la duramadre cubriera el tumor solo si el espacio epidural está ocupado por una cicatriz, como ocurre en los casos de recidiva. En un tumor que nunca ha sido operado, la extensión al espacio epidural presumiblemente puede considerarse como una contaminación de todo el espacio desde el cráneo hasta el sacro. En esta situación, no se debe recomendar valorar la cirugía ya que conlleva una mayor morbilidad, y no hay evidencia que sugiera la resección en bloque podría evitar la recurrencia, esos detalles no se incluyen de forma específica en las publicaciones.
En el caso de precisar un margen amplio de resección debido a la histología del tumor, pero el margen involucra una estructura de alguna relevancia funcional que se debe sacrificar, el proceso de toma de decisiones debe incluir una discusión de coste/beneficio. Si el tumor crece alrededor de la raíz nerviosa, se debe considerar el sacrificio de dicha raíz. Si el paciente rechaza dicho paso quirúrgico, se debe considerar la violación del tumor.
El paciente debe estar completamente informado del riesgo de esta estrategia con referencia al control local y el resultado final, y se indica la terapia adyuvante.
Obviamente, esta planificación cuidadosa se vuelve más importante cuando se involucra un número creciente de estructuras extraespinales, como los vasos principales, pulmón, uréter… El concepto que guiará la planificación será siempre la relación entre la cirugía adecuada (basada en criterios oncológicos) y la morbilidad relacionada. Si la cirugía es apropiada en base a la evidencia de que se puede lograr el control local con una mayor probabilidad de un mejor resultado, entonces se debe discutir con el paciente la opción del sacrificio funcional o un mayor riesgo de morbilidad quirúrgica.
La violación del tumor puede ocurrir durante la cirugía si el cirujano rompe o abre involuntariamente el tumor.
Incluso después de la planificación más cuidadosa, puede ocurrir inesperadamente que se viole el tumor, ya que la visualización del tumor en las imágenes preoperatorias puede no ser completa.
La extensión del tumor determina la planificación quirúrgica. Si el tumor está creciendo anteriormente hacia el mediastino, se requerirá un abordaje anterior para visualizar el tumor y dejar una capa de tejido sano alrededor como margen. La pleura se considera un margen apropiado y puede ser resecado sobre el tumor solo por abordaje posterior, incluso toracoscópicamente.
Un abordaje únicamente posterior, según la técnica de Roy-Camille41 y Tomita39, puede o no proporcionar dicho margen, ya que la disección digital pudiera violar la cara anterior del tumor. Solo en algunos casos, el control visual proporcionado por el abordaje anterior puede proporcionar una resección con un margen seguro.
Como el objetivo final de la resección en bloque es mejorar el control local de la enfermedad, mejorando la supervivencia, se debe planificar antes de la cirugía para conseguir la estabilidad estructural de la columna vertebral tras la resección, por lo que se requiere una artrodesis circunferencial16,42–44. Se usan implantes, injertos autólogos o sustitutos óseos y diversos materiales de inducción osteogénica para lograr la fusión de la artrodesis vertebral en el nivel resecado.
La quimioterapia y la radioterapia pueden afectar de manera negativa la posibilidad de lograr esta fusión. La técnica reconstructiva que se emplea en la mayoría de los casos incluye tornillos pediculares y barras posteriores, así como una construcción (constructo) de reconstrucción de la columna anterior con una malla, prótesis, rellena de hueso biológico16. En el estudio realizado de resecciones en bloque por Boriani y Gasbarini en 220 pacientes, el fracaso de la fusión ocurrió en el 14% de los pacientes, pero únicamente en 9 casos, 4%, fue clínicamente significativo y precisó cirugía de revisión. No hubo cirugía de revisión por fallo de la columna anterior. Los fallos de la fusión posterior ocurrieron en el postoperatorio tardío5.
Los resultados en cuanto a mejor pronóstico y mejor control local de la enfermedad justifican la realización de procedimientos tan exigentes y rigurosos en tumores óseos agresivos benignos y malignos de bajo grado, y de algunas metástasis vertebrales, siendo la resección en bloque el procedimiento con mejores resultados6,15,16,19,21–23,39–41,43,45–50. El cirujano que trata primero al paciente tiene una gran responsabilidad, pues es el primer tratamiento el que más influye en el pronóstico. Para reducir la posibilidad de recurrencia local, morbimortalidad, el manejo del paciente debe realizarse por un equipo multidisciplinar y experimentado.
¿Qué dice la bibliografía al respecto de la resección en bloque en metástasis de columna vertebral?Oliveira et al.51 en 2015 recordaban la variedad de métodos quirúrgicos disponibles para el tratamiento de metástasis vertebrales. Sugerían que para pacientes con una metástasis espinal solitaria sin invasión de canal vertebral y con buena salud general, así como una larga expectativa de vida, la resección del tumor mediante espondilectomía en bloque/ vertebrectomía total con instrumentación estabilizadora es lo más recomendable.
Si bien es cierto que los candidatos para la espondilectomía en bloque no se encuentran con frecuencia51–53, los estudios publicados tienen sesgos por pacientes, por técnica, por complicaciones…
En todos los escenarios de metástasis vertebrales, la radioterapia es una herramienta valiosa para tratar las enfermedades y controlar los focos embolígenos. La radiocirugía es eficaz como tratamiento primario o complementario de los tumores metastásicos de columna vertebral. Las técnicas de embolización ayudan a controlar el sangrado intraoperatorio54–59.
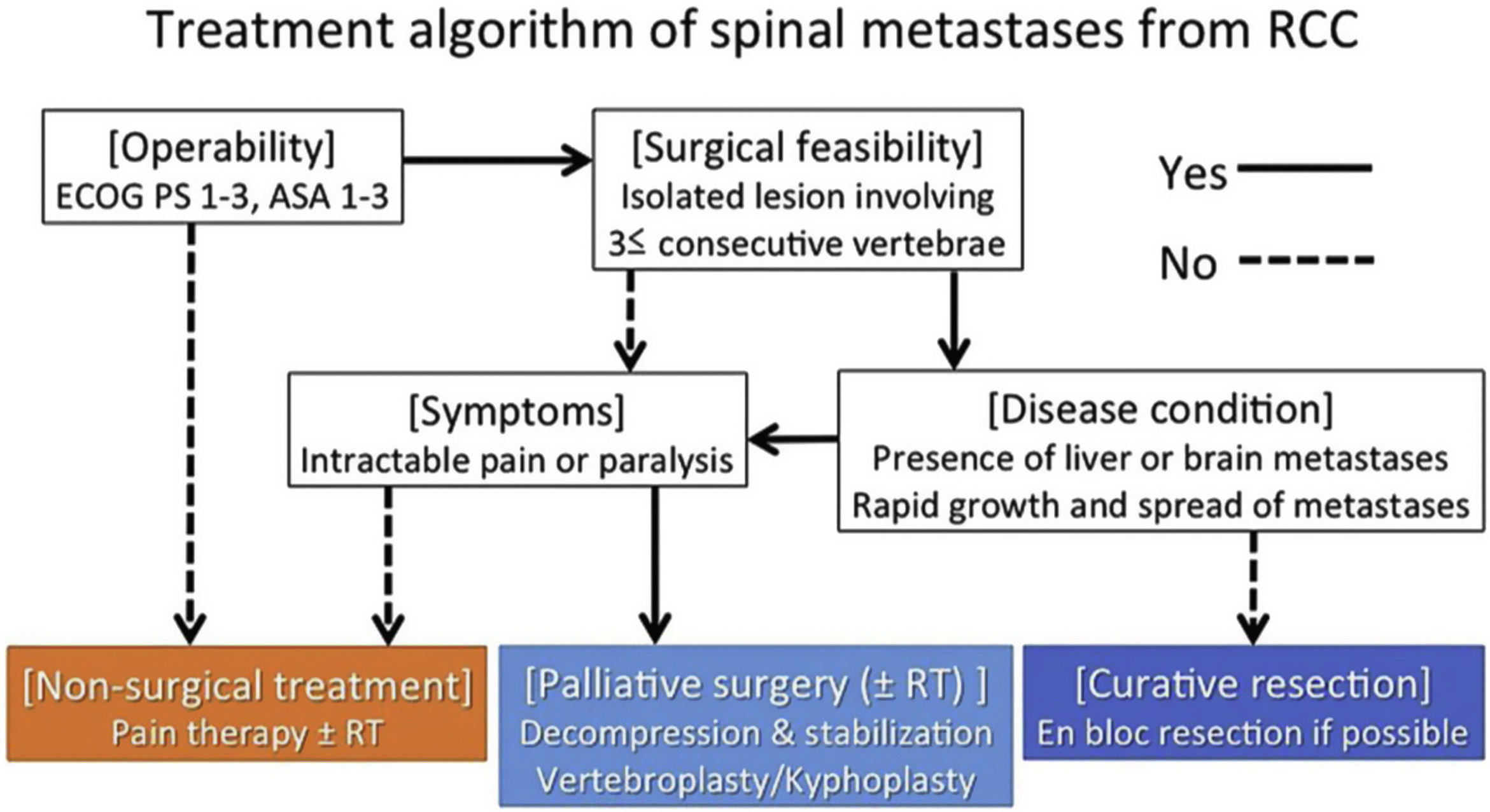
El grupo de estudio del profesor Jaipanya60 trabaja con el marco NOMS11 para la guía de la evaluación integral de pacientes con metástasis espinal. Propone en aquellos pacientes que presentan compresión medular espinal de alto grado y/o mielopatía con cáncer radiosensible, la administración de radioterapia convencional de haz externo, y se les puede ofrecer una cirugía vertebral de descompresión previa para optimizar el resultado neurológico (cirugía de separación). En los tumores radiorresistentes con compresión medular de alto grado y/o mielopatía, recomienda la estabilización y descompresión vertebral seguidas de SRS espinal. Recomienda la resección en bloque para aquellos pacientes con esperanza de vida mayor a 2 años con metástasis solitarias, avalado por Kato et al.61. Estos últimos sostienen que la cirugía de columna de resección en bloque ha perdido popularidad debido a la alta morbilidad perioperatoria y la alta complejidad quirúrgica, por lo que ha sido reemplazada por la terapia híbrida. Sí hay indicación de espondilectomía en bloque en pacientes con una supervivencia esperada superior a 2 años, un tumor metastásico solitario o primario controlado sin metástasis extraespinales, condición cardiovascular conservada y apta para la cirugía, con un estado preoperatorio aceptable (ECOG-2) y en pacientes tratados en centros sin SRS en metástasis con resistencia conocida a la ERBTc.
Hasta ahora, la revisión bibliográfica apoya que el candidato ideal para la cirugía en bloque es un paciente con una metástasis solitaria que se puede resecar por completo. Es la cirugía de elección, especialmente en lesiones metastásicas únicas de carcinoma de células renales y se realiza a través de la una escisión total fragmentaria en la columna cervical y una espondilectomía total en bloque en la columna torácica o lumbar.
El resultado de la cirugía de columna en bloque es excelente, cuando cumple todas las premisas hasta ahora definidas, con una tasa de recurrencia local que oscila entre el 1,1 y el 15,3%61. En aquellos casos en los que se logra la resección completa del tumor, se espera un control local y una supervivencia postoperatoria superiores en comparación con la cirugía citorreductora, incluyendo la reducción del tumor en la columna vertebral anterior y la descompresión de los elementos posteriores. Sin embrago, la tasa de complicaciones perioperatorias mayores es de hasta el 39,7% y la tasa de mortalidad perioperatoria oscila entre el 1,3 y el 9,7%.
La resección en bloque para pacientes con metástasis espinal aislada de un cáncer de tiroides también se ha informado con resultados exitosos61. En una serie de 8 pacientes, al final del seguimiento (promedio de 6,4 años), todos los pacientes estaban vivos y 5 no tenían evidencia de enfermedad.
Aunque se ha enfatizado el enfoque en la resección en bloque para carcinoma de células de riñón y metástasis aislada de tiroides, otras histologías pueden ser candidatas si cumplen ciertos factores. Los pacientes con oligometástasis de cáncer de mama o una metástasis secretora funcional (feocromocitoma) pueden estar indicados según la relación riesgo/beneficio. No obstante, la decisión de proceder a una resección en bloque deber ser multidisciplinar, considerando todos los tratamientos posibles y las preferencias del paciente.
En un subgrupo restringido y cuidadosamente seleccionado de pacientes con metástasis espinal, se sugirió que estas resecciones oncológicas o «en bloque» podrían mejorar el control local y potencialmente llevar a la curación incluso ante una metástasis ósea en la columna vertebral; sin embargo, seleccionar al paciente correcto seguía siendo un desafío. Además, los avances en el campo de la radioterapia espinal estereotáctica brindaron otra opción a los algoritmos de tratamiento, reportando buenas tasas de control local sin la morbilidad asociada con las resecciones en bloque2,3.
La resección en bloque implica un procedimiento en el que el tumor se extirpa sin trasgredir la cápsula tumoral, con el objetivo oncológico de disminuir el riesgo de recurrencia local y mejorar la supervivencia libre de enfermedad. La pieza obtenida tras el estudio histológico debe informar de los márgenes obtenidos. Si el margen es amplio, hablaremos de margen amplio, y si es la propia seudocápsula del tumor, como pudiera ser la duramadre, será un margen marginal. Cualquier apertura voluntaria o involuntaria convertirá el procedimiento en intralesional. Este planteamiento muestra mejor control local y supervivencia4,6,9,14,39.
Las indicaciones de las resecciones en bloque son para pacientes con metástasis solitaria o limitada en la curación o el control local prolongado. Con los avances en oncología radioterápica, específicamente el uso generalizado de la SBRT, se observa comúnmente un control local mejorado y más prolongado10,11. Esto, junto con la evolución de la terapia sistémica dirigida, ha hecho que las indicaciones para una resección en bloque en la población de la columna metastásica sean aún más difíciles de estandarizar.
La espondilectomía en bloque generalmente se ha reservado para pacientes con una metástasis solitaria e histología específica. Seleccionar al paciente adecuado para este tipo de cirugía es un desafío, ya que el pronóstico es difícil de predecir. Tomita y Tokuhashi modificado7,37 son sistemas de clasificación que se han utilizado ampliamente; se han planteado críticas, cuestionando su validez y fiabilidad13–17. Además, se ha informado de la incapacidad para diferenciar el pronóstico bueno y moderado utilizando estas puntuaciones15. Estos sistemas de puntuación no tienen en cuenta los avances recientes en el campo oncológico, como las terapias moleculares dirigidas y la SBRT.
La esperanza de vida ha cambiado durante la última década para algunos tumores, especialmente para los pacientes con carcinoma de células renales, cuya supervivencia mejoró entre 2005 y 2010, debido a tratamientos más actuales18. La histología del tumor, el estado funcional del paciente y la carga sistémica de la enfermedad guiarán al cirujano dentro del grupo multidisciplinar en el proceso de toma de decisiones. Entonces, para considerar el procedimiento en bloque, debe estar presente una oligometástasis de una histología con pronóstico favorable a largo plazo.
La introducción y difusión de la SBRT produjo un cambio significativo en la práctica clínica con respecto a las metástasis espinales; los tumores que antes eran radiorresistentes ahora son radiosensibles debido a las dosis más altas de radiación conformada que pueden administrarse de manera segura. En una revisión sistemática publicada en 200962, Bilsky informó que las tasas de control local después de una resección en bloque en comparación con SBRT fueron similares. Después de la resección en bloque, se observó una tasa de recurrencia local del 7,5% en una mediana de seguimiento de 16 meses. Para la SBRT, la falla del control radiológico o la progresión sintomática osciló entre el 6% y el 13% en una mediana de seguimiento comparable. Recientemente, sin embargo, se ha informado que el control local actual después de la SBRT para el carcinoma renal es del 82% a un año y del 68% a los 2 años. La supervivencia global actual a un1 año fue del 79% y disminuyó al 49% a los 2 años63.
Boriani et al. publican una artículo donde 25 pacientes fueron tratados con procedimiento en bloque por una metástasis solitaria. En el 52% de estos pacientes progresó la enfermedad o fallecieron a los 8-20 meses (32% de mortalidad a los 8 meses), lo que subraya nuestra incapacidad para seleccionar sobrevivientes a largo plazo, en quienes el control local hubiera sido beneficioso en caso de haber efectuado una resección en bloque64. Basándonos en estos datos, el Spine Oncology Study Group (SOSG) recomendó que una metástasis de carcinoma de células renales aislada sin compresión epidural debería someterse a SBRT como primera línea de tratamiento en lugar de una resección en bloque (recomendación fuerte). Si hay recurrencia local tras la SBRT y el paciente está bien sin otras metástasis, se puede considerar la resección en bloque debido al potencial de supervivencia a largo plazo. Para ser elegible para SBRT, la enfermedad epidural debe ser mínima para poder maximizar la dosis y evitar la toxicidad medular. La recurrencia local generalmente ocurre en el espacio epidural como consecuencia de la infradosificación35. Después de la SBRT, se observaron mayores tasas de fracaso con ESCC grado 2 y 3 por la progresión en el espacio epidural58. Otro requisito previo es que la lesión metastásica debe ser estable, ya que la SBRT no aborda la inestabilidad mecánica. La escala de SIMS es útil en su valoración65.
Aunque se ha enfatizado el enfoque en la resección en bloque para carcinoma de células renales y metástasis espinal aislada de tiroides, otras histologías pueden ser candidatas si ciertos factores están presentes. El tratamiento de la metástasis vertebral aislada por cáncer de tiroides también se ha informado con buenos resultados66. En una serie de 8 pacientes, al final del seguimiento (promedio de 6,4 años)66. En los pacientes con oligometástasis de cáncer de mama o una metástasis secretora funcional (por ejemplo, el feocromocitoma) se puede indicar en bloque según la relación riesgo/beneficio. No obstante, la decisión de proceder a una resección en bloque debe ser multidisciplinar, considerando todos los tratamientos posibles y las preferencias del paciente.
Los pacientes seleccionados para un procedimiento en bloque de la columna metastásica tienen, generalmente, menos comorbilidades que la población general. Por sí misma, la resección en bloque conlleva una morbilidad significativa. La mayoría de los estudios sobre resección en bloque incluyeron tumores de la columna tanto primarios como metastásicos, ya que este procedimiento es inusual. La tasa general de complicaciones para una ubicación móvil osciló entre el 13 y el 73,4% y la muerte relacionada con complicaciones entre el 0 y el 7,7%14,27,30. La experiencia del equipo en este tipo de procedimiento es determinante para reducir el porcentaje de las mismas. Amendola et al.15 informaron que la falla de hardware que requería revisión fue del 9,7%. La serie más grande sobre resección en bloque se ha publicado recientemente e informa sobre 220 pacientes (tumor óseo primario y oligometastásico)5. Creemos que el análisis de la reconstrucción explicaría dichas cifras, así como de los sistemas empleados para ello. El enfoque combinado, la quimioterapia y la radioterapia neoadyuvantes se asociaron con eventos adversos.
El impacto de una resección oncológica en la calidad de vida relacionada con la salud debe ser aceptable para el paciente, especialmente en la población de columna metastásica donde la esperanza de vida es generalmente reducida. Se pueden obtener resultados oncológicos aceptables después de una resección en bloque para metástasis espinales solitarias. Sin embargo, falta conocimiento sobre los resultados informados por los pacientes después de este tipo de procedimiento. Seleccionar al paciente correcto, para la operación correcta, es fundamental. Probablemente se pueda lograr una calidad de vida relacionada con la salud adecuada con una selección cuidadosa de los pacientes a través de un equipo multidisciplinario y un centro especializado con experiencia.
Goodwin et al.67 efectuaron una revisión tanto de enfermos como de la literatura, donde incluyeron a pacientes afectos con metástasis aisladas de tumores secretores (feocromocitomas, tumor carcinoide, coriocarcinoma, etc.). La resección en bloque supuso la cura de la situación metabólica, así como la disminución de la sintomatología, siendo para ellos el tratamiento ideal al evitar recurrencia local y efectos sistémicos. Los autores puntualizaron que la resección en bloque prevé las complicaciones de crisis hipertensiva intraoperatoria frecuentemente asociada al feocromocitoma tratado de forma intralesional. Informan que la resección en bloque parece ser una opción quirúrgica potencial para tratar la metástasis vertebral. Esta técnica es capaz de controlar las secuelas inducidas por el tumor, de modo que ofrece un control local del tumoral a largo plazo15,18,22,24.
De acuerdo con la clasificación de McDonnell, las principales complicaciones pueden incluir embolia pulmonar, neumotórax, insuficiencia respiratoria que precisa traqueotomía, infección, falla del hardware, paraplejía, hematomas, infarto de miocardio, lesiones aórticas u otras lesiones vasculares, trombosis venosa profunda, lesión intestinal y muerte. Las complicaciones menores incluyen necrosis de heridas superficiales, durotomías, seudomeningocele, lesiones vasculares menores, lesiones peritoneales, hematomas, eyaculación retrógrada, cifoescoliosis, insuficiencia respiratoria o pleuresía reactiva. Las tasas más altas de complicación se asocian con pacientes con recurrencia del tumor después de la escisión intralesional o la contaminación del espacio epidural o una cavidad corporal importante (50% en algunas series)27,38.
En otro estudio de Goodwin68, se asocian a supervivencia deficiente los resultados negativos de los receptores (HER2 y ER/PR), la DFI corta (<24 meses) y un alto grado de invasión de los ganglios linfáticos axilares en el cáncer de mama.
Históricamente, las metástasis espinales se han tratado con enfoques quirúrgicos invasivos (por ejemplo, resección en bloque), EBRT en dosis bajas, o ambos. Desafortunadamente, la resección en bloque, que se utiliza para lograr márgenes quirúrgicos claros, da como resultado una morbilidad sustancial del paciente y un control local deficiente a largo plazo5,7,8.
Este tipo de cirugías invasivas han disminuido en número e indicaciones en gran medida en instituciones con programas de columna multidisciplinarios debido a las altas tasas de complicaciones, y no recomendamos las resecciones en bloque como tratamiento paliativo de pacientes con metástasis espinales múltiples14.
En este estudio de Bandeira et al.69 defienden la resección en bloque de tumores espinales primarios o lesiones metastásicas como un procedimiento desafiante que se correlaciona con una alta tasa de complicaciones y, por lo tanto, debe ser realizado por cirujanos especializados. Dentro de un manejo multidisciplinario de los tumores espinales, es importante mejorar la integración entre la cirugía y otros tratamientos, enfocándose en el tiempo y la planificación adecuada, para reducir los riesgos y maximizar la eficacia de cada tratamiento.
A pesar de todos los riesgos, estos hallazgos confirman que la resección en bloque sigue siendo el procedimiento quirúrgico gold stand para pacientes seleccionados con el fin de lograr mejores tasas de supervivencia y un mejor control local de la enfermedad.
En este estudio del 201970, comentan que el pronóstico de las lesiones metastásicas después de la resección en bloque varía ampliamente según la patología primaria y el estado de la enfermedad sistémica. Realizaron una revisión en esta población donde se estimó que la supervivencia libre de enfermedad a 1, 5 y 10 años fue del 61,8, 37,5 y 0%, respectivamente. La supervivencia general no se definió para esa cohorte, pero otros estudios han estimado que la supervivencia media oscila entre 15 y 27 meses. Se ha informado que las tasas de recurrencia local después de la resección en bloque por metástasis son bajas (11%).
Siguiendo en este estudio, ratifican que tanto para las lesiones primarias como para las metastásicas, la radioterapia previa se identificó como un factor de riesgo de recurrencia local. Pudo deberse a cambios relacionados con la radiación en el tejido peritumoral, que dieron lugar a límites tumorales indiscriminados. El desgarro dural intraoperatorio y la tasa de ocupación tumoral>50% del conducto raquídeo también predijeron una recurrencia local futura.
Informaron que las tasas de recurrencia fueron más altas en los casos de reintervención y si se realizan en un centro no terciario15,45.
De manera general, la resección en bloque conlleva una mayor tasa de complicaciones en comparación con la resección intralesional. Las instituciones que han comenzado a realizar resecciones en bloque publican tasas de complicaciones de hasta el 76%23, lo que destaca la importancia de la comodidad del cirujano al realizar este procedimiento. Demuestran que varios factores operativos afectan la tasa de complicaciones. El abordaje combinado anteroposterior aumenta de forma independiente la incidencia de complicaciones mayores y menores en comparación con un abordaje solo posterior. Este hallazgo no es sorprendente dada la probabilidad del uso de un procedimiento combinado en aquellos casos con una dificultad anatómica más compleja, una mayor pérdida de sangre asociada y una mayor morbilidad. La cirugía previa o la biopsia abierta también parecen conferir un mayor riesgo de complicaciones mayores, tal como lo define la clasificación de McDonnell. La radioterapia previa aumenta las tasas de infección, pero no la tasa general de complicaciones. Un mayor número de niveles también aumenta el riesgo de complicaciones, lógico mayor procedimiento.
Tumores metastásicos de la columna (consideraciones por etiología)Las metástasis espinales representan el tipo más común de tumor de la columna vertebral y ocurren con una frecuencia 20 veces mayor que las neoplasias espinales primarias47. La columna vertebral es el sitio más común de metástasis esqueléticas, con lesiones del esqueleto axial que representan aproximadamente el 39% de todas las metástasis óseas27. La compresión de la médula secundaria a metástasis espinales ocurre en un 5-10% de todos los pacientes con cáncer y hasta en un 40% de los pacientes con metástasis óseas no espinales existentes48. Posteriormente, las metástasis espinales representan una fuente importante de dolor y discapacidad, y una oportunidad potencial para la intervención quirúrgica y la mejora de la calidad de vida. A pesar de la prevalencia de metástasis espinales, existe escasez de datos que evalúen la eficacia de la resección en bloque en esta población de pacientes.
Los cánceres de mama, próstata y pulmón representan clásicamente los tumores primarios más comunes con propensión a metástasis a la columna ósea49. Se ha informado que la resección en bloque es una opción quirúrgica apropiada con una selección adecuada de los pacientes y un estado favorable de la enfermedad sistémica13,14,15,50. Sin embargo, la carga sistémica de la enfermedad oncológica a menudo determina la morbilidad y la mortalidad en esta población. Por lo tanto, es posible que los beneficios de una técnica agresiva de resección en bloque no siempre superen los riesgos, y es imperativo tener en cuenta todas las características del paciente para determinar la extensión óptima de la resección.
Un análisis reciente de 91 pacientes que se sometieron a una resección en bloque por lesiones metastásicas de la columna demostró una tasa de recurrencia local del 11%, con una duración media de seguimiento de 27,4 meses (rango, 4-66 meses)16. Se encontró que un historial de radioterapia previa (p=0,04), desgarro dural intraoperatorio (p=0,03) y una tasa de ocupación tumoral>50% del canal espinal (p=0,02) predecían una recurrencia local futura. Sakaura et al.6 estudiaron a 12 pacientes a los que se les realizó resección en bloque de metástasis torácicas solitarias. La resección en bloque proporcionó control a largo plazo a varios pacientes dentro de su cohorte, con 7 pacientes que sobrevivieron durante un promedio de 61 meses10. Del mismo modo, Huang et al.17 informaron recientemente los resultados de 9 resecciones en bloque para metástasis solitarias en la columna lumbar51. Cinco pacientes permanecieron libres de enfermedad en el momento del seguimiento más reciente (seguimiento medio de 41,2 meses). Otro análisis demostró que la supervivencia promedio después de la resección en bloque es de 15 meses para pacientes con lesiones metastásicas, en comparación con 47,6 meses en pacientes con tumores espinales primarios23. Los beneficios de la resección en bloque, por lo tanto, pueden ser menos dramáticos en una población metastásica, pero no son despreciables.
La resección en bloque puede brindar un beneficio particular a los pacientes con metástasis radiorresistentes. Clásicamente, los carcinomas renales, hepatocelulares, de colon, de tiroides y de pulmón de células no pequeñas y el melanoma se consideran menos sensibles a la radioterapia52. Incluso en una era de radiocirugía cada vez más precisa, el espacio epidural y la médula espinal representan estructuras importantes que limitan la dosis, y las dosis terapéuticas para estos tipos de tumores pueden no ser alcanzables en la columna vertebral. Sin radiación como complemento útil para estas lesiones, la resección en bloque puede brindar una mejor oportunidad de control local que una resección más conservadora. Series de casos han descrito previamente la eliminación exitosa en bloque de carcinomas de células renales, de células no pequeñas, de tiroides y hepatocelulares24,53–56.
En el estudio de Satoshi, Murakami y Demura71, los pacientes del grupo de escisión completa sobrevivieron significativamente más que los del grupo de escisión incompleta (supervivencia a los 5 años: 84% frente al 50%; supervivencia a los 10 años: 52% frente al 8%). Los resultados sugieren considerar la resección quirúrgica completa de las metástasis vertebrales por carcinoma tiroideo, incluso en pacientes con coexistencia de metástasis pulmonares. La extirpación completa de tumores espinales, TES (total en bloc spondilectomy), es una cirugía compleja y técnicamente exigente para los cirujanos de columna. La experiencia del grupo de Satoshi no puede extenderse a todos los centros quirúrgicos, por lo que recomiendan que esta cirugía sea realizada en centros especializados en tumores de columna y por cirujanos con mucha experiencia.
Los resultados del estudio realizado por el grupo de trabajo de Lador y Gasbarrini72 mostraron que los pacientes tratados con escisión completa sobrevivieron significativamente más que los del grupo de escisión incompleta, y que todos los sobrevivientes a largo plazo en el grupo de escisión incompleta experimentaron recurrencia del tumor con el consiguiente deterioro del estado funcional. Por lo tanto, la resección quirúrgica completa de las metástasis solitarias de columna es factible y tiene el potencial de mantener el estado funcional así como de prolongar la supervivencia.
El artículo escrito por Satoshi, Murakami y Demura en el 2016 remarca que la metástasis espinal se considera un indicador negativo de la supervivencia global debido a la dificultad de la resección quirúrgica.
Las mejoras en las técnicas quirúrgicas junto con la embolización preoperatoria, en las últimas 2 décadas, han logrado excelentes resultados clínicos, con baja morbilidad.
Hasta la fecha del estudio, en 2016, no había ningún estudio que evaluara los resultados clínicos de la resección quirúrgica curativa en las metástasis vertebrales que surgen de los carcinomas de células renales. Este estudio tuvo como objetivo examinar la supervivencia de los pacientes que se sometieron a este procedimiento para esta enfermedad, con el fin de proponer una estrategia de tratamiento eficaz basada en un análisis de los posibles factores pronósticos.
Se incluyeron 36 pacientes (26 hombres y 10 mujeres) con una edad media de 58,6 años. Las indicaciones quirúrgicas para la metastasectomía de las lesiones de la columna se basaron en los siguientes criterios: metástasis solitaria en la columna, factibilidad quirúrgica (el tumor afectó a 3 niveles espinales consecutivos), operabilidad (estado funcional del Eastern Cooperative Oncology Group [ECOG PS] 3) y enfermedad estable sin otras metástasis o con un número limitado de metástasis. Dieciocho pacientes, el 50%, tenían metástasis espinales cuando se diagnosticó el carcinoma de células renales primario o estaban dentro del primer año tras del diagnóstico (metástasis sincrónica). El intervalo medio libre de enfermedad entre la resección primaria del riñón y el diagnóstico de metástasis espinales fue de 27,9 meses (0-132 meses); mientras que el intervalo medio entre la resección primaria del riñón y la resección de las metástasis espinales fue de 35,7 meses (0-146 meses).
La resección quirúrgica como tratamiento de la recurrencia del tumor después de la irradiación de las metástasis vertebrales se realizó en 10 pacientes (27,8%). La dosis media de radiación fue de 47,5Gy y la duración media entre la irradiación y la cirugía fue de 9,6 meses. Para los pacientes con una metástasis vertebral solitaria en el momento de la cirugía, las tasas de supervivencia específica de cáncer a los 3, 5 y 10 años fueron del 84,6; 76,2 y 76,2%, respectivamente. Para los pacientes con una metástasis espinal solitaria y metástasis pulmonares en el momento de la cirugía, las tasas de supervivencia específica de cáncer a los 3, 5 y 10 años fueron del 72,7, 54,5 y 27,3%. No hubo recurrencia tumoral local en ninguno de los 36 pacientes durante los períodos de seguimiento.
Motzer et al.73 describieron 5 factores pronósticos que marcaban una supervivencia reducida: estado funcional de Karnofsky<80%, nivel de lactato deshidrogenasa sérica>1,5 veces el límite superior del rango normal, nivel de hemoglobina en el rango normal inferior (13,5g/dl en hombres y 11,0g /dl en mujeres), nivel de calcio sérico corregido>10mg/dl, y tiempo desde el diagnóstico inicial del carcinoma de células renales hasta el inicio de la administración de interferón-alfa superior a un año.
Realizaron el estudio dividiendo a los pacientes en 3 grupos de riesgo: riesgo favorable (sin factores de riesgo), riesgo intermedio (uno o 2 factores de riesgo) y riesgo elevado (más de 3 factores de riesgo). Solo la presencia de metástasis hepáticas se asoció significativamente con la supervivencia a corto plazo después de la metastasectomía espinal (p<0,001).
El riesgo elevado o intermedio según los criterios de Motzer (P1/4 0.067) y la presencia de metástasis en los ganglios linfáticos (P1/40.078) estuvieron asociaciones con la supervivencia a corto plazo. Por el contrario, la tasa de supervivencia a los 3 años fue del 72,7% para los pacientes con metástasis pulmonares en el momento de la metastasectomía espinal. Por lo que apoyaron la idea de que la metastasectomía de una lesión vertebral solitaria en estos pacientes es adecuada. Los resultados que obtuvieron indican que la resección de las metástasis raquídeas puede prolongar la supervivencia en los pacientes previamente seleccionados.
La razón más probable de la supervivencia prolongada es la resección con intención curativa de las metástasis espinales que comprometen indubitablemente el estado funcional del paciente, es más procedimiento quirúrgico (fig. 2).
Las tasas de supervivencia de cáncer a 5 y 10 años para pacientes que se sometieron a resección quirúrgica curativa de metástasis espinales solitarias que se originaron por carcinoma de células renales fueron 69 y 58%. Las metástasis hepáticas se asociaron con una supervivencia a corto plazo, no así las metástasis pulmonares. Para los pacientes previamente, seleccionados, la metastasectomía vertebral puede potencialmente prolongar la supervivencia.
En el siguiente estudio Are older patients with solitary spinal metastases fit fot total en -bloc surgery?74 e investigó TES en 78 pacientes con metástasis vertebrales solitarias. Para ello los dividieron en 2 grupos, el grupo A (>65 años, n=32) y el grupo B (<60 años de edad, n=46). No hubo diferencias significativas entre los 2 grupos en cuanto a la duración de la cirugía, la pérdida de sangre, la transfusión de sangre o la duración de la estancia hospitalaria (p>0,05). La tasa de complicaciones perioperatorias en el grupo A fue mayor que en el grupo B (p<0,05).
Observaron que los pacientes de mayor edad pueden experimentar tasas de supervivencia y recurrencia local similares a las de los pacientes más jóvenes, tratados con TES. La calidad de vida y el deterioro neurológico de los pacientes que recibieron TES mejoraron y se alivió el dolor. A pesar de que los pacientes mayores tienen un mayor riesgo de complicaciones perioperatorias, este factor no parece conducir a resultados adversos graves. Los pacientes mayores siguen siendo buenos candidatos para recibir TES para curar la metástasis solitaria después de una preparación selectiva, cuidadosa y estricta.
El tipo de tumor, en lugar de la edad, sí influyó en la supervivencia de los pacientes tras la cirugía, lo que también respalda los resultados del análisis de supervivencia.
El tiempo medio de supervivencia de los 2 grupos que se sometieron a TES fue de 20,6 y 23 meses, respectivamente, lo que significa una supervivencia más prolongada que con la cirugía paliativa (8,9.10,6 meses).
En el caso de pacientes con metástasis espinales secretoras, la resección en bloque puede proporcionar una opción quirúrgica excepcionalmente útil. Esta técnica ha sido descrita en el marco de feocromocitoma, carcinoide, paraganglioma, coriocarcinoma y tumores mesenquimatosos fosfatúricos secretores del factor de crecimiento de fibroblastos15,57–59. Estos tipos de tumores pueden beneficiarse únicamente de la resección en bloque, ya que este enfoque teóricamente elimina la capacidad funcional de las lesiones y proporciona un mejor control de los síntomas en comparación con una resección subtotal60.
Finalmente, se ha demostrado que varios tipos de tumores raros son susceptibles de resección en bloque. Se han informado casos de resultados óptimos a largo plazo en carcinoma epitelial-mioepitelial metastásico61, carcinoma de células renales de la columna vertebral24, leiomiosarcoma62, osteosarcoma metastásico75 y carcinoma de células acinares, entre otros. Sin embargo, debido a la rara naturaleza de estos tipos de tumores en el contexto de las metástasis vertebrales, poco se puede concluir definitivamente sobre la superioridad general de la resección en bloque en estos casos.
ConclusionesLa resección en bloque mejora el control local sobre la resección intralesional para lesiones agresivas primarias4,12,20,21,31. La mejora asociada en la supervivencia general puede justificar el aumento de la morbilidad de la cirugía, ya que estos tipos de tumores tradicionalmente responden mal a las opciones de tratamiento adyuvante.
En bloque puede ser una técnica apropiada para lesiones metastásicas cuidadosamente seleccionadas, como tumores secretores de hormonas y tumores radiorresistentes solitarios, pero debe considerarse en el contexto del estado de la enfermedad sistémica del paciente y la morbilidad de la cirugía13–15,50.
Las tasas de complicaciones son más altas después de la resección en bloque en comparación con las técnicas de resección convencionales76.
Los pacientes que se consideran para resección en bloque pueden ser mejor manejados por cirujanos especializados en centros terciarios de alto volumen23–25.
La resección en bloque, Amy Yao et al. la recomiendan para pacientes con pronóstico favorable, mientras que la resección paliativa y citorreductora se sugiere para pacientes con pronóstico medio y malo. La resección en bloque tuvo el tiempo de supervivencia postoperatoria promedio más alto en los estudios revisados, mientras que la resección paliativa tuvo el más bajo.
Tras la revisión de la bibliografía hasta la fecha de la publicación de este artículo se puede concluir que los datos apoyan que la recurrencia local es la peor complicación, porque afecta de manera negativa a la calidad de vida y al pronóstico de la enfermedad.
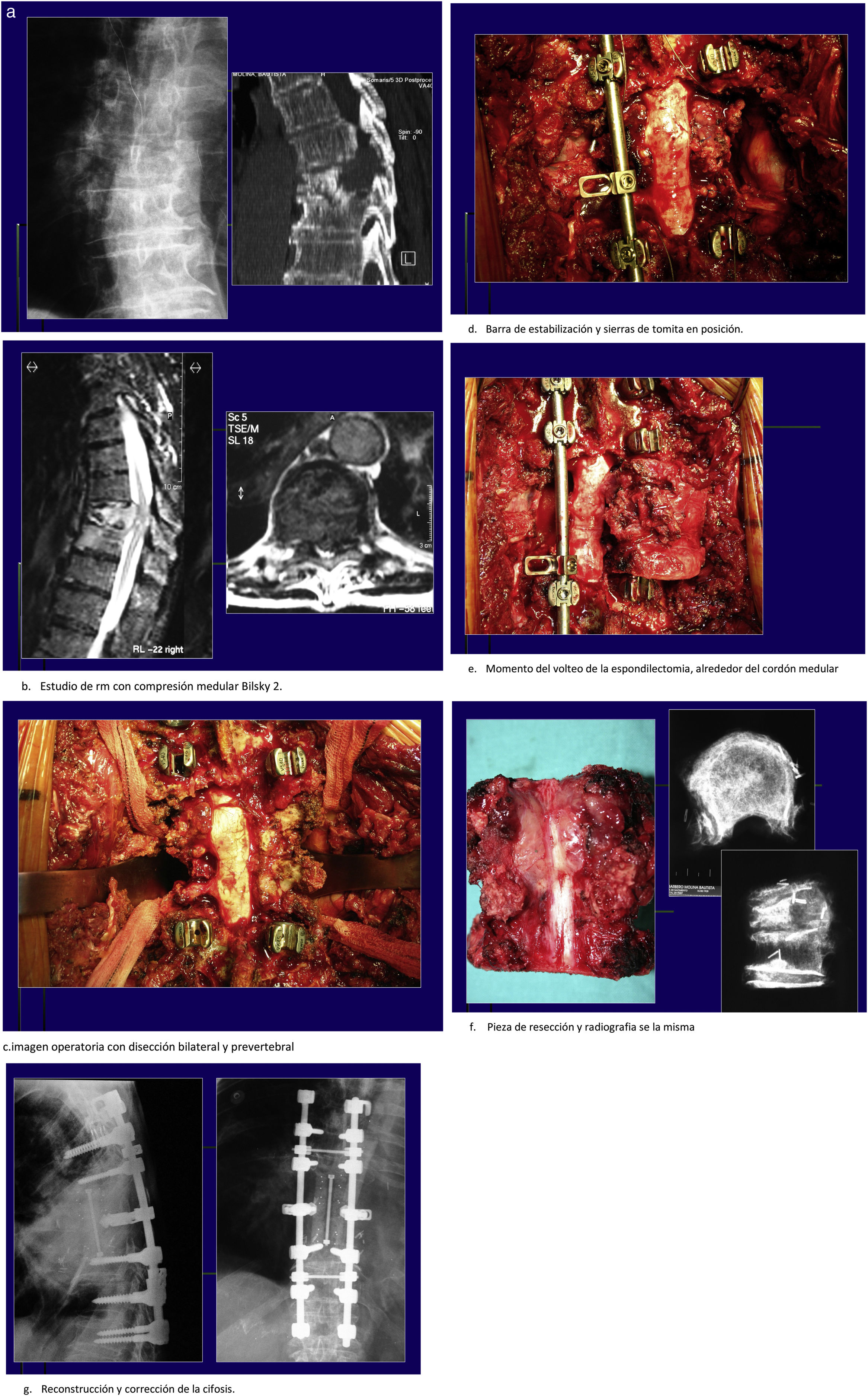
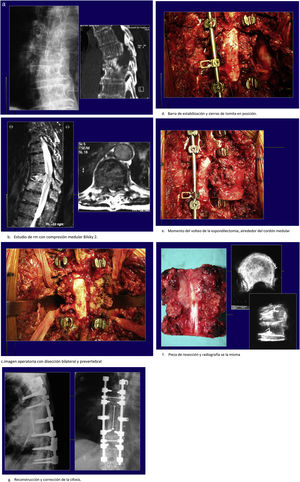
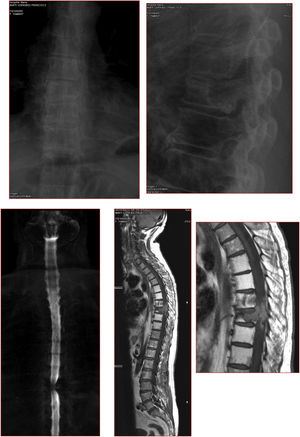
Caso clínicoPaciente de 75 años, con pérdida de la función neurológica en pocos días. Frankel C. Diagnosticado de carcinoma renal hace 3 años. Presenta fractura patológica a nivel de T7-T8. Estudio de extensión negativo (fig. 3).
Caso clínico de paciente. Estudio de extensión negativo.
a. Radiografía y tomografía computarizadas con fractura y cifosis tras fractura patológica.
b. Estudio de resonancia magnética con compresión medular Bilsky 2.
c. Imagen operatoria con disección bilateral y prevertebral.
d. Barra de estabilización y sierras de tomita en posición.
e. Momento del volteo de la espondilectomía, alrededor del cordón medular.
f. Pieza de resección y radiografía de la misma.
g. Reconstrucción y corrección de la cifosis.
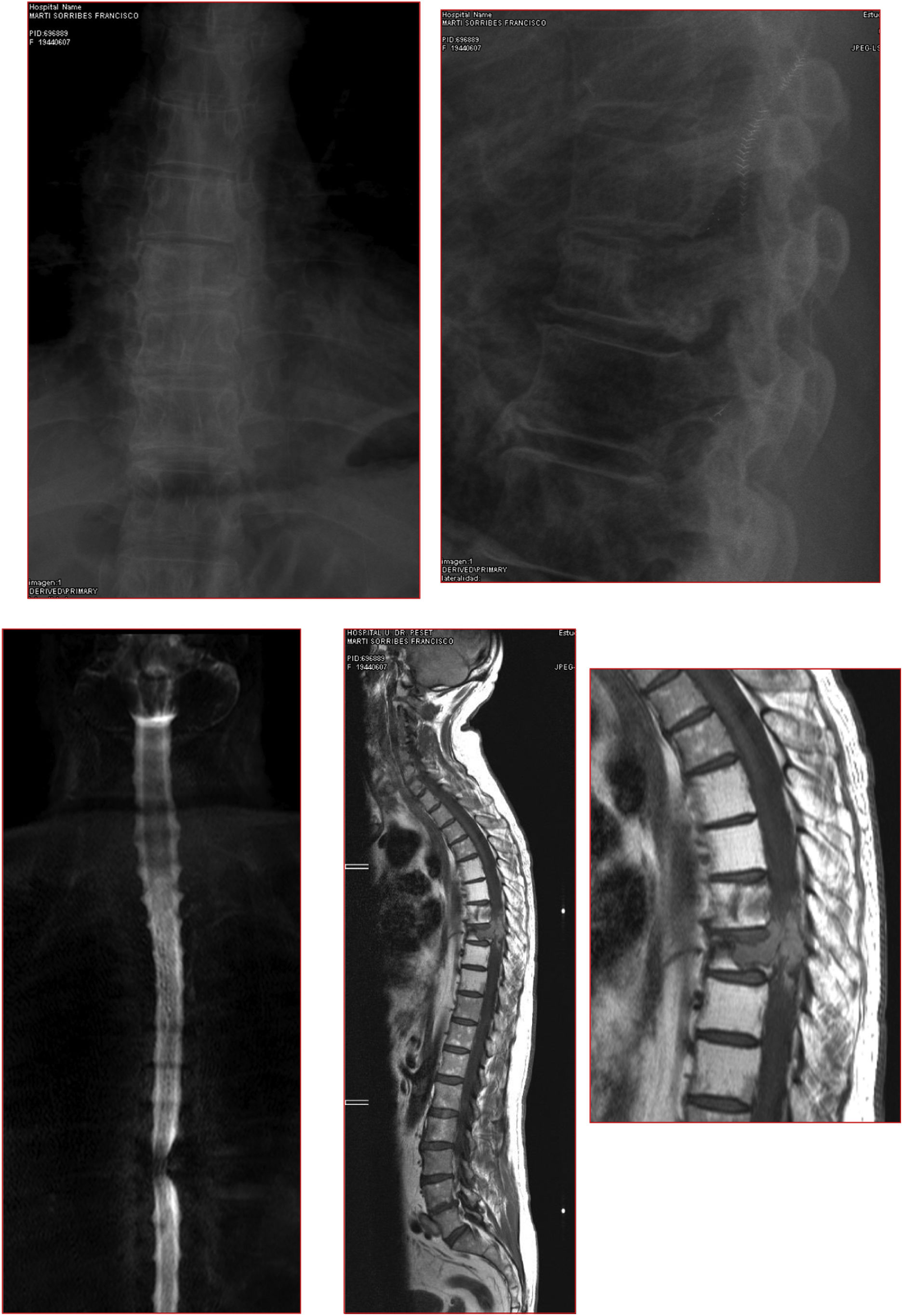
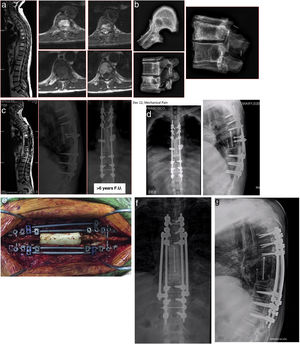
Varón de 65 años, diagnosticado de síndrome de Gilbert. Presenta nefrectomía en el 2006 por carcinoma renal. En el preoperatorio tiene una Cr de 1,36mg/dL. Presenta metástasis a nivel T7-T8 tratada hace un año con radioterapia, nueva progresión. Hipotiroidismo posradioterapia. CPAP nocturno (fig. 4).
Caso clínico. CPAP nocturno.
a. Radiografías y resonancias magnéticas que muestra los cambios tras RT, recurrencia de la lesión con compresión medular y de extremidad proximal de los arcos costales izquierdos.
b. Pedículo derecho libre, pars libre izquierda, niveles de descompresión. Al encontrarse fracturados, el nivel estimado libre de enfermedad, debe incluir los platillos adyacentes.
c. Radiografía de la pieza de resección de T7-8, extremidad proximal de costillas incluidas en la resección.
d. Estudio de seguimiento a 6 años.
e. Rotura de las barras, posiblemente, como consecuencia de la RT, no fusión anterior.
f. Cirugía de revisión, estabilización con 4 barras.
g. Ocho años. Años de evolución desde la primera intervención.
Nivel de evidencia I.
Conflicto de interesesNo hay conflicto de intereses.