Introducción
El hierro en el cuerpo humano es fundamental para el buen funcionamiento del organismo, pues forma parte de numerosas enzimas que regulan diversos procesos y rutas metabólicas, además de participar específicamente en el transporte de oxígeno.
La anemia ferropénica es una enfermedad de origen multifactorial en la que la dieta, los factores genéticos y los hábitos de vida son muy relevantes. La deficiencia de hierro es el paso previo a la aparición de la anemia ferropénica, cuyos síntomas resultan en muchas ocasiones inespecíficos, y el diagnóstico, aunque relativamente sencillo, no siempre se realiza a tiempo1.
Una de las principales causas de la deficiencia de hierro es que la cantidad de este mineral que se absorbe procedente de la dieta no es suficiente para cubrir las necesidades del organismo. Los expertos estiman que la cantidad de hierro aportada por la dieta es adecuada para la población general si supera los 18 mg diarios, que es la ingesta diaria recomendada para las mujeres jóvenes2.
Por otro lado, la absorción de hierro depende en primer grado de la fisiología del individuo, es decir, del estado de los depósitos de hierro del organismo3. Igualmente, la absorción de hierro puede estar condicionada por la biodisponibilidad de este micronutriente en la dieta, principalmente debido a la proporción de hierro en forma hemo (alta disponibilidad) o en forma no hemo (baja disponibilidad) que contengan las dietas3 y por la presencia en éstas de otros componentes de los alimentos que favorezcan o inhiban su absorción4. La mayor parte del hierro ingerido es no hemo, cuya absorción está muy condicionada por otros componentes de los alimentos que pueden ser tanto potenciadores como inhibidores. Entre los potenciadores destacan el ácido ascórbico y un compuesto de origen peptídico denominado "factor carne", el cual está presente en carnes rojas, pero también en otros alimentos de origen animal como el pescado y las aves. Respecto a los inhibidores de la absorción de hierro no hemo, se encuentran los fitatos, los oxalatos, los fosfatos y los carbonatos4.
Hierro: distribución, funciones y regulación
El cuerpo humano contiene entre 40 y 50 mg de hierro por kg de peso, de los cuales el 75% está destinado a cubrir funciones metabólicas y el 25% restante se encuentra almacenado formando parte de la ferritina y la hemosiderina5; su función metabólica esencial es el transporte de oxígeno. Algunas enzimas que contienen hierro hemo, como las catalasas y peroxidasas, intervienen en reacciones redox. El hierro no hemo también forma parte de otras enzimas presentes en rutas metabólicas esenciales para el organismo5.
En lo relativo a la regulación del contenido de hierro en el organismo, el cuerpo humano debe mantener cantidades de hierro estables, ya que tanto la deficiencia de hierro como el exceso (hemocromatosis) producen efectos dañinos para el organismo. En el caso de la deficiencia de hierro, estos efectos remiten cuando se vuelve a alcanzar concentraciones séricas de hierro y ferritina normales. El principal medio de regulación del contenido de hierro en el organismo es la absorción del hierro, ya que no existen medios de control de excreción de este mineral3. En sujetos con concentraciones de hierro normales, se reducirá la absorción de hierro, mientras que en personas con deficiencia de hierro, la absorción se verá incrementada. El mecanismo regulador de la absorción del hierro se encuentra aún en estudio, pero parece ser que están implicadas varias hormonas y proteínas, entre las que destacan la ferroportina, proteína transportadora que permite la salida del hierro del enterocito, y la hepcidina, que controla la acción de la ferroportina favoreciendo o inhibiendo la salida de hierro desde el enterocito y el macrófago hacia el plasma. La síntesis de esta hormona circulante se realiza en el hígado6 y el contenido de hierro en plasma puede inducir o inhibir su síntesis7. Cuando no es necesario el aporte de hierro al organismo desde los enterocitos, la hepcidina se expresa y se une a la ferroportina y hace que ésta se internalice y se degrade, con lo que se inhibe la salida de hierro del enterocito8,9.
Deficiencia de hierro y anemia
Desde el punto de vista clínico, la anemia ferropénica se define como una concentración insuficiente de eritrocitos maduros circulantes en sangre10. La OMS la define, en términos de salud pública, como una concentración de hemoglobina < 2 desviaciones estándar de la media de la población11, lo que corresponde a una concentración de hemoglobina en mujeres jóvenes < 11 g/dl y en niños, < 12 g/dl. Los varones no suelen sufrir deficiencia de hierro o anemia ferropénica; de hecho, en sus sucesivos informes, la OMS no proporciona datos para este grupo, aunque el punto de corte se fija en valores < 14 g/dl.
Con mayor prevalencia que la anemia, se encuentra la deficiencia de hierro. La OMS, en su informe de 2001, la define como un estado en que no existen depósitos movilizables de hierro en el organismo y se observa que el aporte de hierro a tejidos está afectado, incluido el de la formación de eritrocitos. Las etapas avanzadas de la deficiencia de hierro se asocian con la anemia ferropénica. La deficiencia de hierro se diagnostica cuando uno o más parámetros indicadores del estado de hierro se encuentran alterados. Uno de los más comunes es el descenso en la concentración de ferritina, que es el depósito de hierro del organismo. Se considera que hay deficiencia de hierro cuando los valores de ferritina en personas mayores de 5 años de edad son < 15 mg/dl y en niños menores de 5 años cuando los valores se sitúan por debajo de 12 mg/dl11.
Prevalencia de la anemia en el mundo
La anemia ferropénica es un problema de salud pública mundial y una de las enfermedades nutricionales más importantes. Un elevado porcentaje de mujeres, tanto en países desarrollados como en países en vías de desarrollo, se ven afectadas por esta enfermedad. Así, según la OMS11, la prevalencia de la anemia por deficiencia de hierro en mujeres de países desarrollados es del 10%, mientras que se cuadruplica entre las mujeres de países en vías de desarrollo.
En Europa se estima que la prevalencia de la deficiencia de hierro en mujeres jóvenes oscila entre el 8 y el 33%12, y aunque en España no se dispone de datos contrastados sobre la prevalencia de esta carencia nutricional, las estimaciones son del mismo orden.
Causas de la anemia ferropénica y principales grupos de riesgo
La causa más frecuente de la anemia ferropénica es la deficiencia de hierro. Cuando se establece que la causa de la anemia es el déficit de hierro, debe investigarse a su vez la causa de esta disminución13.
Las causas de la anemia ferropénica pueden clasificarse por su mecanismo de producción14:
- Por aumento de los requerimientos: durante el primer año de vida, la adolescencia o el embarazo. También los requerimientos están aumentados cuando hay un aumento de las pérdidas (p. ej., debido a la menstruación u otro tipo de hemorragias).
- Por aporte insuficiente: alteraciones de la absorción como síndromes de mala absorción o resecciones del tubo digestivo. También cuando el aporte a través de la dieta es insuficiente o las reservas son insuficientes en el nacimiento por prematuridad, hemorragia intrauterina, etc.
Por todo esto, los principales grupos en riesgo de anemia ferropénica son las mujeres jóvenes (edad fértil), los niños y, aunque en menor medida, las personas de edad avanzada. También debería tenerse en cuenta como grupo de riesgo a los individuos que consumen dietas veganas, con ausencia total de productos de origen animal, lo cual puede ser un factor de riesgo de deficiencia de hierro15.
Consecuencias de la anemia ferropénica para la salud
La deficiencia crónica de hierro suele desembocar en anemia ferropénica, y ésta se refleja en la disfunción de diversos órganos y sistemas corporales. Esta carencia puede afectar al desarrollo cognitivo y psicomotor en niños y adolescentes y al estado del sistema inmunitario16-18. También aumenta el riesgo de sufrir procesos infecciosos19 y afecta al rendimiento de la actividad física y la capacidad de trabajo, debido a la alteración de fuentes energéticas por el músculo20.
Los pacientes con deficiencia de hierro presentan alteraciones en las funciones gastrointestinales y en los patrones de producción hormonal y el metabolismo21.
La anemia durante el embarazo aumenta el riesgo de muerte perinatal en la madre y el neonato, además de incrementar el riesgo de mortalidad infantil22. Incluso se ha relacionado que la madre tenga anemia ferropénica con un mayor riesgo de depresión posparto y un descenso en la interacción madre-hijo23,24.
Tratamiento de la anemia ferropénica
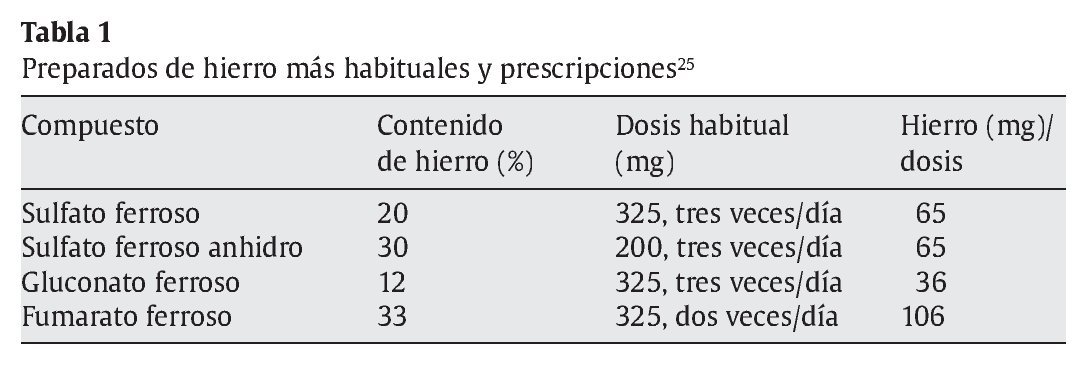
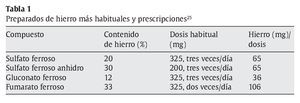
Una vez que se ha diagnosticado la anemia ferropénica, el tratamiento consiste generalmente en la prescripción de suplementos de hierro por vía oral (tabla 1). La forma más utilizada son los comprimidos de sulfato ferroso25, por ser el compuesto que produce menos efectos adversos (dolor abdominal, ardor de estómago, náuseas, diarrea y estreñimiento). Se ha observado que los complejos y las formas queladas de hierro reducen en gran medida los síntomas gastrointestinales25.
Entre los complejos de hierro estudiados más recientemente, destaca un complejo de hierro-inulina26. La inulina es un fructooligosacárido natural con propiedades potenciadoras de la absorción del hierro. El quelato de glicinato ferroso también se ha estudiado, aunque los resultados obtenidos hasta el momento en cuanto a su eficacia como vehículo de hierro son contradictorios27-29. En general se estima que, tras 12 semanas con tratamiento oral de compuestos de hierro, el organismo vuelve a valores normales. Cuando esto no ocurre, cabe sospechar una infección por Helicobacter pylori o gastritis crónica30-32.
En pacientes con intolerancia al tratamiento oral con hierro o que no responden a él, se procede a la terapia de hierro parenteral33. Tradicionalmente se ha evitado la terapia parenteral con hierro, principalmente por los riesgos de shock anafiláctico potencialmente elevados34. En la actualidad, los compuestos que más se utilizan son los dextranos de hierro de alto y bajo peso molecular, el gluconato férrico y la sacarosa ferrosa en pacientes con insuficiencia renal crónica25.
Biodisponibilidad del hierro
Factores dietéticos
La dieta es uno de los principales factores que pueden influir en el estado de hierro de un individuo sano, ya que tanto el contenido de hierro de los alimentos como su naturaleza condicionan su absorción intestinal. El hierro se absorbe casi exclusivamente por el intestino, más concretamente en la zona proximal del duodeno, y se diferencian dos vías de absorción dependiendo de la forma de hierro. El hierro hemo se absorbe fácilmente por los enterocitos y está presente sólo en alimentos de origen animal, como carnes rojas, pescados y aves; aun en éstos, el contenido no suele superar el 40% del hierro total, y el resto es hierro no hemo35. La tasa de absorción del hierro hemo es mayor, ya que sigue una ruta de absorción intestinal distinta y no está condicionada por la presencia de inhibidores o potenciadores de la absorción3,4.
El hierro no hemo se encuentra en nuestra dieta en un porcentaje mucho más elevado, aunque su absorción es menor y depende fundamentalmente de los depósitos de hierro del individuo36. El hierro no hemo procedente de los diferentes alimentos forma un pool en el estómago y luego pasa al intestino. Para una mejor absorción, este hierro necesita dos condiciones: un medio ácido y que esté en forma ferrosa (Fe2+). El medio ácido ya lo tiene en el estómago y en la zona del duodeno, concretamente en la zona apical del enterocito; la enzima ferrorreductasa reduce el Fe3+ a Fe2+ 3,4.
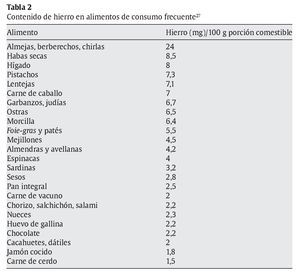
El hierro no hemo también se halla en carnes, pescados y aves, pero fundamentalmente en huevos, granos, verduras y frutas (tabla 2).
Ingestas recomendadas
En España, para mujeres entre 10 y 49 años, la recomendación se establece en 18 mg diarios37, mientras que en niñas y niños menores de 10 años, la cantidad es de 9 mg diarios. En cuanto a niños mayores de 10 años, la cantidad recomendada de hierro es 12 mg y en chicos jóvenes hasta 19 años es de 15 mg, coincidiendo con la etapa del crecimiento y el desarrollo puberal. En los varones jóvenes, la ingesta recomendada se establece en 10 mg de hierro diarios, casi la mitad de lo que necesitan las mujeres en el mismo tramo de edad. Esto se debe fundamentalmente a que no tienen una periódica pérdida de hierro por la menstruación.
Componentes de los alimentos que modifican la absorción de hierro
Algunos de los componentes de los alimentos pueden potenciar o inhibir la absorción del hierro dietético. Los potenciadores de la absorción del hierro más conocidos y eficaces son el ácido ascórbico y los alimentos de origen animal como carnes, pescados y aves ("factor carne"). También potencian la absorción del hierro algunos ácidos orgánicos como el ácido cítrico, el málico, el tartárico y el láctico.
Por lo que respecta a los inhibidores de la absorción de hierro dietético, la mayoría son compuestos presentes en alimentos de origen vegetal, de los que destacan los fitatos presentes en la fibra, algunos polifenoles, los oxalatos e incluso algunos minerales como el calcio.
Potenciadores de la absorción de hierro:
- Ácido ascórbico: a día de hoy se considera que el ácido ascórbico es el mayor potenciador de la absorción de hierro no hemo y actúa por diferentes vías. La vitamina C favorece la existencia de un medio ácido en el estómago, reduce la forma férrica del hierro a ferrosa, que es más soluble, forma quelatos solubles con el hierro en el estómago y mantiene la solubilidad del hierro no hemo cuando el alimento entra en el medio alcalino del intestino38,39.
- Carnes, pescados y aves: los componentes de estos alimentos aumentan la absorción de hierro no hemo y, a diferencia de otros potenciadores, además aportan hierro hemo. La capacidad de estos tres grupos de alimentos para fomentar la biodisponibilidad se debe, concretamente, a las proteínas de los músculos, y no a la proteína animal en general40-42.
- Otros ácidos orgánicos: ácidos orgánicos como los ácidos cítrico, málico, tartárico y láctico también potencian la absorción de hierro no hemo43,44.
Inhibidores de la absorción de hierro:
- Fitatos: aunque estudios iniciales indicaban que la fibra dietética podía inhibir la absorción del hierro45,46, estudios más recientes muestran que la fibra soluble no influye sustancialmente en su absorción47. El consenso entre varios estudios sobre el tema parece indicar que más bien es el elevado contenido en fitatos de los vegetales, y no la fibra dietética, lo que produce un efecto inhibidor de la absorción de hierro48,49.
- Polifenoles como los taninos del café y el té se unen al hierro no hemo para formar complejos insolubles, con lo que se reduce su absorción43,48. En cuanto a los polifenoles presentes en alimentos vegetales, legumbres y condimentos, también tienen un potente efecto inhibidor de la absorción de hierro43. Verduras como espinacas, lentejas y remolachas tienen un elevado contenido en polifenoles y una baja disponibilidad de hierro50.
- Calcio: aunque es conocido que el calcio puede reducir la absorción de hierro, los numerosos estudios realizados hasta el momento han obtenido resultados dispares, lo que lleva a pensar que las interacciones calcio-hierro son complejas51,52.
Alimentos funcionales y mejora de la absorción de hierro
Otra estrategia de prevención de la deficiencia de hierro es la fortificación de alimentos. Los alimentos funcionales están siendo una buena alternativa para intentar prevenir diferentes carencias nutricionales, como la deficiencia de hierro53. La fortificación de alimentos con compuestos de hierro puede ser, por lo tanto, una estrategia bastante útil para incrementar la ingesta de hierro en poblaciones con mayores requerimientos de este nutriente; de hecho, la fortificación con hierro es la más común en los alimentos infantiles industriales54.
También se añade hierro a los cereales durante el molido de la harina. Todavía de un modo experimental, también se ha logrado enriquecer otros alimentos como el azúcar, la sal y la salsa de soja, que pueden ser buenos vehículos para el hierro53,55,56.
Uno de los principales problemas a los que se enfrenta la industria agroalimentaria a la hora de fortificar los alimentos con compuestos de hierro es el riesgo de que sufran modificaciones organolépticas que hagan que el consumidor no los acepte53, por lo que la investigación en los últimos años se ha centrado en optimizar los compuestos de hierro utilizados en la fortificación favoreciendo su inclusión en el alimento a la vez que se mejora la biodisponibilidad de este micro-nutriente53,55-57. Se han obtenido éxitos notables mediante la micro-encapsulación de las sales de hierro55-57 o combinando dichas sales con otros compuestos protectores como las fitasas54.
El contenido de hierro en los alimentos fortificados suele situarse por encima del 15% de la ingesta diaria recomendada por porción o cada 100 g del alimento, y puede llegar hasta el 100% de la ingesta recomendada58. Se ha observado que ingestas de hierro superiores a las recomendadas no implican un riesgo para la salud, por lo que en ese aspecto no se establecen límites máximos como los existentes para otros minerales. Únicamente Reino Unido ha establecido un umbral de seguridad de 17 mg para los alimentos fortificados58.
Conclusiones
Teniendo en cuenta lo expuesto en este trabajo, el principal objetivo en la lucha contra la anemia ferropénica se debe centrar en la prevención primaria, evitando la deficiencia de hierro y con ello que se produzca la anemia. Para ello, es importante conocer e identificar los alimentos y componentes de los alimentos que permitan diseñar dietas con hierro de alta biodisponibilidad. Fortificar con hierro los alimentos puede ser una estrategia útil en la consecución de este objetivo, aunque todavía queda un largo camino para obtener compuestos de hierro fácilmente absorbibles que no modifiquen las características organolépticas de los alimentos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
*Autor para correspondencia.
Correo electrónico:jalfmtz@unav.es (J.A. Martínez Hernández).
INFORMACIÓN DEL ARTÍCULO
Historia del artículo:
Recibido el 5 de mayo de 2010
Aceptado el 10 de mayo de 2010