La morfología espermática se ha utilizado como factor pronóstico en fertilización in vitro; sin embargo, en inseminación intrauterina (IIU) su rol predictivo es controversial. El objetivo de este estudio fue determinar el impacto que tiene la morfología espermática como parámetro aislado del espermiograma en la probabilidad de embarazo de parejas que son tratadas con IIU.
Material y métodosEstudio retrospectivo de los ciclos de IIU realizados en la Unidad de Medicina Reproductiva de Clínica Las Condes entre enero del 2016 y diciembre del 2018. Regresión logística de las siguientes variables: morfología espermática agrupada en 0-1%, 2-3% y≥4%, recuento total de espermatozoides con motilidad progresiva inseminados, edad de la mujer y del hombre.
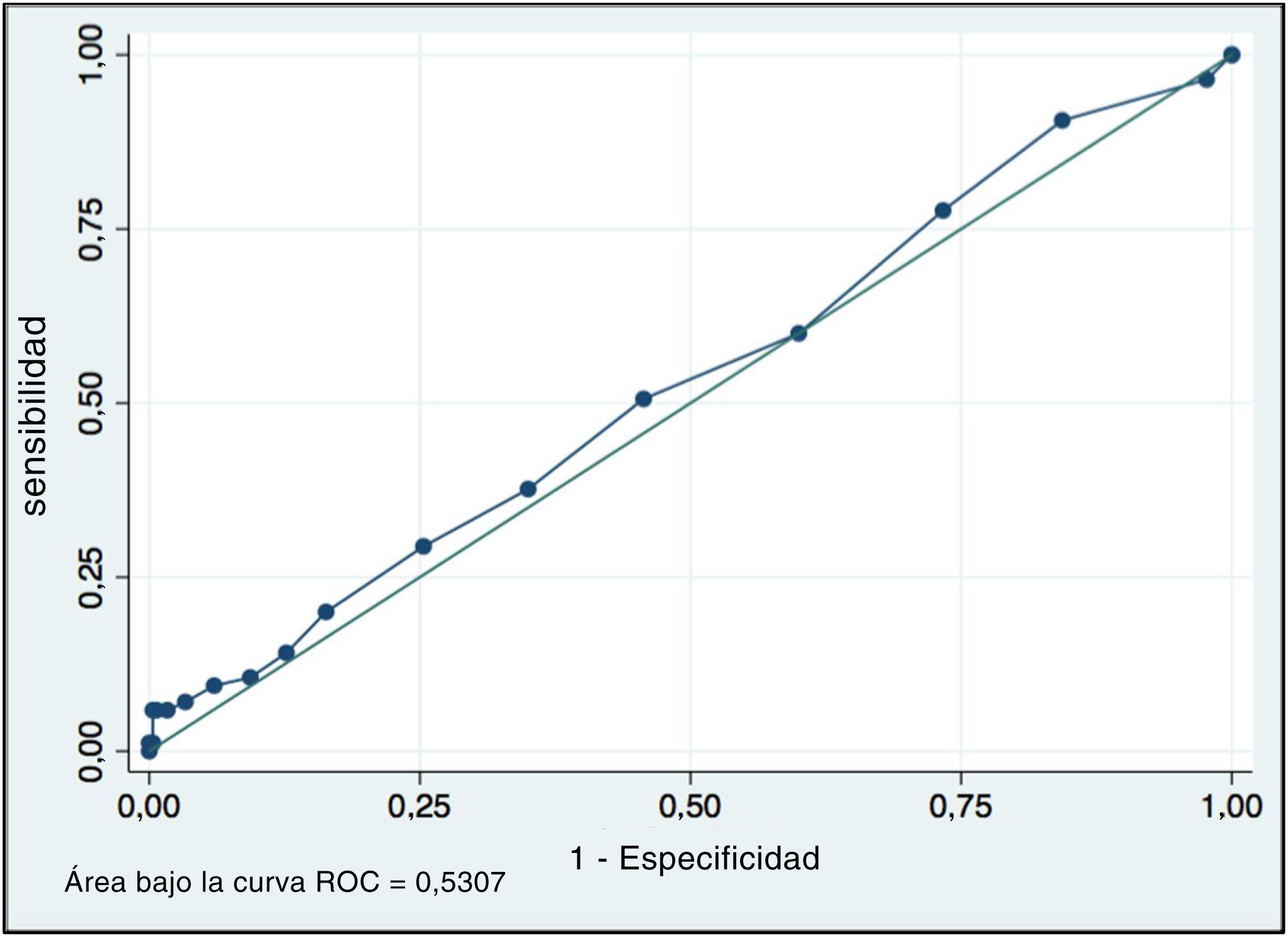
ResultadosSe incluyeron 385 casos, diagnosticándose embarazo clínico en 85 de ellos. Al separar en grupos de morfología espermática<4% y≥4% la tasa de embarazo fue de 22% en ambos grupos. La edad de la mujer fue el único factor estadísticamente significativo en la regresión logística. El área bajo la curva de ROC de morfología espermática como predictor de embarazo fue de 0,53.
ConclusionesNuestro estudio concluye que la morfología espermática no debe ser considerada como parámetro único a la hora de decidir si una pareja puede ser tratada o no con IIU, eliminando la teratozoospermia aislada como indicación directa de fertilización in vitro. No fue posible determinar un punto de corte de morfología espermática que sirva como predictor de embarazo.
Sperm morphology has been used as a prognostic factor in in vitro fertilization, however, in intrauterine insemination (IUI) its predictive role is controversial. The aim of this study was to determine the impact of sperm morphology as isolated parameter of the spermiogram has on the probability of pregnancy in couples that are treated with IUI.
Material and methodsRetrospective study of IUI cycles performed in the Reproductive Medicine Unit of Clínica Las Condes between January 2016 and December 2018. Logistic regression of the following variables: sperm morphology grouped in 0-1%, 2-3% and≥4%, total progressively motile sperm count inseminated, age of the woman and the man.
ResultsA total of 385 cases were included and clinical pregnancy was diagnosed in 85 of them. When separating into groups of sperm morphology<4% and≥4%, the pregnancy rate was 22% in both groups. The age of the woman was the only statistically significant factor in the logistic regression. The area under the ROC curve of sperm morphology as a predictor of pregnancy was 0.53.
ConclusionsOur study concludes that sperm morphology should not be considered as a single parameter when deciding whether or not a couple can be treated with IUI, eliminating isolated teratozoospermia as a direct indication for in vitro fertilization. It was not possible to determine a cut-off point for sperm morphology that serves as a predictor of pregnancy.
El espermiograma es considerado un examen básico en la evaluación de la fertilidad masculina, informando una serie de parámetros que aportan una visión global de la calidad espermática. Dentro de estos parámetros se encuentra la morfología espermática.
En 1986 Kruger et al. introdujeron criterios estrictos para clasificar la morfología espermática con el objetivo de poder hacer reproducible la evaluación y que sirviera como un indicador pronóstico en fertilización in vitro (FIV). Estos autores reportaron una clara relación entre la morfología de los espermatozoides y una FIV exitosa1,2.
Esta situación se vio revolucionada con la introducción de la inyección intracitoplasmática de espermatozoides, introducida en 1992 por Palermo et al., necesitando solo un espermatozoide funcionalmente normal por ovocito y perdiendo el valor pronóstico que tenía hasta ese entonces la morfología espermática3.
El punto de corte de normalidad para la morfología espermática ha sido constantemente reevaluado por la Organización Mundial de la Salud, siendo el último límite inferior de normalidad un 4% según los criterios estrictos de Kruger4.
Por otra parte, numerosos estudios han evaluado el impacto que tiene la morfología espermática en el éxito de la inseminación intrauterina (IIU), encontrando discrepancias en sus resultados5–10. Esto ha llevado a replantearse la idea de que la morfología espermática debe ser considerada como un parámetro indicador de pronóstico a la hora de elegir entre IIU y FIV.
Un reciente metaanálisis que incluyó un total de 41.018 ciclos de IIU encontró que no hay diferencia estadísticamente significativa en las tasas de embarazo clínico al comparar hombres con morfología≤4% y>4%11.
El objetivo de este estudio es determinar el impacto que tiene la morfología espermática como parámetro aislado del espermiograma en la probabilidad de embarazo de parejas que son tratadas con IIU.
Material y métodoPoblación de estudioEl estudio se realizó en la Unidad de Medicina Reproductiva de Clínica Las Condes, en Santiago de Chile. Se analizaron de forma retrospectiva los resultados de las parejas sometidas a un máximo de 3 ciclos de IIU realizados entre enero del 2016 y diciembre del 2018.
Se consideró la morfología espermática del último espermiograma previo al ciclo de IIU, el cual se realizó en todos los casos antes de 3 meses de la inseminación. Todas las parejas presentaban permeabilidad tubaria demostrada, ya sea por histerosalpingografía o por laparoscopia, y la muestra espermática tuvo un recuento total de espermatozoides con motilidad progresiva (TMSC) mayor de 1,5 millones. Se incluyeron parejas de 18 a 45 años de edad. Se excluyeron los registros cuando faltaban datos sobre la permeabilidad tubaria, parámetros del espermiograma o el resultado del embarazo.
Análisis del semenPara evaluar la calidad del semen se siguieron las indicaciones del manual de la Organización Mundial de la Salud de 201012. El espermiograma se realizó con 2-7 días de abstinencia sexual, en una muestra fresca y como máximo hasta 60min postemisión de esta y por solo 2 operadores debidamente entrenados. Una vez que la muestra fue emitida se almacenó en una estufa a 37°C por 15-60min hasta que licuara. Luego se evaluaron los parámetros macroscópicos: volumen, aspecto, viscosidad, pH y tiempo de licuefacción. Posteriormente se evaluaron los parámetros microscópicos: recuento espermático, motilidad, vitalidad, morfología y recuento de células no espermáticas. El recuento se realizó con cámara Makler colocando 10ul de muestra fresca en el centro del disco inferior de la cámara y se realizó el conteo en el cuadriculado usando un objetivo 20x. La motilidad se realizó sobre portaobjetos colocando 10ul de muestra fresca y sobre ella un cubreobjetos de 22×22mm. Con objetivo de 40x se evaluaron los porcentajes de espermatozoides mótiles progresivos, mótiles no progresivos y los espermatozoides inmótiles. La vitalidad se realizó en portaobjetos de igual manera que la motilidad, pero utilizando tinción de eosina 0,5% en 0,9% de NaCl para identificar espermatozoides muertos. Para la morfología se realizó un frotis de 0,7ul de la muestra, se fijó y luego se tiñó con hematoxilina de Harris y eosina. Se analizó la forma de los espermatozoides siguiendo el criterio estricto de Kruger con objetivo 100x y aceite de inmersión. Para la evaluación confiable de la motilidad, la vitalidad y la morfología se contaron como mínimo 400 espermatozoides en distintos campos visuales, cada vez que fue posible debido a las características de cada muestra.
Preparación de la muestra de semen para la inseminación intrauterinaLa muestra de semen se obtuvo mediante masturbación, 2h antes de la IIU, luego de 2 a 3 días de abstinencia. La selección de espermatozoides se realizó mediante separación espermática utilizando kit de gradiente de densidad de soluciones de 80 y 40% marca COOK Medical®, y para los lavados y capacitación espermática se utilizó buffer de gametos marca COOK Medical®, siguiendo el protocolo Cook modificado que se describe a continuación: en un tubo Falcon de 15ml se preparó una columna agregando lentamente en orden 1ml de Cook 80% y 1ml de Cook 40% formando un menisco entre ambas soluciones para evitar homogenización. Sobre la columna se agregó 1-1,5ml de semen y se centrifugó por 15min a 1.200-1.500rpm; si la muestra tenía un volumen mayor se prepararon tantas columnas como fuese necesario. Después de la centrifugación se descartó el sobrenadante y se transfirió el pellet a un tubo de Falcon nuevo. Luego se lavó el pellet agregando 2ml de buffer de gametos y centrifugando por 5min a 1.200-1.500rpm. Se descartó el sobrenadante y se realizó un segundo lavado para finalmente entregar la muestra resuspendida en 0,4ml de medio. Se registró la motilidad y el recuento antes y después de la separación espermática, utilizando una cámara Makler. Se utilizó la morfología del último espermiograma disponible, no volviéndose a reevaluar el día de la IIU, ya que este parámetro se considera bastante constante. El número total de TMSC fue definido como el producto entre el número total de espermatozoides separados y el porcentaje de motilidad progresiva.
Estimulación ovárica e inseminación intrauterinaLa técnica de IIU fue la misma en todos los casos. Básicamente, las pacientes fueron sometidas a inducción de la ovulación usando citrato de clomifeno, letrozol y/o gonadotrofinas, de acuerdo con la preferencia del médico tratante, y se realizó ultrasonido transvaginal de forma seriada para monitorizar el desarrollo folicular y endometrial. Cuando al menos uno o 2 folículos llegaron a un diámetro promedio de 17mm o más se desencadenó la ovulación mediante la administración de gonadotrofina coriónica humana; cuando existían 3 o más folículos dominantes el ciclo se canceló para disminuir el riesgo de embarazo múltiple. La inseminación intrauterina se realizó 24-36h después de la administración de la gonadotrofina coriónica humana utilizando un catéter Frydman®, marca Balton®.
Confirmación de embarazoSe realizó una prueba de embarazo 14 días después de la IIU y un ultrasonido transvaginal 14 días tras la prueba de embarazo. Se definió embarazo clínico, según el glosario ICMART, como la presencia de uno o más sacos gestacionales en el ultrasonido transvaginal13.
Análisis estadísticoSe consideraron los siguientes datos para un análisis uni y multivariado: edad de ambos miembros de la pareja, morfología normal de espermatozoides en el último espermiograma, TMSC inseminados y resultado (embarazo clínico). Solo se consideró en el análisis un ciclo por paciente; se consideró el último ciclo realizado, dentro de los primeros 3 ciclos de IIU. La morfología normal de espermatozoides se realizó de acuerdo con los criterios de la Organización Mundial de la Salud4. Para el análisis estadístico se separó en el grupo<4% y≥4%. Se utilizó el análisis de la curva ROC para evaluar el valor predictivo de la morfología espermática en embarazo clínico. Un valor de p<0,05 se consideró como estadísticamente significativo. Los análisis estadísticos se realizaron con el programa Stata® 11.0.
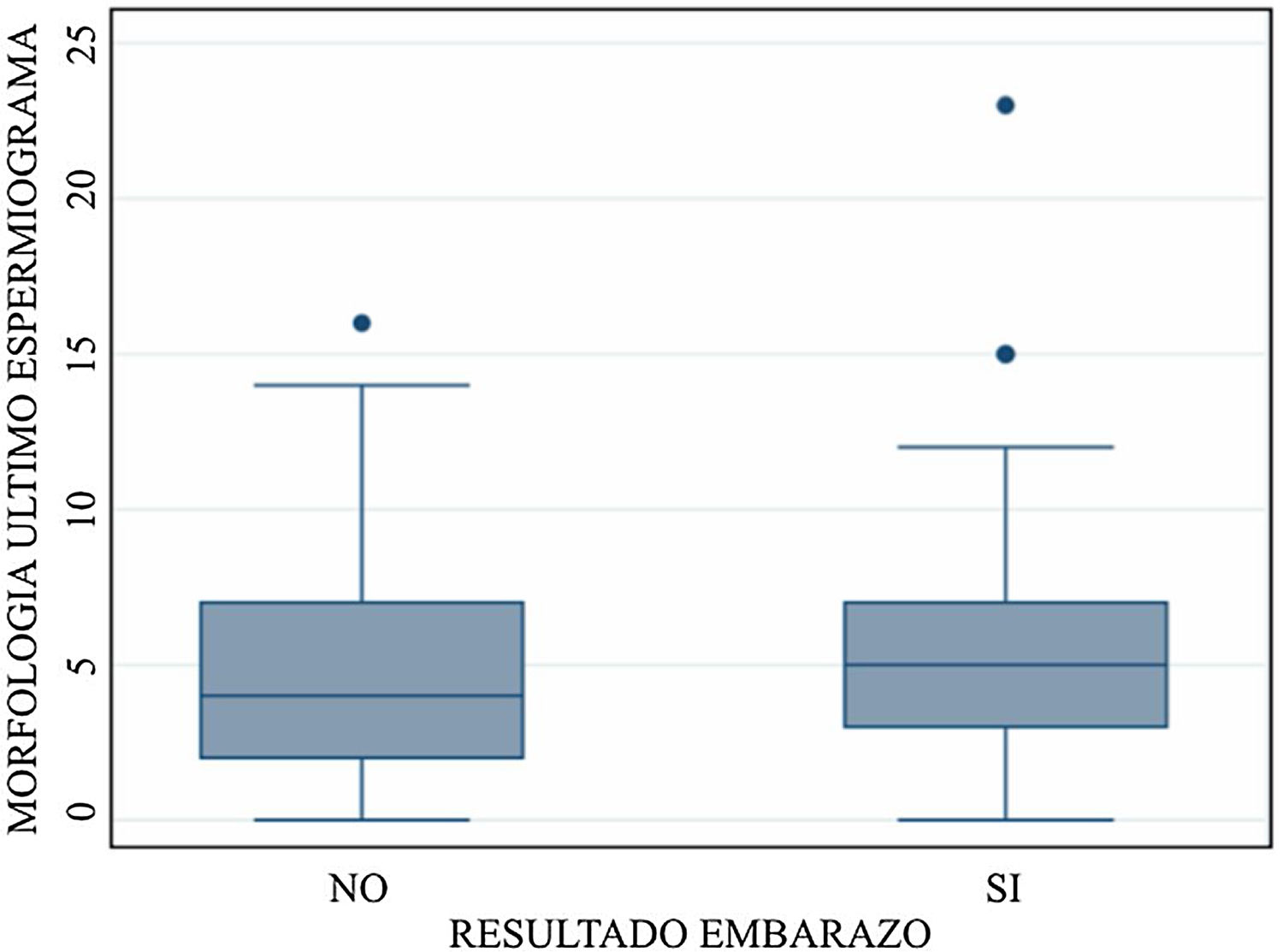
ResultadosSe analizaron un total de 385 parejas en la Unidad de Medicina Reproductiva de Clínica Las Condes durante el periodo comprendido entre enero del 2016 y diciembre del 2018. En 85 casos se diagnosticó un embarazo clínico, con una tasa de embarazo por pareja del 22% y una tasa de embarazo por ciclo de inseminación del 12,6%. Al separar en grupos de morfología<4% y ≥ 4% la tasa de embarazo clínico por pareja fue del 22% en ambos grupos.
Las principales características y resultados de la población analizada se presentan en la tabla 1.
Principales características y resultados de la población analizada
| Grupo total parejas(n=385) | |
|---|---|
| Edad mujer (años), media±DE | 35,3±3,6 |
| Edad hombre (años), media±DE | 38,4±5,1 |
| TMSC (×106), media±DE | 25,0±21,9 |
| Morfología (%), mediana (rango intercuartílico) | 4 (2-7) |
| Morfología≥4%, n (%) | 231 (60,0) |
| Morfología<4%, n (%) | 154 (40,0) |
| Tiempo de infertilidad (años), media±DE | 2,8±1,3 |
| Estimulación ovárica, n (%) | 385 (100) |
| Orales (clomifeno/letrozol), n (%) | 241 (62,6) |
| Gonadotrofinas, n (%) | 144 (37,4) |
| Tasa de embarazo clínico por ciclo de inseminación, % | 12,6 |
| Tasa de embarazo clínico por pareja, % | 22,0 |
| Tasa de embarazo múltiple, % | 4,7 |
En la tabla 2 se presenta el resultado de la regresión logística que considera como variables independientes el porcentaje de morfología normal de espermatozoides en el último espermiograma, agrupado en 0-1%, 2-3% y≥4%, el TMSC de la muestra separada para la IIU, y la edad de la mujer y del hombre (años cumplidos). Solo se observa asociación entre la edad de la mujer y la probabilidad de embarazo (OR 0,903201, IC95% 0,828247-0,984939, p<0,05).
Regresión logística de factores asociados a la posibilidad de embarazo en 385 pacientes sometidas a inseminación intrauterina
| OR | Intervalo de confianza 95% de OR | p | |
|---|---|---|---|
| Edad mujer | 0,903201 | 0,828247-0,984939 | 0,021 |
| Edad hombre | 0,993912 | 0,933242-1,058526 | 0,849 |
| TMSC (×106) | 1,004332 | 0,993417-1,015366 | 0,438 |
| Morfología 0 y 1% | 0,970039 | 0,341494-2,755461 | 0,954 |
| Morfología 2 y 3% | 1,792613 | 0,869491-3,695797 | 0,114 |
| Morfología≥4% | 1,085232 | 0,979303-1,202620 | 0,119 |
La gráfico 1 corresponde a la distribución de la morfología espermática separada en grupos de resultado embarazo y no embarazo, observando una distribución homogénea en cuanto a morfología en ambos grupos.
Al evaluar el valor predictivo de la morfología espermática en la posibilidad de embarazo encontramos un área bajo la curva de ROC de 0,53 (grafico 2), no existiendo un valor de corte de morfología que nos permita predecir el embarazo clínico.
DiscusiónAlgunos parámetros, como la motilidad y la concentración espermática, tienen un claro efecto en los resultados reproductivos de IIU. La morfología espermática, por su parte, se ha utilizado durante los últimos 40 años como un factor predictor de embarazo, sin embargo, en los últimos 3 años varios reportes han relativizado la importancia de este parámetro en el éxito del procedimiento, planteando que no es un factor clínicamente significativo. Kovac et al. reportaron en el año 2017 que la morfología espermática era de poca importancia para lograr un embarazo de forma natural, ya que hombres con una ausencia completa de morfología espermática normal exhibieron altas tasas de embarazo espontáneo5.
El metaanálisis más reciente publicado al respecto por Kohn et al., en el que se incluyeron 20 estudios observacionales y mas de 40.000 ciclos de IIU, no encontró diferencias en las probabilidades de embarazo al utilizar el 4% como punto de corte de morfología espermática normal.
Nuestros resultados mostraron que al realizar la regresión logística de los factores asociados a la posibilidad de embarazo solo la edad de la mujer fue un factor estadísticamente significativo. La edad del hombre, el TMSC y la morfología espermática no lograron significación estadística. Tampoco observamos diferencia en la tasa de embarazo clínico por pareja al separar en grupos de morfología<4% y≥4% (22% para ambos grupos).
Por otra parte, la distribución de la morfología espermática fue bastante homogénea al separarla en grupos de embarazo y no embarazo. Al evaluar la sensibilidad de esta, encontramos un área bajo la curva de 0,53 en la curva ROC, por lo que no fue posible determinar un punto de corte de morfología espermática que sirva como predictor de embarazo.
Las fortalezas de nuestro estudio son que la morfología espermática fue analizada solo por 2 operadores debidamente entrenados, que la evaluación fue realizada como máximo 3 meses antes de la IIU y que los registros de datos permitieron evaluar otras variables confundentes. La única debilidad del estudio es que se trata de un análisis retrospectivo.
Las características de los espermatozoides humanos generan que su morfología sea difícil de interpretar, con la excepción de algunos defectos específicos muy poco frecuentes que se asocian a trastornos genéticos, tales como la globozoospermia y la macrozoospermia14. Por una parte, podría ser que la falta de fiabilidad analítica de la evaluación morfológica de los espermatozoides surja de la heterogeneidad en la preparación y lectura del frotis, la falta de conocimiento y homogeneidad de los sistemas de clasificación, la falta de medidas para mantener la formación de biólogos y, por supuesto, la naturaleza subjetiva de la evaluación morfológica. Por otra parte, podría ser que la evaluación de la morfología espermática se haya vuelto tan estricta que el valor predictivo para IIU se haya perdido tanto para los resultados de esta como para los de la inyección intracitoplasmática de espermatozoides.
Nuestro estudio concluye que solo una morfología espermática alterada no debe ser considerada como parámetro a la hora de decidir si una pareja puede ser tratada o no con IIU. La teratozoospermia aislada no debe considerada como indicación directa de FIV, sin realizar IIU previas. Esto es especialmente relevante en países donde las técnicas de FIV son altamente costosas y pobremente cubiertas por los seguros de salud.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.