En pacientes en hemodiálisis crónica (HC), se ha demostrado que ejercicios aeróbicos y de resistencia mejoran la capacidad física, parámetros metabólicos y cardiovasculares.
Objetivoevaluar en pacientes en HC, el impacto de una rutina de ejercicios de resistencia sobre fuerza muscular, calidad de vida y parámetros metabólicos.
Pacientes y métodotreinta y un pacientes del centro de diálisis realizaron rutina de ejercicios dinámicos y estáticos de resistencia progresiva para tren inferior y abdomen y aeróbico a baja carga con pedalera, 45 minutos de duración, 3 sesiones/semana por 20 semanas. Se midió al inicio y final: peso, glicemia, perfil lipídico, test de marcha de 6 minutos y cuestionario de calidad de vida SF36. En siete de ellos se evaluó fuerza extensora de rodilla mediante la máxima contracción voluntaria. La escala de Borg se utilizó para graduar la progresión de la carga.
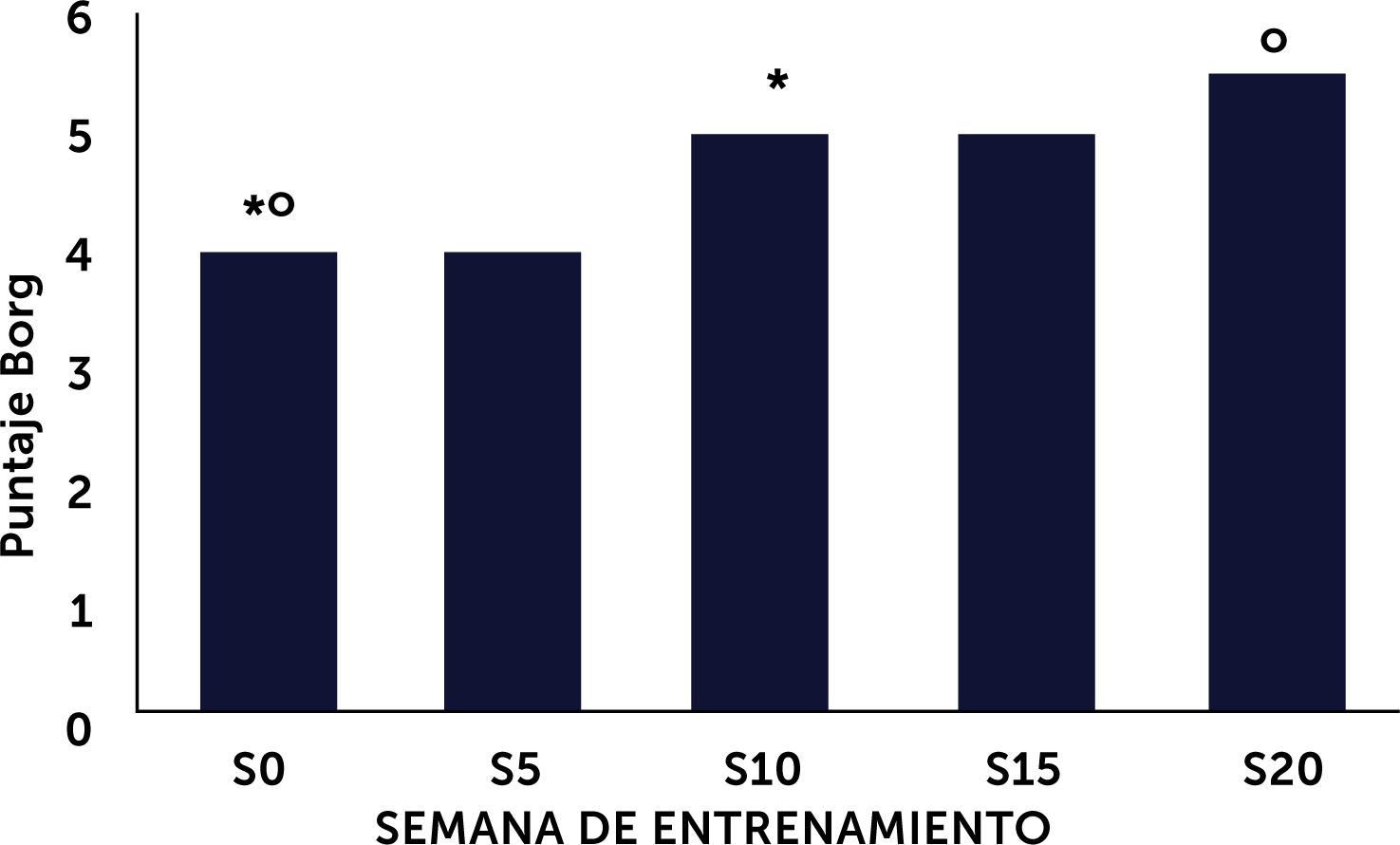
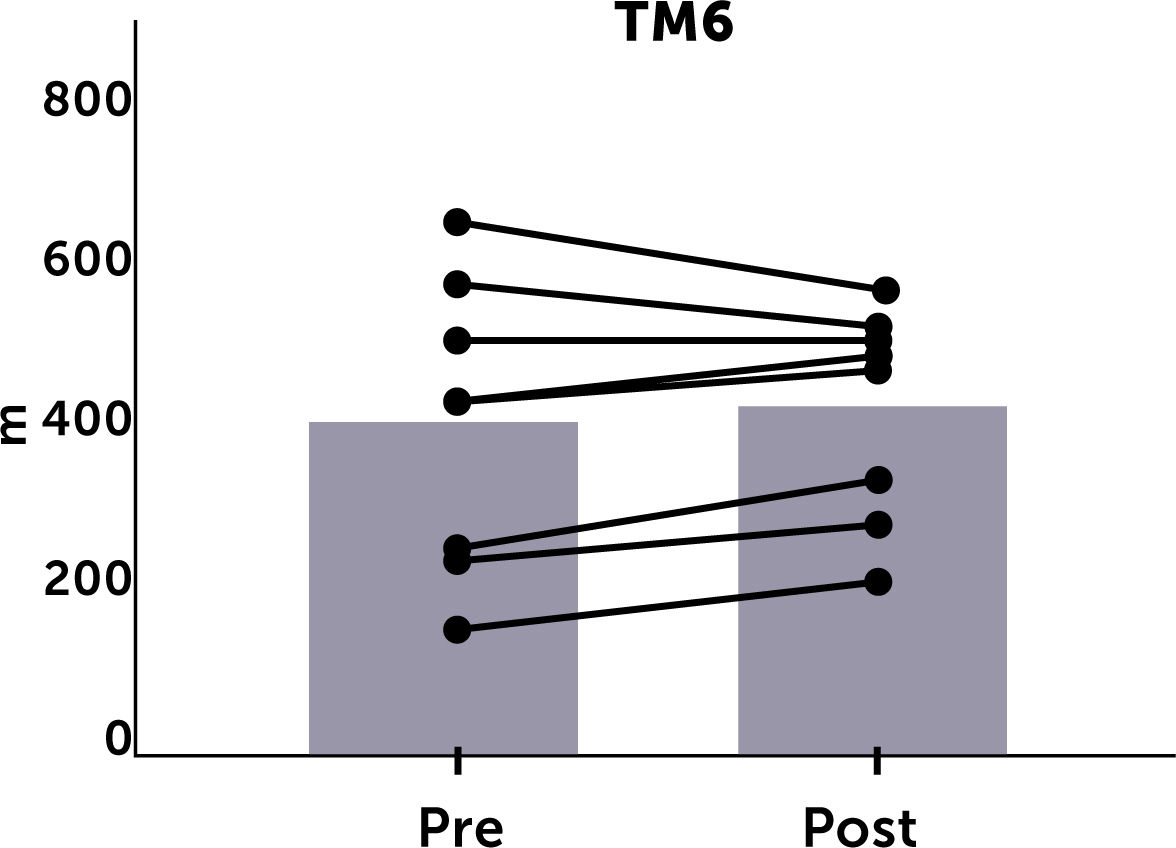
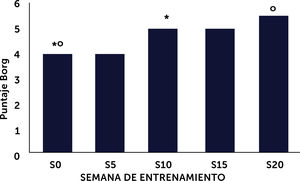
Resultadosdiecinueve pacientes (11 hombres/8 mujeres), completaron 47±6,4 sesiones. No hubo diferencias significativas entre la medición basal y final en los parámetros evaluados. La escala de Borg aumentó significativamente a las semanas 10 (p<0,05) y 20 (p<0,01) respecto del basal. Este aumento en la percepción del esfuerzo concuerda con el aumento en la progresión de intensidad programada para los ejercicios. En 5/8 pacientes se observó un incremento >30 metros en el test de marcha.
Conclusiónaunque esta rutina de ejercicios no determinó cambios estadísticamente significativos en los parámetros evaluados, el aumento en algunos pacientes en su capacidad de marcha es relevante. Más estudios son necesarios para establecer el tipo de rutina de ejercicios que beneficiará a estos pacientes.
In patients in chronic hemodialysis (CH), aerobic and resistance exercises have been shown to improve fitness, metabolic and cardiovascular parameters.
Objectiveto evaluate in patients in CH, the impact of a resistance training routine on muscle strength, quality of life and metabolic parameters.
Patients and methodthirty one patients from the dialysis unit performed a routine of dynamic and static progressive resistance training for lower body and abdomen, and low-load aerobics with a pedal board in 45minute sessions, 3 sessions/week for 20 weeks. Weight, glycemia, lipids, 6-minute walk test and SF36 quality of life questionnaire were measured at the beginning and at the end. In seven patients, knee extensor strength was evaluated by means of the maximum voluntary contraction. The Borg scale was used to evaluate load progression.
Resultsnineteen patients (11M/8F), completed 47±6.4 sessions. There were no significant differences between baseline and final measurements for the evaluated parameters. The Borg scale increased significantly at weeks 10 (p<0.05) and 20 (p<0.01) compared to baseline, indicating that the perception of exercise intensity increased in accordance with increases in intensity in the exercise routines. In 5/8 patients, an increase over 30 meters in the 6-minute walk test was observed.
Conclusionalthough this exercise routine did not statistically determine significant changes in the evaluated parameters, the increase in walk capacity in some patients is relevant. More studies are needed to establish the type of exercise routine that will benefit these patients.
La enfermedad renal crónica (ERC) en etapa de diálisis determina complicaciones cardiovasculares (CV), endocrino metabólicas y músculo esqueléticas que deterioran la capacidad funcional y comprometen la calidad de vida del paciente. La hemodiálisis crónica (HC), realizada usualmente 3 veces a la semana y que implica 4 a 6 horas por sesión, limita aún más la actividad de estos pacientes.
Por otra parte, la insulino resistencia (IR) se puede manifestar en etapas precoces de la ERC, incluso con índice de masa corporal (IMC) bajo 25kg/m2 y es uno de los factores de riesgo CV en los pacientes en diálisis. La sarcopenia, frecuentemente presente en estos pacientes, sería uno de los factores que favorecería la IR y se asociaría con mayor mortalidad1. Se ha demostrado que las terapias dialíticas pueden mejorar la IR2. Sin embargo, los pacientes en HC habitualmente presentan una pérdida de masa muscular. Pacientes con ERC presentan niveles alterados de citoquinas y adipoquinas producidas en el tejido adiposo visceral, como proteína C reactiva ultrasensible (PCRus), IL-6, IL-10 y TNF-α. Esto, también contribuye en forma importante al riesgo CV3. Algunos trabajos han demostrado que sujetos con ERC diabéticos y no diabéticos, presentan niveles de leptina y resistina más altos y de adiponectina más bajos, comparados con sujetos sanos, lo que también se asociarían a mayor IR y mortalidad general y riesgo CV4–6. Estos parámetros podrían permanecer alterados aún después de iniciada la HC.
En sujetos sin ERC, programas de ejercicio han demostrado tener efectos benéficos sobre la presión arterial, el perfil lipídico, la glicemia y los marcadores de inflamación como la PCRus, disminuyendo el riesgo CV y la mortalidad. En sujetos prediabéticos también disminuye la progresión a diabetes mellitus (DM)7. En sujetos con ERC se ha demostrado que, tanto la actividad aeróbica como el entrenamiento de fuerza o resistencia mejoran la capacidad física y que cuando se realizan durante la diálisis, mejoran la presión arterial, función cardíaca (especialmente la función ventricular en pacientes en hemodiálisis), fuerza muscular, capacidad respiratoria y eficiencia de la diálisis8–10.
Los ejercicios de resistencia, aumentan la masa magra y disminuyen la sarcopenia11. Esto lleva a una mejoría significativa metabólica, en la calidad de vida y sobrevida comparado con los que no realizan ejercicio8,12–14, lo que sería independiente del sexo, edad, y de la causa del daño renal9,15,16. Sin embargo, los entrenamientos realizados durante la diálisis, aparentemente no tendrían un impacto significativo sobre citoquinas proinflamatorias10,11,17,18.
El objetivo de este estudio fue evaluar en pacientes de un centro de diálisis, el impacto de una rutina de ejercicios, principalmente de resistencia, diseñada por los autores, sobre la fuerza muscular, la calidad de vida y los parámetros metabólicos después de 20 semanas de entrenamiento.
Pacientes y métodoDe los pacientes que acuden al centro de diálisis de Clínica Las Condes, se seleccionaron aquellos que cumplían con los criterios de inclusión y se les invitó a participar en el estudio. Los criterios de inclusión fueron: pacientes mayores de 18 años, con ERC de cualquier etiología, que estuvieran más de 3 meses en hemodiálisis y que contaran con el consentimiento del nefrólogo tratante. Los criterios de exclusión fueron: amputación de alguna extremidad, insuficiencia cardíaca congestiva, angina, secuelas de accidente cerebrovascular o cualquier trastorno neurológico, paratohormona (PTH) mayor de 1000 pg/ml o pacientes que realizaran ejercicio en forma habitual.
Previo al inicio del estudio, los pacientes firmaron un consentimiento informado. Este proyecto contó con la aprobación del Comité de Ética de Clínica Las Condes.
Antes de comenzar el estudio, se les enseñó a los pacientes cada ejercicio para familiarizarlos con los implementos y las rutinas.
En todos los pacientes se realizó, al inicio y al final del estudio, la medición de peso seco y de talla, una toma de muestra de sangre venosa para la medición de glicemia y perfil lipídico y el test de marcha de 6 minutos. Asimismo, se les aplicó el cuestionario de calidad de vida SF36, versión en español. Además, en los pacientes diabéticos se realizó medición de glicemia capilar antes de iniciar cada sesión de ejercicios.
Rutina de ejerciciosLa rutina de ejercicios consistió en 3 sesiones semanales iniciadas durante la segunda hora de diálisis, de 45 minutos cada una, por un periodo de 20 semanas. La rutina fue diseñada considerando la posición y la movilidad del paciente durante la diálisis. Las sesiones se realizaron bajo la estrecha supervisión de un kinesiólogo y del médico encargado de la diálisis. En cada sesión los pacientes realizaban 10 a 15 minutos de ejercicio aeróbico de baja carga, en una pedalera adaptada a la posición del paciente en el sillón de diálisis. La intensidad del trabajo aeróbico utilizada correspondió al 45% de la frecuencia cardíaca máxima de reserva. A continuación, se realizaron ejercicios dinámicos y estáticos de resistencia muscular progresiva. Para tren inferior se realizaron: contracción estática de cuádriceps, elevaciones de pierna unilateral y flexo-extensión de rodilla unilateral con tobillera de 2-3kg, elevaciones de cadera con abducción usando bandas elásticas (Theraband color verde, rojo, plomo). Para el trabajo de tronco, se realizaron ejercicios de fuerza abdominal de contracción estática con balón. Para evaluar la dificultad del entrenamiento durante su realización se utilizó la escala de percepción de esfuerzo de Borg que va de 0 a 10 (0: sin esfuerzo y 10: máximo esfuerzo). De acuerdo a este parámetro se graduó la progresión de la carga de los ejercicios (cambio de color de banda elástica). La sesión no se iniciaba si el paciente estaba hipertenso o con glicemia <80mg/dl en el caso de los diabéticos. Se realizaron controles de hemodinamia y saturación de oxígeno al inicio, a los 15 minutos y al final de cada sesión. Si el paciente presentaba hipertensión, hipotensión, disminución en la oximetría, disnea o dificultad muscular durante la sesión, ésta se interrumpía.
En siete pacientes (cinco hombres y dos mujeres) se realizó evaluación de la fuerza extensora de rodilla, previo a la realización de la diálisis. Esta se determinó a través de la máxima contracción voluntaria (MCV), registrada con una célula de carga (marca Winlaborat, Argentina), siendo la unidad de medición en kilogramos. La medición se realizó con el paciente en posición sedente, con flexión de rodilla de 70°. La célula de carga se fijó a través de un sistema de cadena en la parte inferior de la silla. La abrazadera se colocó a la altura del tobillo, para poder realizar un torque mayor. La extremidad evaluada fue la dominante. Se enseñó la ejecución del movimiento sin resistencia para lograr un adecuado gesto motor. Se realizaron dos intentos y se registró el mejor de los dos. Se obtuvo el valor de fuerza absoluta y el valor ajustado al peso corporal o fuerza relativa.
Al finalizar todas las sesiones de la rutina de ejercicios se les pidió a los pacientes, su opinión respecto de éste.
Análisis estadísticoLos datos se presentan como promedio±desviación standard (DS). Para la comparación entre los resultados antes y después de la intervención se utilizó el test de Wilcoxon. Para comparaciones múltiples de variables categóricas se utilizó el test de Newman Keuls.
ResultadosSe reclutaron 31 pacientes. De ellos, siete tenían diabetes mellitus tipo 2. Después del inicio de la rutina de ejercicios, dos pacientes recibieron trasplante renal, una paciente tuvo un infarto al miocardio, un paciente desarrolló insuficiencia cardíaca severa, dos pacientes fallecieron y otros seis desistieron de continuar (causa no relacionada con problemas físicos ni de salud), por lo que 19 pacientes completaron la rutina de ejercicios.
Los resultados de las evaluaciones clínicas y de laboratorio se presentan en la tabla 1. No hubo diferencia significativa entre la medición basal y final del peso, el índice de masa corporal, el perfil lipídico ni la glicemia. Tampoco se observó diferencia en el score de bienestar físico y mental de la encuesta SF36.
Características generales y parámetros de laboratorio antes y después de terminar las sesiones de la rutina de ejercicios
| BASAL | FINAL | p | |
|---|---|---|---|
| n (hombres/mujeres) | 19 (11/8) | ||
| Edad (años) | 61,8±13 | ||
| Tiempo en diálisis (meses) | 50,7±43 | ||
| N° sesiones de ejercicios ejecutadas | 47±6,4 | ||
| Peso (kg) | 69,2±12,6 | 69±12 | NS |
| IMC (kg/m2) | 25±3,7 | 25,5±11,9 | NS |
| PTH (pg/ml) | 345,3±258 | ||
| Glicemia (mg/dl) | 97±20,8 | 113,6±80 | NS |
| Colesterol total (mg/dl) | 162,5±57,4 | 168,5±42 | NS |
| cHDL | 40,8±18,9 | 44,6±14,5 | NS |
| cLDL | 89,4±42,5 | 92,3±37,1 | NS |
| Triglicéridos | 173,6±97 | 163,4±92,8 | NS |
| SF36 físico | 41,7±9,5 | 46±8,6 | NS |
| SF36 mental | 46±8,6 | 42,7±11,6 | NS |
IMC: índice de masa corporal; PTH: paratohormona, NS: no significativo.
De las 60 sesiones programadas, los pacientes cumplieron con 47±6,4 [30-55], fundamentalmente por hospitalizaciones o condición general no compatible para realizar actividad física en ese momento.
Se evaluó el puntaje de la escala de Borg basal y en las semanas 5, 10, 15 y 20. Se observó una diferencia significativa entre la mediana del puntaje inicial y la semana 10 (p<0,05) y la semana 20 (p<0,01), para entrenamiento de tren inferior, lo que concuerda con la progresión en la intensidad de los ejercicios realizados (Figura 1). Este aumento en la percepción del esfuerzo concuerda con el aumento en la progresión de intensidad programada para los ejercicios, la que fue ajustada según el color de la banda elástica utilizada y corroborada por la percepción del esfuerzo declarada por los pacientes. La intensidad del entrenamiento progresó desde la categoría “algo fuerte” (puntaje 4) en la semana 5 a “fuerte” (puntaje 5) entre las semanas 10 y 20.
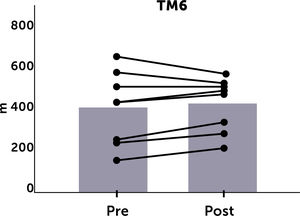
La evaluación del test de marcha a las 20 semanas solo pudo realizarse en 8 pacientes por diversas razones (lesión traumática de extremidad inferior, pie diabético complicado, trasplante renal, traslado de centro de diálisis). Hubo una tendencia a la mejoría en este test al final de toda la rutina de ejercicios (399,7±176 vs. 415,6±126 metros) pero, esta diferencia no fue significativa. Al realizar el análisis individual, se observó que, de los 8 pacientes 5 tuvieron un incremento de más de 30 metros en el test de marcha (Figura 2).
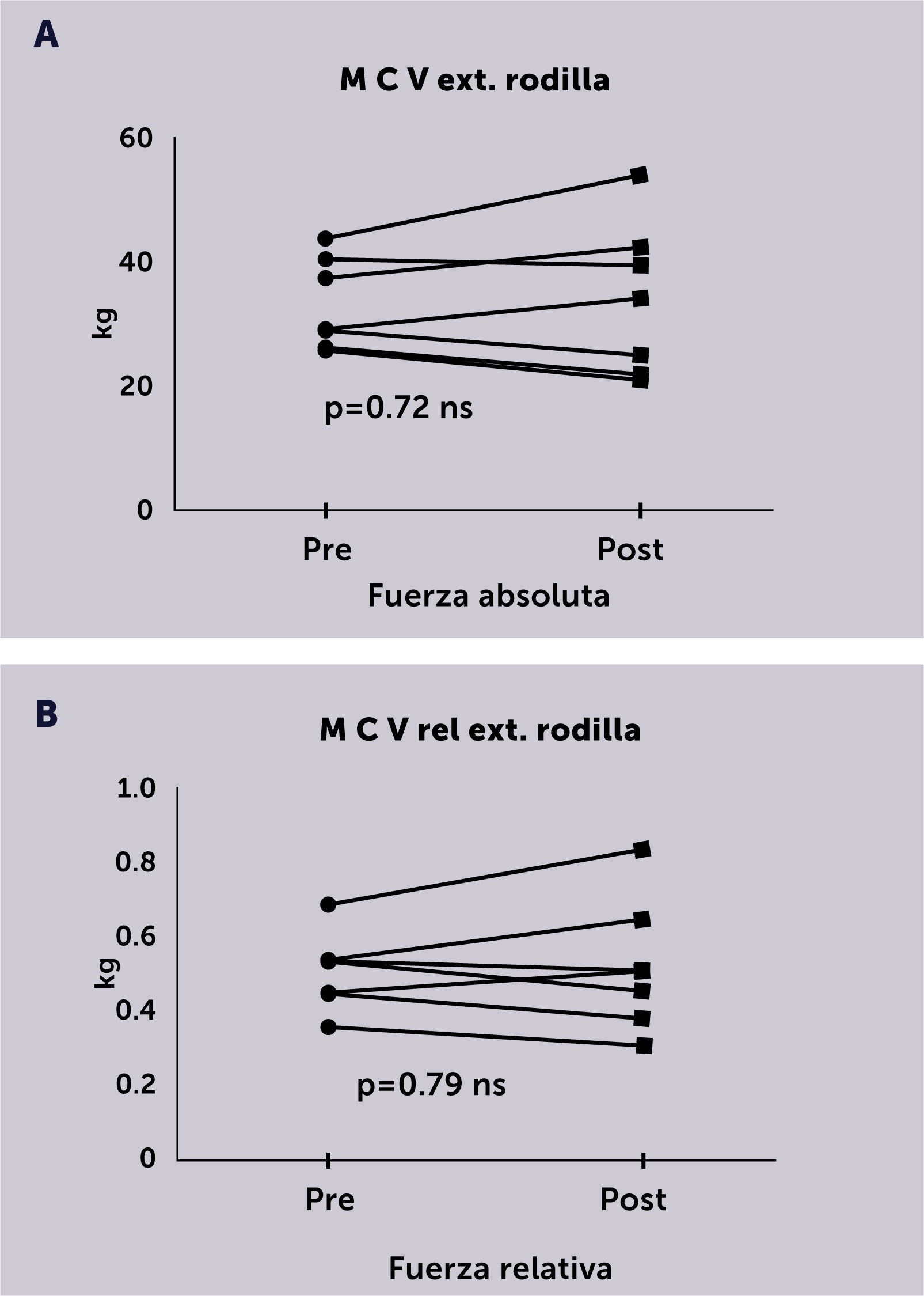
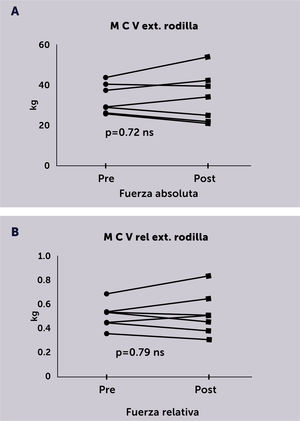
En los siete pacientes en que se evaluó la fuerza extensora de rodilla mediante la MCV al inicio y el final de todas las rutinas de ejercicio, no se observó una diferencia significativa para el valor de fuerza absoluta (Figura 3A) ni para el valor ajustado al peso corporal o fuerza relativa (Figura 3B).
Se les solicitó a los pacientes dar su opinión por escrito, en texto libre y en forma anónima, al completar las sesiones. Todos refirieron que fue una actividad positiva durante el tiempo en diálisis.
DiscusiónDesde hace más de una década, se ha enfatizado el papel del ejercicio en la prevención y tratamiento de diversas condiciones médicas y enfermedades crónicas19. A diferencia de patologías como las broncopulmonares o cardíacas, en la ERC a menudo se omite la indicación de un programa de entrenamiento, por el potencial riesgo de fracturas o complicaciones CV. Sin embargo, aún no existe evidencia que señale los riesgos del ejercicio en pacientes con ERC20. En nuestro medio, aunque se han realizado estudios piloto en algunos centros de diálisis, no se ha logrado implementar un programa supervisado de ejercicios10.
Se ha observado que pacientes con ERC sin terapia dialítica pueden presentar sarcopenia, la que va en aumento en etapas más avanzadas de la enfermedad. Así mismo, hay una tendencia a niveles más altos de glicemia, triglicéridos y PCRus, todos factores que pueden deteriorar la sensibilidad insulínica muscular21. Se ha demostrado que una sesión de ejercicios puede aumentar la sensibilidad a insulina hasta 48 horas después de realizado22. Esto determina un incremento de la captación de glucosa tanto mediada como independiente de insulina lo que a su vez determina una mejoría en niveles de glicemia, lípidos y marcadores de inflamación.
Revisiones sistemáticas de la literatura han demostrado que existe evidencia del beneficio de la actividad física en pacientes en diálisis tanto en la mejoría de la sarcopenia como desde el punto de vista funcional y de la calidad de vida8,23.
Sin embargo, hay que señalar que, la mayoría de los estudios que evalúan programas de entrenamiento en pacientes en HC, han sido realizados en sujetos con promedios de edad igual o menor de 60 años o sin comorbilidades mayores. En nuestros pacientes, el promedio de edad fue de más de 60 años, lo que podría explicar, en parte, porque no observamos una mejoría significativa en los parámetros evaluados. En un estudio realizado en nuestro medio, en el cual observaron mejoría en fuerza de cuádriceps y test de marcha en pacientes en diálisis después de 12 semanas de realizar una rutina de ejercicios similar a la implementada por nosotros, el promedio de edad fue mucho menor que en nuestros casos (46 años). No obstante, tampoco observaron mejoría significativa en parámetros inflamatorios (PCRus, IL6 o TNF alfa) ni en puntajes de calidad de vida o depresión10.
Se ha demostrado que en sujetos mayores disminuye la capacidad aeróbica, lo que se asocia a una menor eficiencia del ejercicio. Esto se relacionaría con una menor cantidad de mitocondrias en el músculo24,25. Sin embargo, el ejercicio aeróbico puede aumentar la eficiencia en un porcentaje mayor que en sujetos más jóvenes (30% vs 2%), pero después de 3-6 meses de entrenamiento24.
Por otra parte, en nuestro medio, la condición de la mayoría de los pacientes en HC es precaria, lo que determina distintas morbilidades, hospitalizaciones frecuentes y limita aún más la adherencia a un programa de ejercicios. En nuestro estudio no se excluyó por edad, por patologías concomitantes como neoplasias o por no cumplir con el total de sesiones, de modo de reflejar la realidad de los pacientes en diálisis.
La adherencia a la prescripción de ejercicio puede ser un factor que influye en los resultados obtenidos. Se ha descrito que la adherencia a programas de fisioterapia varía de un 14% a 70%. Algunas de las barreras identificadas para la realización de ejercicios son baja actividad física basal, escaso autocuidado, problemas psicológicos como depresión, percepción de barreras para la realización de ejercicio y dolor, entre otras26,27. También se debe tener en cuenta que ejercitar durante la diálisis implica limitaciones en el tipo de ejercicios que se pueden ejecutar. Estudios previos se han realizado ejercitando los días alternos a la diálisis lo que permite realizar una gama más amplia de rutinas13. En nuestro estudio, la rutina de ejercicios se adecuó a la situación del paciente durante la diálisis, por lo cual, la variedad de ejercicios fue bastante acotada. Además, para el análisis no excluimos a los que no cumplieron con el total de sesiones programadas. Nuestros pacientes ejecutaron un 78% de lo planificado en el periodo de tiempo. Esto, y el número limitado de pacientes que completó el estudio, pudieron influir en los resultados obtenidos. A pesar de ello, se observó una tendencia a la mejoría en el test de marcha y bienestar físico evaluado por encuesta SF36 y en ningún caso hubo un deterioro. Hay que destacar que cinco pacientes tuvieron un incremento de más de 30 metros en el test de marcha al final de las sesiones de ejercicios. En una revisión sistemática publicada en 2017, se sugiere que un cambio de 14 a 30 metros en el test de marcha, puede ser clínicamente importante cuando se consideran diferentes patologías crónicas28.
Por otra parte, el aumento significativo en la percepción del esfuerzo a través de la rutina de entrenamiento fue acorde con la progresión de la resistencia otorgada por las bandas elásticas de diferente color, evidenciando un aumento de la intensidad del programa. La escala de percepción del esfuerzo ha sido utilizada en otros estudios para controlar la intensidad del entrenamiento en pacientes que se dializan. Su uso es justificado, ya que respeta efectivamente la percepción con la que el paciente está asimilando el ejercicio y es una forma más adecuada de control de intensidad para pacientes que reciben fármacos betabloqueantes en los cuales la frecuencia cardíaca no reflejaría la intensidad del esfuerzo29,30.
Desde el punto de vista metabólico, no observamos diferencia significativa en los parámetros al inicio y al final del estudio. Estudios en los que sí han observado mejoría en masa muscular, fuerza y capacidad funcional, tampoco han demostrado cambios en citoquinas10,11,18. Probablemente, en estos pacientes se debería evaluar otros marcadores más sensibles y que no se vean influenciados por el efecto de la ERC y la diálisis.
Finalmente, hay que considerar que la respuesta al ejercicio puede ser heterogénea y que existen no respondedores. Esto puede deberse a factores como edad, sexo, etnia y genéticos, relacionados con la respuesta metabólica de insulina y glucosa al ejercicio. También influye las características del ejercicio como la modalidad, intensidad, duración y momento del día, entre otros31.
Concluimos que, aunque esta rutina de ejercicios no determinó cambios estadísticamente significativos en los parámetros evaluados, es de destacar el aumento en algunos pacientes en su capacidad de marcha. No hubo complicaciones al aumentar la intensidad de los ejercicios permitiendo la progresión segura de estos. Una rutina de estas características podría atenuar la pérdida de capacidad física en este tipo de pacientes y lograr mejoras en la respuesta individual de algunos de ellos.
Esto puede ser importante para el bienestar físico y mental. El grado de mejoría en la calidad de vida, función muscular y metabólica dependerá de las características de cada paciente. La rutina debe adecuarse a la condición de cada sujeto y debe ser estrechamente supervisada. Tanto el tipo de ejercicios como la duración y periodicidad del entrenamiento dependerán de la condición y evolución del paciente, siendo fundamental su mantención en el tiempo. Más estudios son necesarios para establecer el tipo de rutina de ejercicios que más beneficiaría a estos pacientes.
Declaración de conflicto de interésLos autores no tienen conflictos de interés que declarar.
Financiación:El presente trabajo ha sido financiado por: Proyecto de Investigación
Dirección Académica (PIDA), Clínica Las Condes 2014.
Al Sr. Víctor Cayul por la supervisión de los pacientes en la realización de la rutina de ejercicios y al personal del Centro de Diálisis de Clínica Las Condes por su colaboración en la realización del estudio.