El cáncer de mama es la primera causa de muerte en mujeres chilenas. La mayoría de estos tumores dependen del estímulo estrogénico, por tanto, la deprivación de estrógenos es una parte relevante de su tratamiento. La combinación de terapia endocrina con tratamientos dirigidos ha demostrado prolongar la sobrevida global de pacientes con cáncer de mama avanzado estrógeno dependiente versus la terapia antiestrogénica aislada. Nuevas opciones de manejo sistémico en base a inmunoconjugados y la descripción de nuevos grupos de cáncer de mama estrógeno dependientes con baja expresión del receptor del factor de crecimiento epidérmico humano tipo 2 (HER2-bajo), han abierto otras opciones para pacientes con resistencia endocrina. Junto a una descripción de la experiencia local, mostramos una revisión narrativa de las nuevas opciones de tratamiento sistémico del cáncer de mama avanzado estrógeno dependiente.
Breast cancer is the leading cause of death in Chilean women. Since most of these tumors are estrogen-dependent, estrogen deprivation has historically been a relevant part of breast cancer treatments. However, the combination of endocrine treatment with targeted therapies has demonstrated better efficacy, improving overall survival of advanced estrogen-dependent breast cancer patients, compared to anti-estrogenic therapy alone. In recent decades, novel systemic therapies based on immunoconjugates, along with the discovery of low human epidermal growth factor receptor type 2 estrogen-dependent breast cancers (HER2-low), have expanded the available options for patients that display endocrine resistance. Herein, we deliver a brief review that summarizes novel systemic treatment options for estrogen-dependent advanced breast cancer patients.
El cáncer de mama (CM) es la primera causa de muerte por cáncer en mujeres chilenas1. La mortalidad del CM está altamente relacionada al desarrollo de enfermedad avanzada o metastásica2. Cuando esta enfermedad se extiende más allá de la glándula mamaria y los linfáticos regionales se denomina cáncer de mama avanzado (CMA); este incluye además a pacientes con CM inoperable, con debut con enfermedad metastásica sistémica, etapa IV o de novo; y aquellas pacientes que luego de haber tenido un CM localizado, recaen con enfermedad sistémica. Estudios locales muestran que un 5-10% de las pacientes chilenas debutan con enfermedad metastásica “de novo”, mientras que entre un 15-30% de pacientes con enfermedad temprana presentan recurrencias con enfermedad a distancia3. Pese a los enormes avances en el manejo del CMA, este aún es considerado una enfermedad incurable, donde el principal objetivo terapéutico es aminorar los síntomas y prolongar la sobrevida, manteniendo una buena calidad de vida. No obstante, el avance en el conocimiento de la biología del CM y el desarrollo de nuevas terapias ha permitido el control de la enfermedad por extensos periodos de tiempo en ciertos casos, transformándose así en una condición crónica; algo que vemos más frecuentemente en pacientes con CMA y sobreexpresión/amplificación del receptor del factor de crecimiento epidérmico humano tipo 2 (HER2+) o de su gen (ERBB2), tratados con terapia dirigida anti-HER2. Este fenómeno también ocurre en algunos casos de CM metastásico de novo receptor hormonal positivo (RH+/HER2−), y sin enfermedad visceral o en casos de enfermedad recurrente pero aún considerado como CM endocrino sensible4.
El objetivo del presente artículo es describir la prevalencia y el pronóstico de pacientes con CMA RH+/HER2− en un registro local de pacientes y entregar una breve revisión actualizada de la evidencia disponible sobre el manejo sistémico de la enfermedad.
Materiales y métodosDesde una base de datos de un registro longitudinal de CM local que recopila información de pacientes con CM atendidos en el Centro de Cáncer de la Pontificia Universidad Católica de Chile y del Hospital Dr. Sótero del Río, obtuvimos información de pacientes con CMA RH+/HER2−, para mostrar sus características clínico-patológicas y pronóstico5. Este registro está aprobado por el comité ético científico local.
Con el objetivo de actualizar las recomendaciones del manejo de cáncer de mama RH+ avanzado publicado por nuestro equipo (Sánchez et al.6), realizamos, en una segunda instancia, una revisión narrativa del tratamiento sistémico del CMA RH+/HER2−, utilizando PubMed, con los términos “advanced”, “metastatic”, “breast cancer” and “phase III”. Excluimos los términos “HER2-positive” y “triple negative”. La última búsqueda se hizo el 18-09-2022 con los filtros: “clinical trial”, “humans” y “published in the last 5 years”. Aplicando estos filtros se obtuvieron 59 citas, de las cuales 5 publicaciones eran estudios clínicos fase III aleatorizados, en pacientes con CMA receptor de estrógenos (RE)+/HER2−, utilizando terapia endocrina (TE) combinada. Seleccionamos sólo aquellas publicaciones de estudios nuevos y no aquellas referidas a actualizaciones o reportes de resultados secundarios (calidad de vida, toxicidades, costos; por ejemplo).
En todos los casos, para la definición de CM RH+/HER2− usamos la definición sugerida por la American Society of Clinical Oncology/College of American Pathologists (ASCO/CAP)7.
Extracción de datos en artículos obtenidos de la revisión de PubMed Obtuvimos datos del número de pacientes incluidos en cada estudio, tratamiento y escenario del tratamiento (primera línea (1ªL), segunda línea (2ªL)), resultados en sobrevida libre de progresión (SLP) y sobrevida global (SG). Esta información se incluyó en tablas resumen.
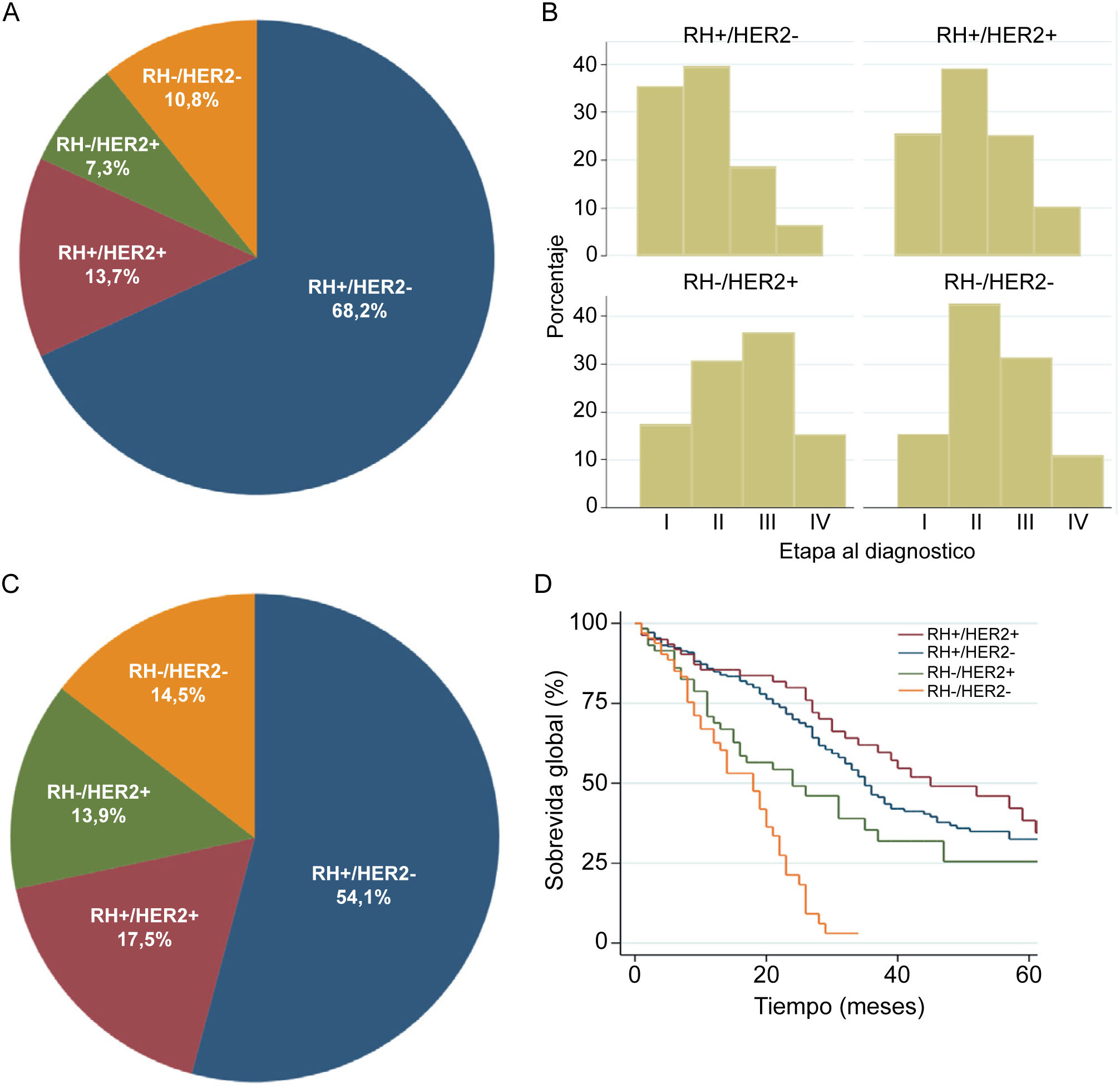
ResultadosCaracterísticas clínicas y pronóstico de CMA RH+/HER2−: experiencia del registro localLa mayoría de los pacientes (3960/5824: 68%) en nuestra base de datos pertenecen al subgrupo RH+/HER2− (Figura 1A). En este grupo, un 6,4% (253) se presentan en etapa IV al diagnóstico de novo (Figura 1B), mientras que, si analizamos el total de pacientes en etapas IV, un 54% corresponde a tumores RH+/HER2− (Figura 1C). Por otra parte, la figura 1D muestra la SG a 5 años de pacientes en etapa IV de acuerdo a subgrupos definidos por inmunohistoquímica (IHC).
Características de las pacientes de nuestro registro de cáncer de mama
A. Distribución de las pacientes según subtipos definidos por inmunohistoquímica. B. Distribución de las pacientes según etapa al diagnóstico y expresión de receptores por inmunohistoquímica. C. Distribución de pacientes etapa IV según subtipos. D. Sobrevida global de pacientes etapa IV según expresión de receptores (RH+/HER2−; RH+/HER2+, RH−/HER2+, RH−/HER2−). Abreviaciones: RH: receptor hormonal; HER2: receptor del factor de crecimiento epidérmico humano tipo 2; SG: sobrevida global.
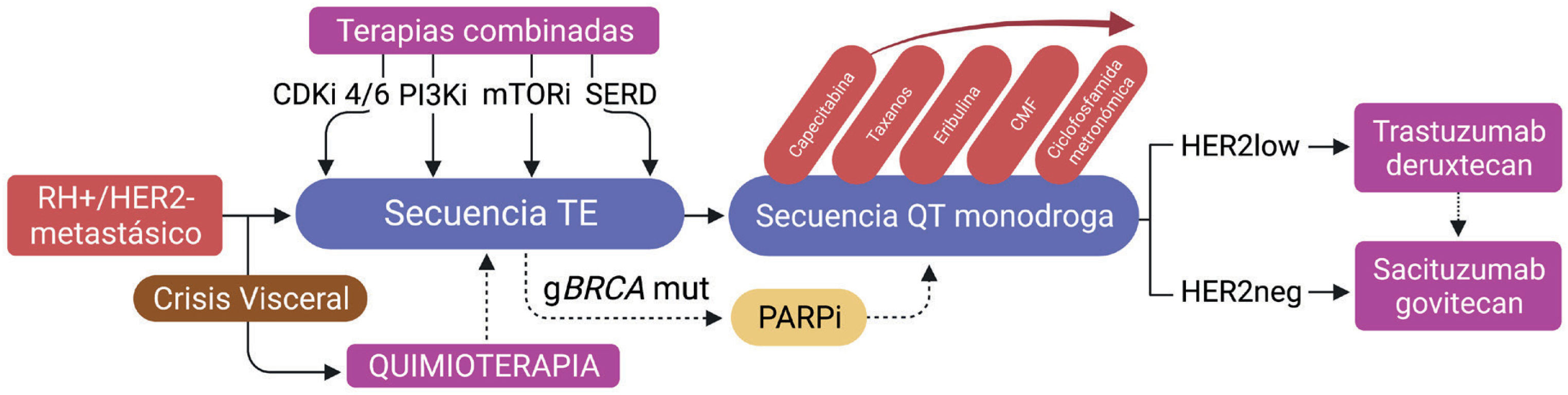
Históricamente, el tamoxifeno fue la primera terapia molecularmente dirigida con efecto antiestrogénico utilizada en CM, aunque inicialmente solo se aplicaba en casos de CMA. Posteriormente se agregaron los inhibidores de aromatasa (IA), los antiestrógenos puros como el fulvestrant, y más recientemente los degradadores selectivos del receptor de estrógenos (SERD), la terapia endocrina (TE) combinada, y los inmunoconjugados (Figura 2)6.
Algoritmo de manejo para pacientes con cáncer de mama avanzado (CMA) receptor hormonal positivo (RH+)
Abreviaciones: RH+/HER2−: receptores hormonales positivos y expresión de HER2 no amplificado; CDKi: inhibidores de ciclinas dependientes de quinasas; TE: terapia endocrina; QT: quimioterapia; PARPi: inhibidores de PARP; PI3Ki: inhibidores de PI3K; mTORi: inhibidores de vía mTOR (Everolimus); SERD: degradadores selectivos del receptor de estrógeno (Elancestrant); CMF: ciclofosfamida, metrotrexato y 5FU.
Actualmente la TE es el pilar fundamental para el manejo inicial de pacientes con CMA RH+/HER2−. De hecho, su uso ha experimentado un aumento sostenido por sobre la quimioterapia (QT) en tratamientos de 1ªL8. En nuestro registro, un 30% de los pacientes CMA RH+/HER2− recibieron TE como 1ªL en el periodo 2000-2005. Este porcentaje aumentó a 70% en el periodo 2016-2019 (p=0,045), reflejando la tendencia mundial y las recomendaciones actuales para el manejo de este subgrupo8.
Recientemente, el uso de TE combinada con IA o fulvestrant en concomitancia con tratamientos biológicos-dirigidos ha demostrado mayor eficacia que la TE aislada. Un ejemplo exitoso de esta estrategia es el uso de inhibidores de quinasas dependientes de ciclina (CDKi) 4 y 6. Los CDKi son moléculas pequeñas que inhiben la acción de proteínas necesarias para la transición G1/S del ciclo celular. El uso combinado de CDKi con TE ha demostrado beneficios en tasas de respuesta, de SLP y SG en comparación con la monoterapia en pacientes con enfermedad metastásica de novo, sensibles o resistentes a TE, con o sin enfermedad visceral, con uso previo de quimioterapia y en mujeres pre y posmenopáusicas9. En la tabla 1 se describen los principales estudios de fase III en CMA RH+/HER2− y uso de CDKi10–16. Estos resultados han sido validados en estudios del mundo real tales como el estudio FLATIRON17, y son hoy la terapia de elección en pacientes con CMA RH+/HER2−. Evidentemente, la decisión sobre la TE acompañante dependerá de si existe resistencia a TE, puesto que en pacientes sensibles a tratamiento hormonal no habría diferencias entre el uso de fulvestrant e IA (PARSIFAL18). Por otro lado, y a pesar de diferencias reportadas en beneficios para sobrevida global, de momento la elección de CDKi 4/6 depende principalmente del acceso y perfil de toxicidad de cada uno de ellos. A la fecha, no existe un estándar definido de tratamiento para los pacientes que progresan tras una 1ªL de TE con CDKi 4/6. En este sentido, el estudio Fase II MAINTAIN19 mostró un beneficio discreto en sobrevida libre de progresión con el uso de CDKi más allá de la progresión, sin embargo, en la actualidad no es el estándar de tratamiento. En ausencia de crisis visceral, la recomendación actual es mantener tratamiento hormonal cambiando la terapia antiestrogénica, o utilizar TE combinada con moléculas dirigidas que inhiban la vía de PI3K/AKT/mTOR, vía involucrada en procesos de crecimiento y sobrevida celular, y cuya desregulación es un factor común en muchas formas de cáncer.
Principales estudios fase III en CMA RH+/HER2− y uso de CDKi
| Estudio | Año | Pacientes | N̊ | Línea de tto. | Ramas | Sobrevida libre de progresión | Sobrevida global |
|---|---|---|---|---|---|---|---|
| PALOMA-210 | 20162023 | PostM | 666 | 1aL | 1) Palbociclib+Letrozolvs2) Placebo+Letrozol | 1: 24,8 meses2: 14,5 meses(HR: 0,58; 95%IC 0,46-0,72; p>0,001) | 1: 53,9 meses2: 51,2 meses(HR: 0,956; 95%IC 0,77-1,17; p=0,33)* |
| MONALEESA-211 | 201620182023 | PostM | 668 | 1aL | 1) Ribociclib+Letrozolvs2) Placebo+Letrozol | 1: 25,3 meses2: 16 meses(HR: 0,56; 95%IC 0,45-0,70; p<0,0001) | 1: 63,9 meses2: 51,4 meses(HR: 0,76; 95%IC 0,63-0,93; p=0,008) |
| MONARCH-312 | 201720192022 | PostM | 493 | 1aL | 1) Abemaciclib+Anastrozol o Letrozolvs2) Placebo+Anastrozol o Letrozol | 1: 28,1 meses2: 14,7 meses(HR: 0,54; 95%IC, 0,41-0,72; p<0,0001) | 1. 67,1 meses2. 54,5 meses(HR: 0,75; 95%IC 0,58-0,97; p=0,0301)* |
| MONALEESA-713 | 201820192023 | PreM | 672 | Sensible a TH | 1) Ribociclib+Tamoxifeno o Letrozol o Anastrozol+Goserelinavs 2) Placebo+Tamoxifeno o Letrozol o Anastrozol+Goserelina | 1: 23,8 meses2: 13,0 meses(HR: 0,55; 95%IC 0,44-0,69; p<0,0001) | 1: 58,7 meses2. 48,0 meses(HR: 0,76; 95%IC 0,61-0,96) |
| PALOMA-314 | 20162018 | PostM | 521 | 2aL | 1) Palbociclib+Fulvestrantvs2) Placebo+Fulvestrant | 1: 9,5 meses2: 4,6 meses(HR: 0,46; 95%IC 0,36-0,59, p<0,0001) | 1: 34,9 meses2: 28,0 meses(HR: 0,81; 95%IC 0,64-1,03; p=0,09) |
| MONARCH-215 | 20172022 | PostM | 669 | 2aL | 1) Abemaciclib+Fulvestrantvs2) Placebo+Fulvestrant | 1: 16,4 meses2: 9,3 meses(HR: 0,55; 95%IC 0,45-0,68; p<0,001) | 1: 46,7 meses2: 37,3 meses(HR: 0,75; 95%IC 0,61-0,95; p=0,013) |
| MONALEESA-316 | 201820212023 | PostM | 726 | 1aL y 2aL | 1) Ribociclib+Fulvestrantvs2) Placebo+Fulvestrant | 1: 20,5 meses2: 12,8 meses(HR: 0,59; 95%IC 0,48-0,73; p<0,001) | 1: 67,6 meses2: 51,8 meses(HR: 0,67; 95%IC 0,50-0,90) |
Abreviaciones: Tratamiento: tto; PostM: postmenopausica; PreM: premenopausica; HR: cociente de riesgo; IC: intervalo de confianza; TH: terapia hormonal; *: valores p no cumplen valores predefinidos de significancia clinica (a pesar de ser menores a 0,05).
Estudios muestran que cerca de un 40% de los CMA RH+ presentan alguna mutación del gen del fosfatidilinositol 3 quinasa (PI3K). En estos pacientes, alpelisib (un inhibidor de PI3K (PI3Ki) oral) ha demostrado beneficios en la SLP. Esto incluye pacientes con o sin tratamientos previos con CDKi 4/6 (SOLAR120 y BYLieve21). No obstante, este beneficio no se ha traducido en mejoras de la SG, ello sumado a problemas de toxicidad relevantes, principalmente rash cutáneo e hiperglicemia, además del costo, que limita su uso en nuestro medio20,22–29 (Tabla 2). Por otra parte, nuevas drogas que atacan otros puntos de esta misma vía de señalización tales como los inhibidores de AKT (serina/treonina proteína quinasa) han mostrado resultados promisorios. Primero, capivasertib, un inhibidor competitivo de 3 isoformas de AKT, mostró un potencial beneficio en SG combinado con fulvestrant en pacientes que progresaban a IA (FAKTION, fase II30). Recientemente, datos preliminares del estudio fase III CAPItello291(NCT04305496) han mostrado un beneficio significativo en la SLP con capivasertib más fulvestrant en pacientes que progresaron a IA con o sin CDKi, comparado con pacientes que usaron sólo fulvestrant31, sugiriendo que el uso de inhibidores de AKT podrían ser una opción para estos pacientes.
Resultados de principales estudios fase III en CMA RH+/HER2− con beneficio clínico en líneas subsecuentes de tratamientos
| Estudio | Año | Pacientes | N̊ | Línea de tto. | Ramas | Sobrevida libre de progression | Sobrevida global |
|---|---|---|---|---|---|---|---|
| DESTINY-Breast0422 | 2022 | HER2− bajo | 557 | ≥2aL | 1) Trastuzumab deruxtecanvs2) Capecitabina, Eribulina, Gemcitabina, Paclitaxel o Nab-paclitaxel | 1: 9,9 meses2: 5,1 meses (HR: 0,50; 95%IC 0,40-0,63; p<0,001) | 1: 23,4 meses2: 16,8 meses (HR: 0,64; 95%IC 0,49-0,84; p=0,001) |
| Subgrupo de pac. RH+1: 10,1 meses2: 5,4 meses (HR: 0,51; 95%IC 0,40-0,64; p<0,001) | Subgrupo de pac. RH+1: 23,9 meses2: 17,5 meses (HR: 0,64; 95%IC 0,48-0,86; p=0,003) | ||||||
| TROPiCS-0223,24 | 20202022 | 543 | ≥2aL | 1) Sazucitumab govitecanvs2) TPC* | 1: 5,5 meses2: 4,0 meses (HR: 0,66; 95%IC 0,53-0,83; p=0,0003) | 1:14,4 meses2: 11,2 meses (HR: 0,79; 95%IC 0,65-0,96; p=0,02) | |
| EMERALD25 | 2022 | PostM | 477 | ≥2aL | 1) Elancestrantvs2) Fulvestrant, Anastrozol, Letrozol o Exemestano | 1: 2,17 meses2: 2,0 meses(HR: 0,77; 95%IC 0,50-0,63; p=0,0097) | - |
| SOLAR-120,26 | 20192021 | PIK3 mutado | 572 | 2aL | 1) Fulvestrant+Alpelisibvs2) Fulvestrant+Placebo | 1: 11 meses2: 5,7 meses(HR: 0,65; 95%IC 0,50-0,85; p<0,001) | 1: 39,3 meses2: 31,4 meses(HR: 0,86, 95%IC 0,64-1,15; p=0,15) |
| OlympiAD27 | 2017 | BRCA mutado HER2− negative | 302 | 1) Olaparibvs2) TPC | 1: 7,0 meses2: 4,2 meses(HR: 0,58; 95%IC 0,43-0,80; p<0,001) | 1: 19,3 meses2: 17,1 meses(HR: 0,90; 95%IC 0,66-1,23; p=0,513) | |
| EMBRACA28 | 2018 | BRCA mutado HER2− negative | 431 | 1) Talazoparibvs2) TPC | 1: 8,6 mesesvs2: 5,6 meses(HR: 0,54; 95%IC 0,41-0,71; p<0,001) | 1: 22,3 meses2: 19,5 meses(HR: 0,76; 95%IC 0,55-1,06; p=0,11) | |
| EMBRACE29 | 2011 | HR+/− y HER2+/− | 762 | ≥1aL | 1) Eribulinavs2) TPC | 1: 3,6 meses2: 2,2 meses(HR 0,76; 95%IC 0,64-0,90; p=0,002) | 1: 13,1 meses2: 10,6 meses(HR: 0,81; 95%IC 0,66-0,99; p=0,041) |
| BROCADE-332 | 2020 | HER2− negative avanzado y BRCA1 o BRCA2 mutado | 509 | 2aL | 1) veliparib+carboplatinpaclitaxelvs2) placebo+carboplatinpaclitaxel | 1: 14,5 meses2: 12,6 meses(HR 0,71; 95%IC 0,57-0,88; p=0,002) | - |
Abreviaciones: PostM: postmenopausica; PreM: premenopausica; HR: cociente de riesgo; IC: intervalo de confianza; TPC: tratamiento a eleccion del tratante; RH+/−: receptor hormonal positivo y negativo; HER2: receptor del factor de crecimiento epidermico humano tipo 2; *: Incluye a pacientes que podrian haber recibido quimioterapia previamente.
Estudios muestran que alrededor de un 50% de los pacientes de CM portadores de mutaciones germinales en genes BRCA (BRCAm) corresponden a tumores RH+/HER2−, y que podrían ser resistentes a la TE combinado27. Los estudios OlympiAD27, EMBRACA28 y BROCADE332 mostraron un beneficio en la SLP de aproximadamente 3 meses en pacientes BRCAm que recibieron inhibidores de la poli-(ADP-ribosa)-polimerasa (PARPi), sin embargo, el beneficio en SG no fue significativo (Tabla 2). Por lo tanto, estos tratamientos todavía se reservan para pacientes que hayan progresado a tratamiento hormonal.
Otro gen frecuentemente mutado en pacientes de CMA es ESR1, gen que codifica para el receptor de estrógeno (RE). De hecho, las mutaciones de ESR1 están presentes en un 25% a 40% de aquellas pacientes tratadas previamente con IA lo cual sugiere que son adquiridas, a diferencia de las mutaciones del gen PIK3CA, las cuales aparecen precozmente en el curso de la enfermedad (troncales)20,26. Las mutaciones de ESR1 generan cambios conformacionales en el RE de tal forma que su activación se vuelve independiente de ligando y disminuye además su degradación. Lo que genera resistencia a IA, y una sensibilidad variable a moduladores selectivos del RE (SERMs), como el tamoxifeno. Nuevas opciones de TE incluye a los degradadores selectivos del RE (SERD) administrados por vía oral y utilizados como monodroga. En este sentido, el estudio EMERALD25 comparó elacestrant (400mg/dia) versus tratamientos de monoterapia estándar (fulvestrant o un IA), en pacientes de CMA RH+/HER2− que habían progresado después de una o dos líneas de TE, una de las cuales debía haber sido un CDKi 4/6 + fulvestrant o IA. El tratamiento con elacestrant mostró beneficios en la SLP y redujo el riesgo de progresión de la enfermedad o muerte en un 30% en la población general del estudio, y en un 45% en pacientes con mutación de ESR1 (Tabla 2), la mutación de ESR1 por tanto sería un marcador de resistencia a IA.
Tradicionalmente, los tumores HER2-negativos se definen por su expresión de HER2 por IHQ. En general, esto incluye aquellos tumores clasificados como 0, 1+ o 2+ en IHQ y negativos para la amplificación de cERBB2 por la técnica de FISH. Sin embargo, recientemente los tumores HER2 1+ y 2+/ISH− han sido reclasificados como “HER2-bajo o HER2-Low”33. Por lo tanto, esta reclasificación incluiría a >60% de pacientes previamente definidos como RH+/HER2−33. El estudio aleatorizado DESTINY-Breast0422, incluyó a 557 pacientes con CMA HER2-bajo, y comparó trastuzumab deruxtecan (TDxd; un inmunoconjugado que combina un anticuerpo monoclonal anti-HER2 más un citotóxico anti topoisomerasa 1), versus QT convencional a elección (nabpaclitaxel, paclitaxel, eribulina, capecitabina o gemcitabina) en pacientes previamente expuestos a TE, CDKi 4/6 y QT. En este estudio la cohorte de pacientes RH+/HER2-bajo (88% de los participantes) la mediana de SLP fue de 10,1 meses en el grupo de TDxd frente a 5,4 meses en el grupo de QT (HR: 0,51; p<0,001), con un beneficio significativo en la SG con medianas de 23,9 vs. 17,5 meses; respectivamente (HR: 0,64; p=0,003) (Tabla 2). Como ya mencionamos, este estudio incluyó a pacientes previamente tratados, de alto riesgo, con pocas opciones de tratamiento con beneficios en sobrevida demostrados, por lo tanto, sus resultados son muy relevantes dado que cambian la conducta en el manejo de pacientes.
Otro inmunoconjugado es el sacituzumab govitecan, droga que combina un anticuerpo monoclonal anti-TROP2, un receptor transmembrana sobreexpresado por células neoplásicas, más QT también con acción anti-topoisomerasa 1. Inicialmente utilizado en pacientes con CM RH−/HER2−, datos recientes han mostrado que sacituzumab govitecan mejora la SLP y tiene un impacto significativo en SG en estos pacientes, con medianas de 14,4 vs 11,2 meses versus QT estándar (eribulina, vinorelbina, capecitabina o gemcitabina). Dicho estudio llamado TROPiCS-0223 incluyó también pacientes previamente tratados, algunos con CDKi (Tabla 2).
Durante su tratamiento, la mayoría de las pacientes CMA RH+/HER2− recibirá una o más terapias citotóxicas. Las opciones son variadas, sin claras diferencias entre una u otra estrategia. El estudio PEARL34 mostró que la combinación de palbociclib y TE es equivalente al uso de capecitabina en pacientes con CMA RH+/HER2− resistentes a IA. Por otra parte, el estudio EMBRACE29, comparó eribulina (una droga con efecto anti tubulina) vs. terapias a elección del tratante en pacientes con CMA tratadas con múltiples líneas de tratamiento (incluidos taxanos, antraciclinas y un porcentaje importante de capecitabina). El uso de eribulina mostró un beneficio significativo en SG, especialmente en pacientes CMA HER2−. La elección y la secuencia del tratamiento con QT debe considerar los tratamientos usados previamente, toxicidades clínicas y económicas, y por supuesto, las preferencias del paciente.
NGS para CMA RH+/HER2−A diferencia de lo que ocurre en otras neoplasias, los estudios de secuenciación masiva o NGS, (next generation sequencing en inglés)35 no han mostrado un beneficio consistente en los pacientes CMA RH+/HER2−. Pese a esto, cada vez son más los biomarcadores con potencial predictivo, que han sido identificados mediante estos estudios. Por ejemplo, identificar a las pacientes portadoras de mutaciones germinales en BRCA1 o BRCA2 permite seleccionar candidatas para PARPi, y que además tienen altas posibilidades de ser resistentes a CDKi 4/636. Otro ejemplo son las mutaciones de PIK3CA, las cuales pueden ser detectadas en tejido tumoral o mediante biopsia líquida, esta última forma parte del estudio estándar de pacientes con CMA RH+/HER2− para definir el uso de PI3Ki37. Por otra parte, dado que se trata de una mutación troncal, podemos realizar estudios en el tejido tumoral mediante técnica de reacción en cadena de polimerasa (PCR) en tiempo real, en busca de mutaciones en los tres hotspots más frecuentes. Las mutaciones de ESR1 también podrían servir como predictoras de resistencia a IA, incluso antes de la progresión clínica de la enfermedad38. No obstante, la evidencia aún es insuficiente y faltan más datos que muestren un impacto en SG para su incorporación a la práctica clínica habitual. Finalmente, existe la alternativa de buscar alteraciones genéticas poco frecuentes, pero candidatas a tratamientos aprobados independientes del tumor de origen (agnósticos), como por ejemplo la presencia de inestabilidad microsatelital (MSI-H), alta carga mutacional (TMB) definido como ≥10 mut/Mb o fusiones del gen NTRK (del inglés Neurotrophic Receptor Tyrosine Kinase). No obstante, la presencia de MSI-H en CM se presenta mayoritariamente en tumores RH−/HER2−, donde ya está aprobado el uso de inhibidores de puntos de control inmune. Por su parte, aún no es claro el rol de TMB como biomarcador predictivo en CM, mientras que las fusiones de NTRK son extremadamente infrecuentes (<1%) y presentes en fenotipos poco habituales.
Por otro lado, la identificación de subtipos moleculares o intrínsecos como por ejemplo Luminal A, B, HER2 enriquecido y tipo-Basal (Basal-like), mediante paneles como PAM505, podría servir como predictores de respuesta a tratamientos combinados39. Desafortunadamente, dado su alto costo y la falta de estudios aleatorizados prospectivos el uso de este tipo de estrategias está aún limitado a la investigación.
Revisión de la literatura últimos 5 añosLa tabla 3 resume los 5 trabajos encontrados40–44. En todos ellos se comparan TE monodroga versus TE combinada, en pacientes con CMA previamente tratados. Tres estudios se enfocaron en la inhibición de la vía PI3K/mTOR, mientras que otros dos evaluaron el uso de inhibidores epigenéticos. Primero, el estudio SANDPIPER40 evaluó la eficacia de taselisib (GDC-0032), un potente PI3Ki más fulvestrant en pacientes PIK3 mutadas. Segundo, el estudio BELLE-343 evaluó otro PI3Ki, en una población no seleccionada, sin embargo su alta toxicidad y baja eficacia han limitado su desarrollo posterior. Tercero, los investigadores del MAIN-A44 evaluaron la utilidad de mantención con everolimus (un inhibidor de la quinasa mTOR) combinado con IA como exemestano, letrozol o anastrozol en pacientes con respuesta tras quimioterapia.
Estudios fase III, RCT, con TE combinada en pacientes con CMA HR+/HER2− publicados en los últimos 5 años
| Estudio | Año | Pacientes | N̊ | Línea de tto. | Ramas | Sobrevida libre de progression | Sobrevida global |
|---|---|---|---|---|---|---|---|
| SANDPIPER40 | 2021 | PostMPIK3CA mutado | 516 | ≥2aL | 1) Taselisib+Fulvestrant2) Placebo+Fulvestrant | 1: 7,4 mesesvs2: 5,4 meses(HR: 0,70, 95%IC, 0,56-0,89; p=0,004) | - |
| E211241 | 2021 | PostM y PreM | 608 | ≥2aL | 1) Exemestano+Entinostat2) Exemestano+Placebo | 1: 3,3 mesesvs2: 3,1 meses(HR: 0,87; 95%IC 0,67-1,13; p=0,30) | 1: 23,4 mesesvs2: 21,7 meses(HR: 0,99; 95%IC 0,82-1,21;p=0,94) |
| ACE trial42 | 2019 | PostM | 365 | ≥2aL | 1) Tucidinostat+Exemestano2) Placebo+Exemestano | 1: 7,4 mesesvs2: 3,8 meses(HR: 0,75; 95%IC 0,58-0,98; p=0,033) | - |
| BELLE-343 | 2018 | PostM | 432 | ≥ 2aL | 1) Buparlisib+Fulvestrant2) Placebo+Fulvestrant | 1: 3,9 mesesvs2: 1,8 meses(HR:0,67; 95%IC 0,53-0,84; p=0,0003) | - |
| MAIN-A44 | 2021 | Enf. Controlada post quimioterapia de 1ra linea | 110 | ≥2aL | 1) Everolimus+IA2) Placebo+IA | 1: 11,0 mesesvs2: 7,2 meses(HR: 0,71; 95%IC 0,47-1,06; p=0,09) | 1: 35,7 mesesvs2: 33,5 meses(HR: 1,0; 95%IC 0,61-1,62; p=0,99) |
Abreviaciones: PostM: postmenopausica; PreM: premenopausica; HR: cociente de riesgo; IC: intervalo de confianza.
Por su parte, un estudio del grupo de investigación del cáncer ECOG-ACRIN41 analizó la combinación de exemestano (IA) con entinostat (un inhibidor de histona desacetilasa (HDACi)) en pacientes con CMA HR+/HER2− resistentes a IA sin lograr mejorar la supervivencia. De manera similar, Jiang Z. et al.42, exploraron el uso de otro HDACi: tucidinostat. El fundamento biológico del uso de HDACi es revertir la resistencia a TE, a través de modificaciones epigenéticas. Desafortunadamente, estos estudios solo mostraron beneficios discretos en SLP sin beneficios en SG y por ende no han cambiado la práctica clínica habitual.
DiscusiónEl objetivo de nuestro trabajo es mostrar datos locales clínico-patológicos y de sobrevida de pacientes con CMA RH+/HER2−, además de entregar una revisión actualizada de su manejo sistémico. Del total de pacientes en nuestra base de datos, dos tercios corresponden a CM RH+/HER2−. Esta proporción es similar a los registros publicados en otras bases de datos internacionales (https://seer.cancer.gov/statfacts/html/breast-subtypes.html).
Pese a que la proporción de pacientes RH+/HER2− en etapa IV al diagnóstico es menor en comparación con otros subtipos de CM (6% vs 15% en tumores HER2 puros), casi la mitad de los pacientes que debutan en etapas IV corresponden a este subtipo. Interesantemente, nuestros datos muestran que los pacientes con CMA RH+/HER2+, poseen niveles similares de SG comparado con RH+/HER2−; sin embargo, en términos numéricos la sobrevida en tumores RH+/HER2+ es superior. Esto probablemente se debe a la existencia de mejores opciones de tratamiento para CMA HER2+, estas se encuentran disponibles en nuestro medio desde hace varios años y anteceden a la aparición y aprobación de TE combinadas efectivas45. Previamente, nuestro grupo de investigación publicó un estudio que demostró que los pacientes con tumores RE+/HER2− bien diferenciados (Luminal A) y que debutaban con enfermedad metastásica, tenían una SG tres veces mayor comparado con otros subgrupos de CMA RH+. Esta cohorte incluyó 211 pacientes con CMA; entre ellos un 39% se presentaron en etapa IV de novo y un 61% con recurrencias sistémicas. Nuestro estudio además demostró que los pacientes tratados en la última década lograban una SG superior a pacientes tratados anteriormente. Sin embargo, esta diferencia no logró significancia estadística4.
Nuevas opciones de TE en combinaciones con CDKi 4/6 u otras terapias dirigidas, e incorporación inmunoconjugados, han mejorado la SG de pacientes con CMA RH+/HER2−, convirtiéndose en estándares de tratamiento en 1aL, 2aL y líneas subsecuentes9 (Figura 2). Algunas tareas pendientes incluyen determinar la secuencia correcta de tratamientos y la búsqueda de mejores biomarcadores que permitan seleccionar estrategias personalizadas; estas se encuentran actualmente en desarrollo. Por otra parte, el uso cada vez más frecuente de estudios con NGS, la irrupción de nuevas técnicas como la biopsia líquida, la identificación de subtipos intrínsecos de CM y la reciente definición del grupo HER2-bajo, nos obligan a replantear la clasificación del CMA basada exclusivamente en la obtención e interpretación de marcadores IHQ clásicos.
Dada la mejoría en SG en estos pacientes, el manejo de las toxicidades agudas y, particularmente, de toxicidades crónicas, cobran cada vez más relevancia, requiriendo en algunos casos un manejo específico más interdisciplinario. Asimismo, el creciente uso de algunas de estas estrategias en el escenario adyuvante, como por ejemplo abemaciclib (CDKi) u olaparib (PARPi) en pacientes BRCAm46,47, plantea un desafío respecto al manejo de pacientes con CM RH+ precoz que recaen tras haber recibido esos tratamientos. Finalmente, el acceso y los costos de estos nuevos tratamientos son algo a tener en consideración ya que representan un gran desafío en Chile y el mundo.
Nuestro trabajo tiene limitaciones y fortalezas. Primero, es un estudio retrospectivo que reúne datos nacionales; sin embargo, todos los pacientes provienen de 2 centros de salud ubicados en Santiago, la capital de Chile. De esta forma, puede que nuestros hallazgos no sean un reflejo de la heterogénea realidad nacional. Pese a esto, nuestra base de datos constituye el registro nacional más grande de un subtipo específico de CMA, y uno de los más grandes a nivel latinoamericano. Segundo, nuestra revisión bibliográfica incluyó sólo los estudios principales y puede haber obviado otros que reportan estrategias terapéuticas con datos iniciales o publicadas en otras bases de datos. Nos parece relevante mostrar la experiencia local en este tema junto con las principales publicaciones que modifican la práctica clínica, lo cual ayuda a contextualizar la discusión de estrategias de manejo que sean compatibles con nuestras posibilidades, y que respondan a las necesidades y características clínicas locales.
Finalmente, el reporte de datos y experiencias del mundo real tal como los expuestos en nuestro trabajo, ayudarán a una mejor definición del curso de la enfermedad en nuestros pacientes, adaptando las terapias de acuerdo a la complejidad epidemiológica local.
Consideraciones éticas:Este trabajo incluyó datos de pacientes de una base de datos de un registro longitudinal de CM local que recopila información de pacientes con CMA RH+/HER2− atendidos en el Centro de Cáncer de la Pontificia Universidad Católica de Chile y del Hospital Dr. Sotero del Rio, para mostrar sus características clínico-patológicas y pronóstico. Este registro ha sido aprobado por el comité ético científico local y sus datos han sido publicados parcialmente5.
Financiamiento:Fundación Chile Sin Cáncer
Conflicto de interésLas y los autores se declaran sin conflictos de interés