¿ INTRODUCCIÓN
El cáncer de próstata (CaP) es la segunda neoplasia más común después del cáncer de piel en los varones y la segunda causa de muerte en hombres por cáncer después del cáncer de pulmón.1 Se atribuyen los numerosos factores al aumento en la incidencia del cáncer de próstata. Más de 200,000 hombres en los Estados Unidos son diagnosticados anualmente con CaP y 30,000 hombres mueren cada año por esta enfermedad. Después de los 50 años de edad la incidencia de CaP aumenta tres o cuatro veces cada 10 años.1 Los afroamericanos muestran la tasa de incidencia más elevada de CaP; la incidencia global de CaP en ellos aumentó de 124/100,000 a 250/100,000, lo que representa un incremento de 102%. Los hispano-americanos presentaron una incidencia intermedia: 104/100,000. Los países asiáticos, sobre todo Japón y China, presentan una de las tasas más bajas de incidencia y mortalidad por cáncer de próstata en el mundo. La incidencia de mortalidad por CaP en Japón entre 1992 a 1995 fue de 4/100,000.2 En México, en 1998, el CaP ocupó el segundo lugar respecto de la incidencia entre las neoplasias del varón, después del cáncer de piel. En cuanto a la mortalidad general, ocupó también el segundo lugar de la totalidad de las neoplasias después del carcinoma cervicouterino.3
La etiología del CaP no es del todo clara. Hasta el momento, los aspectos que se han considerado como factores de riesgo son: la edad del individuo, la producción y metabolismo de los andrógenos, el área geográfica/etnia, el hábito dietético y la historia familiar.
Actualmente existen dos sistemas de estadificación clínica: El sistema TNM (Tumor -Nódulo-Metástasis) ampliamente utilizado en la comunidad europea; y el sistema americano (Whitmore-Jewitt staging system modified). La diferencia entre estos dos sistemas estriba en que el TNM contiene un mayor número de subdivisiones.
El sistema de estadificación TNM fue propuesto y publicado en 1978 por el American Joint Committee on Cancer (AJCC) y la Union Internationale contre le cancer (UICC). Los tres aspectos que valora este sistema son: el estadio local del tumor, la afectación de los nódulos linfáticos y la presencia de metástasis.
El sistema Gleason es el método más utilizado para analizar el grado histológico de diferenciación. Fue propuesto por el Veterans Administration Co-operative Urological Research Group (VACURG). En este sistema, la clasificación se basa en el grado de diferenciación glandular y en el patrón de crecimiento tumoral referido al estroma prostático. Este patrón varía desde bien diferenciado (grado I) hasta indiferenciado (Grado V). Debido a que la mayoría de los carcinomas prostáticos contienen más de un patrón histológico, este sistema también toma en cuenta la heterogeneidad en las diferentes áreas del tumor, asignando un grado histológico al patrón predominante o primario y otro a cualquier patrón secundario prevalente. La puntuación combinada de los grados primarios y secundarios está claramente relacionada con la conducta biológica del tumor.
La Hiperplasia Prostática Benigna (HPB) se define histológicamente como una enfermedad caracterizada por aumento de las células epiteliales y estromales en el área periuretral de la próstata.4-5 Es un proceso patológico que contribuye con el desarrollo de síntomas del tracto urinario inferior en hombres de edad avanzada. La principal complicación de los pacientes con HPB son las usuales molestias del tracto urinario bajo, tipificados por nicturia, tenesmo, disminución en la fuerza y el calibre del chorro, sensación de vaciamiento vesical incompleto.6
La HPB es el tumor benigno más común en varones y su incidencia está relacionada con la edad. La prevalencia de la HPB es dependiente de la edad, con inicio en su desarrollo después de los 40 años de edad. Para los 60 años de edad, su prevalencia es 50% y para los 85 años de edad es de 90%. Aunque la evidencia clínica de la enfermedad ocurre con menos frecuencia, los síntomas del tracto urinario bajo, también se relacionan con la edad. Aproximadamente la mitad de todos los hombres con diagnóstico histológico de HPB tienen síntomas del tracto urinario bajo de moderados a severos.7
Al igual que el CaP, está relacionada con la edad del individuo y requiere andrógenos para desarrollarse y crecer. A diferencia del CaP, la HPB es una lesión benigna que rara vez progresa hacia una neoplasia maligna. Otra disimilitud respecto al CaP es que no existe ninguna evidencia de que HPB sea clonal, sólo se han encontrado algunos cambios genéticos que implican estabilidad genómica. En HPB no se detectan grados morfológicos en el núcleo que son característicos en las neoplasias maligna. En la patología hiperplásica con frecuencia presenta crecimientos variables del estroma y se ha sugerido que la secreción de factores de crecimiento por parte del mesénquima podría actuar sobre las células epiteliales adyacentes y contribuir al desarrollo de la hiperplasia de estas últimas.8
Los estudios de laboratorio y clínicos han identificado dos factores necesarios para el desarrollo de la HPB: dihidrotestosterona (DHT) y envejecimiento. Se ha demostrado que con la edad, la próstata se vuelve más sensible a andrógenos. Se ha sugerido varias teorías en esta área, entre las que se incluyen: 1) interacciones estroma-epitelio (las células del estroma pueden regular el crecimiento de células epiteliales u otras células del estroma por medio de un mecanismo parácrino o autócrino secretando factores de crecimiento como factor de crecimiento básico de fibroblastos o factor de crecimiento transformante); 2) el envejecimiento actúa en células primordiales que sufren un bloqueo en el proceso de maduración que las previene de entrar en muerte celular programada (apoptosis) y se inmortalizan.7
Se estima que la dieta puede contribuir con 35% de todos los cánceres humanos.9 La evidencia epidemiológica revela consistentemente que una ingestión baja de antioxidantes o un nivel sanguíneo bajo de antioxidantes puede incrementar el riesgo de padecer cáncer. Tanto el tabaquismo como la inflamación crónica -dos de las principales causas de cáncer- tienen como un fuerte componente a los radicales libres en su mecanismo de acción.
Recientemente se ha evocado que el daño oxidativo juega un papel crítico en varias condiciones clínicas como lo son las enfermedades malignas. Las Especies Reactivas de Oxígeno (EROs), pueden causar oxidación del DNA y daño a proteínas, daño a genes supresores tumorales y un aumento en la expresión de proto-oncogenes. El cáncer muestra un cambio pro-oxidativo en el estado oxidoreducción.
Las EROs son potenciales carcinógenos ya que facilitan la mutagénesis, además de la promoción y progresión de los tumores; incluso células normales nos muestran una incrementada proliferación y expresión de genes relacionados con el crecimiento si son expuestas a peróxido de hidrógeno o superóxido
La mayoría de las mutaciones inducidas por EROs parecen envolver a la guanina, causando tranversiones G-T, si esto se relaciona con genes críticos como oncogenes o genes supresores tumorales puede dar como resultado iniciación o progresión del cáncer. La hiperplasia prostática crónica es diagnosticada en la mayoría de los hombres alrededor de los 40 años. Pero la aparición tardía del carcinoma prostático sugiere que un proceso de múltiples pasos está involucrado en la carcinogénesis y los más razonables candidatos para la formación endógeno de genotoxinas en estas etapas tardías de la vida es la acumulación de EROs.10
Para proteger contra los efectos tóxicos de las EROs y modular sus efectos fisiológicos, las células han desarrollado un sistema intrínseco de defensa antioxidante. El sistema antioxidante enzimático es muy complejo, siendo compuesto por pequeñas moléculas de gran peso antioxidante (Vitaminas E, C, A), enzimas antioxidantes primarias (manganeso, cobre, zinc superóxido dismutasa, catalasa, glutation peroxidasa) y enzimas antioxidantes secundarias (glutation reductasa y glucosa 6 fosfato deshidrogenasa). Las proteínas y enzimas reparadoras de DNA son consideradas como parte del sistema antioxidante, así como las proteínas secuestradoras de metales son importantes en la modulación del estado celular antioxidante. El óxido nítrico modula los niveles de las EROs, en parte por su reacción con el anión superóxido, finalmente las proteínas involucradas en la respuesta al estrés celular también son importantes en la modulación del daño oxidativo; cada componente del sistema antioxidante es específicamente localizado en compartimentos subcelulares.11
La superóxido dismutasa (SOD) es una enzima que cataliza la dismutación del radical superóxido a peróxido de hidrógeno y oxígeno que a su vez pueden ser eliminados por la catalasa o la glutation peroxidasa.
El papel de la Manganeso superoxido dismutasa (Mn-SOD) en la carcinogénesis permanece incierto, la inducción de SOD2 en los tumores puede ser debida al estrés y genotoxicidad inducida por la exposición a oxidantes y a la inflamación. Esta enzima también se ha visto implicada en la resistencia de células tumorales a las drogas citotóxicas y la radiación.
Muchos estudios han sugerido que el gen de Mn-SOD podría ser un gen de supresión tumoral y que tumores malignos tienen menor actividad de Mn-SOD; sin embargo, en muchos tipos de células tumorales se ha encontrado que contienen altos niveles de Mn-SOD comparados con su contraparte no maligna.12 Está descrito en la bibliografía internacional que en células tumorales del cáncer de esófago, estómago, ovario, pleura, así como en la leucemia, hay una expresión aumentada de SOD, mientras que en cánceres como el de páncreas, colorrectal y el melanoma, hay una expresión disminuida de la enzima.12-15
¿ MATERIALES Y MÉTODOS
Sujetos de estudio: La recolección de muestras se llevó a cabo de diciembre de 2006 a marzo de 2007, seleccionando las muestras de los pacientes registrados en la libreta de cirugía del Servicio de Urología del Hospital Central Militar y que cumplieron con los criterios de inclusión, exclusión y eliminación.
Criterios de inclusión: Pacientes con diagnóstico de:
a). Cáncer de próstata con síndrome obstructivo urinario bajo; b). Hiperplasia prostática benigna, con indicación de resección transuretral prostática (RTUP) y prostatectomía radical.
Criterios de exclusión: Pacientes que: a). No autorizaron el participar en el procedimiento; b). No fueron candidatos a RTUP.
Criterios de eliminación: a). Pacientes cuyo RNA extraído y purificado presentaba una concentración y pureza inadecuada para el estudio; b). Tejido que en el traslado sufra desnaturalización del material genético.
La cantidad de tejido necesaria para la investigación fue de un gramo hasta cinco gramos. La obtención de las muestras se hizo inmediatamente después de la realización de la intervención quirúrgica; el tiempo de traslado que se tomó como máximo fue de una hora: desde la obtención de la muestra hasta su traslado al laboratorio de Biología Molecular de la Escuela Médico Militar, donde se mantuvieron a una temperatura de -70°C en el ultracongelador Revco® (Legaci ULT2186 3-35 Dupont SVVA Refrigerants) hasta el procesamiento de la extracción de RNA.
Extracción y cuantificación de RNA. El RNA total fue extraído con el kit de extracción de RNA total usando el SV Total RNA Isolation System (Promega, Madison, WI, USA), se tomaron 150 mg de cada una de las muestras con técnica estéril, evitando contaminación de RNAsas, homogenizándolas con un politrón (Omni µH International), siguiendo las indicaciones del proveedor, a la elusión final de RNA total por último se les agregó 2 µL de inhibidor de RNAasas y se guardaron a -83°C para posteriores análisis. La verificación de la integridad del RNA total se realizó por medio de electroforesis en un gel de agarosa a 2%, colocando 6 µl del RNA total extraído por muestra y se visualizaron las bandas con luz UV (EDAS 290 KODAK). La cuantificación del RNA total se llevo a cabo por medio de fluorescencia con SYBR Green, con el multidetector Synergy HT-I (BIO-TEK Instruments, Inc. Higland Park, Vermont, USA).
Estandarización de la técnica de RT-PCR en tiempo real. Para el desarrollo de la RT- PCR en tiempo real se diseñaron oligonucleótidos específicos (primers) del gen de interés (Mn-SOD) y para los genes de referencia (candidatos endógenos): subunidad ribosomal 18s, gliceraldehido-3 fosfato deshidrogenasa (GAPDH), glucosa 6 fosfato deshidrogenada (G6PDH) y -actina (BACT); los genes endógenos se validaron con el software BestKeeper32 y se tomó el más estable como control endógeno de la carga de RNA total. Las secuencias fueron obtenidas del GenBankTM (Tabla 1). La búsqueda de las secuencias se realizó en (http://www.ncbi.nlm.nih.gov/ BLAST/) para confirmar su especificidad.
Los primers sintetizados (Invitrogen, Carlsbad, CA) fueron los siguientes: gen de interés Mn-SOD; genes candidatos endógenos: BACT, 18s, GAPDH y el gen G6PDH, los cuales fueron optimizados a una temperatura de 57°C (Tabla 1).
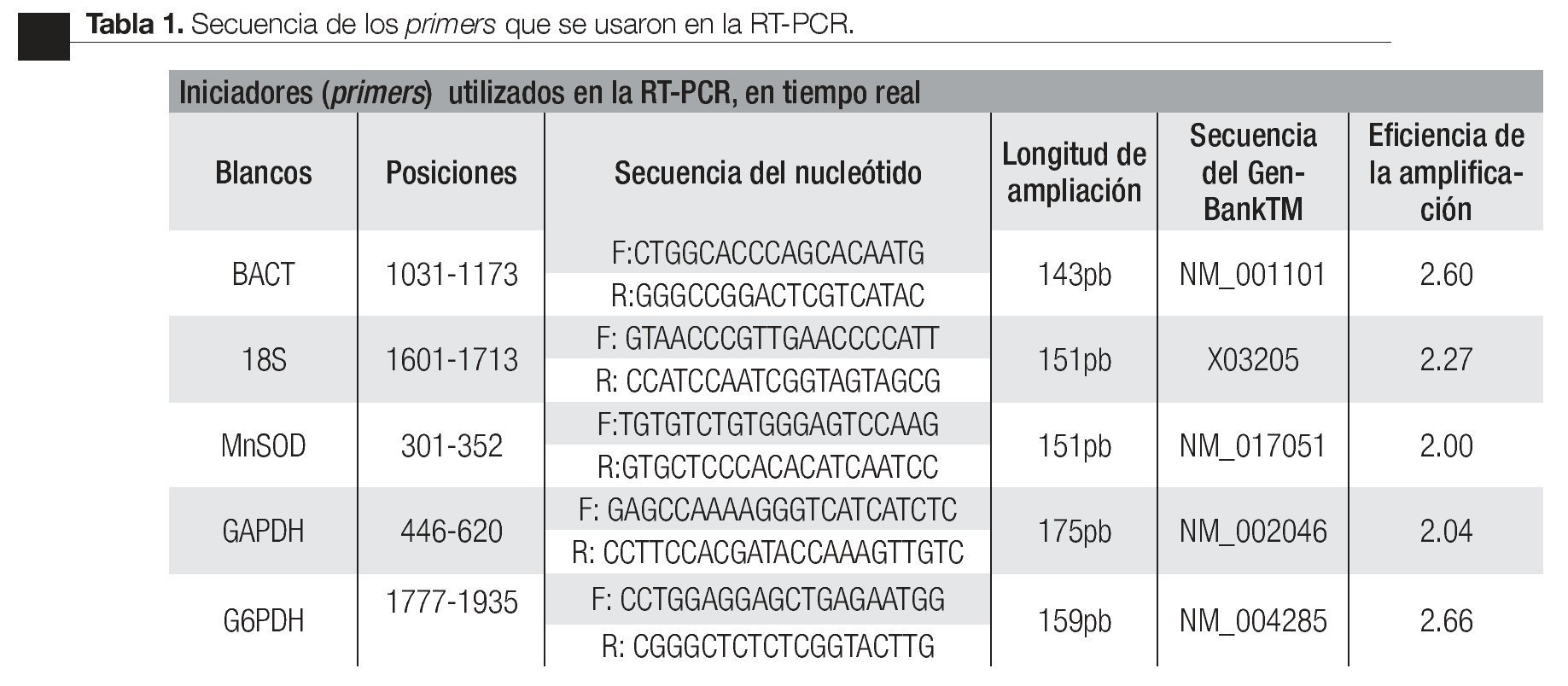
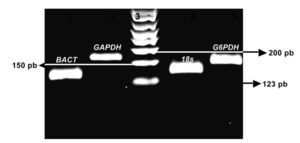
Las condiciones para la RT-PCR fueron optimizadas con un termociclador de gradiente (Gradient Px2 Thermal Cycler Hybaid, Franklin, MA) utilizando el kit SuperScriptTM III Platinum® SYBR® One-Step qRT-PCR Kit with ROX (Invitrogen, Carlsbad, CA). Las secuencias tomadas corresponden a los registros en el GenBankTM bajo el siguiente número de accesiones: Mn-SOD, NM_017051; BACT, NM_001101 ; GAPDH, NM_002046; subunidad 18s, X03205 y G6PDH, NM_004285. Los productos de amplificación por RT-PCR fueron visualizados por electroforesis en un gel de agarosa a 2% y estudiados con el sistema de análisis de electroforesis EDAS 290, (KODAK, New Haven, CT) (Imagen 1). Los resultados obtenidos de las amplificaciones como son las condiciones de temperatura, concentraciones de primers, dNTPs (nucleótidos) y volúmenes, fueron transferidos al protocolo de amplificación en tiempo real con el sistema de detección Rotor gene 6.0 (Corbett Life Science, Sidney City, Australia).
Imagen 1. Productos de la amplificación por RT-PCR en tiempo real, con las muestras de RNA total de CaP e HPB. Se observa la electroforesis en gel de agarosa al 2.0 % El carril 1 es el producto de la amplificación del gen BACT (143pb), carril 2 GAPDH (175pb), carril 3 Marcador de 123pb, carril 4 sub-unidad 18s (151pb), carril 5 G6PDH (159pb).
Protocolo de RT-PCR en tiempo real Rotor-Gene 3000. Las reacciones de la RT-PCR en tiempo real se realizaron con 10 ng de RNA extraído de los tejidos estudiados; las diluciones para la validación del control interno, cuantificación absoluta y la determinación de las eficiencias de todos los primers, se realizaron usando el kit SuperS-criptTM III Platinum® SYBR® One-Step qRT-PCR Kit with ROX (Invitrogen, Carlsbad, CA), el cual es una mezcla de reacción que contiene un complejo de Taq DNA polimerasa (Platinum) con anticuerpo, el cual inhibe la actividad a temperatura ambiente y dicho anticuerpo es desnaturalizado en la fase inicial del ciclo de la PCR (95oC a los cinco minutos). Los siguientes componentes de la reacción fueron preparados a una concentración final: de la mezcla de reacción de 6.25 µl 2X SYBR® Green I (un amortiguador contenido en SYBR® Green I dye) 0.4 mM por cada dNTP y 6 mM MgSO4, (ROX Reference Dye) el cual es un estabilizador del amortiguador (1X), 4 µL RNA total, 0.25 µl SYBR® Green One Step Enzime Mix (contenida en SuperScriptTM III RT Platinum® Taq DNA polymerase, e Inhibidor de RNasa (Recombinante de Ribonucleasa), 0.4 µl MgCl2 (50 mM), 0.4 µL del primer forward (0.4 µM), 0.4 µL del primer reverso (0.4 µM), y 0.8 µL de agua libre de RNAsas (12.5 µL de la mezcla reacción final), y llevados a tubos 100 µL. La reacción se llevó a cabo inicialmente a 52°C por 10 minutos para la síntesis de DNA y 94°C por cinco minutos para la el inicio de la actividad de la Taq polimerasa (Platinum Taq) y la predesnaturalización del híbrido RNA-cDNA, seguido de los 40 ciclos de amplificación de la PCR, cada ciclo consistente de 95°C por 20 segundos (s), 57°C por 20 segundos, 72°C por 20 segundos, el cual tuvo tres lecturas de puntos de fluorescencia a 57°C, 72°C y 83°C, respectivamente. El paso de la curva melting tuvo un intervalo de temperatura de 60°C a 98°C, con un incremento de temperatura de 0.1°C por segundo y finalmente un paso a 40°C. Para la cuantificación absoluta fue necesario determinar el ciclo umbral (Ct) para cada trascrito. La expresión tanto de los genes candidatos endógenos como del gen de interés (Mn-SOD); fueron cuantificados individualmente con el modelo estadístico BestKeeper Gene para la validación de los endógenos y con el modelo estadístico (REST©) para el análisis de las eficiencias y la cuantificación relativa de los genes endógenos y Mn-SOD.
Análisis de datos: Los datos de las eficiencias y de la cuantificación absoluta (CT) de los genes fueron analizados usando el software Rotor-Gene 6.0 (Corbett Life Science, Sidney City, Australia). La determinación de los CT fue realizada con el software antes mencionado; los datos fueron graficados con el mismo y exportados a una tabla del Excel dando regresiones lineales similares para las eficiencias de los primers, donde se compara la concentración logarítmica contra el (CT), y los datos de las curvas de calibración para Mn-SOD y GAPDH fueron analizados por el mismo software antes mencionado.
Para la determinación de la pendiente y los coeficientes correlación de Pearson se utilizó una tabla de Excel. Para la validación se utilizó el modelo estadístico BestKeeper Gene.
Análisis de datos: Los resultados se graficaron en una tabla de Excel donde previamente se importaran los CT del software Rotor gene 6.0, y se utilizó el software PRISMA tomando las relaciones representativas HPB y las muestras con CaP.
Se utilizo la prueba t de Student para compararlos cambios en la regulación génica del gen de Mn-SOD en ambos tejidos y así determinar si hay diferencia estadísticamente significativa. Para la aplicación de las pruebas estadísticas se utilizó el programa Graph Prisma versión 3.32.
¿ RESULTADOS
Del total de los 60 pacientes de los que se obtuvieron las muestras, 20 (33.3 %) tenían diagnóstico establecido de CaP, mientras que 40 (66.7%) tuvieron diagnóstico establecido de HPB. Dentro del grupo de pacientes con diagnóstico de CaP hubo un promedio de edad de 70.4 años (rango 55 a 90), el promedio de concentración del antígeno prostático específico (APE) preoperatorio en este grupo fue de 39.75 ng/mL. (rango 0.005 a 416), ocho pacientes (40%) tuvieron una concentración de APE < 4 ng/mL; dos pacientes (10%), tuvieron una concentración de APE entre 4 ng/mL y 10 ng/mL, y 10 pacientes (50%) tuvieron una concentración de APE > 10 ng/mL. El puntaje en la escala de Gleason fue de cinco en un caso (5%), seis en un caso (5%), siete en seis casos (30%), ocho en nueve casos (45%), nueve en tres casos (15%). A 18 pacientes (90%, se les realizó RTUP, mientras que a dos (10%) se les realizó prostatectomía radical.
Dentro del grupo de pacientes con diagnóstico establecido de HPB (40 pacientes), hubo un promedio de edad de 68.3 años (rango 47 a 86), el promedio de concentración de antígeno prostático específico preoperatorio fue de 7.21 ng/mL. (rango 0.26 a 58.6), 20 pacientes (50%) presentaron una concentración de APE < 4 ng/mL, 13 pacientes (32.5%) tuvieron una concentración de APE de entre 4ng/mL y 10 ng/mL y siete pacientes (17.5%) tuvieron una concentración de APE > 10 ng/mL. A los 40 pacientes se les realizó RTUP.
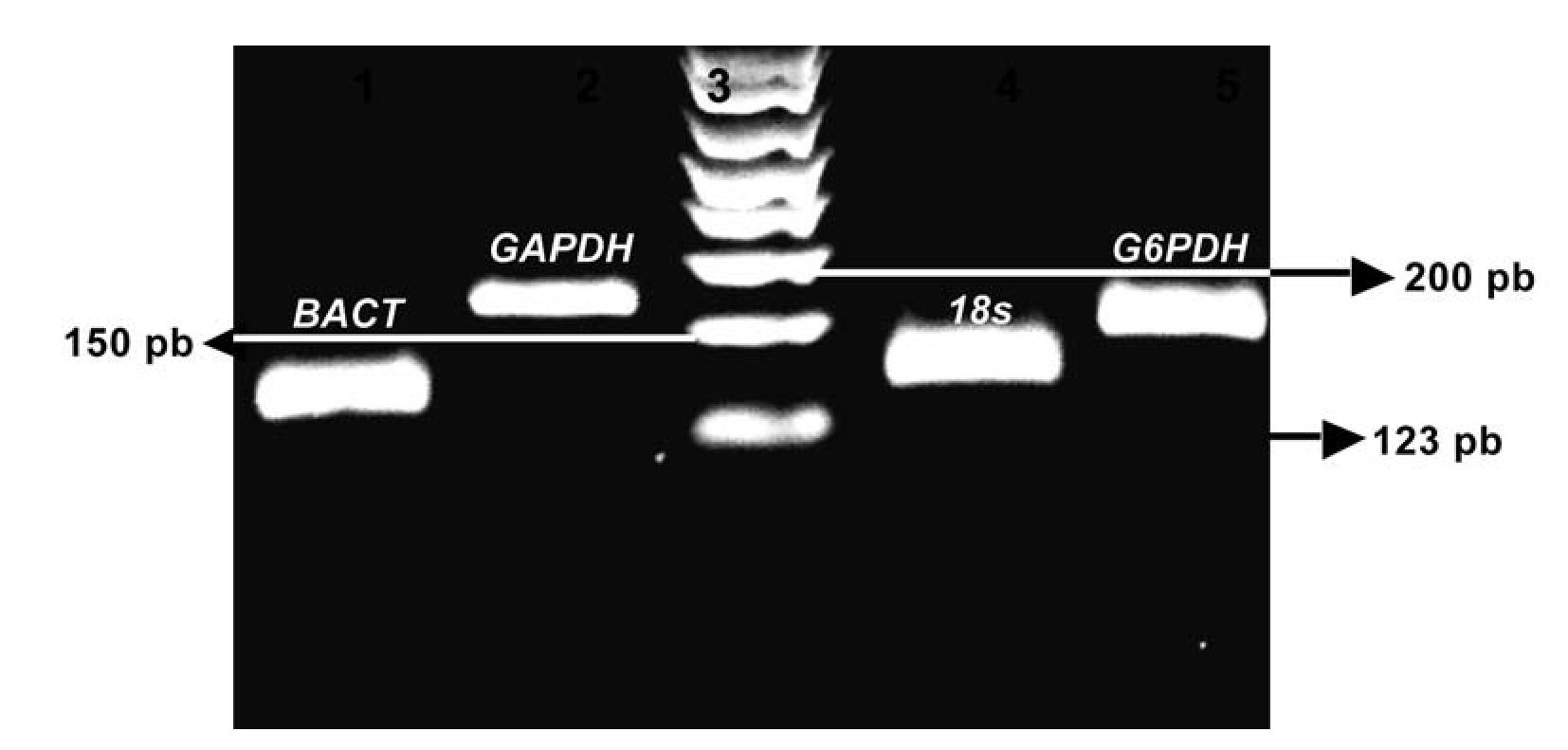
Para poder determinar el endógeno adecuado y el más estable, se realizó RT-PCR en tiempo real por triplicado de cada una de las muestras de CaP y se compararon tomando las CT (la media del triplicado de cada muestra); estos datos se exportaron al software REST (Imagen 2). Después de exportar y analizar los datos se tomó como gen endógeno a GAPDH, el cual presentó una estabilidad superior a los otros tres (p <0.005) y un coeficiente de correlación de Pearson de 0.953 con el gen de interés Mn-SOD (Tabla 2).
Imagen 2. Curvas de disociación de los productos de los genes analizados. Con la metodología del SYBR Green I se representa en la curva melting de cada amplicon analizado, inicialmente usando el software Rotor-Gene 6.0 (Corbett Life Science, Sidney City, Australia). El análisis de la curva melting es un método rápido y exacto para observar la especificidad de la PCR. Los picos de las gráficas representan las temperaturas en (ºC) para el gen Mn-SOD, 87.7ºC, gen BACT 86ºC, gen subunidad 18s, 85.9ºC, gen G6DPH, 83.5 ºC y gen GADPH, 84.1 ºC los cuales fueron sometidos al protocolo de disociación a una temperatura de 60-98°C.
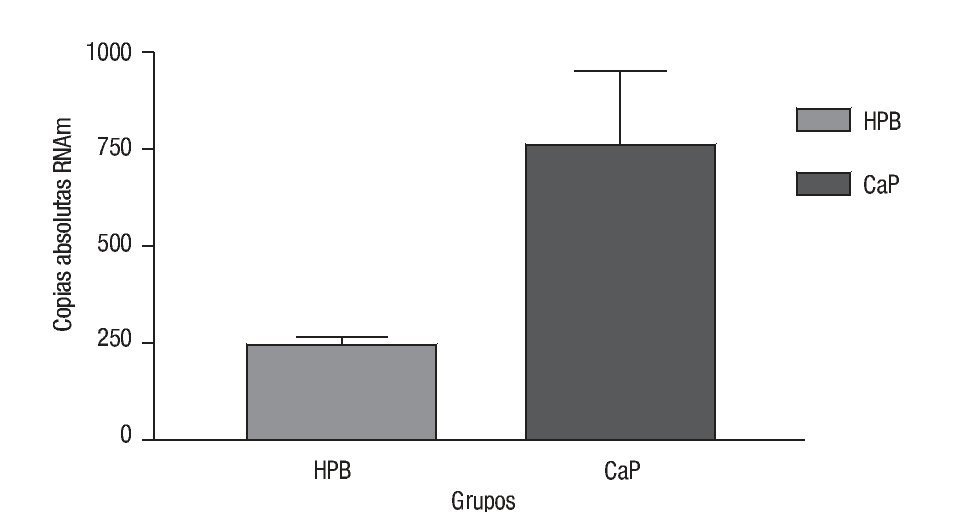
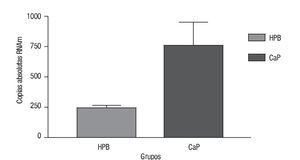
Las copias absolutas de mRNA de Mn-SOD de CaP y HPB (Imagen 3) se compararon con la prueba t con una diferencia estadística de p = 0.0002; la media de copias absolutas para CaP fue de 765.7 con una desviación estándar de la media de 185.2. La media de HPB fue de 242.8 con una desviación estándar de la media de 18.43. Por lo que después del análisis de los resultados de estos datos de expresión encontramos que hay 3.15 veces más de sobreexpresión génica de Mn-SOD en CaP comparado con HPB (Imagen 4).
Imagen 3. Electroforesis representativa de los RNA extraídos de los tejidos con CaP e HPB (150ng), en gel de agarosa al 2.0 %. En la imagen, se observan las bandas características de las subunidades 18s y 28s, las cuales nos indican que no hay evidencia de degradación de las muestras y a su vez nos confirma la presencia del resto del RNA total extraído debido a la integridad de las bandas antes mencionadas realizado con el protocolo kit de SV Total RNA Isolation System (Promeg®, Madison, WI, USA).
Imagen 4. Expresión génica de Mn-SOD. Se compararon las copias absolutas de Mn-SOD en ambos grupos de CaP y HPB (p = 0.0002), en el eje de las y se muestra el número de copias absolutas de ambos grupos. Para HPB (SEM = 18.43), para CaP (SEM = 185).
¿ DISCUSIÓN
En nuestro estudio demostramos que el gen que codifica para Mn-SOD se encuentra expresado 3.15 veces más en el tejido con cáncer de próstata que en la hiperplasia prostática benigna. Nosotros creemos que este aumento puede indicar que la actividad de la enzima esta elevada, ya que en otro estudio se demostró lo mismo con respecto a esta enzima, Mn-SOD (datos no mostrados de inmunohistoquímica) y así también, puede ser parte de los mecanismos de defensa contra los metabolitos del oxígeno producidos durante el estrés oxidativo. Por otra parte se puede postular que esta actividad aumentada esté provocando la alteración de funciones celulares produciendo respuestas como proliferación celular y muerte celular programada (apoptosis), pudiendo ser una de las causas de la evolución de la enfermedad, incluso del grado de malignidad.
Han habido muchos informes sobre la relación entre EROs y proteínas, enzimas y cofactores que pueden ser transformados por moléculas modificadas por los radicales libres y que pueden inducir la carcinogénesis; se sabe que la sobre-expresión de Mn-SOD y la glutation-transferasa (GST) inducen junto con el desbalance oxidativo daño a la membrana celular que aparece en varios tumores humanos.
Hay datos que muestran que la expresión de las enzimas antioxidantes, como Mn-SOD y GST, aumentan en ciertas displasias, incluso se ha observado este aumento en el suero de pacientes con carcinoma del esófago, estómago, pulmón y ovario. Es posible que estas enzimas o su producto génico (mRNA), puedan servir como marcadores tempranos de cambios premalignos que tengan un riesgo alto de cáncer prostático invasivo.
Las anteriores observaciones sugieren que el desarrollo selectivo de inhibidores para la Mn-SOD serán de gran interés como potencial estrategia terapéutica para ciertos cánceres, incluso el de próstata.16
Es muy probable que cambios epigenéticos o alguna mutación en el gen de Mn-SOD sean la causa del nivel alto que encontramos en la expresión de Mn-SOD en el CaP y que esto a su vez sea la causa de los altos niveles de esta proteína encontrados en la mitocondria de las células con CaP, hallazgo encontrado en otro de nuestros estudios (datos no mostrados), esto podría tener efectos potenciales en la supervivencia y proliferación de las células tumorales, hecho que se ha encontrado en otros tumores que se comportan en forma agresiva y con mal pronóstico para el paciente.
La enzima Mn-SOD probablemente juega un papel muy importante en la resistencia a los tratamientos de varios tumores y se ha observado que la sobreexpresión de enzimas antioxidantes simultáneamente, participan en la evolución de tumores invasivos, por lo que nuestros resultados demuestran que la sobreexpresión génica de esta enzima también juega un papel importante, ya que este producto génico es necesario para la codificación y traducción de dicha proteína.
Para evaluar los cambios en la expresión de este gen, empleamos la metodología de la Reacción en Cadena de la Polimerasa en combinación con Retrotranscripción reversa (ver metodología), empleando además la metodología en tiempo real, con ello analizamos los niveles de expresión del gen de Mn-SOD, como ya comentamos antes el gen se encuentra sobre-expresado 3.15 veces más, comparado con tejidos hiperplásicos, esta puede ser la causa del aumento de la concentración de su producto génico (Mn-SOD mitocondrial) de los pacientes con cáncer de próstata, aunque hacen falta más estudios para explicar la causa específica de la inmunorreactividad alta de MnSOD en este tejido.14 Finalmente sobre este aspecto hay controversia ya que en otros resultados, se ha sugerido que un incremento en la expresión del gen Mn-SOD puede inducir reversión de la transformación fenotípica en las células tumorales.13
Por otro lado nuestros resultados sugieren que hay una alteración en el balance pro-oxidativo-antioxidante en el CaP, este desbalance, se sabe que altera los procesos oxidoreducción celulares, el crecimiento, proliferación y ciclos celulares, ya que se sabe que ciertos radicales libres median la activación de vías de transducción celular, de factores de trascripción como son Fos, Jun, y el factor nuclear KB y un aumento en la actividad mitocondrial en dichas células.17
Por otro lado se ha demostrado que hay diferencias en la morfología, crecimiento y tumorogenicidad celular de acuerdo con el incremento de la Mn-SOD tanto a nivel génico como a nivel de proteína. Nuestros resultados sugirieron que más allá de la proteína Mn-SOD, el gen sobreexpresado altera la situación intracelular en la mitocondria o en el número mitocondrial. Varios estudios han sugerido que ésta sobreexpresión juega un papel importante en la alteración del número, talla, forma y distribución mitocondrial. Los resultados que se presentan en este estudio sugieren que el gen de expresión Mn-SOD puede tener efecto sobre ambos procesos tanto en la función mitocondrial, como en el crecimiento de células tumorales. Oberley y colaboradores, analizaron que el decremento de la actividad Mn-SOD, como la disminución de la expresión génica juega un papel crítico en la transformación maligna, ya que el incremento experimental en la actividad Mn-SOD puede inducir diferenciación en células tumorales.11
¿ CONCLUSIONES
Mediante el análisis por RT-PCR en tiempo real, se encontró una sobreexpresión génica de 3.15 en cáncer de próstata comparado con hiperplasia prostática benigna.
Los resultados nos muestran que no hay relación entre las concentraciones del APE y la sobreexpresión génica de Mn-SOD.
La determinación de la expresión génica de enzimas antioxidantes estrechamente relacionadas con el cáncer, como lo es la Mn-SOD, puede ser empleada en un futuro como marcador tumoral para el diagnóstico temprano de la enfermedad, considerando el bajo costo de esta técnica.
Correspondencia:
Dr. Esaú Floriano Sánchez.
Escuela Médico Militar. Cerrada de palomas S/N. Col. Lomas de San Isidro. México, D.F.
Teléfono: 5540 7728 extensión 175; Fax: (52) 5520 2121.
Correo electrónico:floriano_esa@yahoo.com