conocer la tasa de concordancia del ganglio marcado con semilla Magseed® con el ganglio centinela marcado mediante tecnecio, en las pacientes con enfermedad ganglionar en el momento del diagnóstico que han recibido tratamiento neoadyuvante.
Pacientes y métodosestudio descriptivo retrospectivo de 44 mujeres diagnosticadas de carcinoma de mama estadios cT1-4/cN1/cM0, que recibieron quimioterapia neoadyuvante entre enero 2016 y diciembre 2020, y que tras una reevaluación radiológica se realizaron una cirugía mamaria con ganglio centinela en el Hospital General Universitario de Alicante. En las pacientes cN1 con respuesta radiológica axilar completa, la detección del ganglio centinela se llevó a cabo mediante doble técnica, extrayéndose por lo menos 3 ganglios. Además, se realizó una disección axilar dirigida mediante semilla magnética Magseed®, para su correcta localización y escisión.
Resultadosla tasa de concordancia al realizar la disección axilar dirigida fue del 93,2%. La tasa de respuesta completa tras la quimioterapia neoadyuvante fue del 45,45%.
Conclusionesla disección axilar dirigida mejora la estadificación axilar tras la quimioterapia neoadyuvante, ya que reduce la tasa de falsos negativos respecto a la biopsia selectiva del ganglio centinela de manera aislada.
To know the concordance rate of the ganglion marked with Magseed® with the sentinel node marked by technetium, in patients with limph node disease at diagnosis, that had received neoadjuvant treatment.
Patients and methodsRetrospective descriptive study of 44 women, diagnosed with stage cT1-4 / cN1 / cM0 breast carcinoma, who received neoadjuvant chemotherapy between January 2016 and December 2020, and who after radiological re-evaluation, have undergone breast surgery with sentinel node at the General University Hospital of Alicante. In cN1 patients with a complete axillary radiological response, detection of the sentinel node is performed using a double technique, removing at least 3 nodes. In addition, axillary dissection directed by Magseed® magnetic seed is performed, for its correct location and excision.
ResultsThe concordance rate when performing targeted axillary dissection was 93.2%. The complete response rate after neoadjuvant chemotherapy was 45.45%.
ConclusionsTargeted axillary dissection improves the axillary staging after neoadjuvant chemotherapy, since it improves the false negative rate with respect to sentinel lymph node biopsy in isolation.
Los avances en los estudios en las pacientes con cáncer de mama han permitido paulatinamente disminuir la morbilidad quirúrgica, desescalando las cirugías hacia intervenciones menos agresivas. Así ocurre también con el tratamiento de la axila, ejemplo de ello es la biopsia selectiva del ganglio centinela (BSGC).
Sin embargo, un subgrupo de pacientes que presentan la enfermedad localmente avanzada, identificada mediante un diagnóstico histopatológico de metástasis ganglionar, y que son subsidiarias de tratamiento con quimioterapia neoadyuvante, siguen recibiendo cirugías axilares agresivas, con gran morbilidad secundaria1,2, pese a que en torno a un 40% de ellas habrán alcanzado una respuesta completa axilar tras la terapia sistémica primaria (TSP)3,4. Conocer qué pacientes han conseguido una respuesta patológica completa y podrían beneficiarse de un tratamiento conservador axilar es un reto actualmente.
En un intento de disminuir esta morbilidad, se propuso sustituir la linfadenectomía axilar por BSGC para la estadificación ganglionar en las pacientes posquimioterapia. Hoy en día la BSGC posquimioterapia es una técnica ampliamente aceptada en las pacientes con axila negativa clínicamente (cN0)5. Además, gracias a diversos estudios (ACOSOG Z1071, SENTINA, SN FNAC)3,6,7 se está realizando BSCG en las pacientes con axila positiva al diagnóstico (cN1), que tienen una respuesta radiológica completa axilar tras la quimioterapia (cN0). Para realizar esta técnica de BSGC posquimioterapia asumiendo una tasa de falsos negativos inferior al 10% se deberían utilizar 2 trazadores y localizar «al menos» 3 ganglios centinelas8–10.
Recientemente, nuevas líneas de investigación sugieren que esta tasa de falsos negativos podría disminuirse realizando una disección axilar dirigida (TAD, targeted axillary dissection), combinando la BSGC y la extirpación del ganglio marcado previamente a la intervención5,11. Para realizar esta técnica una de las opciones disponibles es la semilla magnética. Magseed® es un tipo de sistema localizador magnético, no radiactivo, que fue aprobado por la FDA para la localización de lesiones mamarias12,13. Greenwood et al.13 concluyen que la identificación del ganglio axilar patológico posquimioterapia, previamente marcado con Magseed®, fue exitosa en todos los casos. Mariscal et al.14, describieron una disminución de la tasa de falsos negativos del 21,4 al 5,9% cuando se comparó la BSCG con la TAD con Magseed®.
Atendiendo a los avances en este campo, se presenta una revisión de nuestra casuística que pretende establecer la tasa de concordancia del ganglio centinela cuando es marcado con Magseed® frente al marcaje mediante tecnecio.
Material y métodosSe expone un estudio descriptivo retrospectivo de las pacientes diagnosticadas de carcinoma de mama cT1-4cN1cM0 tratadas con quimioterapia neoadyuvante entre enero de 2016 y diciembre de 2020, y que tras una reevaluación radiológica han recibido una cirugía mamaria con ganglio centinela en el Hospital General Universitario de Alicante (HGUA).
ObjetivosEl objetivo principal fue determinar la tasa de concordancia del ganglio marcado con Magseed® con el ganglio centinela detectado mediante tecnecio.
Los objetivos secundarios fueron identificar la respuesta anatomopatológica del ganglio centinela tras la quimioterapia neoadyuvante y describir el número de ganglios extirpados.
Criterios de inclusiónLos criterios de inclusión son:
- •
Mujeres con cáncer de mama cN1 al diagnóstico.
- •
Ser mayores de 18 años.
- •
Mujeres con cáncer de mama que han recibido quimioterapia neoadyuvante.
- •
Realización de BSGC tras respuesta radiológica completa tras la quimioterapia neoadyuvante.
- •
Mujeres intervenidas en el HGUA con firma del consentimiento informado.
El criterio de exclusión es ser mujer con cáncer de mama cN2 al diagnóstico.
ProcedimientoSegún el protocolo del HGUA, en las pacientes con cáncer de mama que son subsidiarias de TSP y que son cN1 al diagnóstico, se lleva a cabo un marcaje de los ganglios patológicos (máximo 2) mediante clip tipo Tumark®, de manera que puedan ser identificados y reevaluados al finalizar el tratamiento neoadyuvante. Actualmente se indica BSCG tras TSP en las pacientes cN1 de inicio con respuesta radiológica axilar completa (tanto por resonancia magnética como por ecografía). En estas pacientes, la detección del ganglio centinela siempre se lleva a cabo mediante una doble técnica (tecnecio y hierro supraparamagnético [Magtrace®]), debiendo extraerse al menos 3 ganglios. Además, se realiza TAD desde noviembre de 2018, de tal manera que, a aquellas pacientes con ganglio marcado previamente, tras la TSP, se les coloca la semilla magnética (Magseed®) o un arpón para su correcta localización y escisión.
El día antes de la cirugía, las pacientes acuden al Servicio de Medicina Nuclear para colocar el radiotrazador con tecnecio y se realizan una linfogammagrafía a los 60 minutos de la inyección.
El análisis de los ganglios centinela se realiza de manera intraoperatoria con citología y one-step nucleic acid amplification (OSNA). Ante cualquier resultado positivo (células tumores aisladas, micrometástasis o macrometástasis) o no localización del ganglio centinela, se realiza linfadenectomía axilar. Las micrometástasis se definen por OSNA como un recuento de mRNA de citoqueratina-19 de entre 250-5.000 copias y las macrometástasis mayor de 5.000 copias. Las células tumorales aisladas se definen cuando el número de copias es menor de 250. En caso de ganglio centinela negativo no se realiza más abordaje axilar.
Análisis estadísticoPara el análisis estadístico, se empleó el paquete estadístico SPSS 22 para Windows. Se ha realizado un análisis descriptivo en el que los parámetros cualitativos se han descrito como frecuencias y porcentajes, y los parámetros cuantitativos como medias y desviaciones estándar. Para comparar las variables cuantitativas no paramétricas entre 2 grupos se utilizó el test de Mann-Whitney, T Student y Chi cuadrado. Un p-valor < 0,05 se requirió para determinar significación estadística.
ResultadosDe las 238 mujeres con cáncer de mama que recibieron TSP en los 5 años del estudio, 44 cumplieron los criterios de inclusión (cN1 al inicio con respuesta radiológica completa tras la quimioterapia neoadyuvante).
La edad media al diagnóstico son 47,64 años (rango de 27 a 75 años). El tipo histológico más frecuente fue el carcinoma de tipo no especial (NOS) grado III (65,9%). En cuanto a la inmunohistoquímica, el perfil más habitual fue el Luminal B (38,6%), seguido del triple negativo (35,1%) (tabla 1).
Descriptivo de las variables del estudio (n=44)
| n (%) | |
|---|---|
| Diagnóstico AP | |
| NOS I | 1 (2,3) |
| NOS II | 14 (31,8) |
| NOS III | 29 (65,9) |
| Inmunohistoquímica | |
| Luminal A | 1 (2,3) |
| Luminal B-Her2 negativo | 17 (38,6) |
| Luminal B-Her2 positivo | 6 (13,6) |
| Her2 puro | 5 (11,4) |
| Triple negativo | 15 (34,1) |
| Tamaño tumoral al diagnóstico | |
| T1 | 9 (20,45) |
| T2 | 28 (63,64) |
| T3 | 7 (15,9) |
| Tipo de cirugía mamaria | |
| Conservadora | 24 (54,5) |
| Mastectomía | 20 (45,5) |
AP: anatomopatológico; n: tamaño muestral; NOS: carcinoma infiltrante de tipo no especial.
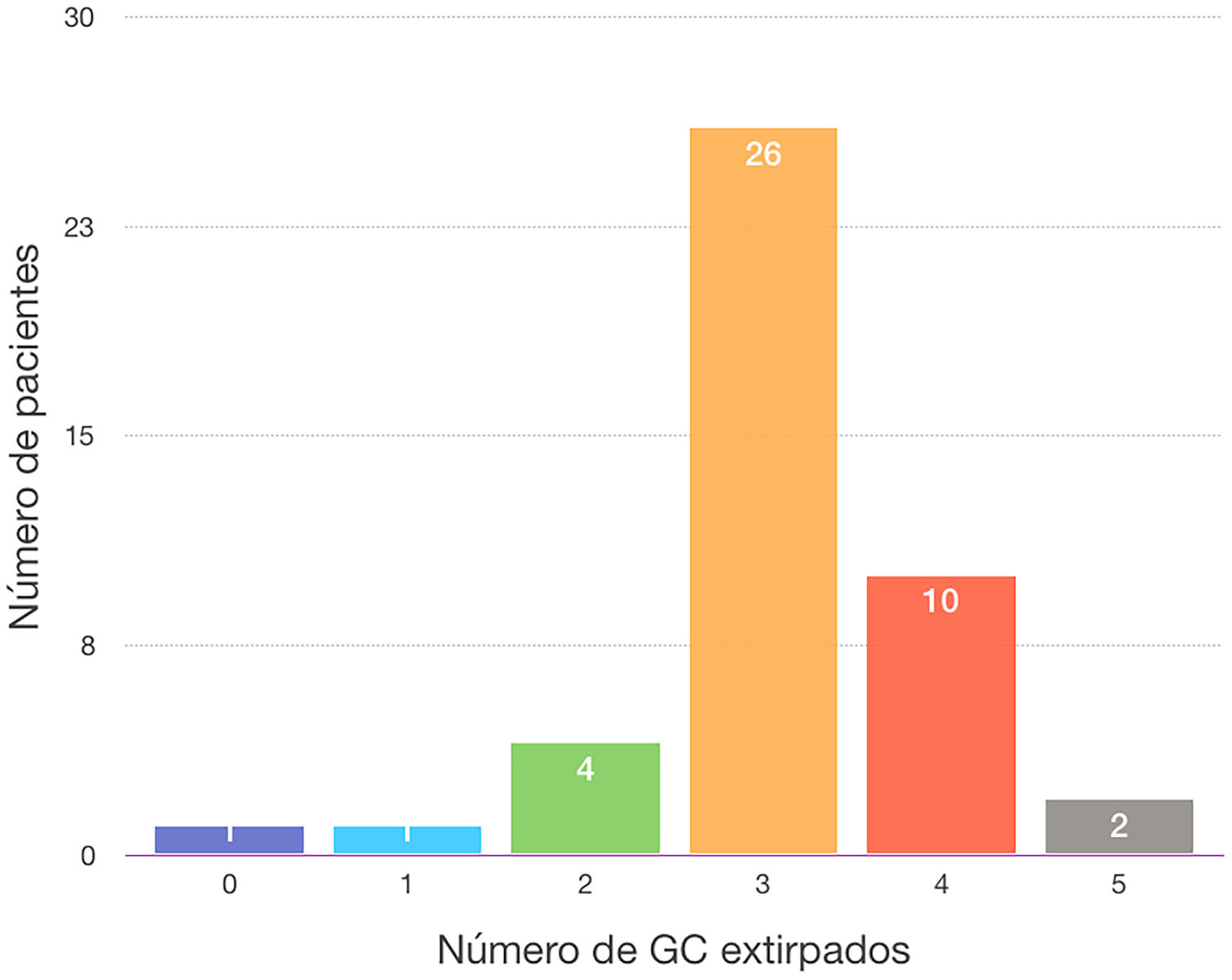
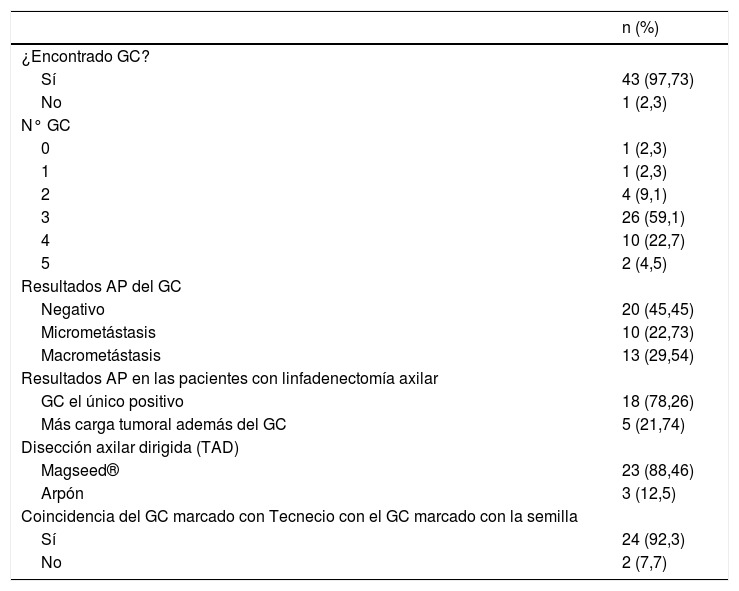
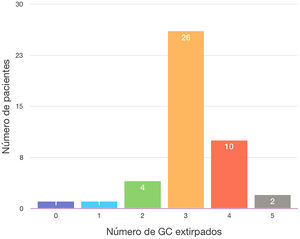
El ganglio centinela fue localizado en 43 de las 44 mujeres de la muestra (97,7%). En una paciente no migró ninguno de los 2 trazadores empleados (2,3%), por lo que se realizó una linfadenectomía axilar directa, siendo todos los ganglios de la misma negativos (10 en total). La media del número de ganglios centinelas extirpados fue de 3,11. En el 86,36% de los casos se obtuvieron 3 o más ganglios centinelas. Se localizó en una paciente un ganglio (2,3%) que al resultar su análisis positivo se realizó una linfadenectomía axilar (total 2 ganglios +/9 ganglios en total); en 4 pacientes 2 ganglios (9,1%), en 2 de estas pacientes los 2 ganglios centinelas fueron negativos, no realizando linfadenectomía axilar y siendo operadas en el año 2016. En otra paciente (año 2017) se colocó un arpón para la TAD, siendo el ganglio positivo y realizando linfadenectomía axilar (1+/15). El último caso, del año 2020, uno de los 2 ganglios estaba marcado con semilla Magseed® para la TAD, resultando ambos negativos, no realizando linfadenectomía axilar) (tabla 2 y fig. 1).
Análisis descriptivo de los ganglios centinela (n=44)
| n (%) | |
|---|---|
| ¿Encontrado GC? | |
| Sí | 43 (97,73) |
| No | 1 (2,3) |
| N° GC | |
| 0 | 1 (2,3) |
| 1 | 1 (2,3) |
| 2 | 4 (9,1) |
| 3 | 26 (59,1) |
| 4 | 10 (22,7) |
| 5 | 2 (4,5) |
| Resultados AP del GC | |
| Negativo | 20 (45,45) |
| Micrometástasis | 10 (22,73) |
| Macrometástasis | 13 (29,54) |
| Resultados AP en las pacientes con linfadenectomía axilar | |
| GC el único positivo | 18 (78,26) |
| Más carga tumoral además del GC | 5 (21,74) |
| Disección axilar dirigida (TAD) | |
| Magseed® | 23 (88,46) |
| Arpón | 3 (12,5) |
| Coincidencia del GC marcado con Tecnecio con el GC marcado con la semilla | |
| Sí | 24 (92,3) |
| No | 2 (7,7) |
AP: anatomopatológico; GC: ganglio centinela.
En cuanto al resultado anatomopatológico del ganglio centinela, en el 45,45% de los casos se informó un resultado negativo del ganglio, confirmando la respuesta patológica completa axilar. En las 23 pacientes restantes, con micro y macrometástasis, se realizó una linfadenectomía axilar (tabla 2).
Tras el estudio histológico en diferido de las 23 linfadenectomías axilares, en el 78,26% el ganglio centinela fue el único ganglio positivo encontrado. En el 59% de las pacientes del estudio se realizó TAD, colocándose 23 semillas Magseed® y 3 arpones. Se pudo recuperar el 100% de las semillas y los arpones. No hubo incidencias durante la cirugía. De esos 26 ganglios marcados, 24 fueron también ganglio centinela con tecnecio (92,3% de concordancia) (tabla 2).
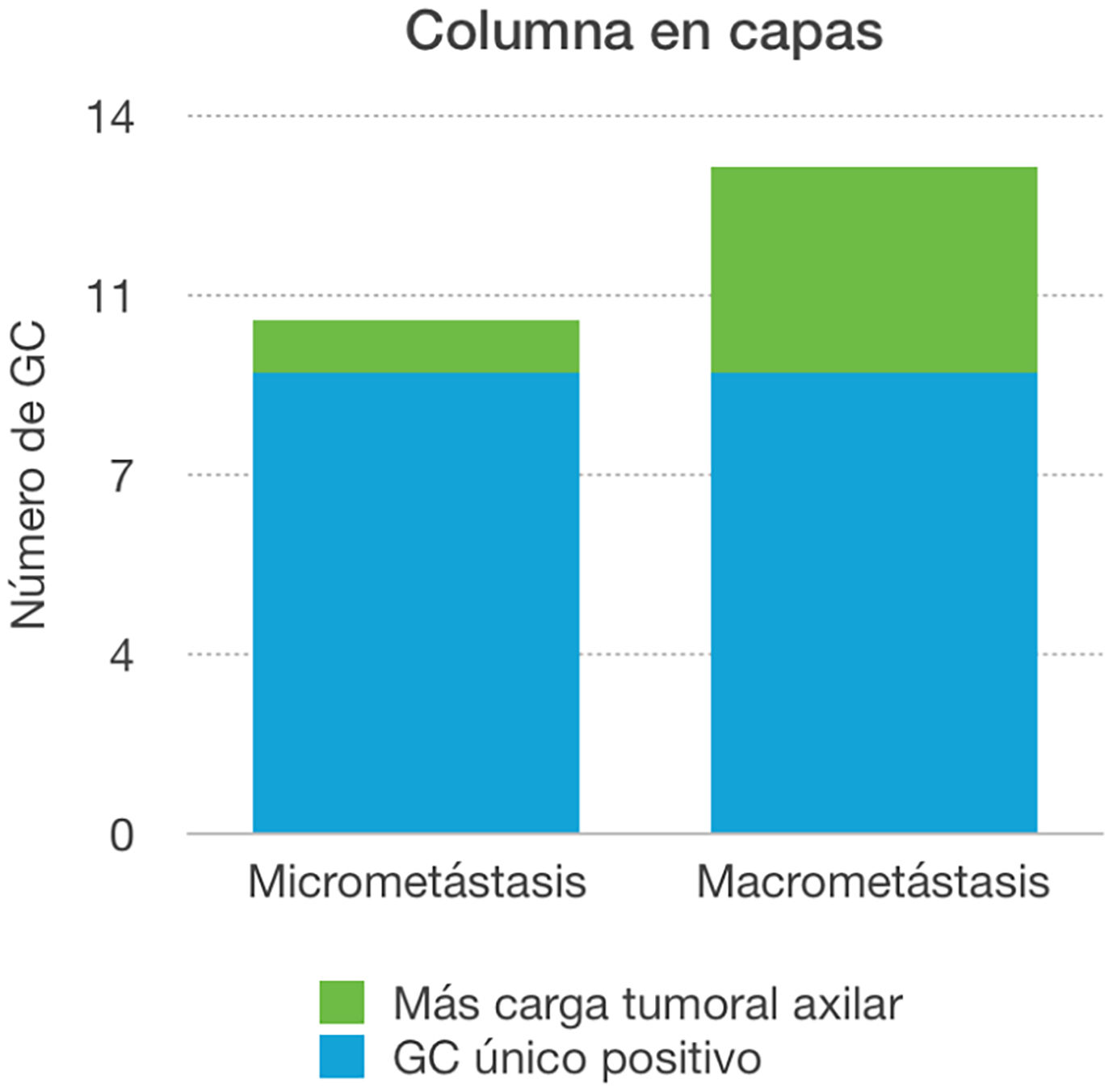
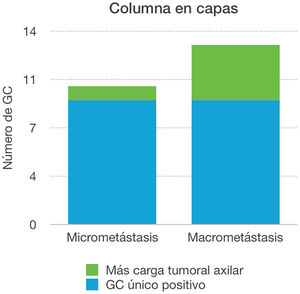
En cuanto al análisis separado de la carga axilar en función del resultado positivo del ganglio centinela, se evidenció que de las 10 pacientes con micrometástasis, en el 90% de los casos, ese ganglio fue el único afecto en la linfadenectomía axilar. Sin embargo, cuando el ganglio centinela fue positivo a macrometástasis en el 69,23% el ganglio centinela fue el único ganglio positivo, mientras que en 4 casos (30,77%) detectamos otros ganglios patológicos, siendo las diferencias estadísticamente no significativas (p > 0,05) (fig. 2 y tabla 3).
Dados los progresos en el tratamiento neoadyuvante en las pacientes con cáncer de mama con afectación ganglionar axilar al diagnóstico, existe un interés creciente en el uso de técnicas mínimamente invasivas que puedan identificar a las pacientes que logran una repuesta anatomopatológica completa después de la TSP con el fin de evitar la linfadenectomía axilar. El dilema surge en la dificultad para identificar a priori a estas pacientes, con el fin de ajustar la indicación quirúrgica a su nueva estadificación axilar.
Tras señalarse una tasa de falsos negativos (TFN) elevada con el uso de un solo trazador en la BSGC (superior al 10%), actualmente se realiza la BSGC utilizando un doble trazador y obteniendo al menos 3 ganglios centinela3,6,7. Nosotros actualmente utilizamos tecnecio y hierro supraparamagnético (Magtrace®). En el ensayo clínico llevado a cabo por la ACOSOG Z10713, se objetivó una tasa de falsos negativos del 12,6% en las pacientes con metástasis axilar tratadas con quimioterapia y posterior BSGC, la cual disminuyó a 9,1% cuando se obtenían más de 3 ganglios centinela. Además, cuando se identificaba el ganglio marcado previo a la neoadyuvancia con un clip, la TFN disminuyó al 6,8%. En nuestro centro se realiza desde noviembre de 2017 TAD con arpón, dado que era el procedimiento estándar para la localización de las lesiones no palpables. Tiene la gran ventaja de ser barato, sin embargo, resulta incómodo para la paciente y puede movilizarse15–19. A partir de noviembre de 2018 comenzamos el uso de la semilla Magseed®, dejando de lado el arpón por las desventajas que este nos mostraba. Su detección resulta sencilla mediante el sistema Sentimag®, ya que tenemos amplia experiencia en el uso de esta sonda dado que la utilizamos para la detección del ganglio centinela con el trazador de hierro. Magseed® es una semilla magnética, no radioactiva, compuesta por acero inoxidable, que mide 1 × 5 mm, que puede implantarse antes de la cirugía, facilitando la programación quirúrgica y mejorando la comodidad tanto del cirujano como de las pacientes. La colocación de la semilla Magseed® es realizada por un radiólogo sin necesidad de interactuar con otros servicios. El principal inconveniente que tiene este sistema es su precio y que además puede alterar la resonancia magnética, por lo que debe realizarse su colocación tras el estudio de la respuesta a la quimioterapia. Tal y como se ha descrito en el apartado de resultados, la detección de la semilla no supone generalmente un problema (100% de localización en esta revisión).
Nuestra alta tasa de localización del ganglio centinela tras TSP (97,7%) nos lleva, una vez más, a afirmar la realización de BSGC tras la quimioterapia neoadyuvante, tal y como está descrito en la literatura3,6,7.
Respondiendo al objetivo principal, la tasa de concordancia entre el ganglio marcado previo a la quimioterapia (TAD) y el ganglio centinela con tecnecio fue excelente (92,3%). Dicha tasa de concordancia se encuentra por encima de la media publicada en un artículo de revisión de Ersoy et al.1. De los 2 casos en los que no hubo concordancia (7,7%), uno de ellos no pudo ser evaluado porque no migró el tecnecio.
Como se desprende de los resultados, en el 86,3% de las mujeres operadas se obtuvieron al menos 3 ganglios centinela, siguiendo las recomendaciones actuales de la BSGC posquimioterapia para la disminución de la TFN. De los 6 casos (13,7% de la muestra) en que se identificaron menos de 3 ganglios centinela, en 3 de ellos hicimos linfadenectomía axilar, bien porque no migró el tecnecio o bien porque el ganglio centinela fue positivo. En los 3 casos restantes se obtuvieron ganglios centinela negativos y no realizamos linfadenectomía axilar: 2 de ellas son pacientes intervenidas en el año 2016 y en ese momento no seguíamos los protocolos actuales y el tercer caso, aunque operada en el año 2020, individualizamos el caso al ser una mujer de 75 años.
En las pacientes en las que se realizó linfadenectomía axilar por ser el ganglio centinela positivo, el 78,26% (n=18), el ganglio centinela fue el único positivo del total de ganglios obtenidos. Si desglosamos estos resultados según la carga axilar del ganglio centinela, en el 90% de los casos de micrometástasis no se encontraron más ganglios positivos. Sin embargo, ese porcentaje baja al 69,23% cuando el ganglio centinela era positivo a macrometástasis. Estos resultados muestran una tendencia a tener menor carga axilar total ante el resultado de una micrometástasis en el ganglio centinela, por lo que abre la puerta a futuros debates acerca del manejo axilar, si bien nuestros resultados no son estadísticamente significativos debido al bajo tamaño muestral. Hoy por hoy, tal y como nos muestra el estudio de la Dra. Morrow20, lo aceptado es realizar una linfadenectomía axilar ante cualquier resultado de positividad en el ganglio centinela.
Es preciso estandarizar procedimientos con el fin de ofertar el mejor tratamiento a las pacientes. Así Boughey et al.21 establecen unos estándares para que todos los cirujanos que se dedican a la cirugía de la mama operen con base en los mismos criterios. A nivel de la cirugía de la axila, se aconseja la localización del ganglio previamente clipado y biopsiado.
Actualmente, desde las principales sociedades científicas (NCCN10, SESPM22, o la 16th St. Gallen International Breast Cancer Conference23), en aquellas mujeres con diagnóstico de N+ (ganglios positivos) al inicio y que han recibido quimioterapia neoadyuvante, con respuesta completa a nivel axilar, se recomienda realizar la técnica de BSGC con un doble trazador, con extracción de al menos 3 ganglios y realizar TAD.
ConclusiónExiste una alta tasa de concordancia entre el ganglio biopsiado prequimioterapia y posteriormente marcado para su exéresis (TAD) y el ganglio centinela. Esta nueva técnica ayuda a disminuir la TFN y por tanto debe ser considerada el nuevo estándar en el manejo de la paciente con cáncer de mama y axila positiva.
Una de las opciones para TAD son las semillas magnéticas, dado que son un sistema seguro y sencillo, cómodo para el paciente y para el cirujano.
En el 45,45% de las pacientes inicialmente N1 hemos podido obviar la linfadenectomía axilar gracias a que el ganglio centinela fue negativo, disminuyendo así posibles morbilidades a la paciente.
En aquellas pacientes cuyo ganglio centinela fue positivo a micrometástasis, solo en el 10% de las mismas hubo más carga tumoral axilar.
Consideraciones éticasTodas las pacientes ofrecieron el consentimiento para la recogida de datos. La información de las pacientes incluidas en nuestro trabajo ha sido tratada de manera anónima y confidencial. La base de datos generada por nuestra unidad solo es accesible por miembros del equipo investigador, quedando protegida de usos no permitidos por personas ajenas a la investigación.
El tratamiento, la comunicación y la cesión de los datos de carácter personal de todas las participantes se ajusta a lo dispuesto en la Ley Orgánica 3/2018 de 5 de diciembre de Protección de Datos Personales y Garantía de los Derechos Digitales y siguiendo las normas de bioética de la declaración de Helsinki de la Asociación Médica Mundial sobre principios éticos para las investigaciones médicas.
FinanciaciónEsta investigación no ha recibido ayudas que provengan de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.