Las pacientes con cáncer de mama y compromiso ganglionar son llevadas rutinariamente a vaciamiento axilar. Sin embargo, en los casos donde los ganglios positivos se negativizan después de la quimioterapia, las pacientes pueden ser seleccionadas para la disección axilar dirigida. Esta técnica consiste en realizar la marcación del ganglio positivo y después administrar manejo sistémico neoadyuvante. Si se logra una respuesta clínica e imagenológica completa, las pacientes son llevadas a resección del ganglio marcado y de los ganglios centinelas. Este procedimiento permite un buen control locorregional de la enfermedad, evita vaciamientos axilares fútiles y disminuye el porcentaje de complicaciones posquirúrgicas como la linfedema. El objetivo de nuestra revisión fue describir la concordancia entre el ganglio centinela y el ganglio clipado; para esto se siguió la guía PRISMA. Se realizó una búsqueda bibliográfica en las bases de datos de Pubmed, Embase, LILACS y WoS, se ingresaron estudios que cumplieron los criterios de inclusión y se encontró que la concordancia entre el ganglio centinela y el ganglio clipado es del 70,9%. Realizar la técnica de disección axilar dirigida, incluso en las pacientes donde no se encuentre el ganglio clipado después de la neoadyuvancia, así como en los centros donde no dispongan con la marcación de ganglios axilares, es una opción factible teniendo en cuenta la elevada concordancia entre el ganglio clipado y los ganglios centinelas. El procedimiento bajo estas circunstancias permite disminuir la morbilidad quirúrgica del vaciamiento axilar manteniendo la seguridad oncológica.
Patients with breast cancer and nodal involvement are routinely referred for axillary emptying. In cases where positive nodes are negative after chemotherapy, patients may be selected for targeted axillary dissection. This technique consists of marking the positive node and then administering neoadjuvant systemic management. If a complete clinical and imaging response is achieved, patients are taken to resection of the marked node and sentinel nodes. This procedure allows good locoregional control of the disease, avoids futile axillary emptying and reduces the percentage of post-surgical complications such as lymphedema. The objective of our review was to describe the agreement between the sentinel node and the clipped node; for this we followed the PRISMA guide and performed a literature search in Pubmed, Embase, LILACS and WoS databases. We found that the agreement between the sentinel node and the clipped node is 70.9%. Performing Targeted Axillary Dissection, even in patients where the clipped node is not found after neoadjuvant treatment, as well as in centers where axillary node marking is not available, is a feasible option taking into account the high concordance between the clipped node and the sentinel nodes. The procedure under these circumstances reduces surgical morbidity of axillary emptying while maintaining oncologic safety.
El cáncer de mama es una enfermedad de interés en salud pública, que registró 2.261.419 casos nuevos en 20201. Los avances en el manejo local y sistémico han logrado disminuir la mortalidad y mejoría en la calidad de vida de estas pacientes2.
El desescalonamiento terapéutico busca mantener el control oncológico con el mínimo tratamiento efectivo, disminuyendo el número de complicaciones funcionales y estéticas manteniendo un buen control de la enfermedad3, como lo observado con la sustitución del vaciamiento axilar por el ganglio centinela y la disección axilar dirigida4.
Las pacientes con axila positiva que son sometidas a manejo neoadyuvante, pueden lograr respuesta completa al tratamiento, dependiendo del perfil de inmunohistoquímica, manejo administrado y compromiso local de la enfermedad5. En estos casos el vaciamiento axilar es innecesario6 y el ganglio centinela presenta tasas de falsos negativos mayores al 10%, consideradas inaceptablemente altas7–9.
Caudle en 2016, describe la técnica de disección axilar dirigida, que consiste en marcar el ganglio positivo antes de iniciar la neoadyuvancia. En caso de volverse negativo después del tratamiento las pacientes son llevadas a ganglio centinela más resección del ganglio marcado, con el fin de evaluar el estado patológico de la axila, con lo que se logran tasas de falsos negativos de alrededor del 2%10 y una morbilidad quirúrgica menor al vaciamiento axilar11. La principal limitación de esta técnica consiste en la dificultad para identificar el ganglio marcado después de la quimioterapia, así como los costos y tecnología necesaria para la marcación12, por lo que no ha sido ampliamente difundida en países de Latinoamérica.
El objetivo de nuestra revisión fue identificar la concordancia entre el ganglio centinela y el ganglio marcado en las pacientes llevadas a disección axilar dirigida.
Materiales y métodosLa revisión sistemática de la literatura se realizó siguiendo la guía PRISMA. Se realizó la búsqueda bibliográfica en las bases de datos de PubMed, Cochrane, EMBASE, LILACS y WoS cruzando las palabras clave «disección axilar dirigida», «quimioterapia neoadyuvante», «ganglio positivo», «cáncer de mama», «ganglio centinela», «ganglio marcado» y «correlación». La estrategia de búsqueda la diseñaron 2 de los autores. La estrategia de búsqueda y la de selección de artículos se encuentran en la tabla suplementaria 1 y 2 respectivamente. Se incluyeron reportes de casos, revisiones sistemáticas de la literatura, estudios de cohortes y experimentos clínicos que estuvieran escritos en idioma inglés o español. Los criterios de selección de los pacientes incluyeron: 1) Pacientes con cáncer de mama y ganglio axilar positivo, 2) tratamiento neoadyuvante, 3) realización de ganglio centinela, 4) resección del ganglio marcado y 5) descripción de la concordancia entre el ganglio centinela y el ganglio marcado con clip.
El proceso de selección de los artículos se realizó por un solo investigador y se realizó en 2 pasos previa exclusión de los artículos duplicados. Primero se revisaron los títulos y resúmenes de todos los artículos. En la segunda selección se revisaron los textos completos. Posteriormente uno de los autores realizó la extracción de los datos de cada publicación en una plantilla en Excel® diseñada para tal fin. Los datos recolectados incluían el tamaño tumoral, perfil de inmunohistoquímica, perfil histológico, tipo de neoadyuvancia, tipo de cirugía primaria en mama y el porcentaje de concordancia entre el ganglio centinela y el ganglio marcado.
No se realizó la evaluación de la calidad de los estudios dado que, aunque se podían incluir estudios de cohortes y experimentos clínicos, la información relevante para esta revisión era uno de los brazos de los estudios, convirtiéndolos en series de casos. Se describirá el porcentaje de concordancia entre el ganglio centinela y el clip marcado. El periodo de tiempo en el que se realizó la búsqueda fue desde la inserción hasta el 30 de marzo de 2023. Consideramos que las características de los estudios fueron suficientemente similares, por lo que realizamos la agrupación de los datos. Como análisis post hoc se evaluó por medio de la prueba de Mann-Whitney o de Fisher la asociación bivariada entre el porcentaje de concordancia de los estudios con el número de los participantes, la edad promedio de los participantes, el estadio clínico al momento de ingresar al estudio, el perfil inmunohistoquímico, porcentaje de personas con uno a 3 ganglios previo a la marcación patológica, técnica para marcar el ganglio centinela y la localización radiológica. Se definió un nivel de significación del 0,05. Las variables correspondían al total de participantes del estudio y no necesariamente a los sujetos incluidos en el análisis de concordancia, dado que por la metodología de los estudios no todos los sujetos eran candidatos para ser incluidos en el análisis.
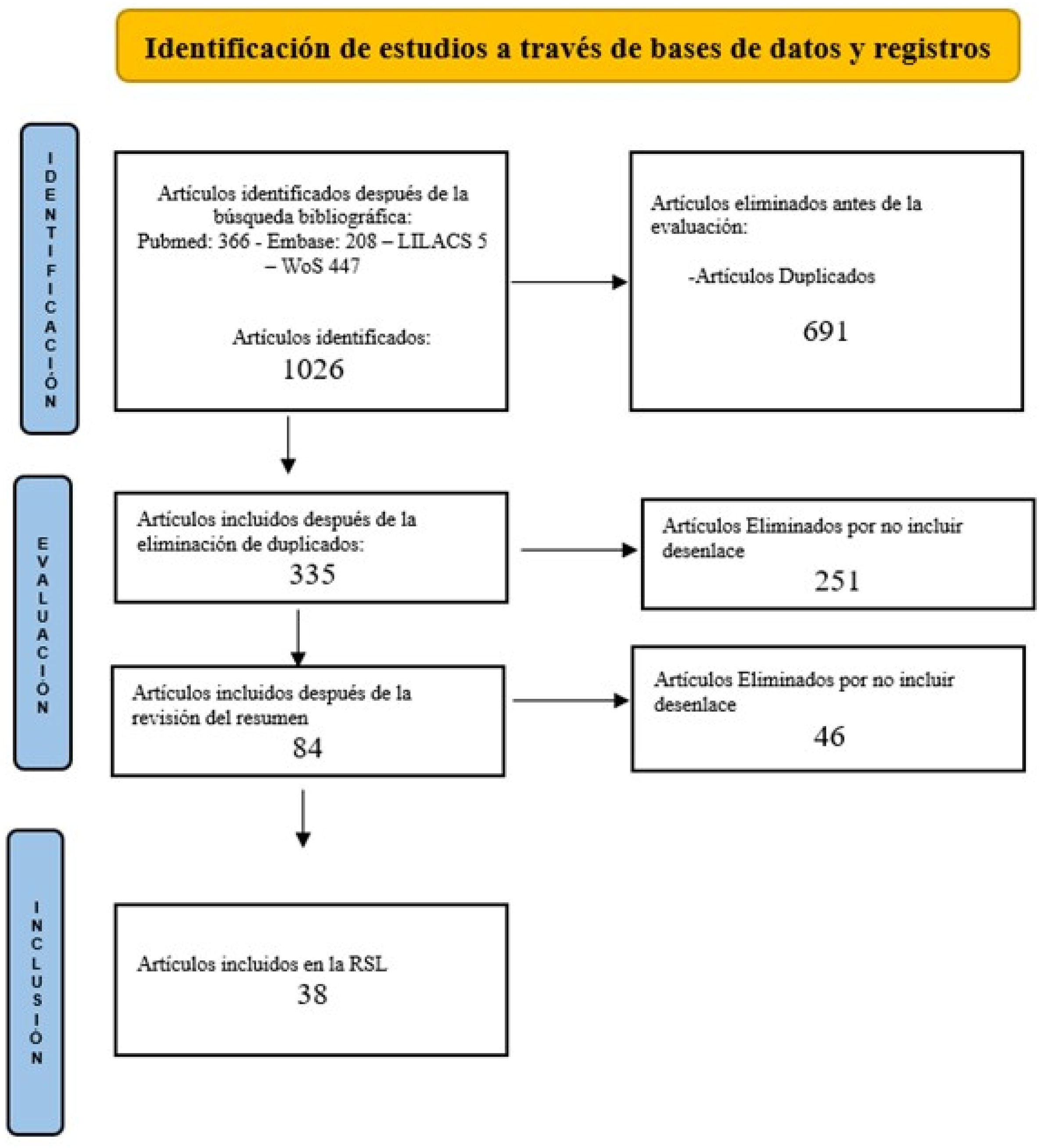
ResultadosEn la búsqueda en las bases de datos se identificaron 1.026 artículos, de los cuales se eliminaron 691 artículos duplicados. Se realizó una evaluación inicial de los títulos y resúmenes de los 335 estudios y se eliminaron 251 por no incluir la concordancia entre ganglio marcado y ganglio centinela. Se leyeron a texto completo 84 artículos y se eliminaron 46 por no presentar el desenlace de interés. Se incluyeron 38 artículos en esta revisión (fig. 1).
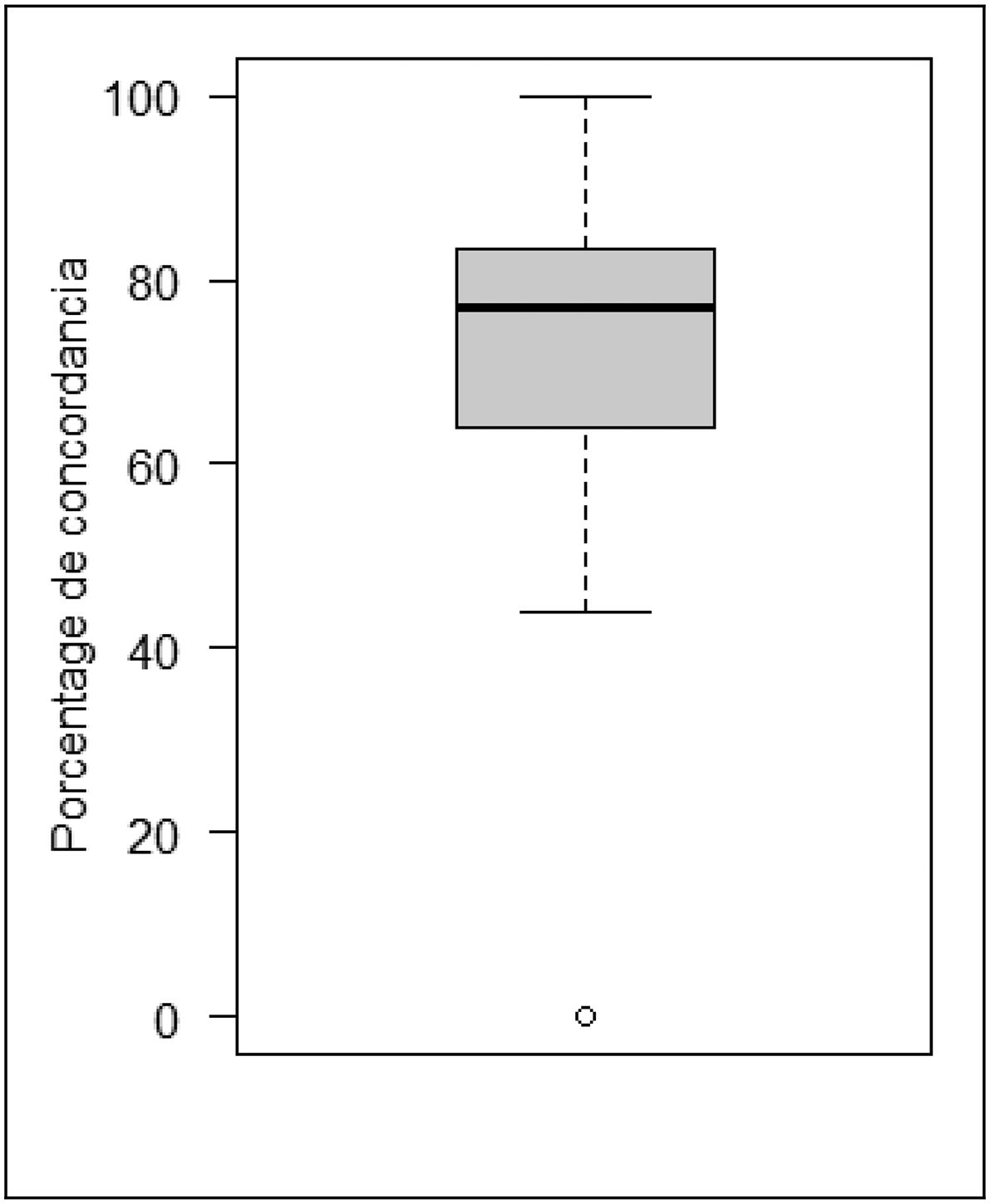
El número total de pacientes incluidos en los estudios fue de 1.715 y la edad promedio ponderada de todas las pacientes fue de 51,3 años (promedio mínimo de 39,0 años y máximo de 73,0 años). El perfil histológico fue ductal infiltrante en el 86,3%, 5,1 en lobulillar y 8,4 en otros tipos histológicos. En relación con el perfil de inmunohistoquímica; el 47,0% fue receptor hormonal positivo/HER2 negativo, un 32,0% HER2 positivo y un 21,0% triple negativo. El tamaño tumoral fue 61,8% T2; 20,4% T3; 14,7% T1; 2,7% T4 y 0,1% T0. El 96,0% recibieron quimioterapia como neoadyuvancia, 1,0% hormonoterapia y 3,0% fue intervenido quirúrgicamente. El número de ganglios patológicos previo a la marcación fue de uno a 3 ganglios el 86,8% y solo un 13,1% fue mayor a 3 ganglios. El porcentaje de concordancia entre el ganglio centinela y el ganglio marcado fue del 70,9%. (tabla 1). En estudios con más de 10 pacientes la concordancia mínima fue del 44,0% y la máxima fue de 95,6% con una mediana de 77,1% (tabla 1 y fig. 2).
Características de los estudios seleccionados
| Autorprincipal | Año depublicación | Número de pacientes | Concordancian (%) |
|---|---|---|---|
| Acea-Figueira E13 | 2022 | 72 | 56 (77,7) |
| Allweis TM14 | 2020 | 50 | 40 (80,0) |
| Aragon-Sanchez S15 | 2022 | 31 | 23 (74,1) |
| Arienzo F16 | 2023 | 50 | 32 (64,0) |
| Baker JL17 | 2022 | 23 | 22 (95,6) |
| Barry PA18 | 2023 | 137 | 75 (54,7) |
| Budel LR19 | 2023 | 127 | 93 (73,2) |
| Cabioglu N20 | 2018 | 86 | 70 (81,3) |
| Camacho Falcon M21 | 2022 | 27 | 17 (62,9) |
| Caudle AS10 | 2016 | 134 | 103 (76,8) |
| Chen JH22 | 2023 | 59 | 26 (44,0) |
| De Boniface J23 | 2022 | 121 | 58 (47,9) |
| Flores-Funes D24 | 2021 | 53 | 32 (60,3) |
| Fuertes Manuel J25 | 2022 | 30 | 15 (50,0) |
| García-Moreno JL26 | 2019 | 1 | 0 (0,0) |
| Harborough KE27 | 2021 | 25 | 17 (68,0) |
| Has Simsek D28 | 2022 | 15 | 10 (66,6) |
| Hayes M29 | 2017 | 11 | 10 (90,9) |
| Khallaf E30 | 2020 | 20 | 17 (85,0) |
| Mariscal Martínez A31 | 2021 | 27 | 15 (55,5) |
| Martínez M31 | 2022 | 44 | 34 (77,2) |
| Muñoz P32 | 2021 | 5 | 5 (100,0) |
| Natsiopoulos I33 | 2019 | 70 | 53 (75,7) |
| Navarro-Martinez J34 | 2021 | 1 | 1 (100,0) |
| Piñeiro Á35 | 2020 | 16 | 13 (81,2) |
| Pinto CS36 | 2022 | 36 | 30 (83,3) |
| Pinto D37 | 2022 | 18 | 16 (88,8) |
| Porpiglia M38 | 2022 | 26 | 23 (88,4) |
| Pudis M39 | 2021 | 24 | 17 (70,8) |
| Reitsamer R40 | 2021 | 33 | 26 (78,7) |
| Rolph R41 | 2020 | 24 | 20 (83,3) |
| Romics L42 | 2022 | 39 | 29 (74,3) |
| Shaari E43 | 2023 | 92 | 70 (76,0) |
| Sierra JN44 | 2023 | 65 | 60 (92,3) |
| Sun J45 | 2021 | 45 | 36 (80,0) |
| Taback B46 | 2018 | 36 | 19 (52,7) |
| Yousri M47 | 2022 | 11 | 9 (81,8) |
| Zaragoza Ballester P48 | 2022 | 31 | 24 (77,4) |
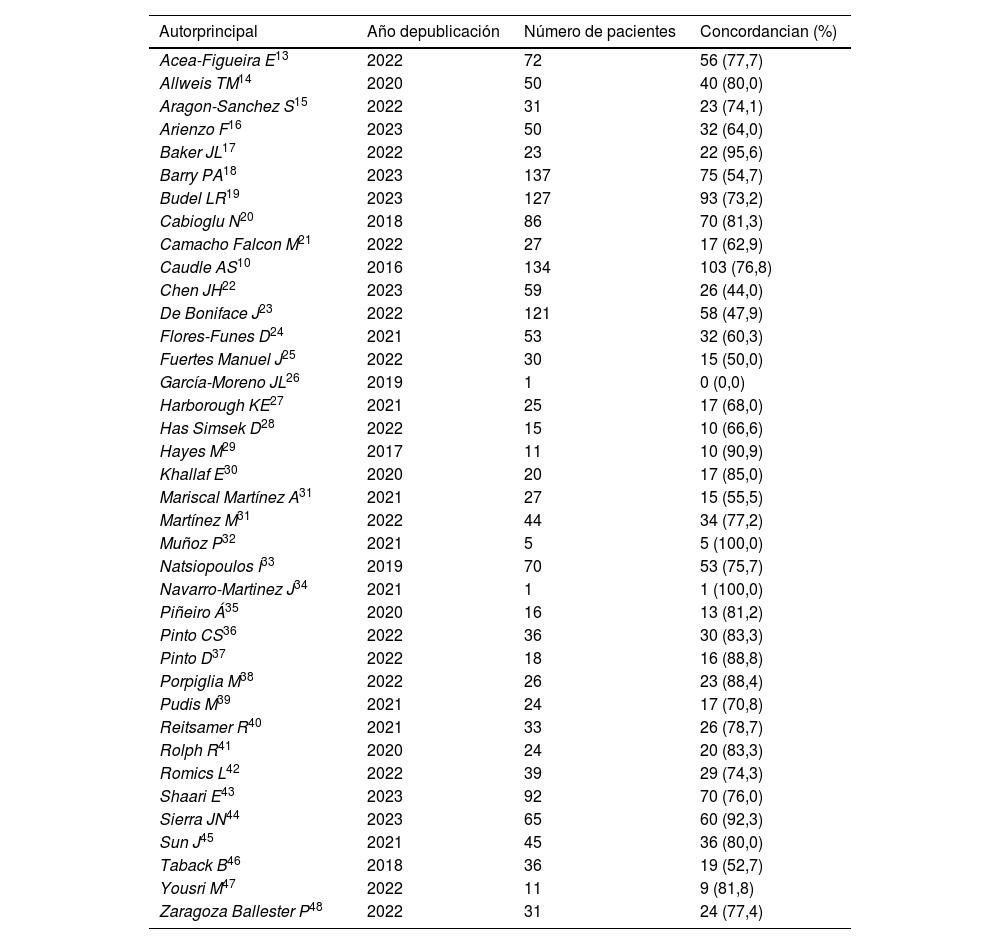
En la tabla se describe el autor principal de los 38 estudios seleccionados para la revisión sistemática, el año de publicación, el número de pacientes incluidos y el numero con el porcentaje de casos en las que concuerda el ganglio marcado con el ganglio centinela.
En el análisis post hoc se encontró que los estudios que tuvieron una concordancia entre ganglio centinela y ganglio marcado en la disección axilar dirigida por debajo del primer cuartil tenían personas de mayor edad (primer cuartil media de edad 55,8 y mayor a primer cuartil media 50,1 p=0,01) y tenían más personas con perfil inmunohistoquímica triple negativo (primer cuartil 30,0% con triple negativo y mayor a primer cuartil 16,0% p=0,01).
DiscusiónLa técnica del ganglio centinela constituye el estándar de manejo en los pacientes con axila negativa y en aquellas con ganglios positivos generalmente se les recomienda vaciamiento axilar4. Sin embargo, se ha planteado que el vaciamiento axilar ofrece información diagnóstica en la estadificación y pronóstico de las pacientes con cáncer de mama, y puede tener un objetivo terapéutico relacionado con el control local de la enfermedad49. Los inconvenientes de esta cirugía se relacionan fundamentalmente con las principales complicaciones asociadas a la técnica, lesiones neurovasculares y linfedema, los cuales afectan la calidad de vida de las supervivientes50,51.
Un grupo especial de pacientes lo constituyen aquellas que, con axila positiva en la evaluación inicial, reciben tratamiento neoadyuvante logrando una respuesta patológica axilar completa. Diferentes estudios han mostrado que el producto del vaciamiento axilar en estos casos no tiene ganglios positivos, lo que sugiere que el vaciamiento axilar puede ser innecesario en estos casos6. Por otra parte, los estudios muestran que la técnica del ganglio centinela en este escenario no es totalmente confiable, dada su inaceptable tasa de falsos negativos, que se han descrito como mayores al 10%7–9. De lo anterior surge el planteamiento de identificar y marcar durante la biopsia inicial el ganglio positivo, para después del manejo neoadyuvante resecarlo en cirugía junto con los ganglios centinelas, procedimiento descrito como «disección axilar dirigida». Esta técnica disminuye la tasa de falsos negativos10, con adecuado control oncológico52 y baja tasa de complicaciones11.
Existen diferentes técnicas de marcación del ganglio positivo, que incluyen semillas radioactivas53, tecnecio54, semillas ferromagnéticas55, clips de titanio56 y carbón37, que posteriormente se buscan con sondas con tecnología especializada, fluoroscopia57, cirugía ecoguiada58, arpones59, visión directa e incluso con tecnología de radar-luz infrarroja59 y radiofrecuencia al momento de la cirugía60.
En nuestra revisión sistemática encontramos que el ganglio clipado concuerda con el ganglio centinela en un 70,9% de los casos. Estos resultados evidencian que en la mayoría de los casos la marcación del ganglio clipado no es necesaria, ya que se reseca con el ganglio centinela. Adicionalmente, en el análisis post hoc se encontró que en los estudios con menor concordancia entre las 2 técnicas había personas de mayor edad y con perfil inmunohistoquímico triple negativo. Estos hallazgos generan la pregunta de investigación, si pueden haber características de los pacientes que limiten la relación entre el ganglio centinela y el ganglio clipado.
La principal limitación de esta técnica consiste en la dificultad para la visualización del clip en el ganglio marcado después de la neoadyuvancia, así como los costos de algunas técnicas de marcación como las semillas radioactivas12 y el temor a los riesgos de complicaciones derivadas de colocar arpones en la fosa axilar, por lo que no ha sido ampliamente difundida en Latinoamérica. Por lo tanto, los pacientes son llevados a vaciamiento axilar6 o se proponen alternativas quirúrgicas sin marcación del ganglio clipado basadas en la concordancia que existe entre el ganglio centinela y el ganglio marcado61,62.
Algunos autores consideran que no es necesaria la marcación del ganglio metastásico, ya que la sola realización del ganglio centinela después de la terapia sistémica primaria en estos casos, presenta tasas de recaída muy bajas con tasas de falsos negativos de un 5% cuando se realiza con técnica dual y se extirpan al menos 3 ganglios63. Al respecto, consideramos que el no identificar adecuadamente la persistencia de la enfermedad posterior a la quimioterapia, puede conducir a un tratamiento insuficiente de la terapia sistémica adyuvante y comprometer el resultado oncológico y afectar el pronóstico, especialmente en pacientes con cáncer de mama HER2 positivo y triple negativo donde la enfermedad residual se usa para guiar el uso de una terapia sistémica adyuvante adicional.
La principal limitación de nuestra revisión sistemática fue que la selección y extracción de los datos fue realizada por un autor. Como fortalezas se encuentran la aproximación sistemática de la búsqueda, selección y extracción de los datos. Consideramos que los hallazgos encontrados y el protocolo propuesto puede ayudar a centros, especialmente en Latinoamérica, donde no se disponga de la posibilidad de realizar marcaciones de los ganglios axilares, a que realicen la técnica de disección axilar dirigida, lo que permitiría mantener el control oncológico de la enfermedad con una menor morbilidad.
ConclusionesLa disección axilar dirigida es una técnica quirúrgica validada, segura y reproducible, que permite evitar el vaciamiento axilar con un buen control oncológico y menor morbilidad en pacientes con ganglio positivo que se negativiza después de la neoadyuvancia. La tasa de concordancia entre en ganglio centinela y el ganglio marcado es mayor al 70%, por lo que en la mayoría de los casos no es indispensable la marcación del ganglio clipado para su resección.
FinanciaciónLos autores declaran no haber recibido financiación para este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.