valorar la omisión de la linfadenectomía axilar sistemática (ALND) en las pacientes con cáncer de mama N1, con respuesta patológica axilar (RPA) tras tratamiento sistémico primario. Descripción y experiencia en la técnica disección axilar dirigida. Identificar qué subtipos se asocian a mayor RPA.
Pacientes y métodosestudio descriptivo, retrospectivo de 90 pacientes con carcinoma de mama estadios cT1-T3/N1/M0 que recibieron tratamiento sistémico primario en el Instituto Valenciano de Oncología, entre enero de 2020 y diciembre de 2023; 63 recibieron quimioterapia y/o terapia anti-HER2 y 27 hormonoterapia. Se realizó biopsia y marcaje del ganglio sospechoso (máximo 3). En la cirugía, se colocó un arpón en el ganglio axilar y, además, se llevó a cabo la técnica de ganglio centinela con tecnecio-99m y azul de metileno.
Resultadosse consiguió RPA en 46/90 casos (51,2%), en 30/46 (65,2%) fue respuesta patológica completa pCR y en 16/46 células tumorales aisladas o micrometástasis. En 44/90 (48,8%) se observó macrometástasis y por lo tanto se llevó a cabo ALND o Rt axilar. No se han producido recaídas axilares ni a distancia. Detección del ganglio marcado: 100%. La RPA se produjo en: Luminal A, 26%; Luminal B, 42%; HER2-positivo, 86% y triple negativo, 66%.
Conclusionesen el Instituto Valenciano de Oncología (IVO) la disección axilar dirigida es una técnica factible. Más del 50% de la cohorte tuvo una RPA evitando la ALND. Los subtipos HER2-positivo y triple negativo, tienen la mayor tasa de respuesta. Se trata de un procedimiento oncológicamente seguro; NO inferior a ALND.
To assess the omission of systematic axillary lymphadenectomy (ALND) in patients with N1 breast cancer with axillary pathological response (APR) after primary systemic treatment (PST). Description and experience of the Technique: Target Axillary Dissection TAD. Identify which subtypes are associated with higher APR.
Patients and methodsA descriptive, retrospective study of 90 patients with cT1-T3/N1/M0 stage breast carcinoma who received TSP at the Valencian Institute of Oncology (IVO), between January 2020 and December 2023; 63 received chemotherapy and/or anti-HER2 therapy and 27 received hormonal therapy. Biopsy and labeling of the suspicious lymph node (maximum 3) were performed. In the surgery, a harpoon was placed in the axillary lymph node and the sentinel lymph node (BSGC) technique was also performed with technetium-99m and methylene blue.
ResultsAPR was achieved in 46/90 cases (51.2%), in 30/46 (65.2%) pCR, and in 16/46 ITC (isolated tumor cells) or micrometastases remained. Macrometastases were observed in 44/90 (48.8%) and therefore ALND or axillary Rt was performed. There have been no axillary or distant relapses. Detection of the marked node: 100%. RPA occurred in: Luminal A, 26%; Luminal B, 42%; HER2-positive, 86% and Triple Negative, 66%.
ConclusionsIn the IVO, ADT is a feasible technique. More than 50% of the cohort had an APR avoiding ALND. The HER2-positive and triple negative subtypes have the highest response rate. It is an oncologically safe procedure; NOT less than ALND.
El cáncer de mama (CM) constituye la neoplasia maligna con mayor incidencia en el mundo, con más de 2.260.000 nuevos casos al año1. Si aproximadamente el 10% de los CM inician con afectación axilar, se podría inferir que tendríamos unos 250.000 CM con axila positiva, susceptibles de tratamiento sistémico primario (TSP)2. En las últimas 3 décadas, el manejo de las pacientes con CM se ha caracterizado por una tendencia constante hacia una cirugía axilar menos invasiva, 2 estrategias principales han contribuido a esta intención: el desarrollo del procedimiento de ganglio centinela (BSGC)3–5 y la introducción del TSP, bien quimioterapia neoadyuvante, terapias anti-HER2 y tratamientos hormonales o biológicos, indicados según cada inmunofenotipo tumoral6.
El alto valor predictivo negativo de GC, en más del 90%, implica que los pacientes con GC negativo (pN0) probablemente no tengan ganglios adicionales afectos. De hecho, estos pacientes pueden ahorrarse la linfadenectomía axilar sistemática (ALND), con la consiguiente ventaja en la disminución de la morbilidad y mejoría en la calidad de vida. Los ensayos clínicos aleatorizados demostraron que el BSGC es de hecho equivalente a la ALND en términos de control de la enfermedad locorregional y supervivencia en pacientes con CM temprano7–11. En el ensayo IBCSG 23-01, se reportó que la realización de ALND representa un sobretratamiento en los pacientes con CM en etapa temprana cuyo GC presenta solo células tumorales aisladas (ITC) o micrometástasis (mi) (focos >0,2 mm - ≤2 mm, pN1mi) y no tiene ningún beneficio en términos de supervivencia libre de enfermedad (SLE) o supervivencia general (SG), estos mismos resultados se podrían extrapolar a las pacientes con ITC/mi tras TSP12.
El TSP se utilizan actualmente en pacientes con CM localmente avanzado para convertir tumores inoperables en resecables o reducir los tumores a una dimensión compatible con la cirugía conservadora de mama, también para valorar la respuesta tumoral in vivo y más recientemente, para negativizar la axila y así poder omitir la ALND13,14. Los pacientes N+ son los que más se benefician del TSP evaluando la respuesta tanto en la mama como en la axila: sobre todo en los TN y los HER215. La obtención de un pCR tras TSP, se correlaciona fuertemente con un pronóstico más favorable tanto en SLE como SG16. Como el TSP puede inducir fibrosis axilar y alterar el drenaje linfático, los principales problemas asociados con BSGC son la baja tasa de identificación del GC y la alta tasa de falsos negativos (FN). A partir de 2005, con el ensayo NSABP-27 se inicia la realización del GC pos-QT NEO, pero ya indican el uso de las 2 técnicas de detección, azul y tecnesio 99m, para lograr obtener una tasa de FN por debajo del 10%17. En 2013 los resultados del ensayo SENTINA retrasan la posibilidad de realizar con seguridad el GC pos-QT NEO, debido a las altas tasas de FN y una baja tasa de identificación del GC, pre- y pos-QT neoadyuvante18. En el mismo 2013, la Dra. Judy Boughey, del MD Anderson, demuestra poder reducir la FNR extrayendo al menos 2 ganglios centinelas19. En 2015 en el estudio holandés (MARI), realizan el marcaje del ganglio positivo de inicio, con una semilla de I125, bajando los FN al 7%20. En 2016 la Dra. Caudle en el MD Anderson acuña el termino TAD (Target Axillary Dissection), uniendo la técnica de clips + BSGC, para identificar ganglios positivos en pacientes luego de recibir TSP, disminuyendo de esta manera al 2% la tasa FN21. Nuestra técnica se basa en una modificación de esta última, cuya variante principal es el uso de una semilla de nitinol (niquel y titanio) y no de I125.
Los objetivos de nuestro trabajo fueron: valorar la omisión de la ALND en las pacientes con CM cT1-T3 cN1M0, con respuesta patológica axilar (RPA) tras tratamiento sistémico primario (TSP)-; la descripción y experiencia de la técnica en el Instituto Valenciano de Oncología (IVO) e identificar qué subtipos se asocian a mayor RPA.
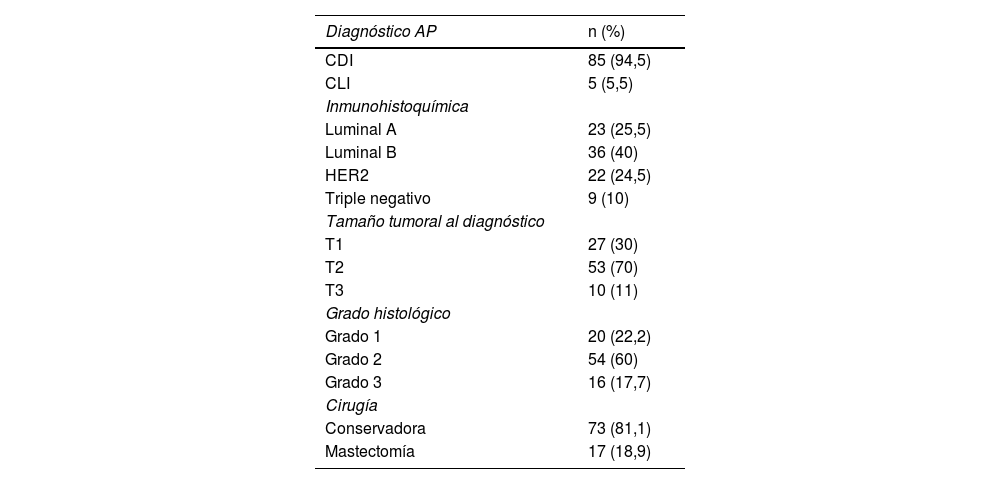
Material y métodosSe expone un estudio descriptivo retrospectivo. La cohorte está conformada por 90 pacientes, seleccionadas entre enero de 2020 y diciembre de 2023, (89 mujeres y un varón), con CM, cT1-T3N1M0 que recibieron TSP, 63 recibieron quimioterapia y/o terapia anti-HER2 y 27 pacientes recibieron hormonoterapia. Ochenta y cinco pacientes con carcinoma ductal infiltrante (CDI) y 5 con carcinoma lobulillar infiltrante (CLI). Tamaño tumoral medio de 36 mm (6–90 mm). Edad media 53,5 años (28-81) (tabla 1).
Descripción de las variables del estudio (n = 90)
| Diagnóstico AP | n (%) |
|---|---|
| CDI | 85 (94,5) |
| CLI | 5 (5,5) |
| Inmunohistoquímica | |
| Luminal A | 23 (25,5) |
| Luminal B | 36 (40) |
| HER2 | 22 (24,5) |
| Triple negativo | 9 (10) |
| Tamaño tumoral al diagnóstico | |
| T1 | 27 (30) |
| T2 | 53 (70) |
| T3 | 10 (11) |
| Grado histológico | |
| Grado 1 | 20 (22,2) |
| Grado 2 | 54 (60) |
| Grado 3 | 16 (17,7) |
| Cirugía | |
| Conservadora | 73 (81,1) |
| Mastectomía | 17 (18,9) |
AP: anatomopatológico; n: tamaño muestral; CDI: carcinoma ductal infiltrante. CLI: carcinoma lobulillar infiltrante.
Todas las biopsias fueron analizadas con inmunohistoquímica, los subtipos de CM y sus respectivos tratamientos fueron: Luminal A, 23 pacientes: 6 recibieron quimioterapia neo-adyuvante AC por 4 + taxol x 12 ciclos, 17 pacientes con HT NEO, de las pacientes premenopáusicas, 6 fueron bloqueados con goserelina + letrozol por 6 meses, 11 posmenopáusicas recibieron letrozol/anastrazole por 6 meses. Luminal B, 36 pacientes: 18 recibieron quimioterapia neoadyuvante AC por 4 + taxol por 12 meses. De estas, 13 pacientes con HT NEO, fueron tratadas con letrozol + ribociclib por 6 meses (ensayo Ribolaris), 4 pacientes con letrozol por 6 m y un paciente recibió goserelina + letrozol.
HER2-positivo, 22 pacientes: tratadas con transtuzumab + pertuzumab + taxol + o - AC por 4.
Triple negativo (TN), 9 pacientes: tratadas con AC por 4 + taxol por 12 + o -carboplatino.
Se realiza siempre biopsia con aguja gruesa (BAG) del ganglio sospechoso (NO se realiza PAAF), al inicio se marcaban hasta 2 ganglios, ahora se marca un solo ganglio, el más caudal, de un máximo de 3 adenopatías sospechosas (cortical > 3 mm) con un clip metálico, de nitinol (titanio + niquel), y preferiblemente en forma de «U», es mejor para ser localizado por los patólogos al momento de la biopsia extemporánea, generalmente el clip es colocado, en el mismo acto de la toma de biopsia. A todas las pacientes se les realizó mamografía, ecografía y RM pre- y pos-TSP. Se incluyeron solo pacientes con respuesta radiológica completa o parcial mayor.
Circuito y técnicaEl día antes de la cirugía, entre las 10 y 11 a. m., se realiza en medicina nuclear la linfografía externa para detectar el GC marcado con isótopo radiactivo, se inyectan aproximadamente 4 milicurie sub-areolar de tecnecio-99m y al cabo de 30-40 min se adquieren las imágenes para comprobar la localización del(los) ganglio(s) centinela(s). Posteriormente, el día de la cirugía, a las 8 a. m., antes de ingresar al área de hospitalización, el paciente se dirige a la unidad de radiología mamaria, donde en anestesia local, se coloca un arpón en el ganglio y si es necesario también en la mama; luego ingresan al hospital y en quirófano se inyectan 2 cc de azul de metileno 20 min antes de iniciar la cirugía, y uno de los cirujanos realiza 5-10 min de masaje sobre la mama para facilitar la migración del azul a la axila (fig. 1). Se realiza RX del(os) ganglio(s) extraído(s) para confirmar la presencia del clip (fig. 2). Luego los ganglios, tanto el marcado como los centinelas, van al laboratorio de anatomía patológica; en nuestro centro son procesados, de manera intraoperatoria mediante la técnica OSNA (one step acid nucleic amplification), determinando así el número de copias de ARNm de citoqueratina 19 (CK 19) en el GC, el proceso dura unos 20 min. aproximadamente, si el resultado es de 0 a 250 copias de ARNm, se trata de células tumorales aisladas, de 250 copias a 5.000 son micrometástasis y más de 5.000 son macrometástasis. Dada poca probabilidad de encontrar otros ganglios afectos con OSNA menores a 25.00022. hemos elevado nuestra línea de corte, por ende, en nuestra serie, donde todos los ganglios son evaluados por técnica OSNA, salvo los ensayos clínicos que no contemplan el mismo, la suma de las copias reportadas en ganglios estudiados, no debe superar las 25.000 copias para no realizar la ALND.
Las heridas son cerradas con sutura continua absorbible. No colocamos drenajes ni en axila, ni en la mama, excepto si se realiza mastectomía y/o vaciamiento axilar. La paciente generalmente es dada de alta a primera hora del día siguiente. Los resultados definitivos de las biopsias están en un promedio 7 días.
Las terapias adyuvantes, tratamiento sistémico y radioterapia, fueron discutidas en el comité de tumores multidisciplinario. Los tratamientos fueron planteados según práctica clínica habitual.
Los criterios de inclusión son:
- •
Pacientes con cáncer de mama cT1-T3 N1 al diagnóstico.
- •
Ser mayores de 18 años.
- •
Pacientes con cáncer de mama N1 que han recibido tratamiento sistémico primario, bien hormonoterapia, tratamiento anti-HER2 o quimioterapia.
- •
Realización de marcaje del ganglio positivo pre-TSP.
- •
Pacientes intervenidas en el IVO con consentimiento informado.
- •
Pacientes con respuesta radiológica completa o parcial mayor.
Criterios de exclusión
- •
Pacientes con cáncer de mama cN2 al diagnóstico.
- •
Pacientes sin respuesta clínica – radiológica al TSP.
Noventa pacientes con CM recibieron TSP, se consiguió una RPA en 46/90 casos (51,1%); en 30/46 (65,2%) fue respuesta patológica completa pCR, y en 16/46 (34,8%) mi/ITC, de las cuales 12 ypN1mi(sn) y 4 ITC ypN0(i+)sn. En 44 pacientes se observó macrometástasis, en 30 pacientes se llevó a cabo ALND y en 14 Rt axilar, la mayoría de estas últimas estaban incluidas en el ensayo ADARNAT (tabla 2). En 48 meses de seguimiento (con una media de 20 meses, 2-48) no se han producido recaídas axilares ni a distancia. En 13/30 (43%) linfadenectomías se encontraron más ganglios metastásicos. Se realizaron 73 cirugías conservadoras y 17 mastectomías (tabla 1).
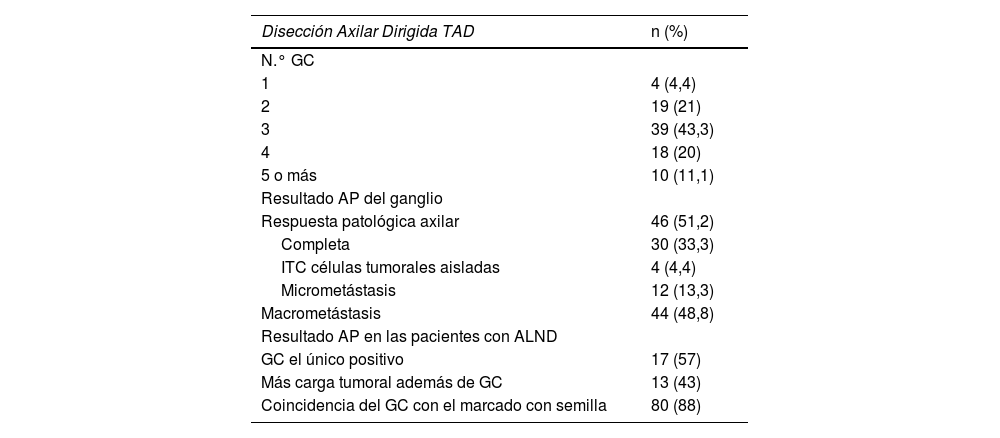
Análisis descriptivo de la disección axilar dirigida (n=90)
| Disección Axilar Dirigida TAD | n (%) |
|---|---|
| N.° GC | |
| 1 | 4 (4,4) |
| 2 | 19 (21) |
| 3 | 39 (43,3) |
| 4 | 18 (20) |
| 5 o más | 10 (11,1) |
| Resultado AP del ganglio | |
| Respuesta patológica axilar | 46 (51,2) |
| Completa | 30 (33,3) |
| ITC células tumorales aisladas | 4 (4,4) |
| Micrometástasis | 12 (13,3) |
| Macrometástasis | 44 (48,8) |
| Resultado AP en las pacientes con ALND | |
| GC el único positivo | 17 (57) |
| Más carga tumoral además de GC | 13 (43) |
| Coincidencia del GC con el marcado con semilla | 80 (88) |
ALND: linfadenectomía axilar sistemática; AP: anatomopatológico; GC: ganglio centinela; ITC: isolated tumor cells; TAD: disección axilar dirigida.
Analizando por subtipos moleculares, la respuesta patológica axilar se produjo en:
- •
Luminal A: 6/23 (26%): 4ypN0 y 2ypmi(sn).
- •
Luminal B: 15/36 (42%): 8ypN0, 5 ypN1mi(sn), y 2 ITC ypN0(i+)sn.
- •
HER2-positivo 19/22 (86%): 14ypN0, 4ypN1mi(sn), y 1 ITC ypN0(i+)sn.
- •
Triple Negativo: 6/9 (66%): 4ypN0, 1 ypN1mi(sn) y 1 ITC ypN0(i+)sn.
Cabe destacar que el 43% de los ganglios ypN1mi(sn) analizados por la técnica OSNA eran de baja carga tumoral, entre 250 y 500 copias de ARNm. Tenían grado histológico 2 o 3 el 78% de las pacientes (tabla 2).
No hubo inconvenientes graves en la colocación de los arpones, ni sangrados importantes que reportar.
No se observó migración del clip ganglionar, a pesar de ser una de nuestras preocupaciones iniciales, se obtuvo el 100% de detección del ganglio axilar marcado con clips. La media de ganglios en la TAD fue de: 3,1 (rango 1-7). La tasa de concordancia entre el GC y el ganglio marcado fue del 88% (80/90) (tabla 2).
DiscusiónLa TAD, validada en la literatura19–21, reduce al mínimo la posibilidad de FN, en nuestro caso hacemos una modificación en el uso de la semilla, utilizamos un clip de nitinol en forma de «U» preferiblemente y no una semilla de I125, de esta manera no tenemos la dificultad del manejo de una semilla radioactiva; nuestros radiólogos no han tenido inconvenientes en la localización de la semilla, en especial cuando existe una respuesta radiológica completa.
En el IVO la técnica es factible, gracias al trabajo conjunto de los servicios de cirugía, oncología médica, oncología radioterápica, radiología, medicina nuclear y anatomía patológica. Más del 50% de la cohorte tuvo una respuesta patológica ganglionar, bien completa o como ITC o mi, de esta manera se evitó la linfadenectomía axilar con la morbilidad que este conlleva
Un artículo del 2018 de la Dra. Morrow, sostenía que se debería omitir la linfadenectomía axilar solo en aquellos casos en que se negativiza totalmente el ganglio axilar pCR, pero no cuando quedan ITC o micrometástasis por el alto riesgo de otros ganglios positivos23. Pero este trabajo se le podría objetar que la axila fue evaluada casi siempre solo clínicamente, que los ganglios positivos no fueron marcados y que el trazador fue utilizado a discreción del equipo quirúrgico.
Parece obvio que los pacientes con enfermedad axilar residual después de TSP tendrían un peor pronóstico en comparación con los pacientes que presentan una pCR. Sin embargo, no está del todo claro si una baja carga tumoral residual influye en el pronóstico de la misma manera. En particular, la importancia clínica de la micrometástasis axilar pos-TSP aún no se ha determinado.
Analizando el estado patológico de los ganglios pos-TSP en una cohorte piloto de pacientes diagnosticados cN+, pasados a ypN-, el grupo del Dr. Tinterri en Milán, tuvo evidencias preliminares de que los pacientes con SLN micrometastásico ypN1mi(sn) tienen supervivencia global (SG) y supervivencia libre de enfermedad (SLE) similares a los de los pacientes pCR, ypN0(sn). Por el contrario, estos resultados fueron significativamente peores en pacientes ypN1/3(sn)24. Estos hallazgos están en línea con el reciente estudio holandés del Dr. Van Nijnatten que evaluó el pronóstico de acuerdo con la enfermedad axilar residual en pacientes N+ y mostró que los pacientes con ypN0 y ypN1mi tienen SLE y SG similares a largo plazo, mientras que los pacientes con ypN1-3 tienen un pronóstico significativamente menos favorable25. Es también posible que en la gran mayoría de las pacientes con micrometástasis tras TSP la ALND sea innecesaria, como lo demostró el estudio IBCSG 23-01 en enfermedad inicial cN0. Al igual que en el estudio NEONOD 224, pretendemos verificar si es oncológicamente seguro NO realizar linfadenectomía axilar en aquellas pacientes con respuesta patológica axilar, bien completa o con poca carga residual.
Estos ensayos clínicos12,24,25, en conjunto con la experiencia del MD Anderson21, son los que nos llevaron a plantear este nuevo enfoque quirúrgico en el manejo de la axila pos-TSP, con muy buenos resultados, tanto en la detección del ganglio como hasta ahora en la recaída local, SG y SLE.
Al comparar nuestros resultados con 3 grandes series de la literatura26–28, vemos que los porcentajes de recaída local son muy bajos, inclusive en aquellos estudios en que no utilizaron el marcaje del ganglio afecto con clips, no superando el 2%. De hecho, en el estudio del IEO, publicado en 2023, con 222 casos cN1 y una negativización del 55%, similar a la nuestra, el porcentaje de recaída local no supera el 1,6 %26.
Respondiendo al objetivo principal, hemos podido omitir la linfadenectomía axilar en 51% de las pacientes con cáncer de mama N1, con RPA tras TSP. Nuestra tasa de localización del ganglio es del 100%, y nuestra media de ganglios extraídos (3,1) nos lleva, una vez más, a afirmar la realización de TAD tras QT, tal y como esta descrita en la literatura26,28.
En cuanto a la interrogante de los subtipos más respondedores, los HER2 y los TN son por mucho los que más se negativizan, en nuestro caso 86 y 66% respectivamente consono con el trabajo del Dr. Barrios27, donde solo habían pacientes TN y HER2-positivo, y los índices de respuesta ganglionar fueron del 90%, con una recurrencia regional de un solo paciente a los 3 años.
En cuanto a no realizar ALND en los casos de células tumorales aisladas o micrometástasis, quizás el punto más álgido, la probabilidad de encontrar otros ganglios en este escenario no supera el 10%, como vemos en la serie de la Dra. Moral Rubio28, por lo tanto, estos pacientes que además van a recibir radioterapia, no tendrían más riesgo de recaída regional. En nuestra experiencia de 4 años, no hemos tenido recaídas axilares ni a distancia.
Definidamente, como vemos en una revisión del año 2020 de la Dra. Boughey hay un incremento paulatino desde el 2009 de BSGC en pacientes N+ pos-TSP con respuesta patológica, haciendo disminuir en el periodo 2015-2019 la ALND en más del 50%29.
Actualmente, las principales sociedades científicas (NCCN, SESPM, Consenso de St Gallen) recomiendan, al igual que nosotros, en aquellas mujeres N+ tras TSP, la disección axilar dirigida, extrayendo el ganglio previamente marcado y realizando también la técnica de GC con doble trazador; obteniendo así al menos 3 ganglios linfáticos.
ConclusiónLa disección axilar dirigida TAD es una técnica, utilizada en el IVO desde hace 4 años, que ayuda a disminuir la tasa de falsos negativos y por tanto debe ser considerada en el manejo de la paciente con cáncer de mama y axila positiva con respuesta al tratamiento sistémico primario. En el 51,2% de las pacientes inicialmente N1 hemos podido obviar la linfadenectomía axilar gracias a que el ganglio marcado se negativizó, o quedó con poca carga residual tumoral, disminuyendo así la morbilidad a la paciente. Vemos como en los últimos 30 años pasamos de la cirugía radical a una mínima y precisa con criterios de seguridad oncológica, tanto en la mama como en la axila, con un impacto estético y psicológico mucho menor en las pacientes. Seguramente el tiempo nos dirá si haber desescalado en radicalidad ha sido lo suficientemente seguro, o si por el contrario, debemos volver a subir algún peldaño en cualquier momento.
Responsabilidades éticasTodas las pacientes tienen firmado el consentimiento informado. La información de las pacientes incluidas en nuestro trabajo ha sido tratada de manera anónima y confidencial. La base de datos generada por nuestra unidad solo es accesible por miembros del equipo, quedando protegida de usos no permitidos por personas ajenas a la investigación. El presente trabajo fue presentado, aprobado y es seguido por el Comité de Tumores Multidisciplinario del Instituto Valenciano de Oncología IVO.
El tratamiento, la comunicación y la cesión de los datos de carácter personal de todas las participantes se ajusta a lo dispuesto en la Ley de Protección de Datos Personales y Garantía de los Derechos Digitales y siguiendo las normas de bioética de la declaración de Helsinki de la Asociación Médica Mundial sobre principios éticos para las investigaciones médicas.
FinanciaciónEsta investigación no ha recibido ayudas que provengan de agencias del sector público, sector comercial o entidades sin ánimo de lucro. Se declara que el estudio esta realizado con los mismos materiales, personal y recursos del IVO.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
AgradecimientosA todas nuestras pacientes que son unas guerreras en la lucha contra esta enfermedad y a todo el personal médico-sanitario y administrativo del IVO que nos permite cumplir nuestro trabajo con profesionalidad, celeridad y ética.