el cáncer de mama es el cáncer más común diagnosticado en la población femenina en el mundo, pero no todas presentan el mismo riesgo absoluto de por vida de desarrollarlo, existiendo un grupo denominado «alto riesgo», con un riesgo igual o mayor al 20%, en quienes la enfermedad inicia en edades más tempranas y tiende a ser más agresiva.
Materiales y métodosse elaboró una revisión de la literatura en bases de datos Google Scholar y PubMed utilizando palabras clave como «cáncer de mama», «alto riesgo», «cáncer de mama inducido por radioterapia», «cribado», «protocolos» e «imágenes». Finalmente se analizaron 53 artículos, tras aplicar los criterios de inclusión y exclusión.
Resultadostodas las mujeres deben realizarse una evaluación de riesgo a partir de los 25 años de edad. En el grupo de alto riesgo la estrategia de cribado debe ser de inicio temprano, multimodal y de periodicidad anual. Existe una amplia evidencia en la literatura de que la resonancia magnética es el método de imagen más sensible para el diagnóstico de cáncer de mama.
Conclusiónla resonancia de mama será el método de elección junto con la mamografía para realizar el cribado anual en este grupo de riesgo. La heterogeneidad de los subgrupos dentro de este grupo de alto riesgo y el advenimiento de la IA mejorando la precisión de los métodos diagnósticos hace plantearse la necesidad de personalizar las estrategias de cribado.
Breast cancer is the most common cancer diagnosed in the female population in the world, but not all women have the same absolute lifetime risk of developing it, there being a group called “high risk” with a risk equal to or greater than 20%, in whom the disease begins at an earlier age and tends to be more aggressive.
Materials and methodsA review of the literature was carried out in Google Scholar and PubMed databases using keywords such as “breast cancer”, “high risk”, “breast cancer induced by radiotherapy”, “screening”, “protocols”, and “images”. Finally, 53 articles were analyzed, after applying the inclusion and exclusion criteria.
ResultsAll women should undergo a risk assessment starting at 25 years of age. In the high-risk group, the screening strategy should be early, multimodal and annual. Ample evidence in the literature that MRI is the most sensitive imaging method for the diagnostic of breast cancer.
ConclusionBreast MRI will be the method of choice along with mammography to perform annual screening in this risk group. The heterogeneity of the subgroups within this high-risk group and the advent of AI improving the precision of diagnostic methods raises the need to personalize screening strategies.
El cáncer de mama (CM) es el tumor maligno más frecuente entre las mujeres del mundo, representando el 12,5% de todos los casos de cáncer nuevos por año1,2. «En Latinoamérica y el Caribe, la proporción de mujeres afectadas por la enfermedad antes de los 50 años (32%) es mucho mayor que en América del Norte (19%)»3.
Pero no todas presentan el mismo riesgo de desarrollar CM, pudiendo encontrar un subgrupo con un riesgo estimado de por vida igual o mayor al 20% categorizadas como de «alto riesgo»4.
En este grupo de «alto riesgo», el CM suele iniciar en edades tempranas, con alto grado de malignidad y peor pronóstico4,5. Por esta razón, el Colegio Americano de Radiología (ACR) ha planteado que toda mujer a partir de los 25 años de edad, debe realizarse una evaluación de riesgo para CM para determinar a cuál subgrupo de riesgo pertenece e indicar el protocolo de cribado y tratamiento6.
El objetivo de este estudio fue realizar, revisando la literatura, una actualización de las características de las pacientes con alto riesgo para CM, los métodos de imágenes disponibles para su evaluación y los protocolos de cribado actualizados para su manejo.
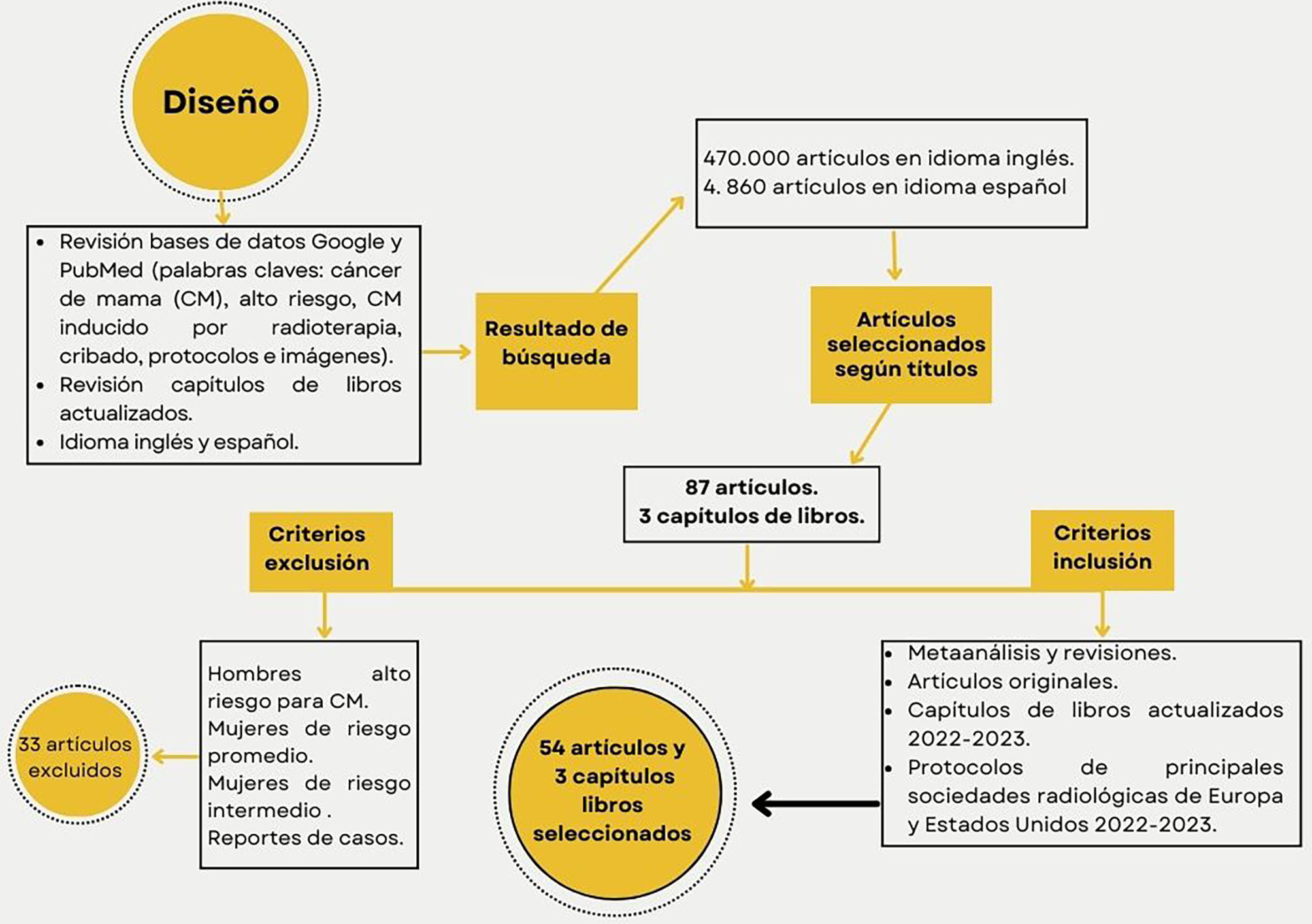
Materiales y métodosDiseñoSe elaboró una revisión de la literatura en bases de datos Google y PubMed en inglés y español; utilizando palabras clave como «cáncer de mama», «alto riesgo», «cáncer de mama inducido por radioterapia», «cribado», «protocolos» e «imágenes». Se realizaron revisiones de capítulos de libros actualizados sobre alto riesgo en CM e imagenología mamaria.
Criterios de inclusiónRevisiones sistemáticas o metaanálisis, revisiones, artículos originales, capítulos de libros sobre alto riesgo para CM e imágenes en el CM actuales, protocolos publicados durante 2023 para el manejo por imágenes por las principales sociedades radiológicas de Europa y Estados Unidos.
Criterios de exclusiónSe excluyeron artículos sobre hombres con alto riesgo para CM, mujeres de riesgo promedio e intermedio para CM y reportes de casos.
Un total de 87 artículos y 3 capítulos de libros fueron seleccionados, posteriormente se realizó lectura de cada resumen para escoger los artículos según criterios de inclusión, finalmente fueron seleccionados 54 artículos y 3 capítulos de libros.
Análisis de datosEl análisis de artículos y capítulos de libros se realizó mediante una lectura completa de los mismos, ordenando las ideas conforme al esquema previamente estructurado para la redacción.
En la figura 1 se ilustra un diagrama de flujo para describir el proceso de evaluación y selección o exclusión de cada artículo y capítulo de libro consultado.
ResultadosFactores que condicionan alto riesgo en cáncer de mamaPedigrí sugestivo de/o conocida predisposición genéticaLas mutaciones genéticas representan del 5 al 10% del total de casos de CM. El riesgo absoluto de desarrollar CM a lo largo de la vida de una mujer es mayor al 60% entre las portadoras de la mutación BRCA1 y BRCA2; y para cáncer de ovario entre el 20 y 40% para BRCA1 y entre el 10 y 20% para BRCA24,7,8.
El riesgo calculado es de 85% para TP53 (síndrome Li-Fraumeni); de 25 a 85% para PTEN (síndrome Cowden y Bannayan-Riley-Ruvalcaba); de 32 a 54% para STK11 (síndrome Peutz-Jeghers); de 41 a 60% para PALB2 y 41 a 60% para CDH1 (cáncer gástrico difuso hereditario)4,8.
Historia familiarCorresponde a mujeres que presentan alto riesgo para CM con base en su historia familiar; en este grupo el riesgo será mayor cuanto más cerca esté el familiar y más joven sea la edad del familiar al momento del diagnóstico6–9.
Los familiares de primer grado son la madre, las hermanas, las hijas, el padre, los hermanos y los hijos6,9.
La incidencia de CM a lo largo de la vida entre las mujeres con un familiar de primer grado afectado es del 13,3% (1 en 7,5) y con 2, del 21,1% (más de 1 en 5)9.
Antecedentes de radioterapia torácica antes de los 30 añosMujeres tratadas con radioterapia de tórax en el manto antes de los 30 años tienen alto riesgo para CM. Los factores que influyen en aumentar este riesgo son: la edad temprana al momento de la radioterapia, dosis, campo de radiación aumentados y duración desde la irradiación10.
Durante el tratamiento de la enfermedad de Hodgkin, el aumento del riesgo estimado de 20 a 25% para desarrollar CM parece comenzar unos 5–8 años después de la radiación10–13. La radiación abdominal superior que expone el tejido mamario a una edad temprana también aumenta el riesgo11.
«Existe una relación lineal entre la dosis de radiación y el riesgo para CM»11.
Historia personal de cáncer de mamaPara las mujeres diagnosticadas con CM y tratadas con cirugía conservadora, la probabilidad de recurrencia locorregional dentro de 10 años es de aproximadamente 19,3%, con una tasa de mortalidad por cáncer a 15 años de 21,4%6.
Si la paciente es diagnosticada con CM antes de los 50 años y presenta mamas densas, entonces el riesgo estimado de por vida para un segundo CM se eleva por encima del 20%14.
Las pacientes diagnosticadas con CM presentan un riesgo anual de 0,5 a 1% de desarrollar CM contralateral y si adicionalmente tienen predisposición genética, el riesgo de desarrollar CM contralateral o cáncer de ovario dentro de los 5 años después de un tumor previo se estima entre 30 y 60%15,16.
Modelos de estimación de riesgoLos modelos matemáticos Tyrer-Cuzick, BRCAPRO y The Breast and Ovarian Analysis of Disease Incidence and Carrier Estimation Algorithm (BOADICEA); evalúan el riesgo de ser portador de una mutación de gen BRCA o el riesgo de desarrollar CM u ovario en personas con familiares portadores conocidos o sospechados de mutación de este gen; estos modelos son adecuados para decidir la indicación o no de resonancia magnética de mama (RM), como método de cribado complementario a la mamografía (MD)17–20.
Deben ser siempre evaluados en conjunto con antecedentes patológicos personales ya que la paciente con elevado riesgo por radioterapia de tórax en edades tempranas o mujeres tratadas por CM en edad inferior a 50 años o con mamas densas, se considerarán alto riesgo independientemente de lo modelos de estimación mencionados21.
El modelo de Gail se enfoca en factores de riesgo no genéticos e incluye información solo de familiares maternos con CM sin considerar la edad de diagnóstico, no siendo aceptable para estimar el riesgo basado en la historia familiar y personal de CM, mutaciones conocidas BRCA/PTEN o TP53 ni mujeres tratadas con radioterapia por linfoma, por lo cual, no es empleado para indicar o no la RM como método de cribado9,17,21.
«El modelo de Claus supone un solo gen autosómico dominante e incorpora parientes de primer y segundo grado y la edad del diagnóstico, pero no predice el riesgo de mutación per se»9.
Técnicas de imágenes para cribado en alto riesgoMamografíaAunque la MD ha sido validada por múltiples ensayos controlados aleatorizados y metaanálisis para reducir la mortalidad por CM a través de la detección temprana, tiene limitaciones, ya que su sensibilidad en mamas densas oscila entre el 25 y el 59% y aproximadamente 30% de las veces, las mamas de mujeres de alto riesgo presentan patrón heterogéneo denso o extremadamente denso del ACR6,22–26.
Tomosíntesis IMúltiples publicaciones han demostrado mayor sensibilidad y especificidad, disminución de rellamadas e incremento en la tasa de detección de CM de la TM en comparación con la MD sola, por ello la TM ha reemplazado ampliamente a la MD como la principal herramienta de detección para riesgo promedio y alto riesgo27–29.
Sin embargo, la TM no ha mostrado reducción en la tasa de cáncer de intervalo al compararla con la MD6,28.
EL ACR ha clasificado tanto a la TM como a la MD apropiadas como técnicas de cribado en poblaciones de alto riesgo en combinación con la RM30,31.
UltrasonidoEl uso del ultrasonido (US) en mamas densas, MD y examen clínico negativos demuestra un incremento en la tasa de detección del CM del 2,8 a 4,6 por cada 1.000 mujeres32,33.
En todos los estudios, los CM detectados por US fueron reportados como pequeños carcinomas invasivos, con alta proporción de ganglios negativos, con tamaño promedio de 9-11 mm32.
Sin embargo, como demostró el estudio ACRIN 6666 el US presenta aumento en la tasa de falsos positivos, y seguimientos a corto plazo y bajo valor predictivo positivo para biopsias comparado con MD o RM6.
La ecografía automática (ABUS) muestra resultados de rendimiento similares al US a mano alzada, presentando limitaciones como cobertura mamaria incompleta, tiempo de interpretación de las imágenes, artefactos, la falta Doppler-Elastografía y de inclusión axilar, que son obstáculos para su aceptación generalizada6.
La Sociedad Europea de Especialistas en Cáncer de Mama (EUSOMA) y la Red Nacional Integral del Cáncer (NCCN), no consideran necesario el uso del US en mujeres de alto riesgo siempre que el cribado anual sea realizado con RM, excepto para reevaluación de hallazgos sospechosos en RM con el fin de localizar la anormalidad y guiar la biopsia34,35.
Resonancia magnética con contrasteLa resonancia magnética con contraste (RM) es indiscutiblemente el método de diagnóstico por imágenes más sensible para detectar el CM (sensibilidad 87–99% y especificidad 72–97%), con una tasa de detección más alta que la MD, TM o US sea cual sea la edad, grupo de riesgo y densidad mamaria34,36–40.
Cabe señalar que los CM detectados con RM son principalmente pequeños, invasivos, con ganglios negativos, más bajo estadio de la enfermedad y reduce la tasa de cánceres de intervalo6,38,41.
La limitación para uso generalizado de la RM se basa en el largo tiempo de exploración e incremento de los costos. Por lo tanto, actualmente solo se implementa de forma rutinaria en el cribado de mujeres con alto riesgo de CM38.
Con el propósito de superar estas limitaciones, Kuhl et al. presentaron un protocolo que acorta a 3 minutos el tiempo de adquisición e interpretación, conocido como protocolo abreviado de Rm (RMab), el cual consta de una secuencia precontraste y poscontraste, usando imágenes de proyección de máxima intensidad (MIP); no siendo afectada la alta precisión diagnóstica al comparar con un protocolo de diagnóstico completo42–44.
Un paso adicional lo dan Man et al., con la técnica ultra rápida o ULTRAFAST por RM, mostrando un nuevo enfoque en la evaluación de la cinética de lesiones mamarias bajo la premisa de que las lesiones malignas realzan antes (dentro 10 segundos) que las benignas (luego de 15 segundos). De esta manera se obtienen imágenes en los primeros 2 minutos posteriores a la inyección del contraste empleando una alta resolución temporal y espacial, centrándose en captar la fase de lavado más temprana45–47.
Mamografía con contraste (CEM)Es una técnica de mamografía de energía dual obtenida después de inyección intravenosa de contraste yodado capturando la neoangiogénesis tumoral. Tiene mayor sensibilidad, especificidad y precisión en un entorno de diagnóstico en comparación con la mamografía digital sola27,48.
La detección con CEM en alto riesgo tiene una sensibilidad del 87,5% (frente al 50% con MD sola) y una tasa de detección del cáncer de 15,5 por 1.000 exámenes en un estudio publicado recientemente48.
Estudios que comparan la CEM y la RM han encontrado sensibilidades similares con especificidades y precisión variables27,48.
Las ventajas de CEM como herramienta de cribado incluyen el menor costo y el tiempo de examen más corto en comparación con la RM con protocolo completo27.
Las limitaciones incluyen el flujo de trabajo, uso de contraste iodado, dosis de radiación (1,2 a 1,8 veces mayor que la de FFDM) y que en la actualidad no todos los centros disponen del sistema de biopsia guiado por CEM27,49.
Recomendaciones de la Sociedad Europea de Imagenología Mamaria (EUSOBI) y la NCCN afirman que la CEM puede considerarse como una alternativa a la RM de mama para mujeres que tienen indicada RM, pero presentan contraindicaciones propias del método35.
Imagen Molecular de la mama (MBI)Requiere una inyección IV de un radiofarmacéutico (tecnecio-99 m sestamibi) seguido de imágenes con una cámara gamma dedicada a la mama. Es capaz de evaluar neoangiogénesis tumoral con alta sensibilidad, incrementando la tasa de detección de CM que miden más de 1 cm. La sensibilidad de la MBI disminuye en el CDIS y en cánceres invasivos que miden menos de 1 cm (84–88%)6,23.
En alto riesgo de CM el incremento de la tasa de detección de MBI fue comparable a la RM cuando se utilizó una dosis radiofarmacéutica de mayor actividad. MBI no se ve limitada por la densidad mamaria. Sin embargo, en la MBI todo el cuerpo se expone a la radiación limitando su uso generalizado en el escenario de cribado6,23.
Inteligencia artificial (IA)«La abrumadora cantidad de imágenes, que generan gran carga de trabajo para los radiólogos, las características de imagen complejas y cambiantes, la calidad heterogénea de las imágenes y la interpretación inconsistente por parte de diferentes radiólogos e instituciones médicas constituyen las principales dificultades en la detección del CM y el diagnóstico por imágenes»50.
Las categorías de aplicación de la IA involucran:50–53.
- •
Control de calidad y adquisición de imágenes, reducción de dosis radiación.
- •
En protocolos de cribado y diagnóstico del CM.
- •
En la mejora de la eficiencia y precisión de las técnicas de imagen.
- •
En la evaluación objetiva de la densidad mamaria, relace de fondo por RM, evaluación de respuesta a terapia neoadyuvante, identificación de fenotipo tumoral a través de RM, score de recurrencia tumoral por RM.
- •
En la evaluación de riesgo para CM personalizando los protocolos de cribado, indicación de pruebas genéticas, cirugías reductoras de riesgo y/o quimioprevención.
Sin embargo, como señalan Lamb et al.53, se deben cumplir una serie de pasos para lograr implementar con éxito la IA en la práctica clínica, como son la validación interna, estudios prospectivos multicéntricos con amplia data y análisis de subgrupos para validación, integración del flujo de trabajo, la educación de los usuarios, la monitorización continua, la legalización y las consideraciones éticas.
Consideraciones en el cribado de alto riesgo- •
Todas las mujeres deben tener una evaluación de riesgo a los 25 años6; este análisis puede ayudar a guiar el inicio del cribado, la frecuencia y las modalidades de imagen óptimas.
- •
El cribado es de inicio temprano con un enfoque multimodal, sin embargo, no existe consenso en diferentes sociedades, de la edad de inicio especifica ni de culminación (70 o 75 años)6,20,35,54,55.
- •
El método de cribado de elección en alto riesgo es la RM de mama (recomendación categoría 2A)6,35,36,54,55.
- •
Para aquellas que no pueden hacerse una RM de mama, se podría considerar CEM o MBI6,38.
- •
Se puede realizar US si no se dispone de imágenes con contraste o imágenes funcionales o no se puede acceder a ellas38.
- a.
BRCA1 y BRCA2: se recomienda realizar MD y RM de mama anual; las diferentes sociedades han recomendado iniciar el cribado con RM de mama a los 25 años con adición de la MD a partir de los 30 años. La ACR ha propuesto retrasar el uso de la MD hasta los 40 años solo si estas pacientes están siendo evaluadas con RM de mama anual desde los 25 años. La NCCN incluye la TM como adición a la MD6,35,54,55. Este subgrupo además tiene recomendación de cirugías reductoras de riesgos y quimioprevención.
- b.
TP53: representa el 1% de los casos de CM hereditario. Existe consenso en iniciar el cribado a partir de los 20 años de edad con RM anual y a partir de los 30 años agregar MD; la NCCN propone agregar TM anual6,35,54,55. Existen guías que recomiendan no realizar MD, por la alta susceptibilidad a la radiación54.
- c.
PTEN: MD con TM y RM de mama anual sin consenso en la edad de inicio, proponiéndose desde los 30–35 años de edad o 5 años antes de la edad del pariente más joven hasta los 75 años35,54,55.
- d.
PALB2 y CDH1: MD o TM y RM de mama anual sin consenso en edad de inicio, planteando la NCCN no iniciar antes de los 30 años, mientras que la Sociedad Española de Oncología Médica (SEOM) propone a partir de los 35 años35,55.
Resumen recomendaciones de cribado y terapia actuales en mujeres de alto riesgo
| Escenario clínico | Métodos de cribado | Conductas terapeúticas a discutir en consejo genéticod |
|---|---|---|
| Mutación genética:BRCA1 y BRCA2 | RM anual a partir de los 25 años de edad.MD o TM anual a partir de los 30 añosa | Mastectomía reductora de riesgoOoforosalpingectomía bilateralQuimioprevenciónModificaciones en el estilo de vida |
| Mutación genética:TP53 | -RM anual de inicio a los 20 años de edad-MD o TMb a partir de los 30 años de edad anualmente | Mastectomía reductora de riesgoModificaciones en el estilo de vida |
| Mutación genética:PTEN | -MD/TM y RM anual iniciando entre los 30 y 35 años de edadc o 5 años antes de la edad del pariente más joven hasta los 75 años | Mastectomía reductora de riesgoModificaciones en el estilo de vida |
| Mutación genética:PALB y CDH1 | MD/TM y RM de mama anual a partir de los 35 años, nunca antes de los 30 añosc | Mastectomía reductora de riesgoModificaciones en el estilo de vida |
| Mujeres con historia familiar de CM y riesgo mayor o igual al 20% | RM de mama anual desde los 25 años de edadMD /TM y RM de mama anual a partir de los 40 años o 10 años antes del familiar más joven diagnosticado con CM, nunca antes de los 30 años. | Mastectomía reductora de riesgoQuimioprevenciónModificaciones en el estilo de vida |
| Radiación torácica antes de los 30 años | MD/TM y RM de mama anual iniciando 8 o 10 añosc después de finalizada la radioterapia, nunca antes de los 25 años | Mastectomía reductora de riesgoQuimioprevenciónModificaciones en el estilo de vida |
| Historia personal CM antes de los 50 años o con mamas densas | MD y RM de mama anual desde el momento del diagnóstico | Modificaciones en el estilo de vidaCirugía o Quimioprevención deberán discutirse según cada caso |
Se sugiere MD con TM y RM de mama con contraste anual iniciando 10 años antes de que el miembro más joven de la familia fuera diagnosticado con CM, no antes de los 30 años; o comenzar a los 40 años (lo que ocurra primero). La SEOM propone realizar RM de mama anual desde los 25 años de edad6,35,54,55.
Radiación torácica antes de los 30 añosMD/TM y RM de mama anual iniciando 8 o 10 años (sin consenso) después de finalizada la radioterapia, pero no antes de los 25 años de edad6,35,54.
Historia personal de cáncer de mama antes de los 50 años o con mamas densasMD y RM de mama anual, ambos desde el momento del diagnóstico6.
Imagen durante las estrategias de reducción de riesgoMastectomía reductora de riesgo (MRR)«Debe ser considerada en todos los individuos con variante genética patógena/probablemente patógena en genes de susceptibilidad al CM de alta penetrancia, historia familiar convincente o en aquellos que recibieron radioterapia de tórax antes de los 30 años de edad»8.
Disminuye el riesgo de CM por BRCA1 y BRCA2 hasta un 90%, con una incidencia de 0,7% por paciente y 0,35% por mama. La mastectomía preservadora de piel es aceptada como igual de segura que la mastectomía preservadora de aréola-pezón. Se recomienda realizar RM de mama 6 meses antes de la cirugía para descartar CM y una RM posquirúrgica (técnica que mejor cuantifica el volumen fibroglandular), para evaluar si quedó o no tejido fibroglandular y si quedó, cuantificarlo para decidir si realizar una nueva cirugía, cribado con US (si no hay tejido) o con RM (si hay tejido)54,55.
Diversos estudios han propuesto que existe un riesgo de recurrencia ipsilateral (RRI) en la mastectomía parcial (MP) realizada a portadoras de mutación BRCA con CM (sin diferencias entre BRCA1 y BRCA2), similar al RRI encontrado en pacientes con CM no portadoras de dicha mutación, tampoco se han encontrado diferencias estadísticamente significativas en la sobrevida global (SG) entre ambos grupos56.
El RRI en portadoras BRCA posterior a la mastectomía total fue menor al encontrado en pacientes a las que se le realizó una MP, sin embargo, la SG y la sobrevida específica por CM fueron similares entre ambos grupos56.
Salpingooforectomía bilateralEs recomendada para la prevención de cánceres de ovario, trompas de falopio, en portadoras de mutaciones BRCA1 y BRCA2, con una baja certeza en cuanto a la disminución de riesgo para CM57.
QuimioprevenciónRecomendada únicamente en mujeres con edad igual o mayor a 35 años de edad8.
Estudios han demostrado que en pacientes con mutación BRCA con CM, el uso de tamoxifeno tiene efecto protector contra el CM contralateral. Sin embargo, no se ha podido demostrar el beneficio para la quimioprevención primaria en portadoras BRCA1/BRCA2, ni en otras mutaciones genéticas de alta penetrancia55. No existen datos sobre el uso de raloxifeno en personas portadoras de BRCA1/BRCA2 y otras mutaciones patógenas o que hayan recibido radiación torácica previa8.
Para las personas premenopáusicas sanas con alto riesgo para CM, los datos sobre la relación riesgo/beneficio del tamoxifeno parecen relativamente favorables. En este grupo es inapropiado el uso de raloxifeno e inhibidores de aromatasa8.
En mujeres posmenopáusicas, la relación riesgo/beneficio del tamoxifeno, raloxifeno e inhibidores de aromatasa (exemestano-anastrozol), están influenciadas por la edad, la presencia de útero o condiciones comórbidas8.
El cribado se realizará con MD/TM y RM de mama anual como se describió en este subgrupo previamente.
ConclusionesTodas las mujeres deben ser evaluadas a partir de los 25 años con la finalidad de determinar el riesgo que presentan para CM.
En este grupo de mujeres con alto riesgo falta consenso por parte de las principales sociedades en temas como a qué edad comenzar el cribado, el uso alterno o sincrónico de la RM y MD, individualización de los protocolos de cribado y edad de finalización del mismo.
La RM es el método de imagen más sensible para el diagnóstico de CM, y será el método de elección junto con la MD y/o TM para realizar el cribado con periodicidad anual en todos los subgrupos.
LA CEM o MBI se consideran métodos de imágenes alternativos a la RM en caso de contraindicaciones de la misma. Puede realizarse US como completo a la MD/DBT anual solo cuando las técnicas funcionales no estén disponibles.
La heterogeneidad de los subgrupos en mujeres de alto riesgo y el advenimiento de la IA mejorando la precisión y tiempo de los métodos diagnósticos, hace plantearse la necesidad de personalizar las estrategias de cribado.
Consideraciones éticasPor tratarse de una revisión de artículos ya publicados, no se han vulnerado los principios éticos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores no declaran ningún conflicto de intereses.