la mastitis granulomatosa es una enfermedad inflamatoria crónica que se presenta como un tumor mamario doloroso, asociado a abscesos y fístulas, que puede simular un carcinoma. Su etiología no es clara y se postula un mecanismo autoinmune modulado por el bacilo Corynebacterium. No existen guías diagnósticas ni algoritmos terapéuticos. En nuestro estudio analizamos las presentaciones clínicas, imágenes, cultivos y hallazgos patológicos junto con los tratamientos, resultados y evolución.
Material y métodosrealizamos un estudio descriptivo, retrospectivo y observacional de las pacientes con diagnóstico de mastitis granulomatosa tratadas en nuestro hospital en el periodo 2017-2022.
Resultadosse evaluaron 51 pacientes con una edad media de 38,1 años; que habían tenido embarazos y lactancia, 88,2%. Clínica: tumor palpable abscedado y/o fistulizado, 74,5%; tumor palpable doloroso 13,8%; tumor asintomático, 11,7 %; eritema nodoso, 11,7%; imágenes BIRADS 4-5: 82,3%; tamaño promedio: 3,54 cm. Patología: vacuolas quísticas asociadas a Corynebacterium en 24 biopsias (47,1%); bacteriología: cultivos positivos para Corynebacterium en 13 de 47 muestras (27,6%). Tratamiento: antiobioterapia 92,1%; inmunosupresión, 78,4% y tratamiento quirúrgico 60,7 %. Tiempo medio de inmunosupresión con corticoides 7,09 meses y con metotrexato 9,27 meses. Complicaciones: 9,8%; secuelas estéticas: 39,2% tiempo libre de enfermedad: 14,04 meses. Recurrencias: 13,7 %.
Conclusionesla búsqueda bacteriológica y patológica del Corynebacterium junto a un abordaje multidisciplinario es esencial para un tratamiento a medida del paciente en pos de lograr el mayor éxito terapéutico.
Granulomatous mastitis is a chronic inflammatory disease that presents as a painful breast mass, associated with abscesses and fistulas, which can mimic carcinoma. Etiology is still unclear, and an autoimmune response related to Corynebacterium is postulated. There are no diagnostic guidelines or therapeutic algorithms. In our study we analyzed the clinical presentations, images, cultures, and pathological findings together with the treatments, results, and evolution.
Material and methodsWe carried out a descriptive, retrospective, and observational study of patients diagnosed with granulomatous mastitis treated in our hospital in the period 2017-2022.
Results51 women. Average age 38.1 years. Pregnancies and Lactation 88.2%. Clinic: Abscessed and/or fistulized palpable mass 74.5%, painful palpable mass 13.8%. Asymptomatic mass 11.7%. Erythema Nodosum 11.7% BIRADS images 4/5: 82.3%. Average size: 3.54 cm. Pathology: Cystic vacuoles associated with Corynebacterium in 24 biopsies (47.1%). Bacteriology: positive cultures for Corynebacterium in 13 of 47 samples (27.6%). Treatment: antibiotic therapy 92.1%, immunosuppression 78.4%, surgical treatment 60.7%. Mean time of immunosuppression with corticosteroids 7.09 months and with methotrexate 9.27 months. Complications: 9.8% Aesthetic sequelae: 39.2% Disease-free time: 14.04 months. Recurrences: 13.7%.
ConclusionsThe bacteriological and pathological search for Corynebacterium and a patient tailor made multidisciplinary approach is essential to achieve therapeutic success.
La mastitis granulomatosa idiopática (MGI), descripta en 1972 por Kessler y Wolloch1, es una enfermedad inflamatoria benigna, crónica e infrecuente, caracterizada por la presencia de granulomas no caseosos. Típicamente se presenta en las mujeres jóvenes como un tumor mal definido, doloroso y de rápido crecimiento generalmente acompañado de eritema, abscesos, fístulas y/o úlceras, simulando una mastitis aguda o un cáncer de mama. Su etiología aún no está dilucidada y la teoría más aceptada la considera una inflamación local autoinmune. Taylor reportó en 2003 una fuerte asociación con el Corynebacterium y Renshaw en 2011 definió un subtipo con un patrón quístico rodeado por neutrófilos vinculado al Corynebacterium, especialmente la especie kroppenstedtii, bajo el termino: «mastitis granulomatosa neutrofílica quística» (MGNQ)2,3. Las imágenes son mayormente inespecíficas e interpretadas con sospecha de malignidad (BIRADS 4-5), por lo tanto, el diagnóstico diferencial es por medio de una biopsia histológica. El tratamiento antibiótico es mayormente empírico debido a la dificultad para lograr aislamiento bacteriano y se realiza inmunosupresión con corticoides utilizando también metotrexato (MTX) asociado4. Los abscesos son drenados por punción o quirúrgicamente en cuadros complejos. La tumorectomía es útil en lesiones no complicadas y se recomienda evitar grandes resecciones5. Las recurrencias con tratamiento farmacológico son del 30-50%, del 15% en los casos de respuesta parcial agregando exéresis quirúrgica y del 6,6% en las lesiones no complicadas tratadas solo quirúrgicamente. Las secuelas cicatrízales y deformidad mamaria son las complicaciones más frecuentes4–7. El objetivo del trabajo es analizar nuestra experiencia multidisciplinaria en el diagnóstico y la instauración de un tratamiento y seguimiento personalizado, identificando las características de las pacientes que han recaído y logrado la curación para poder mejorar el abordaje terapéutico.
Material y métodosEstudio retrospectivo, descriptivo y observacional. Se utilizó la base de datos de los servicios de cirugía general (sección mastología), reumatología y anatomía patológica, evaluándose 51 pacientes con diagnóstico de mastitis granulomatosa en el período 2017-2022. Se relevaron datos demográficos, embarazos y lactancia, antecedentes mamarios, las presentaciones clínicas según los 4 patrones de Yaghan8 (A- tumor asintomático B- tumor inflamatorio C- tumor con absceso D- tumor con fístula y/o úlcera, agregándose la “E” en caso de enfermedad extra mamaria asociada. Se evaluaron los hallazgos de las imágenes, cultivos, anatomía patológica, PPD y radiografías de tórax. Las biopsias con diagnóstico de MGI fueron examinadas con técnicas de Ziehl-Neelsen, PAS, Gram y Giemsa, y se revisó el material buscando lesiones quísticas rodeadas de neutrófilos. Se analizaron los tratamientos, evoluciones, complicaciones y secuelas, el tiempo libre de enfermedad (TLE) y las recurrencias. La curación fue definida como la ausencia de enfermedad clínica y por imágenes una vez finalizado el tratamiento, y la recurrencia como su manifestación luego de 3 meses de curación.
ResultadosDatosDemográficos: se evaluaron 51 pacientes del sexo femenino con una edad media de 38,1 años (26-59). Treinta y tres pacientes (64,7%) de nacionalidad argentina, 8 (15,7%) de Perú, 6 (11,7%) de Paraguay, 3 (6%) de Bolivia y una (1,9%) de Venezuela; 45 habían tenido embarazos y lactancia (88,23%), 4 antecedentes de mastitis lactacional (7,84%) y 2 infección poscolocación de prótesis mamarias (3,92%), una hiperprolactinemia y galactocele (1,96%) y una tratamiento previo con progesterona (1,96%). En ningún caso hubo lactancia en el año previo a la presentación de la enfermedad.
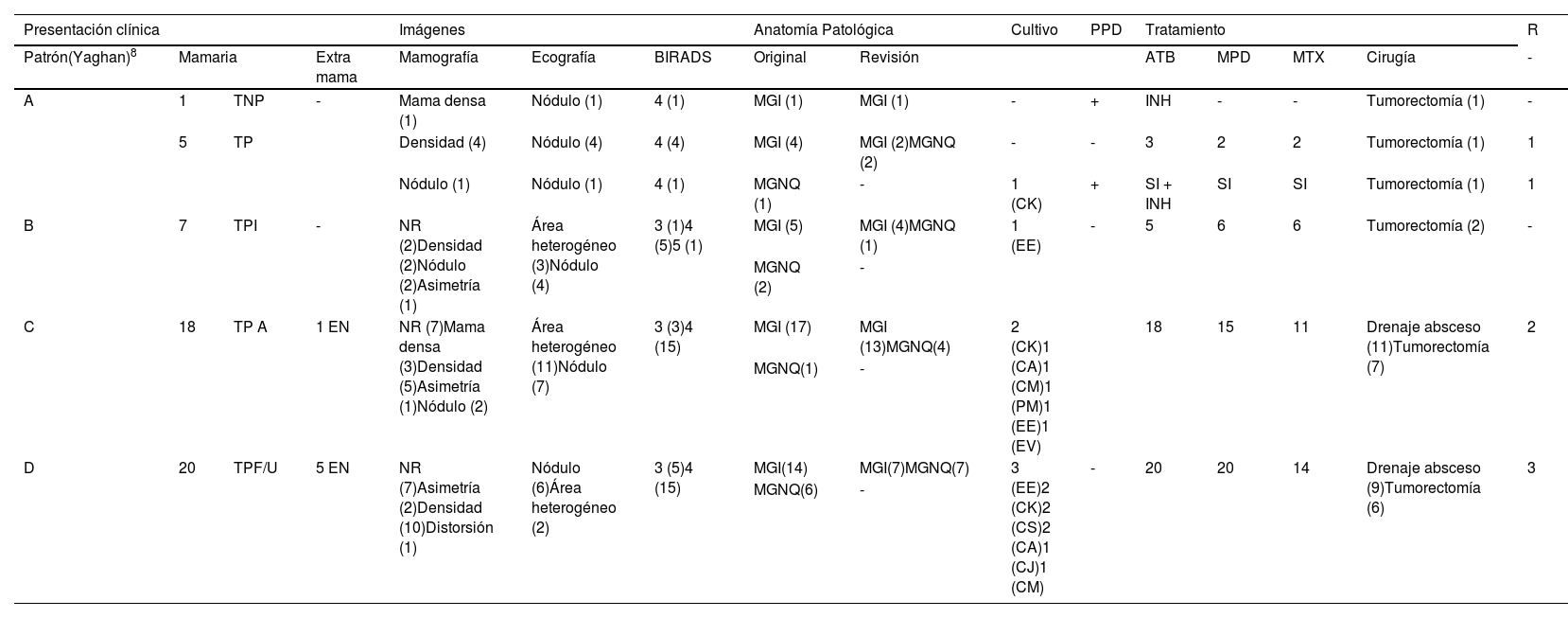
Signosy síntomas: la presentación clínica más frecuente fue la de un tumor palpable, doloroso, unilateral acompañado con fístulas y/o úlceras en 20 pacientes (39,2%), en 18 casos con absceso (35,3%) y en 7 pacientes con tumor inflamatorio (13,8%). Seis pacientes tuvieron tumores asintomáticos (11,7%), uno de los cuales fue un hallazgo imagenológico no palpable (1,9%); 6 pacientes (11,7%) presentaron eritema nodoso como manifestación extra mamaria asociada (fig. 1 - tabla 1).
Patrones de Yaghan. A) Tumoración tipo A: asintomática, B) tipo B: tumoración inflamatoria, C) tipo C: tumoración asociada con absceso y D) tipo D: Tumoración con fístulas y úlcera8.
Presentación clínica, imagenológica y patológica. Tratamiento y evolución
| Presentación clínica | Imágenes | Anatomía Patológica | Cultivo | PPD | Tratamiento | R | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Patrón(Yaghan)8 | Mamaria | Extra mama | Mamografía | Ecografía | BIRADS | Original | Revisión | ATB | MPD | MTX | Cirugía | - | |||
| A | 1 | TNP | - | Mama densa (1) | Nódulo (1) | 4 (1) | MGI (1) | MGI (1) | - | + | INH | - | - | Tumorectomía (1) | - |
| 5 | TP | Densidad (4) | Nódulo (4) | 4 (4) | MGI (4) | MGI (2)MGNQ (2) | - | - | 3 | 2 | 2 | Tumorectomía (1) | 1 | ||
| Nódulo (1) | Nódulo (1) | 4 (1) | MGNQ (1) | - | 1 (CK) | + | SI + INH | SI | SI | Tumorectomía (1) | 1 | ||||
| B | 7 | TPI | - | NR (2)Densidad (2)Nódulo (2)Asimetría (1) | Área heterogéneo (3)Nódulo (4) | 3 (1)4 (5)5 (1) | MGI (5) | MGI (4)MGNQ (1) | 1 (EE) | - | 5 | 6 | 6 | Tumorectomía (2) | - |
| MGNQ (2) | - | ||||||||||||||
| C | 18 | TP A | 1 EN | NR (7)Mama densa (3)Densidad (5)Asimetría (1)Nódulo (2) | Área heterogéneo (11)Nódulo (7) | 3 (3)4 (15) | MGI (17) | MGI (13)MGNQ(4) | 2 (CK)1 (CA)1 (CM)1 (PM)1 (EE)1 (EV) | 18 | 15 | 11 | Drenaje absceso (11)Tumorectomía (7) | 2 | |
| MGNQ(1) | - | ||||||||||||||
| D | 20 | TPF/U | 5 EN | NR (7)Asimetría (2)Densidad (10)Distorsión (1) | Nódulo (6)Área heterogéneo (2) | 3 (5)4 (15) | MGI(14) | MGI(7)MGNQ(7) | 3 (EE)2 (CK)2 (CS)2 (CA)1 (CJ)1 (CM) | - | 20 | 20 | 14 | Drenaje absceso (9)Tumorectomía (6) | 3 |
| MGNQ(6) | - | ||||||||||||||
CA: Corynebacterium amycolatum; CJ: Corynebacterium jeikeium; CK: Corynebacterium kroppenstedtii; CM: Corynebacterium minutissimum; CS: Corynebacterium spp; EE: Estafilococo epidermidis; EN: Eritema nudoso; EV: Estreptococo viridans; INH: isoniacida; MGI: Mastitis granulomatosa idiopática; MGNQ: Mastitis granulomatosa neutrofílica quística; NR: no realizado; PM: Proteus mirabilis; R: recurrencia; TPF/U: tumor palpable con fístula/úlcera; TNP: tumor no palpable; TP: tumor palpable; TPA: tumor palpable abscedado; TPI: tumor palpable inflamatorio.
Diagnóstico por imágenes: el 100% de las pacientes fueron evaluadas con ecografía y en 35 (68,6%) también se realizó mamografía, siendo el 82,3% de las imágenes categorizadas BIRADS 4-5 (tabla 1). En 34 pacientes (66,6%) se observaron lesiones doppler positivas en la ecografía y en 31 (60,7%) imágenes tubulares hipoecoicas símil dedos (fingerlike), las cuales se extendían desde la lesión hacia la piel, las cuales corresponderían a trayectos fistulosos en desarrollo y muchas veces finalizaban en colecciones superficiales (fig. 2). El tamaño tumoral promedio fue de 3,54 cm (0,8-9)
Anatomía patológica y bacteriología: se realizaron 35 biopsias histológicas con guía ecográfica (68,6%), 12 biopsias quirúrgicas (23,6%) y 4 tumorectomías (7,8%). Veintisiete pacientes fueron diagnosticadas como MGI (52,9%) y 24 como MGNQ (47,1%). La revisión modificó el diagnóstico de MGI a MGNQ en 14 casos (27,4%) y en 10 de 24 muestras de MGNQ (41,6%), se hallaron bacilos dentro de las lesiones quísticas (fig. 3 A y B) (tabla 1). Se tomaron muestras de cultivo en 47 pacientes (92,1%); 20 pacientes tuvieron cultivo positivo (42,5%), 13 de ellos fueron positivos para Corynebacterium (65%), siendo el Corynebacterium kroppenstedtii el más frecuente (5 pacientes), 5 para Staphylococcus epidermidis (25%), un caso con Streptococcus viridans (5%) y otro con proteus (5%) (tabla 1).
Se realizaron en todas las pacientes radiografía de tórax y PPD, siendo esta última positiva en 2 casos (3,92%), los cuales fueron estudiados con cultivo para BAAR (negativo) y TAC de tórax sin imágenes patológicas. Ambas recibieron profilaxis antituberculosa con isoniazida por 6 meses.
Tratamientoy evolución: 47 pacientes (92,1%) recibieron tratamiento antibiótico empírico y acorde con antibiograma según rescate bacteriológico, con una duración media de 1,75 meses (1-4). Los más utilizados fueron amoxicilina más ácido clavulánico, ciprofloxacina, clindamicina, trimetoprima sulfametoxazol y claritromicina (fig. 4 A). De las 28 pacientes (54,9%) que finalizaron el tratamiento: 15 pacientes recibieron tratamiento con MPD 8 mg/día asociado a MTX 15 mg/semanal (fig. 4B) y 8 de ellas además recibieron a tratamiento quirúrgico (4 drenajes de abscesos, 3 tumorectomía más drenaje y una tumorectomía); 5 solo fueron tratados con MPD y cirugía (3 tumorectomía más drenaje, una tumorectomía y un drenaje de absceso). Una solo con MTX, una con MPD, MTX, azatioprina (AZA) y tumorectomía. Una paciente era trasplantada renal, por lo que ya recibía tratamiento inmunosupresor y fue tratada solo con tumorectomía, 3 pacientes recibieron solo tratamiento antibiótico y punción evacuación de colección, 2 pacientes solo fueron tratadas con tumorectomía.
El tiempo medio de tratamiento con MPD fue de 7,09 y con MTX de 9,27 meses con un TLE de 14,04 meses (3-37). Las pacientes que recibieron tratamiento antibiótico y drenaje de colección tuvieron un TLE de 17,6 meses. En las pacientes que tuvieron tratamiento quirúrgico el TLE fue de 33,5 meses. Al momento del cierre del estudio 17 pacientes (33,3%) se encuentran bajo tratamiento inmunosupresor con MPD y MTX (4,93 y 7,35 meses de media, respectivamente) y 12 de ellas recibieron tratamiento quirúrgico (5 drenaje de abscesos, 3 tumorectomías más drenaje de absceso, 2 tumorectomías y 2 drenajes de absceso); 6 pacientes (11,7%) recibieron antibióticos, iniciaron inmunosupresión y además 3 de ellas fueron tratadas quirúrgicamente (2 drenajes de absceso y biopsia, y una tumorectomía más drenaje) pero abandonaron el seguimiento entre 1-2 meses de iniciado el tratamiento (tabla 1).
Secuelas: 20 pacientes (39,2%) presentaron secuelas cicatrízales y deformidad mamaria debido a la evolución natural de la enfermedad y los tratamientos realizados (fig. 4C).
Complicaciones: como producto del tratamiento farmacológico, 5 pacientes presentaron complicaciones intratratamiento (9,80%), 2 presentaron leucopenia, 2 insuficiencia suprarrenal (ambas venían con tratamiento iniciado en otros centros con altas dosis de corticoides) y una con anemia.
Recurrencias: 7 pacientes (13,72%) presentaron recaída a los 8,7 meses de media (4-13). En 5 casos la recurrencia fue posterior al tratamiento médico (71,4%) y en 2 postratamiento quirúrgico inicial y único (28,6%). En 2 pacientes la recaída se manifestó en la mama contralateral y en una de ellas la lesión original fue MGNQ y la recurrencia contralateral MGI.
DiscusiónLas evidencias sugieren que la mastitis granulomatosa se asocia con factores inmunológicos e inflamatorios. Los desbalances entre el ambiente, la paciente y la microbiota alterarían el microambiente mamario induciendo la liberación de factores inflamatorios que resultan en daño epitelial ductal y disbiosis desencadenando una respuesta a antígenos del Corynebacterium. Si bien algunas especies de este bacilo forman parte de la microbiota normal, existen evidencias de que algunas especies son patogénicas, siendo el kroppenstedtii la más fuertemente relacionada a la mastitis granulomatosa y serian el puntapié inicial responsable de la respuesta inflamatoria local y en algunos casos a distancia, siendo la más frecuentemente observada la paniculitis mediada por células conocida como eritema nodoso. El Corynebacterium kroppenstedtii es un bacilo lipofílico y su presencia se asocia con recurrencias9–12 Hay 3 formas de identificar al Corynebacterium: cultivos, hallazgo patológico y secuenciación genómica. Por muchas razones este bacilo ha sido subdetectado y subreportado. Es muy difícil detectarlo en el cultivo sin medios y tiempo adecuados para su desarrollo y también si al momento de obtención de la muestra el paciente está bajo tratamiento antibiótico. El hallazgo patológico dependerá del sitio y calidad de la muestra, tiempo de evolución y del trabajo del patólogo4–10. La detección directa amplificando mediante PCR y secuenciando una región del genoma del 16s ARNr bacilar, han influido en el aumento de los casos por Corynebacterium publicados en los últimos años, aunque esta metodología no está disponible en nuestro hospital ni en la mayoría de los centros de atención13.
Analizando nuestra serie observamos que el 74% eran mujeres jóvenes con una tumoración mamaria unilateral que rápidamente evoluciono con dolor, inflamación y compromiso cutáneo, y si bien algunas tuvieron presentaciones asintomáticas, la observación clínica y evolución de las pacientes nos obliga a pensar que los diferentes patrones de presentación propuestos por Yaghan no serían más que etapas evolutivas de la enfermedad. Las imágenes mamográficas de nuestras pacientes no fueron patognomónicas, mientras que la ecografía fue de suma utilidad para la sospecha diagnóstica al observarse lesiones doppler positivas con imágenes FL y colecciones asociadas, permitiendo además la realización de drenajes, la obtención de muestras para cultivo, la monitorización de la respuesta al tratamiento y el seguimiento.
Debe realizarse el diagnóstico diferencial con el cáncer de mama, la tuberculosis y también otras enfermedades reumáticas asociadas (sarcoidosis, enfermedad de Wegener, etc.) por medio de biopsia histológica, tinciones especiales y cultivos. Nuestras pacientes realizaron tratamientos prolongados con antibióticos de adecuada penetración en el tejido adiposo. Algunos autores reportan tratamientos de 7 meses de media e incluso más de un año7,9,10. Si bien es necesario seguir investigando, dadas las evidencias y la baja morbilidad asociada al tratamiento, es razonable dar antibióticos empíricos o acorde a antibiograma acompañando la inmunosupresión. Los de elección son la amoxicilina más ácido clavulánico, claritromicina, doxiciclina, ciprofloxacina y rifampicina10. La respuesta suele ser lenta y muchas veces recién se ven cambios entre las 2 a 4 semanas del tratamiento. Los signos de mejoría son la reducción del tamaño de la lesión, mejoría de las complicaciones cutáneas y ausencia de dolor. Si el cuadro empeora se debería rotar el antibiótico hasta resolución clínica. La inmunosupresión con dosis bajas de MPD y/o MTX con reducción gradual de dosis hasta suspensión y estricto control para evitar efectos adversos debe acompañar al tratamiento antibiótico. La cirugía debe realizarse ante las complicaciones y en pacientes seleccionados con enfermedad no complicada y limitada. En nuestra serie de 51 pacientes, 24 (47,1%) presentaron confirmación histológica de MGNQ, hallazgo indubitable de la presencia del Corynebacterium, 10 de ellas presentaban además bacilos dentro de los quistes y 8 de ellas contaban además con su aislamiento bacteriológico y 5 pacientes con diagnóstico de MGI tuvieron cultivo positivo para Corynebacterium. Por lo tanto, en 29 pacientes (56,9%) hay evidencias del bacilo. Dada la dificultad para aislarlo en los cultivos, pensamos que existiría un porcentaje incierto de casos catalogados como MGI con cultivo negativo que tendrían presencia bacilar subdiagnosticada. De hecho, uno de nuestros casos con diagnóstico de MGNQ con cultivo negativo tuvo una recaída contralateral con biopsia para MGI y cultivo también negativo. Las mayores limitaciones de nuestro estudio son su carácter retrospectivo y que al momento de realizar el trabajo 17 pacientes siguen bajo tratamiento, lo cual limita algunos parámetros estadísticos.
ConclusionesDebido a la falta de un consenso y a los diferentes tratamientos descriptos que condicionan las tasas de respuesta y recaídas, ante la sospecha de una mastitis granulomatosa remarcamos la importancia de la búsqueda del Corynebacterium en cultivos, el diagnóstico patológico precoz y búsqueda de las lesiones quísticas, el tratamiento prolongado con antibióticos acompañado por la inmunosupresión asociado a cirugía en casos seleccionados y con un seguimiento multidisciplinario personalizado. Estas conductas son prometedoras en cuanto a la resolución de las lesiones evitando tratamientos quirúrgicos agresivos y disminuyendo la tasa de recidiva.
Responsabilidades éticasLa información de las pacientes se ha recopilado según las normas del Comité Ético y de Investigación del Hospital Argerich garantizando la confidencialidad de los datos habiéndose obtenido el consentimiento informado por escrito de todas las pacientes incluidas en este estudio.
Consentimiento informadoLos autores declaran que han obtenido el consentimiento de las pacientes para la publicación de este artículo.
FinanciaciónLos autores no han recibido apoyo financiero para la realización del trabajo.
Conflicto de interesesNinguno.