Current topics in Oncology and Radiotherapy
More infoEn los últimos años se han ampliado las indicaciones de quimioterapia primaria (QTP) en pacientes con cáncer de mama. Este cambio en el paradigma terapéutico ha supuesto un replanteamiento del abordaje quirúrgico de la axila y un desafío a la hora de definir las indicaciones de la radioterapia locorregional adyuvante. Inicialmente, la toma de decisiones terapéuticas se ha extrapolado y basado en la evidencia obtenida de estudios aleatorizados en el contexto de cirugía primaria.
Especialmente controvertido es el escenario de afectación ganglionar al diagnóstico. Con la finalidad de reducir la morbilidad derivada de la linfadenectomía axilar (LA) completa, a lo largo de la última década la tendencia ha sido la desescalada terapéutica a nivel axilar.
The indications for primary chemotherapy (PTC) in breast cancer patients have widened in recent years. This therapeutic paradigm shift has led to a rethinking of the surgical approach to the axilla and a challenge in defining the indications for adjuvant loco-regional radiotherapy. Therapeutic decision-making was initially extrapolated and based on evidence from randomized studies in the context of primary surgery.
The scenario of nodal involvement at diagnóstico is particularly controversial. To reduce the morbidity arising from complete axillary lymphadenectomy (AL), the trend over the last decade has been towards therapeutic de-escalation at the axillary level.
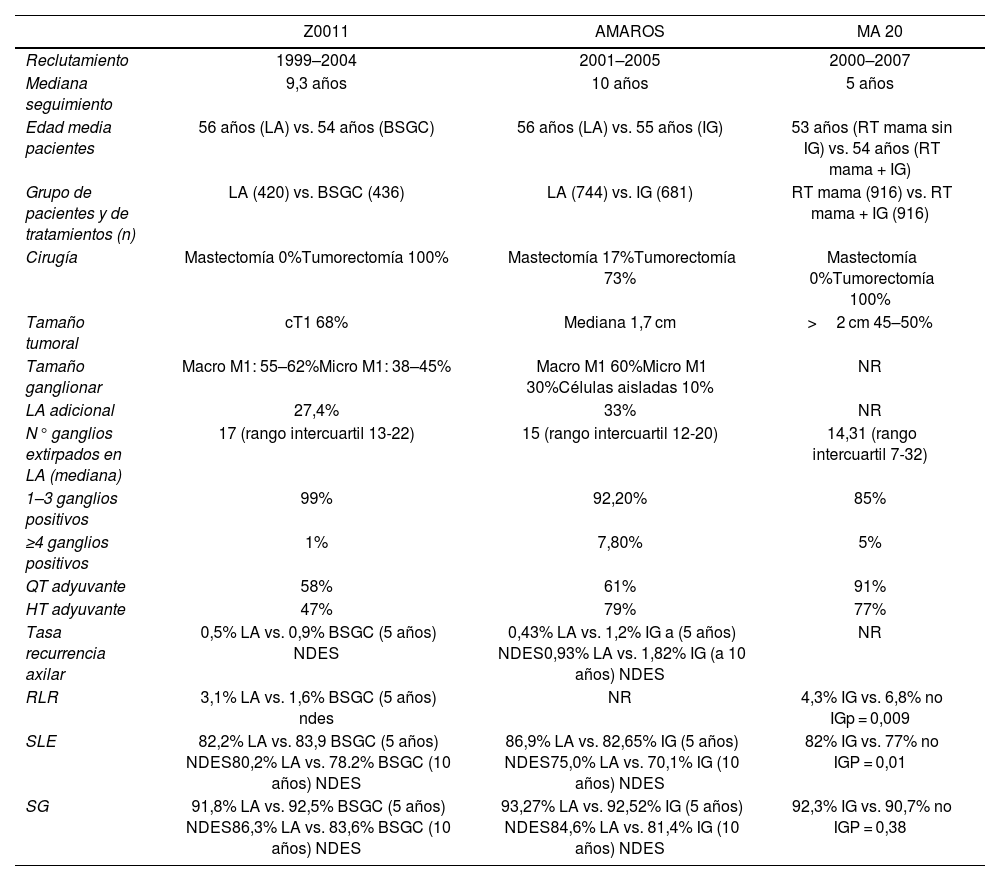
El estudio ACOSOG Z0011, estudio multicéntrico aleatorizado de no inferioridad, supuso un gran cambio en el paradigma del manejo axilar, al demostrar no inferioridad de la biopsia selectiva de ganglio centinela (BSGC) versus la linfadenectomía axilar (LA), en pacientes sin afectación ganglionar clínica (cN0) con tumores T1-T2 en las que se objetivaban hasta 2 ganglios centinelas (GC) positivos. Todas las pacientes fueron sometidas a cirugía conservadora de mama y, por lo tanto, a una irradiación posterior de la misma1,2. El estudio IBCSG 23–01 confirmó la no inferioridad de la LA respecto a la BSGC en tumores ≤5 cm con micrometástasis ganglionar, observándose una mayor tasa de complicaciones y neuropatía en las pacientes sometidas a LA3. Ambos estudios demuestran la no inferioridad de la BSGC respecto a la LA en términos de supervivencia libre de enfermedad (SLE), supervivencia global (SG) y supervivencia libre de recidiva locorregional (SLRL).
Buscando la desescalada terapéutica axilar, estudios aleatorizados posteriores analizaron la posibilidad de reemplazar la LA por la irradiación ganglionar (IG). El estudio AMAROS, con un total de 4.806 pacientes afectas de lesiones cT1–2, cN0 y con BSGC positiva, demostró un control axilar comparable en ambos grupos de tratamiento (recidiva axilar [RA] a 5 años del 0,43 y 1,19% con LA e IG respectivamente), así como una reducción significativa de la morbilidad en forma de linfedema del brazo ipsilateral al efectuar IG. En este estudio, la LA incluyó al menos los niveles I-II y ≥ 10 ganglios, mientras que la IG incluyó los niveles axilares I, II, III y la parte medial de la fosa supraclavicular hasta una dosis de 50 Gy a 2 Gy/fracción en 25 sesiones o una dosis biológica equivalente. Aquellas LA con ≥4 ganglios afectos eran seguidas de una IG adyuvante4. Los resultados a 10 años no mostraron diferencias entre ambos brazos ni en SG (HR, 1,17; 95% CI, 0,89 a 1,52) ni en SLE (HR, 1,19; 95% CI, 0,97 a 1,46)5.
Otro estudio con un diseño similar al anterior, el OTOASOR6, en el que se incluyeron pacientes cN0 con tumores de hasta 3 cm y BSGC positiva, tampoco observó diferencias estadísticamente significativas entre ambos grupos en términos de RA (2,0% en LA vs. 1,7% en RTA) (p = 1,00), SG (77,9% en LA vs. 84,8% en RTA) (p = 0,060) ni en SLE (72,1% en LA vs. 77,4 en RTA) (p = 0,51).
Estos estudios han generado la suficiente evidencia sobre la ausencia de beneficio de la LA en pacientes con cáncer de mama en estadios iniciales cT1–2 con uno o 2 GC positivos, siempre que estas pacientes reciban posteriormente radioterapia, ya sea como adyuvancia a una cirugía conservadora (ACOSOG Z0011)2 o una IG (AMAROS y OTOASOR)4,6 (tabla 1).
Resumen del manejo axilar tras biopsia selectiva del ganglio centinela positiva después de cirugía primaria según los principales estudios randomizados
| Z0011 | AMAROS | MA 20 | |
|---|---|---|---|
| Reclutamiento | 1999–2004 | 2001–2005 | 2000–2007 |
| Mediana seguimiento | 9,3 años | 10 años | 5 años |
| Edad media pacientes | 56 años (LA) vs. 54 años (BSGC) | 56 años (LA) vs. 55 años (IG) | 53 años (RT mama sin IG) vs. 54 años (RT mama + IG) |
| Grupo de pacientes y de tratamientos (n) | LA (420) vs. BSGC (436) | LA (744) vs. IG (681) | RT mama (916) vs. RT mama + IG (916) |
| Cirugía | Mastectomía 0%Tumorectomía 100% | Mastectomía 17%Tumorectomía 73% | Mastectomía 0%Tumorectomía 100% |
| Tamaño tumoral | cT1 68% | Mediana 1,7 cm | >2 cm 45–50% |
| Tamaño ganglionar | Macro M1: 55–62%Micro M1: 38–45% | Macro M1 60%Micro M1 30%Células aisladas 10% | NR |
| LA adicional | 27,4% | 33% | NR |
| N° ganglios extirpados en LA (mediana) | 17 (rango intercuartil 13-22) | 15 (rango intercuartil 12-20) | 14,31 (rango intercuartil 7-32) |
| 1–3 ganglios positivos | 99% | 92,20% | 85% |
| ≥4 ganglios positivos | 1% | 7,80% | 5% |
| QT adyuvante | 58% | 61% | 91% |
| HT adyuvante | 47% | 79% | 77% |
| Tasa recurrencia axilar | 0,5% LA vs. 0,9% BSGC (5 años) NDES | 0,43% LA vs. 1,2% IG a (5 años) NDES0,93% LA vs. 1,82% IG (a 10 años) NDES | NR |
| RLR | 3,1% LA vs. 1,6% BSGC (5 años) ndes | NR | 4,3% IG vs. 6,8% no IGp = 0,009 |
| SLE | 82,2% LA vs. 83,9 BSGC (5 años) NDES80,2% LA vs. 78.2% BSGC (10 años) NDES | 86,9% LA vs. 82,65% IG (5 años) NDES75,0% LA vs. 70,1% IG (10 años) NDES | 82% IG vs. 77% no IGP = 0,01 |
| SG | 91,8% LA vs. 92,5% BSGC (5 años) NDES86,3% LA vs. 83,6% BSGC (10 años) NDES | 93,27% LA vs. 92,52% IG (5 años) NDES84,6% LA vs. 81,4% IG (10 años) NDES | 92,3% IG vs. 90,7% no IGP = 0,38 |
BSGC: biopsia selectiva del ganglio centinela. GGL: ganglionar. HT: hormonoterapia. IG: irradiación ganglionar. LA: linfadenectomía axilar. M1: metástasis. NDES: no diferencias estadísticamente significativas. NR: no respuesta. RLR: recurrencia locorregional. RT: radioterapia. SG: supervivencia global. SLE: supervivencia libre de enfermedad. QT: quimioterapia.
Otros estudios han analizado en beneficio de la IG en pacientes con afectación de hasta 3 GC tratadas con cirugía primaria. El MA207 y el EORTC 22922–109258 aleatorizaron a las pacientes a recibir radioterapia exclusiva de la mama/pared torácica o radioterapia de la mama/pared torácica (50 Gy normofraccionados) y de las áreas ganglionares (axila niveles I-III, parte media supraclavicular y cadena mamaria interna [CMI]) entre 45 y 50 Gy.
La adición de la IG mostró un beneficio absoluto en términos de SG a 5 años en el MA.20 y a 5 y 10 años en el de la EORTC 22922–10925. La irradiación de la región media supraclavicular y la CMI se asoció con una mejoría significativa de la SLE (HR 0,85 [IC del 95%: 0,77 a 0,94]) y de la supervivencia libre de enfermedad a distancia (SLED) (HR 0,82 [IC del 95%: 0,73 a 0,92]). A su vez, los campos de radioterapia más amplios se asociaron con un aumento del riesgo de neumonitis, epitelitis y linfedema, observándose a 15 años una mayor incidencia de efectos pulmonares a largo plazo estadísticamente significativa al incluir la irradiación de la CMI9.
El beneficio de la IG en pacientes con 1–3 GC positivos queda confirmado también en el metaanálisis de Oxford del EBCTCG (Early Breast Cancer Trialists' Collaborative Group)10. Se trata de un metaanálisis de 22 estudios con un seguimiento de hasta 10 años, que incluyen 3.786 mujeres a las que se realizó mastectomía y LA de al menos el nivel I-II axilar, estratificando en 0,1 a 3 o ≥ 4 ganglios positivos. En estos estudios las pacientes fueron aleatorizadas a recibir o no radioterapia de la pared torácica, la axila o la fosa supraclavicular (o ambas) y de la CMI. No se observó beneficio con la IG en pacientes sin afectación ganglionar en términos de recaída locorregional, recidiva global ni en mortalidad por cáncer de mama. Sin embargo, en las pacientes con afectación ganglionar, independientemente del número de ganglios positivos y de haber realizado tratamiento sistémico adyuvante, la IG aumentó la tasa de la recaída locorregional, recurrencia global y mortalidad por cáncer de mama.
Manejo de la axila tras tratamiento sistémico neoadyuvanteEl siguiente paso hacia delante en la desescalada terapéutica axilar traslada la cuestión al escenario del tratamiento sistémico primario (TSP).
Varios estudios prospectivos han evaluado el papel de la BSGC seguida de la LA en las pacientes con afectación ganglionar metastásica al diagnóstico y que presentaban una respuesta clínica completa. Kuehn et al. (SENTINA) hallaron una tasa global de falsos negativos del 14,2% de la BSGC en la rama de mujeres clínicamente positivas (cN+) al diagnóstico con respuesta clínica completa a la quimioterapia neoadyuvante (ycN0)11. En el ensayo ACOSOG-Z107112, el análisis de 603 pacientes cN1 detectó una tasa de falsos negativos de la BSGC del 12,6%. Otro estudio, el SN FNAC, reportó en las mismas condiciones una tasa de falsos negativos del 13,3%, sin hallar correlación entre el tamaño de la metástasis de la BSGC y la tasa de ganglios no centinela positivos13.
El posterior análisis por subgrupos de estos estudios reveló que la tasa de falsos negativos de la BSGC tras neoadyuvancia en pacientes cN1 podría reducirse por debajo del 10% con la adopción de las siguientes medidas: doble uso de agentes de rastreo ganglionar (radiotrazador y colorante azul); identificación y estudio de ≥3 BSGC; marcaje previo al TSP del ganglio radiológicamente afecto y su posterior exéresis durante la cirugía. El estudio RAPCHEM, BOOG 2010–03 demostró una reducción de la tasa de falsos negativos hasta el 2% con la disección axilar dirigida (TAD) del ganglio marcado con biopsia positiva al diagnóstico y la realización de BSGC en comparación a la exéresis únicamente del ganglio marcado, con la cual se apreciaban tasas de falsos negativos de 4%14.
El siguiente paso por evaluar es en qué pacientes con afectación patológica ganglionar tras neoadyuvancia podría omitirse la LA, siendo esta sustituida por una IG.
De acuerdo con los resultados de los estudios no aleatorizados de los que disponemos, cuando persiste afectación ganglionar tras TSP, no podemos omitir la LA y continuamos administrando la IG con el incremento del riesgo de linfedema y de morbilidad que ambos tratamientos comportan.
Con la finalidad de desescalar el manejo axilar en pacientes cN+ que tras TSP presentan persistencia de afectación ganglionar, surgen los estudios aleatorizados ALLIANCE A011202 y ADARNAT (Adjuvant Disection Axillary Radiotherapy and Neoadjuvant Therapy). El objetivo de estos estudios es valorar si es posible omitir la LA y reemplazarla por la IG manteniendo las tasas de control locorregional y supervivencia.
El estudio ALLIANCE A011202 analiza en pacientes cT1-3 N1 con BSGC positiva tras quimioterapia primaria (QTP), si la IG sin LA no es inferior a la LA seguida de la IG (sin incluir los niveles I-II disecados), en términos de intervalo libre de recurrencia. Las pacientes son aleatorizadas a LA seguida de radioterapia de la mama/pared torácica, nivel III axilar y SCL (sin incluir los niveles I-II) versus radioterapia de la mama/pared y áreas ganglionares (niveles axilares I-II-III y SCL) sin LA. Hasta el momento se han reclutado 2.012 pacientes y la fecha estimada de finalización primaria será en enero de 2024.
El estudio ADARNAT, a diferencia de otros estudios, incluye a pacientes tratadas con hormonoterapia (HT). Se pretende incluir un total de 1.660 pacientes con cáncer de mama (cT1-T4b focal N0 o N1) tras TSP con BSGC positiva. Las pacientes son estratificadas en función del tipo de TSP (HT o QT) y la afectación ganglionar (micro o macrometástasis). Las participantes son aleatorizadas a LA seguida de IG versus IG sin LA (las áreas ganglionares a irradiar se detallan en la tabla 2). El objetivo primario es analizar las recidivas axilares a 5 años (clínica y radiológicamente). Está previsto finalizar el reclutamiento del estudio en junio de 2026.
Volúmenes de irradiación ganglionar en relación con el estadio clínico, la respuesta a neoadyuvancia y el abordaje quirúrgico axilar
| Estado clínico al diagnóstico | Respuesta a neoadyuvancia | Áreas a irradiar | |
|---|---|---|---|
| cN0 | ypN0/ypN0 (i+) | No indicación de irradiación | |
| ypN1mi/ypN1 | BSGC | IG axila I, II, III, supraclavicular +/− CMI | |
| LA | IG niveles no extirpados (axila III, supraclavicular) +/− CMI(EEC: IG axila I, II, III, supraclavicular) | ||
| ypN2–3 | LA | IG niveles no extirpados (axila III, supraclavicular) + CMI(EEC: IG axila I, II, III, supraclavicular) | |
| cN+ | ypN0/ypN0 (i+) | BSGC/TAD | IG axila I, II, III, supraclavicular +/− CMI |
| ypN1mi/ypN1 | BSGC/TAD | IG axila I, II, III, supraclavicular +/− CMI | |
| LA | IG niveles no extirpados (axila III, supraclavicular) +/− CMI(EEC: IG axila I, II, III, supraclavicular) | ||
| ypN2–3 | IG niveles no extirpados (axila III, supraclavicular) + CMI(EEC: IG axila I, II, III, supraclavicular) | ||
| Irradiación de CMI | - En caso de tumores localizados en cuadrantes internos y/o región retroareolar de la mama y que presenten afectación ganglionar- Y en aquellos casos cN2/N3 e ypN2/N3 | ||
BSGC: biopsia selectiva de ganglio centinela. CMI: cadena mamaria interna. EEC: extensión extracapsular. IG: irradiación ganglionar. LA: linfadenectomía axila. TAD: disección axilar dirigida.
Otro escenario controvertido son aquellos casos con afectación clínica al diagnóstico y que tras TSP presentan una respuesta patológica completa (RPC). El estudio aleatorizado NSABP B-51/RTOG 1304 (NRG 9353) evalúa el papel de la radioterapia en pacientes cT1-T3 cN1 con RPC tras QTP. Pretende determinar si las pacientes con BSGC y RPC pueden tratarse exclusivamente con radioterapia de toda la mama/pared torácica o bien requieren además de IG. También analizan si la radioterapia de la pared torácica y ganglionar mejora el intervalo libre de recurrencia tras la mastectomía. El estudio estratifica las pacientes en función del tipo de cirugía (tumorectomía o mastectomía), factores pronósticos (receptores de estrógenos, Her2 neu y presencia o no de RPC a nivel de la mama). A su vez, analiza la eficacia de los tratamientos para tumores según el subtipo molecular y la respuesta al tratamiento neoadyuvante. Está estimado seleccionar 1.636 pacientes y la fecha de finalización primaria es en julio del 2023.
En la actualidad disponemos en la literatura de varios estudios retrospectivos no aleatorizados que han valorado el papel de la irradiación tras QTP.
Krug et al.15 publicó un análisis retrospectivo de un subgrupo de pacientes incluidos en los estudios aleatorizados de neoadyuvancia GeparTrio, GeparQuattro y GeparQuinto. Describió que aquellas pacientes que no recibieron radioterapia adyuvante, incluso a pesar de alcanzar una RPC, presentaron una menor tasa de SLRL y de supervivencia libre de progresión (SLP) a 5 años (81,5% versus 90% con radioterapia, p < 0,001) y 67,4% versus 75,4% con radioterapia, p < 0,001) respectivamente. El beneficio de la radioterapia fue más marcado en pacientes cN+. El análisis multivariante, ajustado por parámetros basales y estadio patológico del tumor, identificó la radioterapia como un factor independiente de SLRL y SLP.
Stecklein et al.16 describió una reducción del riesgo de recaída local (RRL) (HR 0,497; IC 95%, 0,279–0,884; P = 0,02) y a distancia (HR 0,731; IC 95%, 0,541–0,988; P = 0,04) en pacientes cN+ que tras QTP y cirugía recibían una IG, en todos los subtipos tumorales, reduciendo especialmente el riesgo de recaída a distancia en pacientes Her2 positivas en tratamiento con trastuzumab (HR 0,237; IC 95%, 0,109–0,517; P = 0,0003). Este mismo grupo propone un nomograma basado en las características del tumor y la respuesta al TSP para predecir el RRL a 10 años con y sin IG.
En el estudio de Mamounas et al.17, realizado sobre una población de 3.088 pacientes, se identificaron como principales factores pronósticos de recaída local en pacientes tratadas con QTP la edad, las características clínicas del tumor al diagnóstico y la respuesta ganglionar patológica.
Los datos de numerosos estudios en pacientes afectas de cáncer de mama localmente avanzado sugieren que la radioterapia postoperatoria mejora el control local incluso en pacientes que tienen una RPC a la QTP18–21.
¿Qué dicen las guías?La última versión de las guías de práctica clínica de la NCCN (versión 4.2022) recomienda la LA (incluyendo los niveles I y II axilares) en aquellas pacientes con enfermedad clínica residual tras TSP. En los casos de negativización de la axila con TSP se considera la realización de una BSGC (nivel de evidencia 2B) con exéresis del ganglio marcado. La guía recomienda el uso de marcador dual y la extracción de 3 o más ganglios centinelas (disección axilar dirigida, TAD). En caso de no identificarse el GC, indica la LA de los niveles I y II.
En cuanto a IG tras QTP la recomendación es que se tome la decisión en función del estadio más desfavorable (ya sea el clínico o el patológico). Aquellas pacientes sin afectación ganglionar al diagnóstico que reciben QTP y una cirugía conservadora con BSGC negativa, deben recibir irradiación únicamente sobre el volumen mamario, considerándose la adición de una sobreimpresión o Boost sobre el lecho de tumorectomía según indicación. En el caso de pacientes mastectomizadas sin afectación ganglionar, la indicación de irradiación adyuvante vendrá determinada por el tamaño de la lesión al diagnóstico (cT3-cT4) y los márgenes de resección tras la cirugía.
En el caso de afectación ganglionar al diagnóstico y negativización de la misma tras la neoadyuvancia, los datos de los que disponemos sugieren un mayor riesgo de recaída locorregional, por lo que a la espera de estudios como el NSABP B-51/RTOG 1304 (NRG 9353) debe considerarse la IG en pacientes de riesgo no disecadas.
En aquellas pacientes con afectación ganglionar al diagnóstico y respuesta clínico-radiológica a la neoadyuvancia pero con afectación en la BSGC (ypN1) la indicación actual, a la espera de los resultados de estudios como ALLIANCE 11202 y ADARNAT, es la realización de la LA seguida de IG.
Según las guías St. Gallen22 aquellas pacientes con persistencia de afectación ganglionar clínica tras QTP requieren LA, mientras que dan soporte a la BSGC en aquellas con respuesta clínica axilar. En aquellas pacientes que clínicamente negativizan la axila tras QTP, pero con afectación por macrometástasis del GC, el consenso recomienda LA. En aquellos casos en que el GC presentase micrometastasis o células aisladas, a pesar de que algunos panelistas aceptarían una IG en sustitución de la LA, el resto alientan a la espera de los estudios aleatorizados fase III en marcha que pretenden dar respuesta a esta pregunta. El consenso considera que la disponibilidad de tratamientos sistémicos adyuvantes como capecitabina o trastuzumab emtansina (TDM1) no debe condicionar ni evitar la LA.
¿Qué nos depara el futuro?El siguiente paso en los intentos de desescalada terapéutica axilar tras TSP es el reemplazo de la LA por la IG, o incluso, en casos muy seleccionados, la posibilidad de omisión de cualquiera de ambos abordajes terapéuticos, considerando el número de ganglios afectos y la respuesta anátomo patológica a la TSP.
Recientemente Wild et al.23 publicaron un estudio prospectivo en el que se incluyeron 838 pacientes con un diagnóstico clínico de cáncer de mama cT1–2 N1 que recibían QTP seguida de cirugía (RAPCHEM; BOOG 2010–03). Las pacientes se clasificaron en 3 grupos de riesgo en relación con la respuesta patológica ganglionar a la quimioterapia. Aquellas pacientes con una RPC (ypN0) se clasificaron como bajo riesgo (35% de las pacientes) y se obvió la IG, independientemente de la técnica de cirugía axilar. Las pacientes con uno a 3 ganglios positivos residuales tras QTP se clasificaron como riesgo intermedio (44% de las pacientes) y se realizó irradiación de los niveles axilares I y II solamente en caso de no haberse realizado una LA. Aquellas pacientes con ≥4 ganglios afectos se consideraron en el grupo de alto riesgo (21% de las pacientes) y recibieron una IG (incluyendo los 3 niveles axilares y el área SCL). La tasa de recaída locorregional a 5 años para todo el grupo fue del 2,2%, sin apreciarse diferencias entre los 3 grupos, aunque se detectó que el 36% de las pacientes recibieron un tratamiento con radiación que difería de las indicaciones del estudio. Al evaluar por separado las pacientes que sí recibieron una irradiación de acuerdo con las pautas del estudio (64% de la muestra) se observó que la tasa de recaída local a 5 años se mantenía de igual manera cercana al 2%, ofreciendo unos primeros resultados satisfactorios de la radiación adaptada a la respuesta ganglionar tras neoadyuvancia.
ConclusionesDesde hace décadas el objetivo en el abordaje del cáncer de mama ha sido la desescalada terapéutica, reduciendo las morbilidades asociadas, manteniendo tasas de supervivencia y control local. Clásicamente la irradiación se ha aplicado de manera adyuvante, por lo que su indicación depende de los tratamientos previamente realizados. El escenario de la afectación ganglionar requiere especial atención, especialmente en el contexto de la TSP. En la actualidad no disponemos de suficiente evidencia científica como para omitir la LA y la IG en casos de persistencia de afectación axilar tras TSP. Pero, ¿debe la respuesta a TSP ser incorporada en la toma de decisiones respecto al abordaje quirúrgico y la indicación de irradiación adyuvante? ¿Debe considerarse a la hora de planificar la irradiación el tipo de cirugía axilar realizada en aquellas pacientes con ganglios afectos al diagnóstico? Las decisiones sobre la desescalada en el tratamiento axilar deben tomarse actualmente con precaución, especialmente cuando se omite la LA. Es por ello que estamos a la espera de los resultados de los estudios aleatorizados que se encuentran en marcha y que generarán un mayor nivel de evidencia en el escenario del tratamiento sistémico neoadyuvante.
Responsabilidades éticasSe trata de un artículo de revisión en el que se cumplen las consideraciones éticas.
FinanciaciónLa redacción de este artículo no ha contado con financiación.
Conflicto de interesesLas autoras declaran que no existen conflictos de interés en la redacción de este artículo.