La radioterapia junto con la cirugía y el tratamiento sistémico representan la triada terapéutica de las pacientes con cáncer de mama, consiguiendo altas tasas de control y supervivencia. En los últimos años hemos asistido a una (r)evolución en la concepción del tratamiento del cáncer de mama. El esquema clásico de cirugía seguida de tratamiento sistémico y radioterapia está cayendo en desuso, proponiéndose en su lugar la administración preoperatoria del tratamiento sistémico, buscando no solo maximizar su efecto y favorecer cirugías más conservadoras, sino también en casos seleccionados, llegando a aumentar las tasas de supervivencia libre de enfermedad y supervivencia global. La radioterapia, a su vez, también está evolucionando hacia un cambio de perspectiva: la administración preoperatoria de radioterapia puede ser útil en grupos seleccionados. Los avances radiobiológicos, junto con las mejoras tecnológicas, favorecen la administración de una radioterapia cada vez más precisa y eficaz, así como segura incluso en combinación con fármacos en el contexto preoperatorio. En este artículo, hemos realizado una revisión de la utilidad de la radioterapia preoperatoria para pacientes con cáncer de mama y las posibilidades de combinación con otras terapias.
Radiotherapy together with surgery and systemic treatment, represent the therapeutic triad for breast cancer patients, achieving high control and survival rates. In recent years we have witnessed a (r)evolution in the conception of breast cancer treatment. The classic scheme of surgery followed by systemic treatment and radiotherapy is falling into disuse, with the preoperative administration of systemic treatment being proposed instead, seeking to maximize its effect and favoring not only more conservative surgeries but also, in selected cases, even increasing the rates of disease-free survival and overall survival. Radiotherapy, in turn, is also evolving towards a change of perspective: preoperative administration of radiotherapy can be useful in selected groups. Advances in radiobiological knowledge, together with technological improvements that are constantly being incorporated into clinical practice, favor the administration of radiotherapy in an increasingly precise and effective manner, as well as safe even in combination with drugs in the preoperative setting. In this article, we have reviewed the usefulness of preoperative radiotherapy for breast cancer patients and the possibilities of combination with other therapies.
El cáncer de mama es la neoplasia con mayor incidencia alcanzando 530.000 casos nuevos en los 40 países de Europa y la principal causa de mortalidad por cáncer en las mujeres en 20201.
La cirugía, la radioterapia y el tratamiento sistémico siguen siendo los 3 pilares fundamentales para asegurar el control locorregional y la supervivencia del cáncer de mama. En los últimos años, la combinación de estas 3 estrategias ha sufrido cambios, alternando la secuencia de su administración dependiendo de cada caso, con el fin de personalizar y adaptar cada vez más los tratamientos.
Tratamiento sistémico neoadyuvanteEl tratamiento sistémico primario (TSP) en el cáncer de mama se concibió con el fin de permitir la cirugía en aquellos tumores inicialmente considerados irresecables. Sin embargo, su uso se ha ido extendiendo a evaluar la reducción del tumor y la respuesta patológica y clínica del mismo, ambas asociadas a la supervivencia libre de progresión y a la supervivencia global2.
Esta estrategia tiene especial interés en los subgrupos de pacientes con cáncer de mama con sobreexpresión de Her-2 (HER2+) y en tumores triple negativo (TN), ya que son los que mejor responden a la quimioterapia neoadyuvante. Hay estudios que han demostrado que conseguir una respuesta patológica completa (pCR) tras la TSP, concretamente en el subgrupo de pacientes con tumores TN o HER2+, se asocia a un aumento significativo de la supervivencia global3–5.
Así, en los tumores HER2+, al menos 3 estudios fase III (MD Anderson Cancer Center, NOAH y GEPAR-Quattro trial) compararon la quimioterapia neoadyuvante exclusiva versus dicha quimioterapia más la adición de trastuzumab y los 3 mostraron un aumento significativo (65%) de las tasas de respuesta patológica completa6–10. A su vez, otros grandes estudios aleatorizados demostraron que el empleo de doble bloqueo antiHER2 con trastuzumab/pertuzumab8, y trastuzumab/lapatinib9 actúan sinérgicamente potenciando la respuesta clínica. El estudio Neosphere8 analizó la combinación de trastuzumab y pertuzumab más quimioterapia en las pacientes con cáncer de mama HER-2 amplificado. Los resultados clínicos mostraron que aquellas pacientes que alcanzaron una respuesta patológica completa tenían mayor supervivencia libre de progresión frente a aquellas pacientes que no alcanzaron pCR. Dicho impacto significativo entre la pCR y la supervivencia posicionó esta combinación como el nuevo estándar clínico terapéutico. El estudio Tryphaena11 evaluó las diferencias entre diferentes esquemas de quimioterapia y su combinación con el doble bloqueo HER-2, alcanzando unas tasas de pCR del 57-66% y sin encontrarse diferencias directamente atribuibles a los esquemas de quimioterapia11. El estudio Berenice, basado en la combinación de pertuzumab, trastuzumab y quimioterapia basada en antraciclinas y taxanos neoadyuvantes, alcanzó las mismas tasas de pCR descritas ya previamente y sumando la confirmación en términos de seguridad y tolerancia cardiaca de dicha combinación12.
Igualmente, las pacientes con cáncer de mama TN tienen un peor pronóstico asociado a una menor supervivencia global. El tratamiento sistémico neoadyuvante se ha propuesto como una alternativa en este subgrupo debido a la relación entre las tasas de pCR y la supervivencia global y libre de progresión. Por lo tanto, la pCR se considera un marcador subrogado de supervivencia en las pacientes con cáncer de mama fenotipo TN. El empleo de quimioterapia convencional basados en adriamicina, paclitaxel y ciclofosfamida se asocian a unas tasas de pCR del 35-45%13. La adición de sales de platino a los esquemas de TSP mostraron un incremento en estas tasas. Un reciente metaanálisis de 9 estudios aleatorizados, que incluían a más de 2.000 pacientes con cáncer de mama TN, mostró que la adición de sales de platino incrementaba las tasas de pCR de 37 a 52,1% (p < 0,001)14. Por otro lado, los estudios Keynote-2215, Impassion 03116 y GeparNUEVO17 han demostrado recientemente que añadir inmunoterapia (pembrolizumab, atezolizumab o durvalumab, respectivamente) más quimioterapia incrementan el porcentaje de pCR, en comparación con aquellos que reciben placebo-quimioterapia, aunque el estudio NeoTRIP no mostró beneficio en las pacientes con cáncer de mama TN al añadir atezolizumab al nab-pacliatxel18.
Radioterapia preoperatoriaAlrededor de 8 de cada 10 pacientes con cáncer de mama son tratados en algún momento de su proceso oncológico con radioterapia. Los avances en los tratamientos locorregionales, la cirugía y la radioterapia han contribuido de forma decisiva a disminuir las recidivas locorregionales y a distancia, a la vez que aumenta la supervivencia global. Los resultados del metaanálisis del Early Breast Cancer Trialists' Collaborative Group (EBCTCG), basado en 17 estudios de 10.801 mujeres, mostraron que la radioterapia redujo significativamente el riesgo de recurrencia, locorregional o a distancia a los 10 años, y el riesgo específico del cáncer de mama y la mortalidad a los 15 años de seguimiento19. El mismo grupo publicó en 2014 una actualización con un mayor seguimiento, mostrando una reducción significativa en la probabilidad de recurrencia locorregional y/o a distancia en aquellas mujeres con afectación tumoral de los ganglios linfáticos que habían sido irradiadas, frente a las que no recibieron radioterapia. Dichos beneficios se observaron en todos los grupos de pacientes, tanto en las pacientes con 1-3 ganglios afectados como en aquellas con metástasis en más de 4 ganglios linfáticos. Los beneficios observados mostraron un aumento significativo de la supervivencia del cáncer de mama a los 20 años y fueron independientes de la administración o no de tratamiento sistémico. Según los autores «por cada 1,5 recidivas evitadas durante los primeros 10 años tras la radioterapia, se evitó una muerte por cáncer de mama a los 20 años». Estos resultados corresponden a una época en la que los tratamientos sistémicos no eran tan personalizados, lo que podría influir en cierta medida en su extrapolación a la actualidad. Sin embargo, la incorporación de la radioterapia en el tratamiento multidisciplinar del cáncer de mama tiene un beneficio significativo incluso en aquellas pacientes que consiguen una pCR tras la TSP19–21.
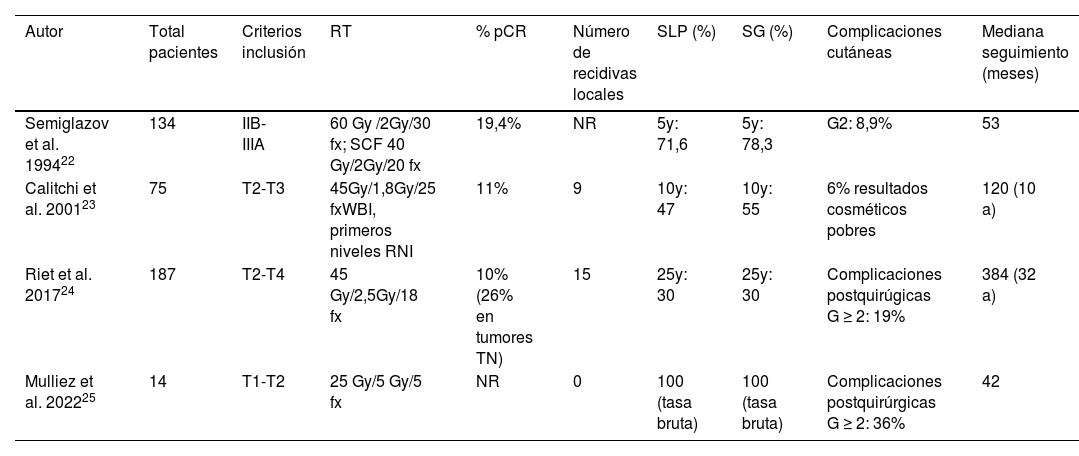
Aunque no se suele considerar su uso prequirúrgico, la radioterapia preoperatoria en el cáncer de mama localizado no es una estrategia novedosa, pues ya ha demostrado ser esta alternativa terapéutica factible, bien tolerada y asociada a unas tasas de pCR del 10-26% tal y como se describe en la tabla 122–24.
Resultados de los estudios que emplean radioterapia preoperatoria en cáncer de mama
| Autor | Total pacientes | Criterios inclusión | RT | % pCR | Número de recidivas locales | SLP (%) | SG (%) | Complicaciones cutáneas | Mediana seguimiento (meses) |
|---|---|---|---|---|---|---|---|---|---|
| Semiglazov et al. 199422 | 134 | IIB-IIIA | 60 Gy /2Gy/30 fx; SCF 40 Gy/2Gy/20 fx | 19,4% | NR | 5y: 71,6 | 5y: 78,3 | G2: 8,9% | 53 |
| Calitchi et al. 200123 | 75 | T2-T3 | 45Gy/1,8Gy/25 fxWBI, primeros niveles RNI | 11% | 9 | 10y: 47 | 10y: 55 | 6% resultados cosméticos pobres | 120 (10 a) |
| Riet et al. 201724 | 187 | T2-T4 | 45 Gy/2,5Gy/18 fx | 10%(26% en tumores TN) | 15 | 25y: 30 | 25y: 30 | Complicaciones postquirúgicas G ≥ 2: 19% | 384 (32 a) |
| Mulliez et al. 202225 | 14 | T1-T2 | 25 Gy/5 Gy/5 fx | NR | 0 | 100 (tasa bruta) | 100 (tasa bruta) | Complicaciones postquirúrgicas G ≥ 2: 36% | 42 |
a: años; Fx: fracciones; NR: no reportado; RNI: irradiación ganglionar; SCF: fosa supraclavicular; TN: triple negativo; WBI: irradiación total mama.
Otros grupos han publicado sus resultados que contribuyen tanto a reforzar la seguridad y utilidad de la radioterapia preoperatoria como a facilitar la identificación y selección de las pacientes con cáncer de mama que más podrían beneficiarse (tabla 1).
Adicionalmente se ha sugerido que la radioterapia aplicada directamente sobre el tejido tumoral activa la inmunidad antitumoral, hecho ausente cuando la radioterapia se administra después de la cirugía. Esta inmunidad radioinducida podría contribuir a eliminar no solo el tumor primario sino también focos microscópicos presentes en la mama ipsilateral y contralateral, además de disminuir el riesgo de micrometástasis a distancia, favoreciendo el desarrollo del denominado efecto abscopal.
Radioquimioterapia preoperatoriaAunque la administración de quimioterapia y radioterapia simultánea es práctica clínica habitual en otros tumores, mostrando incremento en las tasas de control local y supervivencia, la combinación de radio y quimioterapia preoperatoria no se ha generalizado en las pacientes con cáncer de mama. A pesar de que la cirugía seguida de quimioterapia y posterior radioterapia se considera el abordaje más convencional, el creciente uso de los tratamientos neoadyuvantes ha renovado el interés en explorar dicha combinación en el cáncer de mama, especialmente en las pacientes con fenotipos moleculares más desfavorables.
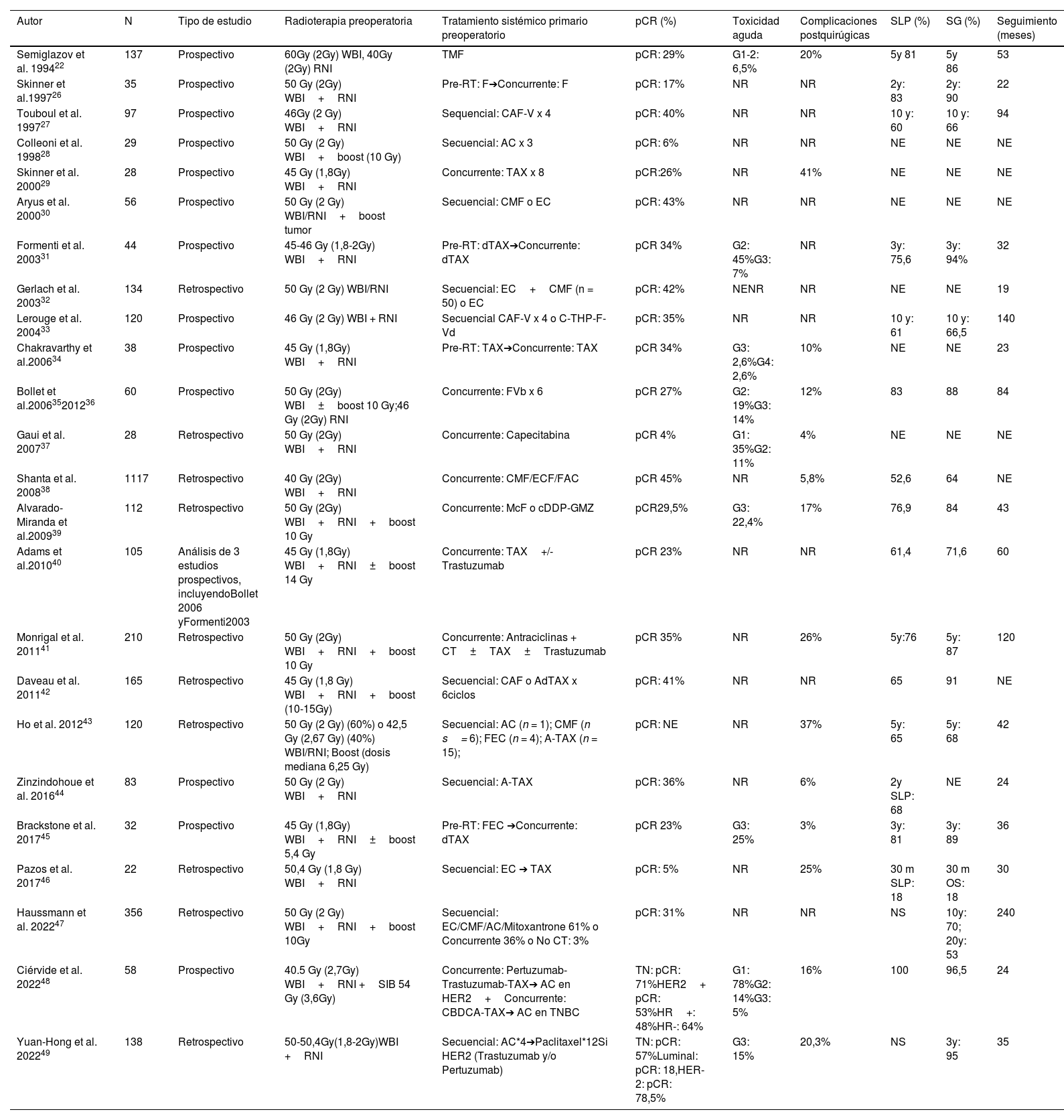
En la tabla 2 se muestra un resumen de los estudios de quimioradioterapia preoperatoria publicados hasta la fecha. Desde 1994 hasta 2022, se han publicado 26 estudios diferentes, 14 prospectivos y 11 restrospectivos, incluyendo un total de 35.980 pacientes con cáncer de mama.
Todos los estudios incluidos en la tabla 2, excepto 2 de ellos, emplearon un fraccionamiento clásico (1,8-2 Gy/día) hasta 40-50,4 Gy sobre la mama y áreas ganglionares. Un total de 10 grupos consideraron la adición de sobreimpresión o boost sobre el lecho tumoral. Aunque no existen estudios específicos que analicen el fraccionamiento en radioterapia preoperatoria en cáncer de mama, los resultados clínicos que apoyan el uso de hipofraccionamiento moderado y ultrahipofraccionamiento en el contexto adyuvante avalan su aplicación también en el contexto preoperatorio.
Resultados de los estudios que emplean radioterapia preoperatoria en cáncer de mama
| Autor | N | Tipo de estudio | Radioterapia preoperatoria | Tratamiento sistémico primario preoperatorio | pCR (%) | Toxicidad aguda | Complicaciones postquirúgicas | SLP (%) | SG (%) | Seguimiento (meses) |
|---|---|---|---|---|---|---|---|---|---|---|
| Semiglazov et al. 199422 | 137 | Prospectivo | 60Gy (2Gy) WBI, 40Gy (2Gy) RNI | TMF | pCR: 29% | G1-2: 6,5% | 20% | 5y 81 | 5y 86 | 53 |
| Skinner et al.199726 | 35 | Prospectivo | 50 Gy (2Gy) WBI+RNI | Pre-RT: F➔Concurrente: F | pCR: 17% | NR | NR | 2y: 83 | 2y: 90 | 22 |
| Touboul et al. 199727 | 97 | Prospectivo | 46Gy (2 Gy) WBI+RNI | Sequencial: CAF-V x 4 | pCR: 40% | NR | NR | 10 y: 60 | 10 y: 66 | 94 |
| Colleoni et al. 199828 | 29 | Prospectivo | 50 Gy (2 Gy) WBI+boost (10 Gy) | Secuencial: AC x 3 | pCR: 6% | NR | NR | NE | NE | NE |
| Skinner et al. 200029 | 28 | Prospectivo | 45 Gy (1,8Gy) WBI+RNI | Concurrente: TAX x 8 | pCR:26% | NR | 41% | NE | NE | NE |
| Aryus et al. 200030 | 56 | Prospectivo | 50 Gy (2 Gy) WBI/RNI+boost tumor | Secuencial: CMF o EC | pCR: 43% | NR | NR | NE | NE | NE |
| Formenti et al. 200331 | 44 | Prospectivo | 45-46 Gy (1,8-2Gy) WBI+RNI | Pre-RT: dTAX➔Concurrente: dTAX | pCR 34% | G2: 45%G3: 7% | NR | 3y: 75,6 | 3y: 94% | 32 |
| Gerlach et al. 200332 | 134 | Retrospectivo | 50 Gy (2 Gy) WBI/RNI | Secuencial: EC+CMF (n = 50) o EC | pCR: 42% | NENR | NR | NE | NE | 19 |
| Lerouge et al. 200433 | 120 | Prospectivo | 46 Gy (2 Gy) WBI + RNI | Secuencial CAF-V x 4 o C-THP-F-Vd | pCR: 35% | NR | NR | 10 y: 61 | 10 y: 66,5 | 140 |
| Chakravarthy et al.200634 | 38 | Prospectivo | 45 Gy (1,8Gy) WBI+RNI | Pre-RT: TAX➔Concurrente: TAX | pCR 34% | G3: 2,6%G4: 2,6% | 10% | NE | NE | 23 |
| Bollet et al.200635201236 | 60 | Prospectivo | 50 Gy (2Gy) WBI±boost 10 Gy;46 Gy (2Gy) RNI | Concurrente: FVb x 6 | pCR 27% | G2: 19%G3: 14% | 12% | 83 | 88 | 84 |
| Gaui et al. 200737 | 28 | Retrospectivo | 50 Gy (2Gy) WBI+RNI | Concurrente: Capecitabina | pCR 4% | G1: 35%G2: 11% | 4% | NE | NE | NE |
| Shanta et al. 200838 | 1117 | Retrospectivo | 40 Gy (2Gy) WBI+RNI | Concurrente: CMF/ECF/FAC | pCR 45% | NR | 5,8% | 52,6 | 64 | NE |
| Alvarado-Miranda et al.200939 | 112 | Retrospectivo | 50 Gy (2Gy) WBI+RNI+boost 10 Gy | Concurrente: McF o cDDP-GMZ | pCR29,5% | G3: 22,4% | 17% | 76,9 | 84 | 43 |
| Adams et al.201040 | 105 | Análisis de 3 estudios prospectivos, incluyendoBollet 2006 yFormenti2003 | 45 Gy (1,8Gy) WBI+RNI±boost 14 Gy | Concurrente: TAX+/-Trastuzumab | pCR 23% | NR | NR | 61,4 | 71,6 | 60 |
| Monrigal et al. 201141 | 210 | Retrospectivo | 50 Gy (2Gy) WBI+RNI+boost 10 Gy | Concurrente: Antraciclinas + CT±TAX±Trastuzumab | pCR 35% | NR | 26% | 5y:76 | 5y: 87 | 120 |
| Daveau et al. 201142 | 165 | Retrospectivo | 45 Gy (1,8 Gy) WBI+RNI+boost (10-15Gy) | Secuencial: CAF o AdTAX x 6ciclos | pCR: 41% | NR | NR | 65 | 91 | NE |
| Ho et al. 201243 | 120 | Retrospectivo | 50 Gy (2 Gy) (60%) o 42,5 Gy (2,67 Gy) (40%) WBI/RNI; Boost (dosis mediana 6,25 Gy) | Secuencial: AC (n = 1); CMF (n s= 6); FEC (n = 4); A-TAX (n = 15); | pCR: NE | NR | 37% | 5y: 65 | 5y: 68 | 42 |
| Zinzindohoue et al. 201644 | 83 | Prospectivo | 50 Gy (2 Gy) WBI+RNI | Secuencial: A-TAX | pCR: 36% | NR | 6% | 2y SLP: 68 | NE | 24 |
| Brackstone et al. 201745 | 32 | Prospectivo | 45 Gy (1,8Gy) WBI+RNI±boost 5,4 Gy | Pre-RT: FEC ➔Concurrente: dTAX | pCR 23% | G3: 25% | 3% | 3y: 81 | 3y: 89 | 36 |
| Pazos et al. 201746 | 22 | Retrospectivo | 50,4 Gy (1,8 Gy) WBI+RNI | Secuencial: EC ➔ TAX | pCR: 5% | NR | 25% | 30 m SLP: 18 | 30 m OS: 18 | 30 |
| Haussmann et al. 202247 | 356 | Retrospectivo | 50 Gy (2 Gy) WBI+RNI+boost 10Gy | Secuencial: EC/CMF/AC/Mitoxantrone 61% o Concurrente 36% o No CT: 3% | pCR: 31% | NR | NR | NS | 10y: 70; 20y: 53 | 240 |
| Ciérvide et al. 202248 | 58 | Prospectivo | 40.5 Gy (2,7Gy) WBI+RNI +SIB 54 Gy (3,6Gy) | Concurrente: Pertuzumab-Trastuzumab-TAX➔ AC en HER2+Concurrente: CBDCA-TAX➔ AC en TNBC | TN: pCR: 71%HER2+ pCR: 53%HR+: 48%HR-: 64% | G1: 78%G2: 14%G3: 5% | 16% | 100 | 96,5 | 24 |
| Yuan-Hong et al. 202249 | 138 | Retrospectivo | 50-50,4Gy(1,8-2Gy)WBI +RNI | Secuencial: AC*4➔Paclitaxel*12Si HER2 (Trastuzumab y/o Pertuzumab) | TN: pCR: 57%Luminal: pCR: 18,HER-2: pCR: 78,5% | G3: 15% | 20,3% | NS | 3y: 95 | 35 |
AC: adriamicina-ciclofosfamida; A-TAX: adriamicina-paclitaxel; CAF-V: ciclofosfaminda, adriamicina-5-fluorouracilo-vincristina; CMF: ciclofosfamida-metotrexato-5fluorouracilo; C-THP-F-Vd: ciclofosfamida-tepirubicina-5fluorouracilo-vindesina; CDDP: cisplatino; CT: quimioterapia, F: 5fluoracilo; FVb: 5fluoracilo-vinorelbine; Mc: mitomicina-C, NR: no reportado; NE: no especificado; TAX: paclitaxel; TMF: thiotepa-metotrexate-5Fluoracilo; x EC: epirubicina-ciclofosfamida A-dTAX: adriamicina-docetaxelAI: inhibidor de la aromatasa; Y: años.
Se han empleado diferentes esquemas de quimioterapia, tanto de forma secuencial previo a la radioterapia (12 estudios) como concomitante con la radioterapia preoperatoria (12 estudios). Solo unos pocos estudios utilizan fármacos dirigidos y la mayoría incluye taxanos en sus esquemas.
Resultados clínicosA pesar de las diferencias entre los estudios incluidos, la tasa de respuesta objetiva general osciló de 64 a 93% y la tasa de pCR varió de entre el 5 y 78,5% (mediana del 53%). Una de las limitaciones más importantes de estos estudios es la falta de información sobre el perfil de toxicidad.
Uno de los argumentos más utilizados para cuestionar la utilidad de la radioterapia preoperatoria en el cáncer de mama son las posibles complicaciones que podría tener la cirugía mamaria, especialmente cuando se requiere una mastectomía y el impacto que podría tener la alteración de la secuencia de tratamientos en la reconstrucción posterior.
Sin embargo, la evidencia existente apunta en otra dirección. La radioterapia preoperatoria permite un procedimiento quirúrgico en un solo paso, mejorando la satisfacción de las pacientes y utilizando de manera más eficiente los limitados recursos de salud. Desde el punto de vista oncológico, se evita el riesgo de retraso en el inicio de la radioterapia posmastectomía motivado por una recuperación quirúrgica prolongada o por la presencia de complicaciones; la cobertura dosimétrica de los objetivos es más fácilmente alcanzable ya que no hay materiales propios de la reconstrucción como expansores metálicos y existe un aumento potencial en la probabilidad de reducir el estadio patológico tumoral y de lograr una resección R0.
La radioterapia preoperatoria es segura y factible cuando se realiza la mastectomía e incluso cuando se realiza la reconstrucción inmediata. Singh et al.50 llevaron a cabo una revisión sistemática de 18 estudios de radioterapia preoperatoria y reconstrucción inmediata incluyendo a un total de 1.047 pacientes mostrando ser un tratamiento seguro tanto oncológica como técnicamente.
La evidencia existente apoya la factibilidad de la administración de radioterapia preoperatoria en el cáncer de mama y su integración con los esquemas de TSP actuales. Las tasas de pCR son alentadoras, especialmente en subtipos moleculares más agresivos. No obstante, surgen dudas sobre la seguridad de la administración simultánea de quimioterapia y radioterapia en el cáncer de mama. La combinación preoperatoria y postoperatoria de radioterapia y taxanos no solo es eficaz y segura, sino que también se relaciona con una mejor supervivencia, especialmente en el contexto de pacientes TN y HER-2+. Además, la administración sincrónica de trastuzumab, pertuzumab o ambos juntos más radioterapia locorregional ha demostrado ser segura y bien tolerada sin aumentar los efectos adversos cardiacos, no solo con esquemas convencionales sino también con esquemas hipofraccionados aun cuando se deba irradiar la cadena mamaria interna51–56. Finalmente, las nuevas técnicas de radioterapia de alta conformación y los sistemas de monitorización de la superficie corporal ayudan a minimizar la dosis en los órganos sanos circundantes a riesgo, incrementando la precisión y seguridad.
Irradiación parcial acelerada de mama preoperatoriaEl tratamiento conservador de la mama es el tratamiento estándar del cáncer de mama en estadios precoces. Dado que el riesgo de recurrencia local es bajo y la mayoría de las recurrencias locales se localizan cerca del lecho quirúrgico, la irradiación parcial acelerada de mama (APBI) es considerada una alternativa a la radioterapia de toda la mama. En cuanto al volumen a irradiar, la definición es más precisa antes de la cirugía y se puede lograr una reducción sustancial de los volúmenes cuando la APBI se administra de forma preoperatoria.
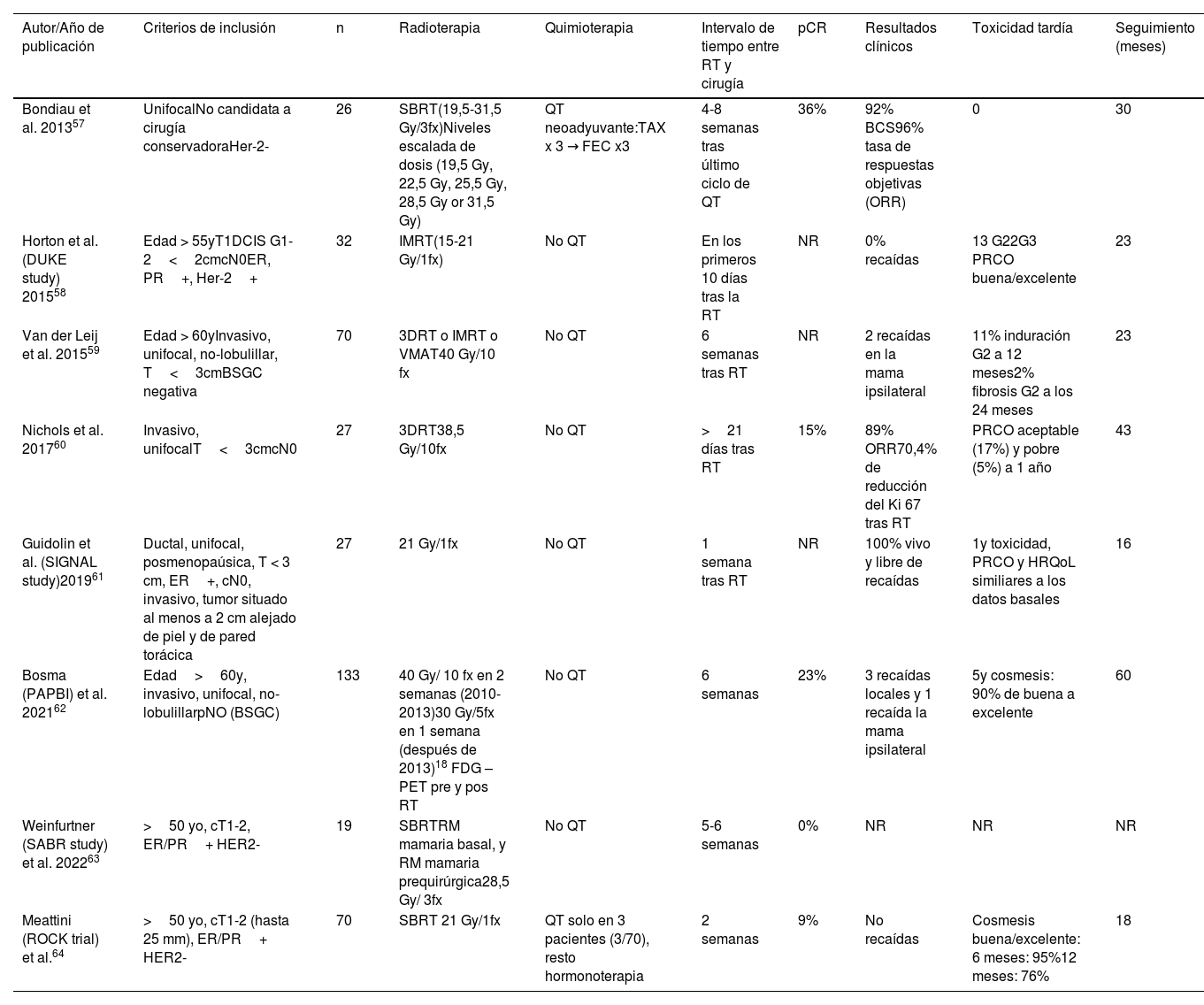
Hasta la fecha son ya varios los estudios de APBI preoperatoria publicados (tabla 3). Aunque las tasas de control clínico son altas, es reseñable destacar las bajas tasas de respuesta patológica en las series publicadas. Aunque las tasas de supervivencia son altas en todos los estudios, había tumor residual en el espécimen quirúrgico. Una de las posibles causas es el corto intervalo de tiempo entre la radioterapia y la cirugía, sugiriendo que el efecto antitumoral de la radioterapia, todavía no se habría culminado al momento de la cirugía.
Resultados de los estudios que emplean irradiación parcial acelerada preoperatoria en cáncer de mama
| Autor/Año de publicación | Criterios de inclusión | n | Radioterapia | Quimioterapia | Intervalo de tiempo entre RT y cirugía | pCR | Resultados clínicos | Toxicidad tardía | Seguimiento (meses) |
|---|---|---|---|---|---|---|---|---|---|
| Bondiau et al. 201357 | UnifocalNo candidata a cirugía conservadoraHer-2- | 26 | SBRT(19,5-31,5 Gy/3fx)Niveles escalada de dosis (19,5 Gy, 22,5 Gy, 25,5 Gy, 28,5 Gy or 31,5 Gy) | QT neoadyuvante:TAX x 3 → FEC x3 | 4-8 semanas tras último ciclo de QT | 36% | 92% BCS96% tasa de respuestas objetivas (ORR) | 0 | 30 |
| Horton et al. (DUKE study) 201558 | Edad > 55yT1DCIS G1-2<2cmcN0ER, PR+, Her-2+ | 32 | IMRT(15-21 Gy/1fx) | No QT | En los primeros 10 días tras la RT | NR | 0% recaídas | 13 G22G3 PRCO buena/excelente | 23 |
| Van der Leij et al. 201559 | Edad > 60yInvasivo, unifocal, no-lobulillar, T<3cmBSGC negativa | 70 | 3DRT o IMRT o VMAT40 Gy/10 fx | No QT | 6 semanas tras RT | NR | 2 recaídas en la mama ipsilateral | 11% induración G2 a 12 meses2% fibrosis G2 a los 24 meses | 23 |
| Nichols et al. 201760 | Invasivo, unifocalT<3cmcN0 | 27 | 3DRT38,5 Gy/10fx | No QT | >21 días tras RT | 15% | 89% ORR70,4% de reducción del Ki 67 tras RT | PRCO aceptable (17%) y pobre (5%) a 1 año | 43 |
| Guidolin et al. (SIGNAL study)201961 | Ductal, unifocal, posmenopaúsica, T < 3 cm, ER+, cN0, invasivo, tumor situado al menos a 2 cm alejado de piel y de pared torácica | 27 | 21 Gy/1fx | No QT | 1 semana tras RT | NR | 100% vivo y libre de recaídas | 1y toxicidad, PRCO y HRQoL similiares a los datos basales | 16 |
| Bosma (PAPBI) et al. 202162 | Edad>60y, invasivo, unifocal, no-lobulillarpNO (BSGC) | 133 | 40 Gy/ 10 fx en 2 semanas (2010-2013)30 Gy/5fx en 1 semana (después de 2013)18 FDG –PET pre y pos RT | No QT | 6 semanas | 23% | 3 recaídas locales y 1 recaída la mama ipsilateral | 5y cosmesis: 90% de buena a excelente | 60 |
| Weinfurtner (SABR study) et al. 202263 | >50 yo, cT1-2, ER/PR+ HER2- | 19 | SBRTRM mamaria basal, y RM mamaria prequirúrgica28,5 Gy/ 3fx | No QT | 5-6 semanas | 0% | NR | NR | NR |
| Meattini (ROCK trial) et al.64 | >50 yo, cT1-2 (hasta 25 mm), ER/PR+ HER2- | 70 | SBRT 21 Gy/1fx | QT solo en 3 pacientes (3/70), resto hormonoterapia | 2 semanas | 9% | No recaídas | Cosmesis buena/excelente: 6 meses: 95%12 meses: 76% | 18 |
BCS: cirugía conservadora; yo: años edad; Fx: fracciones; 3DRT: radioterapia tridimensional conformada; PRCO: resultados cosméticos evaluados por el médico; BSGC: biopsia selectiva de ganglio centinela; SBRT: radioterapia estereotáctica extracraneal; IMRT: radioterapia intensidad modulada; VMAT: arcoterapia volumétrica, QT: quimioterapia; HRQoL: calidad de vida.
En resumen, la factibilidad y la eficacia de un abordaje radioablativo preoperatorio en pacientes con cáncer de mama precoz se han explorado en varios estudios, utilizando diferentes técnicas, dosis/fracción, número de fracciones, dosis total y volúmenes irradiados. Hasta la fecha, los informes preliminares parecen mostrar una baja toxicidad y una tasa aceptable de respuesta patológica.
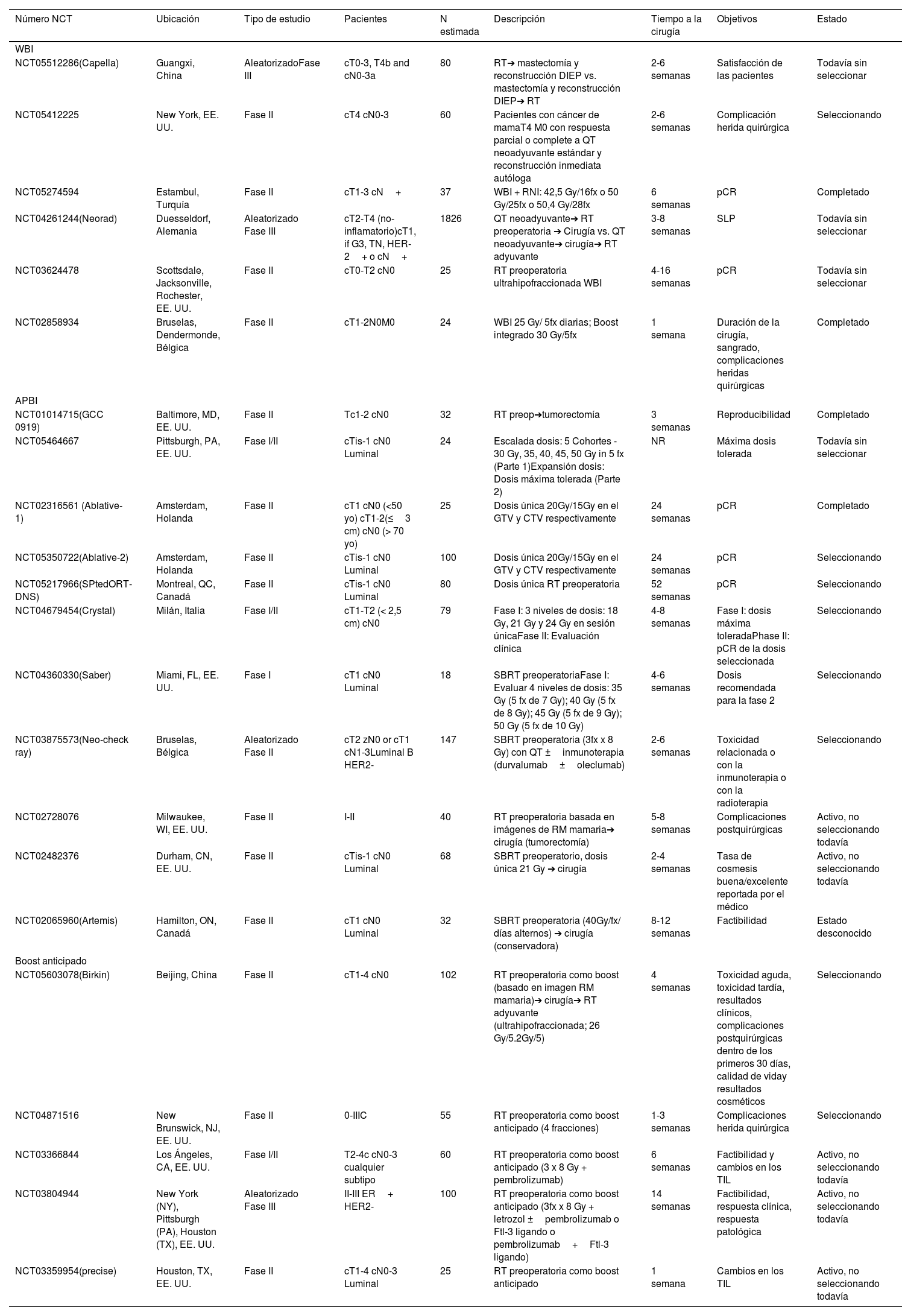
Nuevas perspectivas de radioterapia preoperatoria. Estudios en marchaActualmente, son varios los ensayos en marcha que evalúan el papel de la radioterapia preoperatoria. La tabla 4 recoge 22 estudios que pretenden analizar la utilidad de la radioterapia preoperatoria, en sus diferentes variantes, en el cáncer de mama: 6 estudios emplean irradiación de toda la mama con o sin radioterapia de las áreas ganglionares, 11 estudios APBI y 5 estudios la administración de radioterapia como boost previo a la cirugía y posterior radioterapia adyuvante.
Estudios en marcha de RT preoperatoria
| Número NCT | Ubicación | Tipo de estudio | Pacientes | N estimada | Descripción | Tiempo a la cirugía | Objetivos | Estado |
|---|---|---|---|---|---|---|---|---|
| WBI | ||||||||
| NCT05512286(Capella) | Guangxi, China | AleatorizadoFase III | cT0-3, T4b and cN0-3a | 80 | RT➔ mastectomía y reconstrucción DIEP vs. mastectomía y reconstrucción DIEP➔ RT | 2-6 semanas | Satisfacción de las pacientes | Todavía sin seleccionar |
| NCT05412225 | New York, EE. UU. | Fase II | cT4 cN0-3 | 60 | Pacientes con cáncer de mamaT4 M0 con respuesta parcial o complete a QT neoadyuvante estándar y reconstrucción inmediata autóloga | 2-6 semanas | Complicación herida quirúrgica | Seleccionando |
| NCT05274594 | Estambul, Turquía | Fase II | cT1-3 cN+ | 37 | WBI + RNI: 42,5 Gy/16fx o 50 Gy/25fx o 50,4 Gy/28fx | 6 semanas | pCR | Completado |
| NCT04261244(Neorad) | Duesseldorf, Alemania | Aleatorizado Fase III | cT2-T4 (no-inflamatorio)cT1, if G3, TN, HER-2+ o cN+ | 1826 | QT neoadyuvante➔ RT preoperatoria ➔ Cirugía vs. QT neoadyuvante➔ cirugía➔ RT adyuvante | 3-8 semanas | SLP | Todavía sin seleccionar |
| NCT03624478 | Scottsdale, Jacksonville, Rochester, EE. UU. | Fase II | cT0-T2 cN0 | 25 | RT preoperatoria ultrahipofraccionada WBI | 4-16 semanas | pCR | Todavía sin seleccionar |
| NCT02858934 | Bruselas, Dendermonde, Bélgica | Fase II | cT1-2N0M0 | 24 | WBI 25 Gy/ 5fx diarias; Boost integrado 30 Gy/5fx | 1 semana | Duración de la cirugía, sangrado, complicaciones heridas quirúrgicas | Completado |
| APBI | ||||||||
| NCT01014715(GCC 0919) | Baltimore, MD, EE. UU. | Fase II | Tc1-2 cN0 | 32 | RT preop➔tumorectomía | 3 semanas | Reproducibilidad | Completado |
| NCT05464667 | Pittsburgh, PA, EE. UU. | Fase I/II | cTis-1 cN0 Luminal | 24 | Escalada dosis: 5 Cohortes - 30 Gy, 35, 40, 45, 50 Gy in 5 fx (Parte 1)Expansión dosis: Dosis máxima tolerada (Parte 2) | NR | Máxima dosis tolerada | Todavía sin seleccionar |
| NCT02316561 (Ablative-1) | Amsterdam, Holanda | Fase II | cT1 cN0 (<50 yo) cT1-2(≤3 cm) cN0 (> 70 yo) | 25 | Dosis única 20Gy/15Gy en el GTV y CTV respectivamente | 24 semanas | pCR | Completado |
| NCT05350722(Ablative-2) | Amsterdam, Holanda | Fase II | cTis-1 cN0 Luminal | 100 | Dosis única 20Gy/15Gy en el GTV y CTV respectivamente | 24 semanas | pCR | Seleccionando |
| NCT05217966(SPtedORT-DNS) | Montreal, QC, Canadá | Fase II | cTis-1 cN0 Luminal | 80 | Dosis única RT preoperatoria | 52 semanas | pCR | Seleccionando |
| NCT04679454(Crystal) | Milán, Italia | Fase I/II | cT1-T2 (< 2,5 cm) cN0 | 79 | Fase I: 3 niveles de dosis: 18 Gy, 21 Gy y 24 Gy en sesión únicaFase II: Evaluación clínica | 4-8 semanas | Fase I: dosis máxima toleradaPhase II: pCR de la dosis seleccionada | Seleccionando |
| NCT04360330(Saber) | Miami, FL, EE. UU. | Fase I | cT1 cN0 Luminal | 18 | SBRT preoperatoriaFase I: Evaluar 4 niveles de dosis: 35 Gy (5 fx de 7 Gy); 40 Gy (5 fx de 8 Gy); 45 Gy (5 fx de 9 Gy); 50 Gy (5 fx de 10 Gy) | 4-6 semanas | Dosis recomendada para la fase 2 | Seleccionando |
| NCT03875573(Neo-check ray) | Bruselas, Bélgica | Aleatorizado Fase II | cT2 zN0 or cT1 cN1-3Luminal B HER2- | 147 | SBRT preoperatoria (3fx x 8 Gy) con QT ±inmunoterapia (durvalumab±oleclumab) | 2-6 semanas | Toxicidad relacionada o con la inmunoterapia o con la radioterapia | Seleccionando |
| NCT02728076 | Milwaukee, WI, EE. UU. | Fase II | I-II | 40 | RT preoperatoria basada en imágenes de RM mamaria➔ cirugía (tumorectomía) | 5-8 semanas | Complicaciones postquirúrgicas | Activo, no seleccionando todavía |
| NCT02482376 | Durham, CN, EE. UU. | Fase II | cTis-1 cN0 Luminal | 68 | SBRT preoperatorio, dosis única 21 Gy ➔ cirugía | 2-4 semanas | Tasa de cosmesis buena/excelente reportada por el médico | Activo, no seleccionando todavía |
| NCT02065960(Artemis) | Hamilton, ON, Canadá | Fase II | cT1 cN0 Luminal | 32 | SBRT preoperatoria (40Gy/fx/ días alternos) ➔ cirugía (conservadora) | 8-12 semanas | Factibilidad | Estado desconocido |
| Boost anticipado | ||||||||
| NCT05603078(Birkin) | Beijing, China | Fase II | cT1-4 cN0 | 102 | RT preoperatoria como boost (basado en imagen RM mamaria)➔ cirugía➔ RT adyuvante (ultrahipofraccionada; 26 Gy/5.2Gy/5) | 4 semanas | Toxicidad aguda, toxicidad tardía, resultados clínicos, complicaciones postquirúrgicas dentro de los primeros 30 días, calidad de viday resultados cosméticos | Seleccionando |
| NCT04871516 | New Brunswick, NJ, EE. UU. | Fase II | 0-IIIC | 55 | RT preoperatoria como boost anticipado (4 fracciones) | 1-3 semanas | Complicaciones herida quirúrgica | Seleccionando |
| NCT03366844 | Los Ángeles, CA, EE. UU. | Fase I/II | T2-4c cN0-3 cualquier subtipo | 60 | RT preoperatoria como boost anticipado (3 x 8 Gy + pembrolizumab) | 6 semanas | Factibilidad y cambios en los TIL | Activo, no seleccionando todavía |
| NCT03804944 | New York (NY), Pittsburgh (PA), Houston (TX), EE. UU. | Aleatorizado Fase III | II-III ER+ HER2- | 100 | RT preoperatoria como boost anticipado (3fx x 8 Gy + letrozol ±pembrolizumab o Ftl-3 ligando o pembrolizumab+Ftl-3 ligando) | 14 semanas | Factibilidad, respuesta clínica, respuesta patológica | Activo, no seleccionando todavía |
| NCT03359954(precise) | Houston, TX, EE. UU. | Fase II | cT1-4 cN0-3 Luminal | 25 | RT preoperatoria como boost anticipado | 1 semana | Cambios en los TIL | Activo, no seleccionando todavía |
APBI: irradiación parcial acelerada de la mama; DFS: supervivencia libre de progresión; Flt-3L: ligando; FMS-TK3; WBI: irradiación de toda la mama; RNI: irradiación nodal regional; SB; RT: radioterapia estereotáxica extracraneal; SIB: boost integrado simultáneo; TIL: linfocitos tumorales infiltrantes.
Es de particular interés, el hecho de que 3 estudios (NCT03366844, NCT03875573, NCT03804944) plantean analizar la combinación de radioterapia e inmunoterapia.
Los objetivos clínicos de los ensayos en marcha son variables, incluyendo la evaluación de la factibilidad de la combinación, la tasa de respuesta patológica completa, la identificación de la dosis máxima tolerada, el análisis de la toxicidad aguda, las complicaciones quirúrgicas, el resultado cosmético e incluso evaluar los cambios en los linfocitos infiltrantes de tumores (TIL). Existen diferencias en cuanto al tiempo transcurrido desde la radiación hasta la cirugía, entre 1 y 52 semanas, por lo que se espera que los resultados en términos de respuesta patológica sean diferentes. Los resultados tanto de estos como de futuros ensayos, contribuirán a mejorar el conocimiento de la radiobiología del cáncer de mama y redefinirán mejor el papel de la radioterapia preoperatoria en diferentes escenarios.
ConclusionesLos paradigmas de tratamiento del cáncer de mama están en constante evolución. La secuencia temporal de los tratamientos implicados está cambiando, no es posible sostener un determinado esquema como estándar, sino que debe adaptarse a las condiciones de cada paciente. Las constantes mejoras en los tratamientos sistémicos, con el diseño de esquemas cada vez más personalizados y ajustados a las particularidades de los diferentes cánceres de mama, están modificando el antiguo concepto de quimioterapia. Así mismo, la evolución de la radioterapia para el cáncer de mama, con la generalización de los esquemas de irradiación hipofraccionados y ultrahipofraccionados, así como los modernos avances tecnológicos que permiten realizar tratamientos con alta precisión y seguridad, favorecen el cambio de perspectiva en el manejo multidisciplinar del cáncer de mama.
De este modo, la administración de tratamiento sistémico previo a la cirugía es ya una práctica estándar y la radioterapia preoperatoria en casos seleccionados merece ser considerada ya que en pacientes seleccionados podría ofrecer algunas ventajas clínicas:
- •
En primer lugar, un abordaje preoperatorio permite definir los volúmenes diana de forma más precisa que en el postoperatorio. Disminuiría el riesgo de pérdida geográfica asociada a la delimitación postoperatoria de los volúmenes diana, especialmente en relación al creciente interés en el uso de técnicas quirúrgicas oncoplásticas y el desafío en la localización del lecho tumoral debido al reordenamiento tisular, que dificulta administrar con seguridad este boost.
- •
En segundo lugar, la irradiación preoperatoria facilita la reconstrucción inmediata en aquellas pacientes sometidas a mastectomía, reduciendo los intervalos de demora y probablemente contribuyendo a un mejor resultado cosmético al evitar la irradiación del colgajo y el riesgo asociado de contracción y fibrosis.
- •
En tercer lugar, la radioterapia antes de la cirugía podría favorecer el uso de técnicas de mastectomía conservadoras de piel y/o complejo aréola-pezón al minimizar el riesgo de enfermedad residual posmastectomía, ya que este tejido ya habría sido previamente irradiado.
- •
Cuarto, la administración simultánea de radioterapia y quimioterapia puede afectar el tiempo total de tratamiento, al reducir el número de visitas al hospital, y mejorar la satisfacción del paciente y la adherencia terapéutica a la vez que facilita la reducción del costo total del tratamiento.
- •
Finalmente, la evidencia respalda la hipótesis de que los tumores desarrollan múltiples mecanismos de evasión inmunitaria, y algunos cánceres son inherentemente mejores para «ocultarse» que otros. Se ha sugerido además, que la radioterapia aplicada al tumor activa una potente inmunidad antitumoral, hecho ausente cuando se administra después de la cirugía, y que esta inmunidad radioinducida podría contribuir a eliminar no solo el tumor primario sino también focos microscópicos presentes en la mama ipsilateral y contralateral, además de disminuir el riesgo de micrometástasis a distancia, lo que lleva a un efecto abscopal de la radioterapia preoperatoria.
En definitiva, el manejo multidisciplinar del cáncer de mama deberá incluir la personalización de diferentes tratamientos y combinaciones que permitan avanzar en la individualización del abordaje de cada mujer con cáncer de mama.
AutoríaLos 2 autores han contribuido por igual al manuscrito y comparten la primera autoría.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticasLos autores firmantes del artículo aceptan la responsabilidad definida por el Comité Internacional de Editores de Revistas Médicas (International Committee of Medical Journal Editors, ICMJE).
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.