La radioterapia es uno de los pilares fundamentales del tratamiento del cáncer de mama y tan importante es la irradiación del tumor primario como de las áreas ganglionares, tanto axilares, supraclaviculares como la cadena mamaria interna. Existe un amplio consenso sobre la necesidad de irradiación de volumen mamario después de la cirugía conservadora y de la pared torácica después de la mastectomía. Sin embargo, en cuanto a la irradiación de las regiones ganglionares existe una controversia continua desde hace unos años, que se acrecentó desde el abandono de la linfadenectomía axilar en casos de poca enfermedad en este nivel. Existen diversos estudios que sugieren la necesidad o no de la irradiación de los ganglios, aunque muchos de ellos tienen el problema de no describir exactamente la dosis de radiación recibida en estos niveles, por ello la toma de decisiones es compleja. Una vez se ha decidido que la paciente es candidata a irradiación, la segunda pregunta hace referencia a los volúmenes ganglionares que deben tratarse y finalmente hay que decidir que esquema terapéutico hay que administrar, en estos 2 puntos, a pesar de existir mayor nivel de evidencia también existe controversia. En este artículo se revisa la utilidad de la irradiación ganglionar, así como los volúmenes a irradiar y el fraccionamiento a utilizar, haciendo una propuesta terapéutica.
Radiotherapy is one of the basic mainstays of breast cancer's treatment. Nodal irradiation, including axillary, supraclavicular nodes, and internal mammary chain, is as important as the primary tumor. There is a broad consensus on the need for breast volume irradiation after conservative surgery and chest wall after mastectomy. However, regarding the nodal irradiation, there has been a continuing controversy for some years, which has increased since the abandonment of axillary lymphadenectomy in cases of low burden disease at this level. There are several studies suggesting the need or not for nodal irradiation, although many of them have the problem of not describing the received radiation dose at these levels, and so decision-making is complex. Once it has been decided that the patient is a candidate for irradiation, the second question refers to the lymph node volumes that must be treated. Finally it is necessary to determine which therapeutic scheme must be administered. In these two points, despite the existence of a higher level of evidence as well there is also controversy. This article reviews the usefulness of nodal irradiation, as well as the volumes to be irradiated and the fractionation to be used, making a therapeutic proposal.
La radioterapia junto a la cirugía y al tratamiento sistémico conforman el tratamiento fundamental de las pacientes con cáncer de mama, habiendo conseguido unos resultados excelentes, tanto de control tumoral como de calidad de vida. Desde el punto de vista de la utilidad de la irradiación, existe un consenso amplio sobre la necesidad de irradiación del volumen mamario después de la cirugía conservadora y de la pared torácica después de la mastectomía. Sin embargo, en cuanto a la irradiación de las regiones ganglionares como la axila, la fosa supraclavicular o la cadena mamaria interna, existe una controversia importante desde hace unos años, que se acrecentó desde el abandono de la linfadenectomía axilar en casos de poca enfermedad en este nivel. Por lo que el tema de la irradiación ganglionar es uno de los caballos de batalla en la radioterapia de las pacientes con cáncer de mama de los últimos 10 años y va a seguir siéndolo en los próximos.
Los motivos fundamentales que provocan la amplitud de esta discusión son varios. La necesidad de disponer de seguimiento a largo plazo, mínimo de 5 años y preferiblemente 10 o más, hace que conseguir series homogéneas sea muy complejo porque los métodos diagnósticos y los tratamientos cambian mucho en poco tiempo y hace que las pacientes del principio de la serie no sean estrictamente comparables con las últimas. Otro de los motivos es la poca importancia que se le daba al tratamiento local al razonar que no impactaba en la supervivencia. Es cierto que en las pacientes tratadas hace 40 años, el tratamiento local no tenía impacto en la supervivencia, menos de la mitad de las pacientes vivían más de 5 años, por lo que el beneficio de la radioterapia no se apreciaba y además la toxicidad derivada no era despreciable. La llegada del diagnóstico precoz, las mejoras en la estadificación de las pacientes, las mejoras en el tratamiento sistémico y especialmente la revolución tecnológica, que hemos vivido y estamos viviendo, en radioterapia han provocado que el tratamiento local aumente su importancia e impacte en la supervivencia y en la supervivencia libre de enfermedad. Además, no debemos olvidar que el motivo de máxima preocupación de las pacientes es la recidiva. Finalmente, existe un motivo mucho más técnico y es la poca información disponible en la bibliografía para conocer con exactitud los volúmenes irradiados y las dosis recibidas por cada uno de ellos.
Todo este conjunto de factores comporta una dificultad importante en la toma de decisiones y la discusión actual está centrada en qué pacientes deben recibir irradiación ganglionar, qué volúmenes deben irradiarse y qué dosis y fraccionamiento debe utilizarse. Por ello se ha estructurado este escrito en 3 puntos: necesidad de irradiación, volúmenes y fraccionamiento de dosis.
Necesidad de irradiaciónHasta hace unos años, tras la cirugía, se irradiaba el lecho quirúrgico (mama o pared) y todas las áreas ganglionares, incluyendo los niveles I, II y III axilares, fosa supraclavicular y la cadena mamaria interna homolateral, independientemente de la extensión de la linfadenectomía. El linfedema se presentaba en muchas ocasiones, debido a que se hacían grandes linfadenectomías y se realizaba un sobretratamiento de la axila baja (niveles I y II), con estos volúmenes de irradiación tan grandes la toxicidad cardiaca no era despreciable. Los resultados demostraban una mejora en el control local pero no en la supervivencia, por la toxicidad sobreañadida. Posteriormente, se empezó a considerar que al realizar la linfadenectomía ya se estaban tratando los ganglios axilares bajos, por lo que se dejaron de irradiar los niveles I y II y disminuyó la indicación de irradiación de la mamaria interna. Paralelamente se empezaron a implementar las mejoras tecnológicas como la delimitación de volúmenes en imágenes de tomografía computarizada, la dosimetría en 3 dimensiones (3D), la modulación de intensidad, el control del posicionamiento con imágenes planas o tomográficas de muy buena calidad, los sistemas de inmovilización cada vez más exactos y, finalmente, la irradiación en inspiración profunda, mantenida en los casos de mama izquierda, que aumenta el espacio entra la mama y el corazón, y también mejora la inmovilización, hecho especialmente útil en dosimetrías complejas. Todo ello ha conseguido que la radioterapia sea capaz de aumentar la supervivencia y disminuir la morbilidad.
No existen dudas de la utilidad de la radioterapia cuando existe una afectación de 4 o más ganglios axilares, ya que diversos estudios han demostrado que la radioterapia aumenta las tasas de supervivencia en pacientes con cáncer de mama y aumenta el control de la enfermedad1–5. Sin embargo, la recomendación no es tan clara cuando la afectación ganglionar oscila entre 1 y 3 ganglios linfáticos6. El ensayo NCIC-CTG MA205 demostró que la irradiación ganglionar regional mejora la supervivencia libre de enfermedad, así como el control locorregional y a distancia de la enfermedad en pacientes con afectación en 1 a 3 ganglios. Poortmans et al.7,8 demostraron que la irradiación ganglionar, en pacientes en un estadio similar, aumentaba la supervivencia libre de enfermedad. Un metaanálisis realizado por Budach et al.9,10 concluyó que la irradiación ganglionar, incluyendo la mamaria interna, en este grupo de pacientes, mejoró las tasas generales de supervivencia libre de enfermedad. Paralelamente, con la idea de disminuir la necesidad de linfadenectomía, Giuliano et al.11 demostraron, en el estudio ACOSOG Z0011, que la disección de los ganglios linfáticos axilares de los niveles I y II no proporcionaba ningún beneficio significativo sobre la biopsia selectiva del ganglio centinela. Los resultados de este estudio fueron muy discutidos porque no estaban claros los volúmenes de irradiación y así se abrió una etapa en la que las pacientes con afectación de 1 a 2 ganglios axilares se trataban con diversas opciones: linfadenectomía e irradiación de nivel III y fosa supraclavicular, biopsia del ganglio centinela e irradiación de todas las áreas ganglionares, biopsia del ganglio centinela e irradiación de los niveles I y II axilares o biopsia del ganglio centinela exclusiva. Esta disparidad de tratamientos se aclaró, en parte, con la aparición de los resultados de los ensayos AMAROS12 y OTOASOR13, que mostraron que la irradiación ganglionar de toda la axila y fosa supraclavicular es equivalente a la linfadenectomía axilar baja completada con la irradiación del nivel III axilar y la fosa supraclavicular, por lo que el tratamiento recomendado debe ser la biopsia selectiva del ganglio centinela seguida de la irradiación ganglionar, es decir, se sustituye la linfadenectomía quirúrgica por la linfadenectomía rádica. Este nuevo paradigma se confirmó aún más cuando apareció el reanálisis de la radioterapia realizada en el ACOSOG Z001114, en el que se demostró que el 70% de las pacientes había recibido irradiación como mínimo de los niveles I y II axilares. Recientemente ha aparecido un análisis a más largo plazo del estudio AMAROS que confirma los resultados15.
A pesar de existir toda esta evidencia, se sigue pensando que existe un sobretratamiento, desde el punto de vista de la radioterapia, en este grupo de pacientes con afectación ganglionar en 1 o 2 ganglios. Como ha sido mencionado, una de las dificultades importantes para la toma de decisiones sobre la irradiación ganglionar está en la poca descripción de los volúmenes irradiados en los diferentes estudios. Así, los diferentes estudios llegan a conclusiones contradictorias sobre la necesidad de tratamiento axilar en estas pacientes. Algunos demuestran que incluso las micrometástasis implican un peor pronóstico16 y que el tratamiento local, ya sea radioterapia o cirugía, mejora la supervivencia17–19. Otros concluyen que la irradiación ganglionar en casos de baja carga tumoral o micrometástasis no es necesaria20–22. Incluso un metaanálisis demuestra que la irradiación del nivel III axilar y de la fosa supraclavicular no mejora la supervivencia23. Como hemos mencionado, esta discrepancia podría explicarse porque los volúmenes y dosis exactas recibidas en cada nivel no se informan en los estudios24. Otro factor que contribuye al desconocimiento de la dosis es la denominada irradiación incidental, es decir, la dosis que se recibe en algunos volúmenes de forma no intencional, hecho que ocurre de forma no despreciable en los niveles bajos axilares al irradiar la mama o la pared torácica25. Esta dosis podría ser la responsable de la igualdad entre los grupos de pacientes con irradiación ganglionar y las que no han recibido este tratamiento de forma intencional. Este hecho es particularmente importante cuando se utilizan técnicas de 3D poco conformadas o con los campos tangenciales altos (high tangents).
Existen algunos estudios en marcha, en los que este problema está parcialmente solucionado, ya que tienen en cuenta la dosis recibida en los ganglios, como son los ensayos POSTNOC26, BOOG27 u OPTIMAL28. Los resultados de este último29 se publicaron el año pasado y demuestran que no existen diferencias clínicamente relevantes en la supervivencia libre de enfermedad, entre añadir o no la irradiación ganglionar a la biopsia del ganglio centinela en caso de poca carga tumoral axilar, definida como afectación máxima de 15.000 por OSNA, que es muy similar a un máximo de 2 ganglios afectados30. Sin embargo, en este estudio se pone de manifiesto que las pacientes que no recibieron irradiación de los ganglios axilares, recibieron un mínimo de 30 Gy en los niveles I y II de forma incidental al irradiar el volumen mamario, por ello los autores concluyen que en estos casos de poca afectación ganglionar, la mejor decisión debe ser la biopsia del ganglio centinela seguida de irradiación de los niveles I y II axilares.
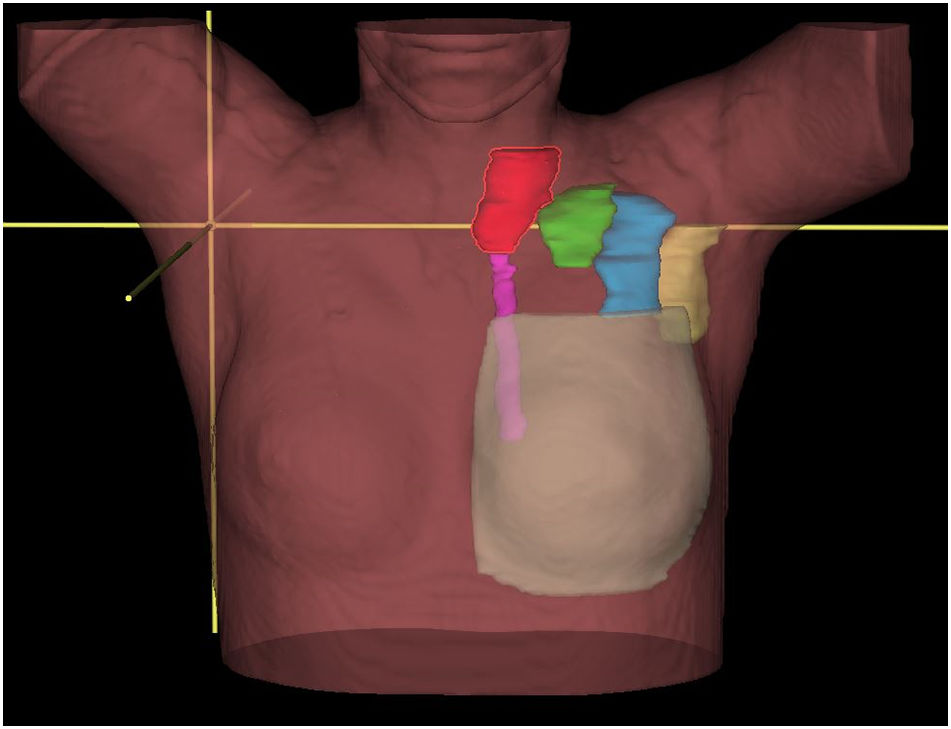
VolúmenesAnatómicamente la axila se divide en 3 niveles, siendo el I el más caudal y el III el más craneal, denominándose también infraclavicular. Asimismo, existe un IV nivel que se corresponde a la fosa supraclavicular. Como ha sido mencionado, existe un consenso universal sobre la necesidad de tratamiento ganglionar en las pacientes con afectación de 4 o más ganglios y desde el punto de vista de la radioterapia deben irradiarse aquellas áreas ganglionares que no han sido extirpadas. En estos casos, generalmente, se ha realizado una linfadenectomía quirúrgica de los niveles I y II, por tanto, los volúmenes a irradiar serán el III y el IV (la mamaria interna se discute más adelante), en el caso hipotético de biopsia únicamente de los ganglios centinelas se deben irradiar los niveles I, II, III y IV.
La radioterapia actual exige una delimitación cuidadosa de los volúmenes a irradiar y una protección extrema de los órganos de riesgo tal como establecen las directrices ESTRO31 y otros estudios32. En la fig. 1 se muestran los diferentes volúmenes ganglionares axilares, supraclavicular y mamaria interna. Este aumento de la precisión comporta una disminución de la irradiación incidental, por ello actualmente no sería correcto «confiar» en la irradiación incidental. En los casos en que se pretenda irradiar alguna región ganglionar, especialmente los niveles I y II axilares, es preferible hacer una correcta delimitación y cálculo dosimétrico. Esta actitud en los casos de poca enfermedad axilar, es decir, mediante la realización de la biopsia selectiva del ganglio centinela, seguida de la irradiación exclusiva de los niveles axilares I y II ha sido sugerida por varios autores33–37 y sigue la idea de la desescalada del tratamiento local axilar según lo aconsejado38.
En nuestro país la mamaria interna ha sido la gran olvidada, hasta no hace mucho tiempo pocos eran los centros que la incluían en sus volúmenes de tratamiento. Al inicio de la irradiación de las pacientes con cáncer de mama se incluía siempre la cadena mamaria interna, era la época de la radioterapia basada en campos anatómicos que comportó buenos resultados pero toxicidades importantes a nivel cutáneo, pulmonar y cardiaco. Por ello, el beneficio de la irradiación de este volumen ganglionar era muy discutible y su utilidad fue muy cuestionada, y dejamos de irradiar la mamaria interna, a diferencia de otros países como Francia o Dinamarca. La llegada de las nuevas tecnologías y la demostración del aumento de la supervivencia gracias a la irradiación hacen que renazca el interés por este volumen y empiezan a aparecer estudios sugiriendo que hay pacientes que pueden beneficiarse de este tratamiento. El estudio danés39, que es un estudio observacional basado en la práctica clínica (lo que hoy denominamos real world data), en el que se comparan pacientes con cáncer de mama derecha en las que se irradió la cadena mamaria con pacientes con cáncer de mama izquierda en las que no se incluyó, con la idea de no aumentar la morbilidad cardiaca, demuestra que las pacientes con cáncer de mama derecha sobreviven más. Estos datos se han confirmado en un reanálisis con 15 años de seguimiento40. Todo ello hace que la indicación de irradiación de mamaria interna homolateral esté aumentando y que deba plantearse como mínimo en los subgrupos de mayor riesgo, es decir, en aquellas pacientes con afectación de 4 o más ganglios axilares.
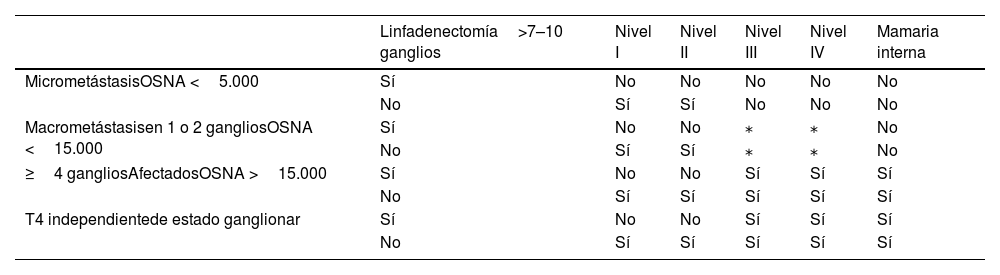
A modo de guía en la tabla 1 se expone una guía de volúmenes a tratar según el estadio y la afectación ganglionar. La biopsia selectiva del ganglio centinela se considera como una linfadenectomía menor de 7 a 10 ganglios. En caso de afectación histológica de la mamaria interna, se irradiarán las regiones axilares en función de la tabla 1 y se añadirá el volumen de la mamaria interna.
Indicación de irradiación de las regiones ganglionares
| Linfadenectomía>7–10 ganglios | Nivel I | Nivel II | Nivel III | Nivel IV | Mamaria interna | |
|---|---|---|---|---|---|---|
| MicrometástasisOSNA <5.000 | Sí | No | No | No | No | No |
| No | Sí | Sí | No | No | No | |
| Macrometástasisen 1 o 2 gangliosOSNA <15.000 | Sí | No | No | ⁎ | ⁎ | No |
| No | Sí | Sí | ⁎ | ⁎ | No | |
| ≥4 gangliosAfectadosOSNA >15.000 | Sí | No | No | Sí | Sí | Sí |
| No | Sí | Sí | Sí | Sí | Sí | |
| T4 independientede estado ganglionar | Sí | No | No | Sí | Sí | Sí |
| No | Sí | Sí | Sí | Sí | Sí |
Desde la aparición de los estudios START41 y del estudio canadiense42, las 15–16 fracciones con sobreimpresión concomitante o secuencial deben ser el estándar en todas las pacientes con cáncer de mama que deban recibir irradiación. Sin embargo, hasta hace muy poco tiempo un número no despreciable de centros no utilizaban estos esquemas más cortos en las pacientes con afectación ganglionar, alegando que en estos estudios no estaba representada la irradiación ganglionar y que se necesitaba más seguimiento para poder evaluar la toxicidad. La publicación de los resultados del hipofraccionamiento en pacientes mastectomizadas43, y que muchas de ellas precisan irradiación ganglionar, confirma la utilidad de este esquema en estas pacientes. Sin embargo, hay que destacar que ha sido la pandemia la gran responsable de la universalización del hipofraccionamiento, ya que en 2020 todas las muchas sociedades científicas44–46 recomendaron de forma muy importante la utilización de esquemas cortos para evitar desplazamientos de las pacientes a los centros hospitalarios.
Por tanto, el esquema de 15 fracciones es el estándar para irradiar los ganglios en pacientes con cáncer de mama. La duda está en utilizar el esquema Fast-Forward. El estudio publicado en 202047 demuestra una equivalencia entre la utilización del esquema estándar de 15 fracciones frente a 5 fracciones de 5,2 Gy. Sin embargo, en este estudio, aunque se han incluido pacientes con irradiación ganglionar, este grupo específico no está descrito por lo que de momento no es recomendable utilizar este esquema ultracorto de forma asistencial48. Existen diversos estudios en marcha utilizando esquemas de 5 días en la irradiación de los ganglios y los resultados preliminares son buenos49 y probablemente, en un futuro no muy lejano, el nuevo fraccionamiento estándar será la irradiación en 5 días, e incluso el Royal College of Radiologist50 acepta el ultrahipofraccionamiento en pacientes con morbilidad importante que dificulte el tratamiento en 15 sesiones.
Hay que destacar que esta progresiva disminución en el número de fracciones va ligada a un aumento progresivo del uso de la tecnología, así en relativos pocos años estamos pasando de la aseveración de que la intensidad modulada no aporta beneficio a la irradiación de las pacientes con cáncer de mama51,52, a la utilización de intensidad modulada, de irradiación volumétrica, técnicas híbridas y sistemas de sincronización respiratoria con irradiación en inspiración profunda, todo ello con sistemas de posicionamiento, mediante comparación de superficies y comprobación con sistemas de imagen, tanto de imagen plana (Mv o Kv) y volumétrica (cone-beam). Toda esta mejora tecnológica ha contribuido a poder disminuir los volúmenes a tratar y la dosis a administrar.
ConclusionesLa radioterapia de las áreas ganglionares en el cáncer de mama sigue siendo controvertida. Sin embargo, existe una necesidad de irradiación de los niveles axilares III y IV después de una linfadenectomía axilar en casos de afectación de 4 o más ganglios, siendo muy recomendable la inclusión de la cadena mamaria interna. En aquellos casos con 1–2 ganglios afectados en los que no se ha realizado una linfadenectomía es muy recomendable la irradiación de los niveles axilares I y II, en caso de haber realizado una linfadenectomía la irradiación podría obviarse. El fraccionamiento a utilizar, por el momento, es el esquema de 15 fracciones de 2,7 Gy.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticasEl presente trabajo no incluye experimentación con seres humanos ni animales.
Conflicto de interesesManuel Algara ha recibido honorarios de Sysmex, Siemens y Carl Zeiss como conferenciante experto. Xavier Sanz ha recibido honorarios de Carl Zeiss como conferenciante experto. Nuria Rodríguez ha recibido honorarios de Astra Zeneca como conferenciante experta. El resto de los autores declaran no tener conflicto de interés.