La estadificación ganglionar inicial está indicada en aquellos casos de carcinoma de mama en los que la información obtenida pueda cambiar la actitud terapéutica o establecer una información pronóstica con implicaciones para el seguimiento de las pacientes.
En los últimos años, los cambios conceptuales introducidos por ensayos clínicos y estudios observacionales han generado nuevos retos con disparidad de criterios respecto a la actitud terapéutica a seguir en determinados casos.
Ello justifica la necesidad de revisar el último documento del Consenso de la SESPM del año 2013.
Aunque el objetivo fundamental del documento es la actualización de la práctica clínica en ganglio centinela de cáncer de mama, los cambios acontecidos en los últimos años en el diagnóstico y el tratamiento de este tumor obligan a incluir aspectos que, aunque ajenos al ámbito estricto del procedimiento de la biopsia selectiva del ganglio centinela, se interrelacionan directamente con él.
Initial nodal staging is indicated in those cases of breast carcinoma in which the information obtained can change the therapeutic approach or establish prognostic information with implications for patient follow-up.
In recent years, the conceptual changes introduced by clinical trials and observational studies have generated new challenges with disparity of criteria regarding the therapeutic approach to be followed in certain cases.
This justifies the need to revise the latest consensus document of 2013.
Although the main objective of the document is to update clinical practice in sentinel lymph node breast cancer, the changes that have occurred in recent years in the diagnosis and treatment of this tumor make it necessary to include aspects that, although outside the strict scope of the selective sentinel lymph node biopsy procedure, are directly related to it.
La estadificación ganglionar inicial está indicada en aquellos casos de carcinoma de mama en los que la información obtenida pueda cambiar la actitud terapéutica o establecer una información pronóstica con implicaciones para el seguimiento de las pacientes. Esto descarta su indicación en el contexto de la enfermedad metastásica. Una vez establecido el diagnóstico de carcinoma de mama (intraductal o infiltrante) es preceptivo el estudio ecográfico de la axila.
La biopsia selectiva del ganglio centinela (BSGC) es un procedimiento diagnóstico desarrollado para la estadificación ganglionar en determinados tumores sólidos, especialmente en el cáncer de mama y en el melanoma; se basa en el fundamento de que las metástasis pasan a través de un ganglio o ganglios (el ganglio centinela [GC]), conectados directamente con el tumor mediante vasos linfáticos, antes de extenderse de forma más generalizada. El poder focalizar el estudio histopatológico en un número limitado de ganglios, permite la ultra-estadificación de las muestras, aumentando la oportunidad de detectar metástasis.
El uso de la BSGC se ha extendido desde la descripción de la técnica para el melanoma en la década de 1990, evidenciándose su utilidad a través de los resultados comunicados por numerosos grupos. Actualmente, es el procedimiento de elección para la estadificación ganglionar del cáncer de mama, y permite seleccionar un subgrupo de pacientes en los que la linfadenectomía axilar no aporta ningún beneficio adicional.
Justificación de la nueva edición del consensoEn los últimos años, los cambios conceptuales introducidos por ensayos clínicos y estudios observacionales han generado nuevos retos con disparidad de criterios respecto a la actitud terapéutica a seguir en determinados casos. Ello justifica la necesidad de revisar el último documento de Consenso del año 20131–3.
El actual documento de Consenso transcribe el trabajo realizado por el grupo de expertos a lo largo de varios meses.
Este Consenso refrendará o modificará las cuestiones consensuadas en reuniones previas (Asociación Española de Cirujanos, Salamanca, octubre de 2001; Sociedad Española de Oncología Quirúrgica, Valencia, octubre de 2001; Sociedad Española de Senología y Patología Mamaria, Murcia, noviembre de 2006, y Valencia, 2010 y 2013)3. Al igual que en consensos previos, los participantes (especialistas en Cirugía General, Ginecología y Obstetricia, Patología, Medicina Nuclear, Oncología Médica, Oncología Radioterápica y Radiología [anexo]) pertenecen a grupos con amplia y demostrada experiencia en el ámbito del GC en el carcinoma de mama.
Introducción metodológicaPara la realización del presente Consenso, hemos reunido a un grupo de expertos de las distintas especialidades implicadas (radiología, patología, cirugía, medicina nuclear, oncología radioterápica y oncología médica) comprometidos especialmente todos ellos con el cáncer de mama y, particularmente, con el procedimiento del GC.
En una primera fase, el grupo delimitó el alcance del Consenso y los objetivos, realizando a continuación una evaluación y la síntesis de la literatura dentro de cada especialidad, buscando los niveles de evidencia existentes para cada una de las situaciones clínicas planteadas, tanto diagnósticas como terapéuticas.
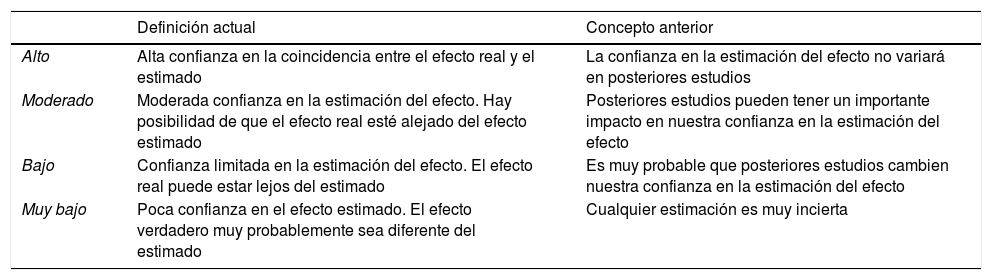
Dicha evidencia se ha clasificado siguiendo el sistema GRADE (Grading of Recommendations, Assessment, Development and Evaluation)4, según el cual la calidad de la evidencia se clasifica en alta o baja, según provenga de estudios experimentales u observacionales (tabla 1).
Sistema GRADE: significado de los distintos grados de evidencia4
| Definición actual | Concepto anterior | |
|---|---|---|
| Alto | Alta confianza en la coincidencia entre el efecto real y el estimado | La confianza en la estimación del efecto no variará en posteriores estudios |
| Moderado | Moderada confianza en la estimación del efecto. Hay posibilidad de que el efecto real esté alejado del efecto estimado | Posteriores estudios pueden tener un importante impacto en nuestra confianza en la estimación del efecto |
| Bajo | Confianza limitada en la estimación del efecto. El efecto real puede estar lejos del estimado | Es muy probable que posteriores estudios cambien nuestra confianza en la estimación del efecto |
| Muy bajo | Poca confianza en el efecto estimado. El efecto verdadero muy probablemente sea diferente del estimado | Cualquier estimación es muy incierta |
La siguiente fase fue, a partir de las evidencias encontradas, formular las distintas recomendaciones expresadas en el Consenso.
Para la clasificación de la evidencia, el grupo de expertos se ha basado fundamentalmente en el balance entre riesgos y beneficios y la calidad de la evidencia obtenida de la revisión de la literatura.
La intención del grupo de expertos ha sido elaborar un Consenso «de mínimos», útil en cualquier medio, independientemente de los recursos humanos o técnicos disponibles.
Con fines prácticos, se han intentado organizar las recomendaciones acordadas de manera sencilla en 2 niveles:
- •
Diagnóstico: que incluye recomendaciones fundamentalmente en el ámbito de la radiología y la patología.
- •
Clínico: adaptándolas a las distintas situaciones (escenarios) clínicos actuales, tanto desde el punto de vista quirúrgico, de oncología médica y radioterápica.
Además, se han incluido algunas sugerencias carentes todavía de la suficiente evidencia como para ser recomendadas, pero con altas probabilidades de ser aceptadas e incluidas en la práctica clínica, una vez concluyan los estudios en marcha, realizados al respecto.
Aunque el objetivo fundamental del documento es la actualización de la práctica clínica en el GC de cáncer de mama, los cambios acontecidos en los últimos años en el diagnóstico y tratamiento de este tumor obligan a incluir aspectos que, aunque ajenos al ámbito estricto del procedimiento de la BSGC, interrelacionan directamente con él.
Definiciones- •
Ganglio centinela (GC): es la primera estación ganglionar que recibe el drenaje linfático tumoral. La negatividad del GC axilar en el cáncer de mama infiltrante en estadio precoz permite evitar la linfadenectomía axilar (evidencia alta, recomendación fuerte 1A).
- •
Desde el punto de vista de la Medicina Nuclear, es el ganglio o ganglios linfáticos regionales que reciben el drenaje linfático directamente desde el tumor primario, detectables en la linfogammagrafía, especialmente si están conectados por un canal linfático.
- •
Desde el punto de vista quirúrgico, se considera al GC aquel o aquellos que presentan una actividad representativa y que están ubicados en el área preseleccionada gammagráficamente.
- •
- •
Ganglio secundario:
- •
Desde el punto de vista de la medicina nuclear, es aquel o aquellos que presentan una captación del trazador en la línea de progresión linfática desde el GC, habitualmente con menor actividad, claramente diferenciada.
- •
Desde el punto de vista quirúrgico, es aquel o aquellos identificados o no previamente en la linfogammagrafía, que tienen una actividad menor del 10% del GC de máxima actividad.
- •
- •
Macrometástasis: infiltración tumoral > 2 mm de diámetro máximo o más de 5.000 copias de ARNm-CK19/uL (OSNA).
- •
Micrometástasis: infiltración tumoral de entre 0,2 y 2 mm de diámetro máximo o un número de copias de ARNm-CK19/uL comprendido entre 250 y 5.000 (OSNA).
- •
Células tumorales aisladas o grupo celular aislado (CTA, GCA): grupos de células menores de 0,2 mm o menos de 200 células, sin reacción estromal. En caso de GCA múltiples solo se mide la de mayor tamaño. En OSNA, corresponde a un número de copias entre 160-250 de ARNm-CK19/uL.
- •
Carga tumoral total (CTT): suma del número total de copias de CK19 de todos los GC positivos5.
- •
Ganglio marcado: ganglio marcado mediante dispositivo metálico o semilla, previo al inicio del tratamiento neoadyuvante y tras la comprobación cito/histológica de metástasis, para su posterior recuperación quirúrgica.
- •
«Bajo riesgo de infiltración ganglionar»: casos que cumplan todos los criterios siguientes: edad mayor de 65 años, tumor T1, tipo histológico ductal, subtipo Luminal A, con axila ecográficamente negativa o con un solo ganglio de sospecha UN35.
- •
«Alto riesgo de infiltración ganglionar»: todos los casos no incluidos en la definición anterior.
- •
Disección axilar dirigida (DAD): disección dirigida del ganglio marcado junto con la BSGC.
- •
Linfadenectomía axilar (LAx): disección y extirpación del tejido linfograso axilar, considerando representativo un número de ganglios mayor de 10. Se categoriza clínicamente en función de los 3 niveles de Berg, respecto a los límites anatómicos del músculo pectoral menor.
- •
TNM: clasificación de la extensión de la enfermedad basada, básicamente, en la información anatómica relacionada con la extensión del tumor primario, el estado de los ganglios axilares y la presencia o ausencia de metástasis a distancia (clasificación TNM).
Estudio ecográfico: la ecografía es la técnica diagnóstica de elección para la estadificación clínica del parámetro cN y debe realizarse en todas las pacientes con cáncer de mama al inicio del diagnóstico. Debe ir dirigida a los 3 niveles anatómicos de Berg ipsilaterales, al tumor y al hueco supraclavicular. El estudio ecográfico ganglionar regional debe ampliarse al territorio de mamaria interna y la axila contralateral ante un carcinoma de mama localmente avanzado. La sensibilidad de la ecografía para la detección de metástasis ganglionares axilares (N+) es de aproximadamente el 50%, con valores de entre el 48,8 y el 87,1%, y una especificidad del 55,6 al 97,3%6,7 con un valor predictivo positivo (VPP) del 100% cuando se asocia a BAG (biopsia con aguja gruesa) o PAAF (punción aspiración con aguja fina). La información ecográfica debe complementarse con:
- •
La RM (resonancia magnética) para la valoración del territorio de la mamaria interna.
- •
PET-CT (tomografía por emisión de positrones), en los pacientes seleccionados con indicación de terapia sistémica primaria (TSP), según la estadificación y el criterio de la Unidad de Mama.
Criterios para la evaluación ecográfica: la sospecha morfológica de metástasis ganglionar se expresará según los criterios de Bedi8 o Amonkar9, el número de ganglios de sospecha y su localización por niveles de Berg. En el contexto de la TSP, se reflejará el tamaño del ganglio metastásico marcado para la valoración de la respuesta.
Clasificación de Bedi: 6 categorías
- •
Tipo 1-3: predominantemente hiperecoicos, morfología de benignidad.
- •
Tipo 4: engrosamiento cortical generalizado.
- •
Tipo 5: la presencia de lobulación asimétrica focal hipoecoica cortical.
- •
Tipo 6: ganglio con sustitución completa del hilio graso, de alta sospecha metastásica.
Clasificación de Amonkar
- •
UN2: ganglio de morfología normal (grosor cortical menor de 3 mm e hilio graso central conservado).
- •
UN3: indeterminado (cortical mayor de 3 mm engrosada de forma uniforme).
- •
UN4: sospechoso (engrosamiento cortical focal mayor de 3 mm, excéntrico con desplazamiento de hilio graso).
- •
UN5: ganglio con hilio totalmente sustituido de alta sospecha metastásica.
La confirmación metastásica de un ganglio sospechoso debe realizarse mediante BAG o PAAF por la posibilidad de falsos positivos de la ecografía. La especificidad de ambas técnicas se aproxima al 100% y las complicaciones son escasas con ambas. Las recomendaciones publicadas apoyan el uso de la BAG por su mayor sensibilidad y por la disponibilidad de tejido residual para estudios complementarios. Sin embargo, la decisión de usar PAAF o BAG dependerá de la experiencia de la Unidad y las preferencias del radiólogo y del patólogo9,10.
Manejo ecográfico axilar: ante cualquier ganglio sospechoso, se recomienda realizar BAG/PAAF dirigida al ganglio de mayor tamaño y en el nivel más alto de Berg, (el de mayor estadificación) a fin de garantizar la estadificación como cN2-cN3. Esto sería válido para cualquier subtipo molecular, excepto si se trata de un ganglio único, UN3 en nivel I, en cuyo caso puede hacerse directamente la BSGC.
Cuando estamos ante un cN1 con 1 a 3 ganglios de sospecha y la paciente tiene indicación de TSP, biopsiamos y marcamos el más sospechoso en la posición más caudal (ausencia de ganglios sospechosos en el resto de los niveles) (escenario 3).
Recomendaciones para el marcaje ganglionar: cuando el marcaje se hace con clip, se recomienda marcar en el mismo acto de la biopsia siempre que sea posible. Con cualquier otro método, el marcaje obliga a la extirpación de ese ganglio, sea metastásico o no (escenario 3).
Patología: consideraciones generalesDatos mínimos necesarios recomendados en la solicitud de BSGC:
- •
Datos de identificación de la paciente.
- •
Diagnóstico histológico del tumor.
- •
Topografía (axilar, mamaria interna, intramamario).
- •
Lateralidad.
- •
Número de GC extraídos.
- •
Reseñar si existe marcador en alguno de ellos. En caso afirmativo, individualizar el ganglio marcado. Se recomienda comprobación radiológica en caso de duda en la identificación del marcador.
- •
Indicar si ha recibido TSP.
Técnicas diagnósticas. Recomendaciones en pre- y posneoadyuvancia
Dos hechos fundamentales han condicionado el desarrollo y la utilización de las diversas técnicas diagnósticas a lo largo de la historia de la BSGC: por un lado, la necesidad de clasificar las metástasis en función de su tamaño y, por otro y especialmente, las indicaciones de LAx.
Además, las técnicas diagnósticas para GC se clasifican, en función del tiempo de respuesta diagnóstica, en:
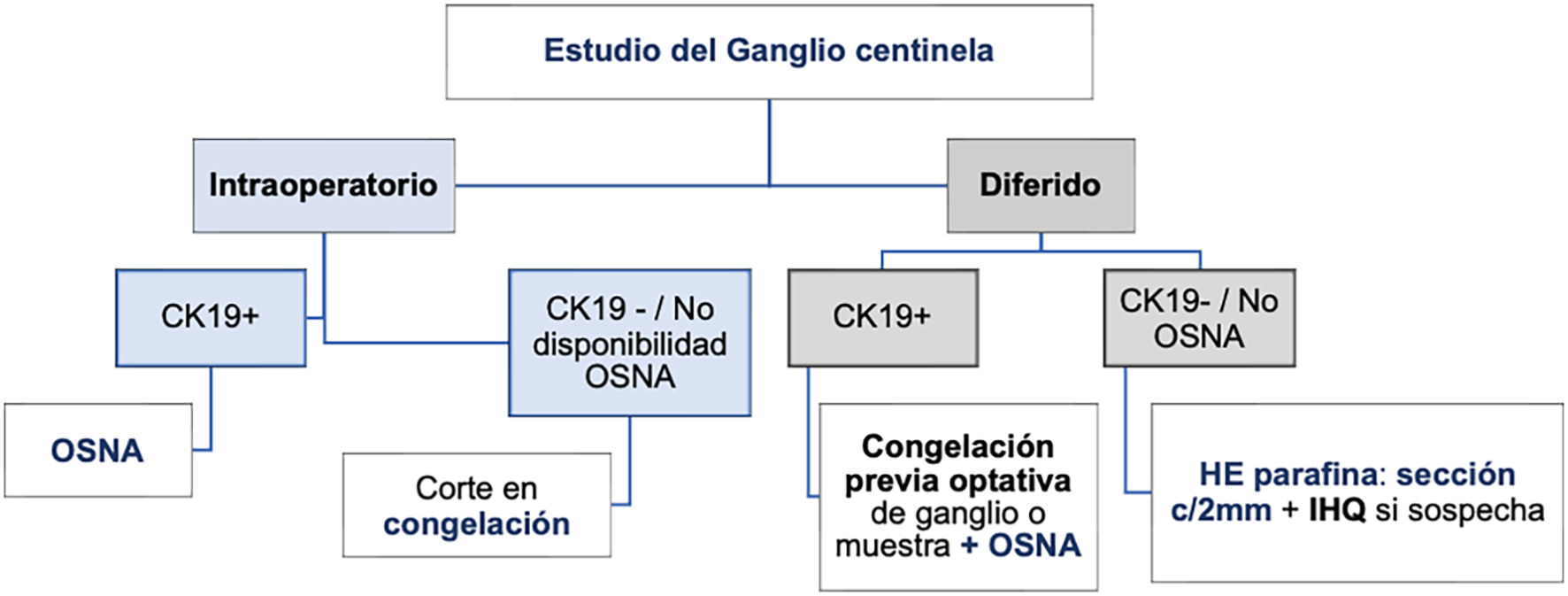
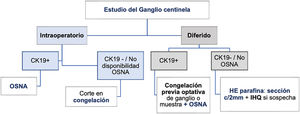
-Técnicas intraoperatorias11,12: deben aplicarse cuando la decisión quirúrgica sobre la axila dependa del resultado de la biopsia. Se emite un diagnóstico rápido durante la intervención quirúrgica y ofrece las siguientes ventajas: evita segundas intervenciones, reduce el riesgo anestésico y las complicaciones posquirúrgicas. Las distintas técnicas intra-operatorias son:
-Impronta citológica: no es recomendable como único método por su baja sensibilidad (61%), que baja al 22% para micrometástasis y porque no ofrece información sobre el tamaño de la metástasis13,14. Puede utilizarse como método complementario.
-Corte de congelación: requiere más tiempo (especialmente cuando son varios los ganglios a estudio) y gran habilidad para el corte. Además, en el proceso de preparación, se puede perder tejido con información diagnóstica. Con hematoxilina-eosina (HE), la sensibilidad descrita para metástasis en general es del 78%, del 94% para macrometástasis y del 40% para micrometástasis12. Se puede mejorar levemente con el uso de citoqueratinas, aunque alarga la duración del procedimiento. En ganglios > 5mm, se recomienda realizar un corte cada 2 mm según el eje mayor del ganglio, hasta un máximo de 5 cortes. No se recomienda profundizar más por la pérdida de material inherente al método. En ganglios < 5 mm, se bisecciona y se debe estudiar un corte de cada mitad. Es importante tener en cuenta que, con esta técnica, solo es posible estudiar una parte del GC, lo que representa menos del 10%, y puede conducir a errores de valoración.
-One-step-nucleic acid amplification (OSNA): es la técnica recomendada siempre que sea posible. Permite el estudio de la totalidad del ganglio y se basa en la detección por PCR Lamp del ARNm de la citoqueratina 19 (CK19), presente en el 95% de los carcinomas de mama. Ofrece un valor cuantitativo del tamaño de las metástasis. El protocolo desarrollado por Tsujimoto15 tiene una concordancia de un 98% con el estudio de cortes seriados utilizando HE y citoqueratinas. Se han publicado varios metaanálisis que cuestionan la concordancia entre el resultado de OSNA y el tamaño de las metástasis, sugiriendo que OSNA puede inducir sobre-tratamiento3. Sin embargo, Tiernan reconoce que OSNA ofrece más sensibilidad (89%) y especificidad (98%), que el método convencional16. Las principales ventajas de OSNA son: estandarización, diagnóstico definitivo en un solo acto (tanto si se realiza intraoperatorio como diferido) y ahorro en recursos humanos, especialmente si el número de ganglios a estudio es mayor de 2. Otras ventajas del método son que permite evaluar en un solo análisis la CTT17. Las principales desventajas de OSNA son que no permite evaluar signos de regresión tras TSP, cuyo significado se detalla más adelante, y que no siempre se puede completar el RCB (Residual Cancer Burden) en caso de ganglios positivos. En situaciones excepcionales en que el único carcinoma infiltrante disponible sea el de la metástasis ganglionar (ausencia de primario en la mama), no podría evaluarse el fenotipo tumoral inmunohistoquímicamente. Dada la excepcionalidad de esta situación, debe considerarse que se trata de una limitación de muy bajo impacto en la práctica clínica. Respecto al coste directo de la técnica, es más elevado que el del estudio histológico convencional, pero OSNA ahorra tiempo de recursos humanos.
Para completar el estudio y evaluar la extensión extracapsular, se debe incluir la grasa periganglionar centinela en un bloque de parafina con el fin de realizar un estudio histológico convencional de la misma3.
Para evitar falsos negativos en los tumores que no expresan CK19, se recomienda comprobar que existe un mínimo del 30% de células CK19 positivas en la biopsia inicial (BAG), antes de realizar la técnica.
En los ganglios marcados, es fundamental indicar la presencia del marcador en la solicitud de patología para que el patólogo confirme su presencia y pueda retirarlo antes del procesamiento técnico del ganglio.
-Sistemas de deep learning: para la detección de metástasis en cortes de congelación. Se han descrito iniciativas para utilizar la inteligencia artificial como ayuda para la detección de metástasis en los cortes de congelación18,19.
Indicaciones de la biopsia intraoperatoria: como criterio general, solo deben ser indicación de estudio intraoperatorio aquellos casos en los que el diagnóstico obtenido implique un cambio en la actitud terapéutica en el mismo acto quirúrgico. Básicamente, este supuesto puede corresponder a los casos de «alto riesgo» de metástasis, es decir:
La sospecha de > 2 ganglios metastásicos, con PAAF/BAG negativas y fuera del escenario de la TSP.
Casos post-TSP negativos o positivos de inicio que se convierten a cN0 (cN0 o cN1➔ ycN0).
En cualquier caso, es recomendable individualizar cada caso en la discusión del Comité de Mama (fig. 1).
Técnicas en diferido: requieren un tiempo no menor de 24 horas para ofrecer un diagnóstico.
-Técnica histológica tradicional (inclusión en parafina y tinción HE): se debe estudiar el ganglio completo y debe ser cortado con bidisección en ganglios < 5 mm o cortes cada 2 mm en ganglios > 5 mm. No permite el estudio de la totalidad del GC por limitaciones inherentes al método. Un único corte de cada superficie con tinción de HE es suficiente19. Se pueden realizar más cortes seriados para detectar micrometástasis y GCA. Esta técnica plantea problemas de medida de las metástasis y se reconocen situaciones de solapamiento entre las diferentes categorías diagnósticas (TNM, AJCC 2018)20. Se recomienda cuando la CK19 sea negativa por inmunohistoquímica en el tumor primario no utilizar OSNA. La sensibilidad y especificidad es similar tanto en la cirugía primaria como tras la neoadyuvancia21–23.
-One-step- nucleic acid amplification (OSNA): es la técnica recomendable. Aunque se diseñó inicialmente para uso intraoperatorio, puede ser utilizada igualmente con carácter diferido, circunstancia a tener en cuenta dadas las modificaciones actuales en las indicaciones de linfadenectomía. Las principales ventajas y desventajas de OSNA se han descrito en el apartado de técnicas intraoperatorias. Para el estudio diferido OSNA, se conservan en congelación a -80°C los ganglios enteros o su lisado y se procesan tras descongelar y según el procedimiento habitual. Deben cumplirse los mismos requisitos que en la forma intraoperatoria (> 30% de CK 19 en el tumor primario e inclusión de la grasa peri-ganglionar para la evaluación de una posible infiltración extra-capsular).
Indicaciones biopsia diferida: casos considerados «de bajo riesgo» de metástasis ganglionar (ver definiciones).
Datos mínimos necesarios en el informe patológico:
- •
Número de GC extraídos.
- •
Lateralidad.
- •
Número de ganglios accesorios.
- •
Si marcaje o no.
- •
Carga tumoral total/ (número copias total de CK19/uL) o diámetro de la mayor metástasis).
- •
Rotura capsular (siempre que sea posible).
- •
Extensión infiltración extracapsular (en mm).
- •
Cambios post-quimioterapia (siempre que sea posible).
- •
Ratio número ganglios afectados/número ganglios total.
- •
Conclusión.
Se considera el valor clínico de las metástasis en 2 contextos distintos: el de la cirugía primaria y el de la TSP.
Metástasis ganglionar en cirugía primaria
➔ Micrometástasis (pN1mic): las metástasis ocultas tienen valor pronóstico independiente en las pacientes con BSGC negativo23. En los casos de tumores luminales, dado que el estado axilar «per se» puede tener menor valor predictivo para el beneficio a TSP que el subtipo intrínseco (especialmente en los carcinomas Luminal A), se recomienda considerar el uso de una plataforma génica para la toma de decisión terapéutica, más que basarla en el estado de la axila24.
➔ Macrometástasis (pN1): se considera un factor de mal pronóstico. Sin embargo, existen dudas sobre el impacto pronóstico de 2 ganglios macrometastásicos solo25.
La técnica OSNA ofrece una cuantificación reproducible y estandarizada del volumen de la metástasis y mediante el cálculo de la CTT se individualiza la probabilidad de más ganglios no centinela metastásicos así como el pronóstico, sin aparente impacto clínico si < 25.000 copias25,26.
Metástasis ganglionar en post-terapia sistémica primaria
Con base en los datos actuales, cualquier volumen metastásico en el GC post-TSP tiene peor pronóstico que los ypN(sn)0 y existe correlación entre el volumen tumoral del GC y el porcentaje de ganglios no-centinela afectos en la linfadenectomía27,28. Sin embargo, el manejo locoregional de estos pacientes está todavía por determinar (cirugía + RT o RT sola)29–31. Recientemente, se han publicado datos controvertidos sobre la necesidad de linfadenectomía axilar tras TSP con tumor residual en 1-2 ganglios axilares32 y se ha sugerido que la omisión de LAx en los pacientes con uno o 2 GC metastásicos, con CTT limitada y biología tumoral favorable tras TSP puede no comprometer el control locorregional ni la supervivencia33. Se necesitan estudios prospectivos para establecer una recomendación.
Por el momento, y a la espera de resultados definitivos de los estudios en marcha, la recomendación del Consenso es realizar la linfadenectomía axilar ante cualquier volumen de enfermedad ganglionar residual tras TSP (incluidas CTA y micrometástasis).
Respuesta patológica completa axilar (RpC): la respuesta completa axilar (ypN0) implica un buen pronóstico, incluso con tumor residual en la mama. El porcentaje de casos cN1 de inicio que se negativizan post-TSP (ypN0) puede llegar al 50-60%34.
Valor pronóstico de los signos de regresión post-TSPLos ganglios previamente metastásicos pueden regresar tras TSP y no dejar ningún signo histológico post-TSP. Los cambios en los ganglios asociados al tratamiento neoadyuvante (fibrosis, inflamación) pueden ser similares a los de la biopsia o a cambios reactivos no relacionados con el tratamiento35,36.
Sistemas de evaluación de respuesta a tratamiento neoadyuvanteEn los últimos años, se han unificado criterios para la definición de la respuesta patológica, que no necesariamente coinciden con la respuesta clínica y/o radiológica. Así, la OMS en su última edición y la AJCC en la 8ª edición del sistema de estadificación TNM20 define la respuesta patológica completa (RpC) como la ausencia de tumor infiltrante en mama y ganglios axilares. Cualquier afectación en los ganglios axilares invalida la RpC, incluidos los grupos tumorales aislados (GCA/CTA).
Los sistemas de gradación recomendados actualmente son: el sistema RCB (Residual Cancer Burden)37 y el sistema de Miller & Payne (M&P)38. La diferencia fundamental entre ambos es que el primero aporta información pronóstica a partir del estatus postratamiento y el sistema M&P aporta información de respuesta al tratamiento comparando el porcentaje de células tumorales en el tumor inicial con el del tumor residual tras TSP. Dado que la técnica OSNA no permite dar una medida exacta, en milímetros, del tamaño de la metástasis ganglionar para el cálculo de RCB, debe valorarse por el Comité de Mama la ventaja de una mayor sensibilidad, especificidad y estandarización del análisis OSNA del GC, frente a la imposibilidad del cálculo exacto de RCB en un porcentaje bajo de casos (mayoritariamente, casos cN0/cN1 negativizados)39.
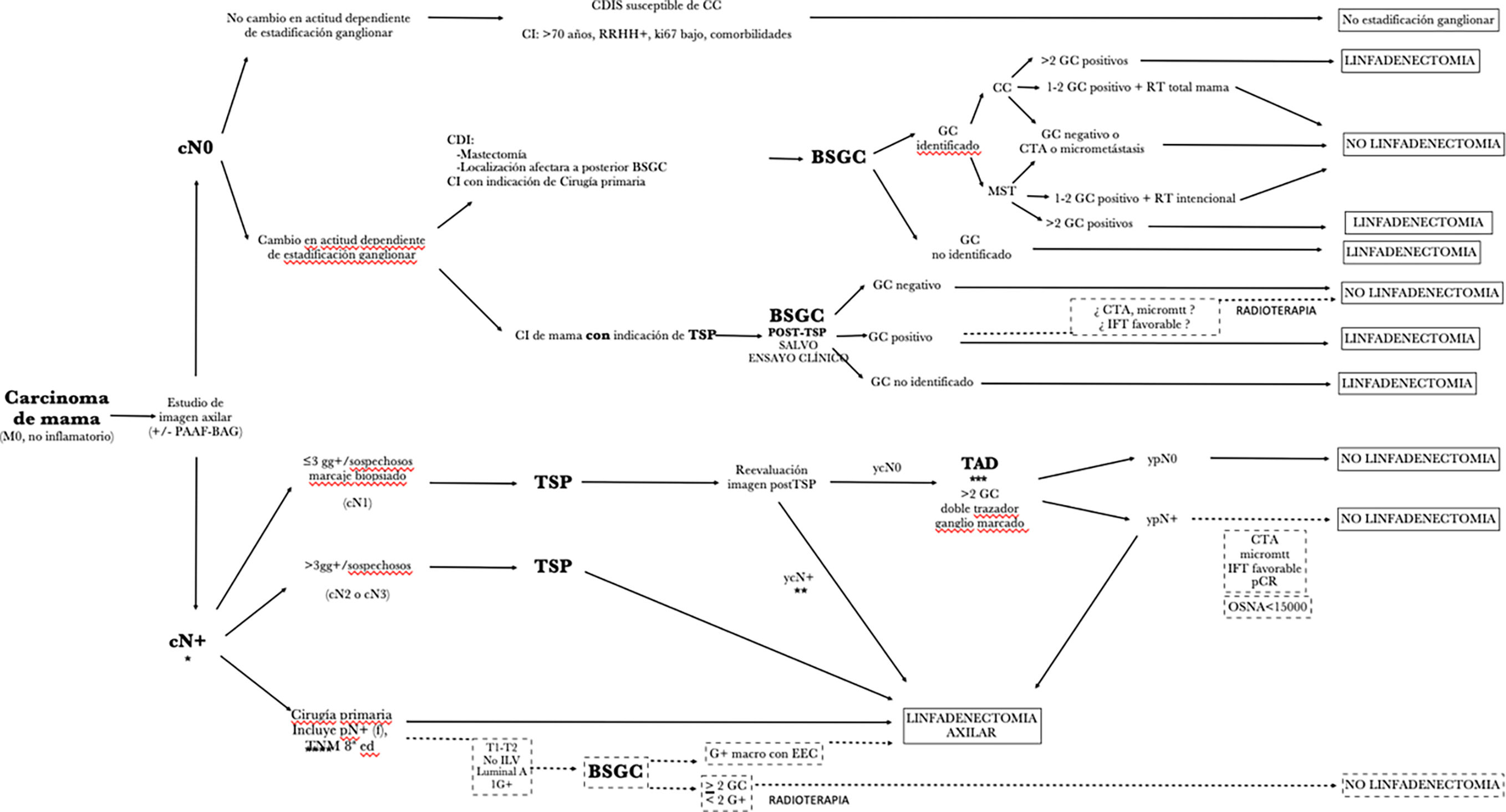
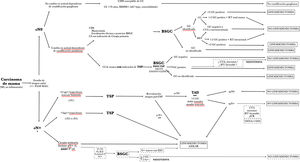
Recomendaciones en los distintos escenarios clínicos (fig. 2, tabla 2)ESCENARIO 1:casos sin evidencia de afectación ganglionar clínico-ecográfica (cN0) y de «bajo riesgo de afectación ganglionar», en los que conocer la estadificación ganglionar no cambia la actitud ni el pronóstico.
Líneas discontinuas: opciones en desarrollo, pero sin suficiente evidencia actual para poder indicarse fuera de los estudios de validación.
*: en caso de cN+ preTSP, si no se dispone de IHQ de la metástasis ganglionar y ante la necesidad de conocer las posibles discrepancias en el inmunofenotipo de la lesión primaria y la metástasis ganglionar, se debe realizar un estudio histológico convencional. Si se dispone de la IHQ de la metástasis ganglionar, puede utilizarse tanto la técnica convencional como la molecular OSNA.
**: en ycN+, se puede considerar la biopsia ecoguiada previa a considerar la linfadenectomía. Un diagnóstico de metástasis constituye indicación de linfadenectomía axilar. Si la biopsia es negativa para metástasis podría considerarse el caso ypN0 y tratarse con radioterapia.
***: En el caso de realizarse solo la BSGC (sin marcaje de ganglio metastásico) la técnica requiere el uso de un doble trazador y el estudio de, al menos, 3 ganglios centinelas.
****: incluye pN+(f) de la 8a edición de la TNM.
Indicaciones para la biopsia selectiva del ganglio centinela
| Criterios de indicación | Carcinomas infiltrantes: T1, T2 (evidencia alta, 1A) y personalizado T3 (evidencia 3), siempre que la axila sea clínica, ecográfica y patológicamente (si procede, ya sea citológica o histológicamente) negativa |
Carcinoma intraductal con:
| |
| Criterios de exclusión o contraindicación | Carcinoma inflamatorio: evidencia moderada, recomendación fuerte 1B |
| Infiltración axilar en ausencia de tratamiento sistémico primario (TSP) | |
| No constituyen criterios de contraindicación | Biopsia escisional previa: siempre que no aparezcan criterios de exclusión (evidencia baja, recomendación fuerte 1C) |
| Cirugía plástica mamaria de aumento o reducción previa | |
| Tumores multifocales y multicéntricos (evidencia 1) | |
| Radioterapia previa de mama y/o axila | |
| BSGC previa por carcinoma | |
| Mujeres gestantes o puérperas lactantes, previa retirada de la lactancia 24 h, utilizar la mínima dosis posible de radiotrazador, y aplicando «protocolo 1 día» (BSGC en el mismo día de la inyección). Contraindicación absoluta del uso de colorante | |
| TSP siempre que se cumplan las condiciones que se explican más adelante (escenarios 2b y 3) | |
| En el carcinoma de mama en el varón se siguen las mismas indicaciones que en la mujer. | |
BSGC: biopsia selectiva del ganglio centinela.
En estos casos, no existe indicación de BSGC. Corresponden a:
- •
Pacientes de muy bajo riesgo con comorbilidades relevantes40–44.
- •
Carcinomas intraductales (CDIS) con indicación de cirugía conservadora.
Son excepciones a esa norma los casos de CDIS con indicación de mastectomía y los tumores en localización anatómica que pueda comprometer la realización de una BSGC posterior.
Para las pacientes programadas para reconstrucción inmediata, se recomienda realizar la BSGC como un procedimiento independiente de la técnica de reconstrucción considerada.
La sobre-estadificación de CDIS a carcinoma infiltrante (CI) en la pieza quirúrgica ocurre en más del 20% de los casos43,45. Dependiendo del protocolo de cada centro, puede considerarse su indicación en casos con alta probabilidad de sobre-estadificación teniendo en cuenta que, ante cirugía conservadora, siempre es posible realizar la BSGC en un segundo procedimiento. En el meta-análisis de Ansari46, los criterios de riesgo de sobre-estadificación en la BAG fueron: diámetro > 4 cm, la edad joven, el alto grado, y la presencia de comedón. Utilizando la técnica OSNA, se detecta un 4% de metástasis frente al 0,3% de la congelación, la mayor parte de las cuales son micrometástasis47.
ESCENARIO 2: Casos sin evidencia de afectación ganglionar clínico-ecográfica (cN0) y en los que conocer la estadificación ganglionar cambia significativamente la actitud y el pronóstico.
En este escenario pueden darse 2 situaciones: ESCENARIO 2a ➔ cirugía primaria
- •
Indicación de la BSGC: casos de carcinomas infiltrantes T1-T3. En los tumores T3, se considera un procedimiento de estadificación factible y seguro en casos seleccionados, de acuerdo con alguna revisión sistemática reciente48.
Procedimiento de identificación y biopsia: el trazador de elección serían los radiocoloides. Si no existe migración en la linfogammagrafía se debe realizar una nueva administración del radiotrazador, mediante la vía complementaria a la utilizada en el primer procedimiento. Si tras la linfogammagrafía planar +/- SPECT/CT no se visualiza drenaje, debe plantearse el rastreo de la axila con sonda y/o imagen en quirófano.
Número de GC biopsiados: se recomienda extraer un número máximo de 3 GC. El último paso debe ser la exploración digital de la axila para la detección de ganglios sospechosos que no hayan concentrado radiotrazador.
En el caso de no migración del trazador y, por tanto, imposibilidad para identificar y biopsiar el GC, debe realizarse estadificación mediante LAx. En este contexto, pueden contemplarse excepciones en casos con baja probabilidad de afectación (CDIS con microinfiltración / upstaging, pacientes con comorbilidad).
Implicaciones clínicas del diagnóstico de la BSGC
- •
GC negativo o con CTA o micrometástasis: puede evitarse la linfadenectomía axilar y la radioterapia adyuvante49–52.
- •
GC con macrometástasis: la actitud dependerá de si la cirugía del tumor primario implica cirugía conservadora o mastectomía:
- •
Si se realiza una cirugía conservadora con radioterapia adyuvante de toda la mama y con terapia sistémica adyuvante, no es necesaria la LAx53, excepto en el caso de que haya 3 o más ganglios infiltrados en cuyo caso, independientemente del tamaño de la metástasis, se indicará LAx.
- •
Si se realiza una mastectomía con la presencia de metástasis en menos de 3 ganglios, permitiría evitar la LAx siempre y cuando se administre la radioterapia axilar con intención terapéutica (Criterios AMAROS y OTOASOR)54–56. Es fundamental evitar el sobretratamiento (o bien linfadenectomía axilar quirúrgica o bien linfadenectomía radical, pero en ningún caso las 2).
- •
En caso del estudio con OSNA, la CTT será el criterio decisorio para la indicación de LAx, independientemente del número de ganglios metastásicos16,17.
- •
ESCENARIO 2b ➔ casos cN0 con indicación de tratamiento pre-operatorio (TSP o radioterapia):
- -
Indicación de la BSGC:
- -
En el escenario de la TSP: exceptuando el carcinoma inflamatorio de mama, en el que la linfadenectomía y la radioterapia posterior a la misma son preceptivas, se indicará BSGC. En estos casos, se aconseja realizar la BSGC en el momento de la cirugía, tras la TSP, y puede realizarse en las mismas condiciones que en los casos de cirugía primaria57.
- -
En el escenario de radioterapia pre-operatoria: generalmente se utiliza en el contexto de estudios clínicos teniendo la BSGC el doble objetivo de asegurar la estadificación y adaptar los tratamientos locales posteriores58,59.
- •
Procedimiento de identificación y biopsia: en la BSGC post-TSP aplica la misma la técnica que la descrita en el escenario 2a. Igualmente, se ha demostrado que obtener más de 3 GC no confiere más información ni utilidad al procedimiento60–63.
- •
Implicaciones clínicas del diagnóstico de la BSGC
- -
La negatividad del/los GC permite evitar la LAx. La indicación de radioterapia ante mastectomía dependerá de la T inicial del sistema TNM de estadificación64,65.
- -
En el caso de GC positivo (macros, micros o ITC), se indica la LAx. Existe la opción de consultar nomogramas validados para individualizar los casos seleccionados en el Comité de Mama.
- -
ESCENARIO 3: casos con metástasis ganglionar de inicio y con indicación de TSP. Es imprescindible la confirmación de metástasis por BAG o PAAF para los ganglios con sospecha radiológica66.
Aunque actualmente no existe ningún estudio que haya demostrado la seguridad oncológica del procedimiento, se plantean las siguientes posibilidades:
- •
La existencia de ≤ 3 ganglios sospechosos y en los que se demuestra enfermedad en al menos uno de ellos (imprescindible la confirmación histológica), es factible intentar un rescate axilar tras el TSP. En este contexto, son posibles 2 actitudes57,67:
- •
La recomendada es la DAD (disección axilar dirigida).
- •
En caso de no ser posible la acción anterior, puede realizarse la BSGC con doble trazador (radiocoloide + colorante azul) y la biopsia de, al menos, 3 GC.
- •
- •
La sospecha de afectación en más de 3 ganglios o la evidencia de conglomerado adenopático (N2-N3) o evidencia de extensión extra-capsular en los estudios de imagen con confirmación histológica, indican la LAx posterior a la TSP, independientemente del grado de respuesta en tumor o axilar tras la revaluación.
Selección ecográfica de pacientes para la indicación de marcaje: se realizará fundamentalmente en los pacientes cN1 ecográfica, con 1 a 3 ganglios de sospecha en nivel I de Berg, sin conglomerados (los niveles de Berg ecográficos no son más que la traducción en ecografía de la anatomía quirúrgica de la axila, tomando como referencia el músculo pectoral menor, que puede identificarse ecográficamente sin dificultad).
En los tumores Her 2+, se valorará la posibilidad de ampliar la indicación de marcaje a los pacientes con hasta 4 ganglios de sospecha en nivel I sin conglomerados. En todo caso, se realizará marcaje único dirigido al ganglio de mayor sospecha morfológica previa con PAAF/BAG positiva (UN 5> UN4 > UN3), de mayor tamaño, y en localización más caudal (en el contexto de la TSP, solo se seleccionan los pacientes con ganglios de sospecha en nivel I y, dentro de ese nivel, se dirige la atención al más caudal). El marcaje del ganglio metastásico se realizará tras la biopsia del mismo64,67. Lo anterior es válido si el marcaje se hace con clip. Si se utiliza cualquiera de los otros métodos, se debe extirpar el ganglio marcado, sea o no metastásico, para su recuperación.
Reevaluación ecográfica de los pacientes para la indicación de DAD tras TSP: en espera de los resultados de estudios prospectivos en marcha, se considerará una respuesta adecuada para indicación de DAD:
- El cambio de morfología de sospecha UN4/UN5 a UN3.
- La normalización de grosor cortical por debajo de 3mm en casos UN3.
- El cambio de volumen significativo superior al 50% inicial, aún en ausencia de hilio graso (especialmente en los pacientes con perfil HER2+/TN).
Quedaría a criterio del Comité de Mama la confirmación de la respuesta mediante nueva PAAF/BAG en los casos de dudas de persistencia de la enfermedad ganglionar.
Procedimiento de identificación y biopsia67. Procedimiento de DAD: exéresis del ganglio marcado + BSGC
Referenciar y extirpar el ganglio metastásico: el marcaje del ganglio metastásico se realizará tras la biopsia del mismo, mediante clip metálico o marcador definitivo (tabla 3). En caso de usar exclusivamente semillas magnéticas o radioactivas para el marcaje del ganglio metastásico, también podría hacerse pre-TSP (estudios MARI, RISAS)68,69 a pesar de que en España no hay legislación clara sobre ello. Debe extirparse el ganglio marcado, coincida o no con el GC. Para la BSGC complementaria a la extirpación del ganglio marcado, no se considera necesario el uso de doble trazador. Si no es posible DAD, puede realizarse la BSGC con doble trazador (radiocoloide + colorante azul) y la biopsia de, al menos, 3 GC.
Características de semillas y dispositivos para localización y recuperación ganglionar y/o de lesiones mamarias
| Año introducción | Tamaño (mm) | Aguja (G) | Disponibilidad | Precisión | Profundidad detección | Riesgo migración | Interferencias quirúrgicas | Tiempo de retirada (días) | Artefacto RMN | Uso combinado BSGC / TAD | Precio | Riesgo desactivado | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Semillas radiactivas | 1999 | 4,5 mm | 18G | ++ | +/- 1mm | > 100 mm | No | No | 30a | Mínimo | Sí | + | + |
| Reflector de radar | 2014 | 12 mm | 16G | +++ | +/- 1mm | 60 mm | + | + | Sin limb | Mínimo | Sí | +++ | ++ |
| Semillas magnéticas | 2016 | 5mm | 18G | +++ | < 10mm | 30-40mm | No | +++ | Sin limb | Sí (4 cm) | Sí | +++ | |
| Semillas radiofrecuencia (RFID) | 2017 | 10mm | 12G | +++ | +/- 1mm | 30-60mm | ++ | No | 30 | Sí (2 cm) | Nob | +++ | ++ |
BSGC/TAD: biopsia selectiva del ganglio centinela/disección axilar dirigida.
El estado del ganglio marcado tras TSP es el indicador más fiable de respuesta en la axila y su estudio mejora la tasa de falsos negativos respecto a los resultados de la BSGC post-TSP sin marcaje.
El marcador debe dejarse en el centro del ganglio para disminuir la probabilidad de «expulsión» tras la respuesta a la TSP. El marcaje del ganglio desde el inicio con el método que vaya a guiar la cirugía posterior ahorra un procedimiento. La recuperación del ganglio en estos casos es próxima al 100%. La tasa de fracasos en la localización del marcador inicial en el tiempo prequirúrgico está en torno al 10%, por lo que se recomienda utilizar marcadores que no pierden visibilidad con el tiempo. No obstante, las diferencias no parecen alcanzar significación estadística.
Se han descrito diferentes métodos de marcaje pre-TSP. El tatuaje de los ganglios permite su visualización directa durante la cirugía a costa de disecciones más amplias, con tasas de recuperación en torno al 90%. Marcar el ganglio metastásico con clip metálico y posterior cirugía ecoguiada requiere un elevado grado de entrenamiento con resultados diversos. Por otro lado, estos coils/marcadores (arpón, semilla 1.25l, semillas magnéticas, dispositivos de radiofrecuencia o infrarrojos) pueden servir de guía para un segundo marcaje. El desplazamiento del coil/marcador en la grasa perinodal circundante y en el tejido fibroso (secundario al encogimiento del ganglio tras TSP) puede ser un factor que dificulte la localización por ecografía para el segundo marcaje. Estas limitaciones han estimulado el interés por desarrollar nuevos métodos que no requieran un segundo procedimiento de localización61,70,71. En la tabla 3, se recogen las principales características de los distintos dispositivos de localización. No parecen existir diferencias en la precisión.
- •
Implicaciones clínicas del diagnóstico de la BSGC: la negatividad de los GC y del ganglio marcado (que puede coincidir o no con un GC) tras TSP (ypN0) permitiría evitar la LAx, mientras que la evidencia de cualquier volumen de enfermedad ganglionar post-TSP es indicación, actualmente, de la misma29,64,72,73. No obstante, existen evidencias (nivel II y III), tanto utilizando el método diagnóstico histológico64,74, como la técnica OSNA75 para evitar la LAx en los casos con factores favorables (CTA, micrometástasis, pCR en la mama, inmunofenotipo luminal A) por lo que ello podría considerarse, en casos seleccionados y tras discusión por el grupo multidisciplinar.
ESCENARIO 4: recidiva o segundo nuevo cáncer ipsi-lateral
No son contraindicación para una segunda BSGC. Es requisito indispensable que haya drenaje en la linfogammagrafía (en la axila ipsilateral o en la contralateral o en ganglios extra-axilares), tanto en los casos con antecedente de cirugía conservadora como de mastectomía previa. En los casos de LAx previa, si no se visualiza nuevo drenaje, no se indica la BSGC.
Si no existe antecedente de LAx, se actuará como en el escenario 275–78.
Existen estudios que muestran parámetros exitosos de la BSGC en los pacientes con recidivas79–81. Los estudios Sentinel Node and Recurrent Breast Cancer (SNARB) mostraron que la repetición de la BSGC no muestra un impacto sobre la supervivencia, aunque sus hallazgos justifican una validación con un estudio prospectivo más amplio82.
ESCENARIO 5: situaciones especiales
- -
Tumor filodes: se recomienda realizar escisión amplia sin estadificación de la axila83
- -
Paget de la mama: se realizará BSGC siempre que haya un carcinoma infiltrante subyacente demostrado histológicamente. En caso de CDIS, ver indicaciones (tabla 1)84,85.
- -
Drenaje exclusivo a cadena mamaria interna86: debe realizarse reinyección por vía complementaria para intentar poner de manifiesto un drenaje axilar. La principal justificación o indicación para biopsiar el GC de cadena mamaria interna es: pacientes < 70 años y tumores > 15 mm, sopesando la cardiotoxicidad de la irradiación adyuvante de MI frente al beneficio de supervivencia87.
- -
Actitud a seguir:
- -
Si BSGC positiva: indicación de irradiación ganglionar (IG) y de cadena mamaria interna (CMI) y niveles axilares I-IV salvo contraindicación por otras causas.
- -
Si BSGC negativa: sin indicación de IG de CMI excepto en los pacientes pN0 de alto riesgo.
- -
Si BSGC no realizada/no concluyente: valorar IG de CMI y niveles axilares en los pacientes de alto riesgo (tabla 3).
- -
- -
Metástasis confirmada en ganglio intramamaria con axila ecográficamente negativa.
- -
El conocimiento de metástasis en ganglio intramamario no invalida la realización de la BSGC. Siempre se debe extirpar el ganglio intramamario afectado (en caso de cirugía conservadora). En caso de no migración del trazador a la axila, se debe reinyectar el trazador subareolar o subdérmico en busca de un GC axilar.
La irradiación ganglionar en el cáncer de mama incluye los niveles axilares I, II III y el IV o supraclavicular55,56. Se hacen constar los casos en que sea necesario tener en cuenta la cadena mamaria interna ipsilateral. En caso de linfadenectomía axilar suficiente (10 o más ganglios) se evitará la irradiación de los niveles I y II, salvo raras excepciones (por ejemplo: adenopatía voluminosa).
Irradiación ganglionar
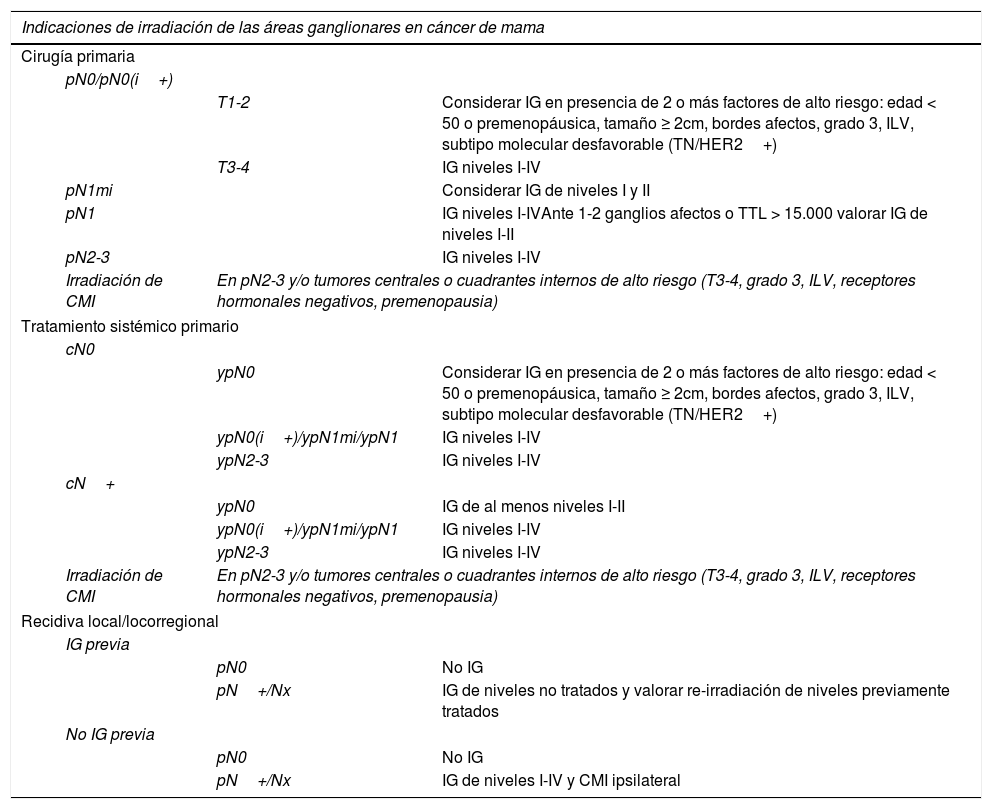
| Indicaciones de irradiación de las áreas ganglionares en cáncer de mama | |||
|---|---|---|---|
| Cirugía primaria | |||
| pN0/pN0(i+) | |||
| T1-2 | Considerar IG en presencia de 2 o más factores de alto riesgo: edad < 50 o premenopáusica, tamaño ≥ 2cm, bordes afectos, grado 3, ILV, subtipo molecular desfavorable (TN/HER2+) | ||
| T3-4 | IG niveles I-IV | ||
| pN1mi | Considerar IG de niveles I y II | ||
| pN1 | IG niveles I-IVAnte 1-2 ganglios afectos o TTL > 15.000 valorar IG de niveles I-II | ||
| pN2-3 | IG niveles I-IV | ||
| Irradiación de CMI | En pN2-3 y/o tumores centrales o cuadrantes internos de alto riesgo (T3-4, grado 3, ILV, receptores hormonales negativos, premenopausia) | ||
| Tratamiento sistémico primario | |||
| cN0 | |||
| ypN0 | Considerar IG en presencia de 2 o más factores de alto riesgo: edad < 50 o premenopáusica, tamaño ≥ 2cm, bordes afectos, grado 3, ILV, subtipo molecular desfavorable (TN/HER2+) | ||
| ypN0(i+)/ypN1mi/ypN1 | IG niveles I-IV | ||
| ypN2-3 | IG niveles I-IV | ||
| cN+ | |||
| ypN0 | IG de al menos niveles I-II | ||
| ypN0(i+)/ypN1mi/ypN1 | IG niveles I-IV | ||
| ypN2-3 | IG niveles I-IV | ||
| Irradiación de CMI | En pN2-3 y/o tumores centrales o cuadrantes internos de alto riesgo (T3-4, grado 3, ILV, receptores hormonales negativos, premenopausia) | ||
| Recidiva local/locorregional | |||
| IG previa | |||
| pN0 | No IG | ||
| pN+/Nx | IG de niveles no tratados y valorar re-irradiación de niveles previamente tratados | ||
| No IG previa | |||
| pN0 | No IG | ||
| pN+/Nx | IG de niveles I-IV y CMI ipsilateral | ||
CMI: cadena mamaria interna; IG: irradiación ganglionar; ILV: infiltración linfovascular.
Tras la cirugía primaria88–92: incluye la mastectomía y la cirugía conservadora seguida de BSGC o linfadenectomía teniendo en cuenta los siguientes supuestos:
➔ pN0, pN0(i+)
- •
T1-T2 podría valorarse la irradiación ganglionar en caso de factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos.
- •
T3. Considerar la irradiación ganglionar.
- •
T4. Indicación de irradiación ganglionar.
➔ pN1mic: Considerar la irradiación ganglionar: puede valorarse la irradiación exclusiva de los niveles I y II.
➔pN1: indicación de irradiación ganglionar.
En caso de 1-2 ganglios positivos, o TTL < 15.000 con el estudio con la técnica OSNA, puede valorarse la irradiación exclusiva de los niveles I y II en casos de bajo riesgo (ver definiciones).
Valorar irradiación de la mamaria interna ipsilateral en los tumores centrales o de cuadrantes internos y factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos o T3-T4.
➔pN2-3: indicación de irradiación ganglionar. Considerar la inclusión de la cadena mamaria interna ipsilateral.
Tras tratamiento sistémico primario93–95: incluye la mastectomía y la cirugía conservadora seguidas de BSGC o linfadenectomía. Se consideran 2 escenarios: ganglios previos negativos (por imagen o punción) o positivos (en este caso siempre confirmados por punción o biopsia).
▪Ganglios previos negativos
➔ ypN0: podría valorarse la irradiación ganglionar en caso de factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos o T3-4.
➔ypN0 (i+), ypN1mic e ypN1: indicación de irradiación ganglionar. Valorar la inclusión de la mamaria interna ipsilateral en caso de factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos o T3-4.
➔ypN2-3: indicación de irradiación ganglionar. Considerar la inclusión de la cadena mamaria interna ipsilateral.
▪Ganglios previos positivos
Indicación de irradiación ganglionar: valorar la irradiación exclusiva de los niveles I y II. Únicamente se podría omitir la irradiación ganglionar en el contexto de un ensayo clínico.
➔ypN0 (i+), ypN1mic e ypN: indicación de irradiación ganglionar. Valorar la inclusión de la mamaria interna ipsilateral en caso de factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos o T3-4.
➔ypN2-3: indicación de irradiación ganglionar. Considerar la inclusión de la cadena mamaria interna ipsilateral.
Se contemplan 2 escenarios, con irradiación ganglionar previa o sin ella.
▪Irradiación ganglionar previa97–99
- -
pN0:sin indicación de irradiación ganglionar
- -
pN+/pNx: el tratamiento deberá ser personalizado. La indicación de irradiación ganglionar irá en función de la localización de la recaída, si está en territorio previamente irradiado o no y de la factibilidad de una resección quirúrgica.
De manera global, se contempla la realización de radioterapia con intención radical de aquellas áreas que no hubieran sido irradiadas previamente, como puede suceder en algunas pacientes con los niveles ganglionares IV o cadena mamaria interna ipsilateral, así como la reirradiación en aquellas áreas que lo hubieran sido previamente.
- -
▪No irradiación ganglionar previa
- -
pN0: no indicación de irradiación ganglionar. pN+/pNx. Si se realizó linfadenectomía reglada previa de niveles I/II, el objetivo de esta segunda cirugía será solo extirpar los ganglios afectos, mientras que, si se realizó exclusivamente BSGC o una linfadenectomía dirigida y limitada, se deberá completar la linfadenectomía de niveles I y II. Se recomienda radioterapia de las áreas ganglionares niveles III,IV y la cadena mamaria interna ipsilateral.
- -
En las ocasiones en que los ganglios no puedan ser resecados se recomienda la realización de sobredosificación de estas áreas tumorales macroscópicas.
Radioterapia primaria concomitante con quimioterapia58,59
Generalmente se utiliza en el contexto de un estudio clínico. La mayoría de estudios que analizan la radioterapia preoperatoria se han realizado en los pacientes con tumores localmente avanzados, en los que el volumen de irradiación comprende la mama y las cadenas ganglionares, por lo que la BSGC no se contempla de manera rutinaria. Sin embargo, estudios en marcha que utilizan estos protocolos contemplan la realización de BSGC de forma previa con el doble objetivo de asegurar la estadificación y adaptar los tratamientos locales posteriores, también se plantea la realización de irradiación parcial acelerada que exige la necesidad de una estadificación ganglionar negativa. Se contemplan 2 escenarios:
- •
cN0 y BSGC negativa o PET negativo: solo estaría indicada la irradiación ganglionar en los casos de T3/T4 o en tumores superiores a 2 cm con factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos.
- •
cN1 con confirmación citológica o histológica o BSGC positiva o PET positivo: indicada la irradiación ganglionar. Valorar la inclusión de la mamaria interna ipsilateral en caso de T3/T4 o en tumores superiores a 2 cm con factores de alto riesgo como grado III, infiltración linfovascular, premenopausia, receptores hormonales negativos o T3-4.
Técnica, dosis y fraccionamiento100,101
La irradiación ganglionar en el cáncer de mama incluye los niveles axilares I, II III, el supraclavicular o IV axilar y la cadena mamaria ipsilateral.
Debe valorarse la irradiación en inspiración profunda mantenida (breath-hold) en las pacientes con afectación de la mama izquierda. No se recomienda la técnica de «high-tangents», sino la dosimetría individualizada adaptando la mejor técnica disponible, incluidas IMRT o VMAT.
Las dosis recomendadas son las mismas que para la mama o la pared torácica, es decir 40,05 Gy en 15 fracciones (2,67 Gy/f). El esquema ultrafraccionado de 5 fracciones, totalmente justificado para la irradiación de mama o de pared torácica, por el momento no puede considerarse estándar para la irradiación ganglionar. En caso de necesidad de sobredosificación ganglionar, esta puede realizarse de forma concomitante. El esquema clásico de 50 Gy en 25 fracciones no debería ser utilizado.
La dosis total y el fraccionamiento empleados para la reirradiación deberán ser individualizadas teniendo en cuenta el tratamiento previo y el tiempo transcurrido. No existe contraindicación para la utilización de fraccionamientos acelerados. En estos casos puede valorarse la utilización de haces de protones.
FinanciaciónNinguno de los autores ha recibido financiación para este trabajo.
Consideraciones éticasLos autores declaran que han seguido los protocolos y guías de su centro de trabajo sobre la publicación de datos de los pacientes.
Conflicto de interésTodos los autores declaran no tener ningún conficto de intereses.
AgradecimientosJuan María De la Cámara de las Heras, Biblioteconomista del Hospital de La Ribera, Alzira.
Jose Aguilar Jiménez. Unidad de Cirugía General, Hospital Universitario La Fe, Valencia, España
Miguel Chiva. Unidad Radiodiagnóstica, Hospital Ramón y Cajal, Madrid, España
Alicia Córdoba. Unidad de Patología Hospital Universitario de Navarra, Pamplona, España
Sheila de la Torre Fernández. Unidad de Medicina Nuclear, Hospital de Torrejón, Madrid, España
José Ferrer Rebolleda. Unidad de Medicina Nuclear ASCIRES, Hospital General,Valencia, España
Amanda Flaquer. Unidad de Oncología Radioterápica, Hospital Universitario de Araba, Vitoria, España
Julia Giménez Climent. Unidad de Cirugía General, Instituto Valenciano de Oncología, Valencia, España
Amparo González. Unidad de Oncología Radioterápica, Hospital General de Valencia, España
Elena Goñi Gironés. Unidad de Medicina Nuclear, Hospital Universitario de Navarra, España
Salomón Menjón Beltrán. Unidad de Ginecología, Hospital Virgen de las Nieves, Granada, España
Antonio Mariscal. Unidad de Radiodiagnóstico, Hospital Universitari Germans Trias i Pujol, Barcelona, España
Ángel Montero. Unidad de Oncología Radioterápica, Hospital HM Sanchinarro, Madrid,España
Ricardo Pardo García. Consultant Oncoplastic Breast Surgeon, Royal Bolton NHS Foundation Trust, Inglaterra
Vicente Peg. Unidad de Patología, Hospital Universitario de La Vall d’Hebrón, Barcelona, España
Maria Jesús Pla Farnós. Unidad de Ginecología, Hospital Universitari de Bellvitge, Barcelona, España
José Luis Raya. Unidad de Radiodiagnóstico, Hospital Reina Sofía de Córdoba, Córdoba, España
Juan Ignacio Rayo Madrid. Unidad de Medicina Nuclear, Complejo Hospitalario de Badajoz, Bajadoz, España
Maria Eugenia Rioja Martin. Unidad de Medicina Nuclear, MD Anderson Cancer Center, Madrid, España
Jose Ignacio Sánchez Méndez. Unidad de Ginecología, Hospital Universitario La Paz, Madrid, España
Irene Vicente Zapata. Unidad de Radiodiagnóstico, Hospital Ramón y Cajal, Madrid, España
Begoña Vieites. Unidad de Patología, Hospital Universitario Virgen del Rocío, Sevilla, España
Isabel Villanego. Unidad de Oncología Radioterápica, Hospital Puerta del Mar, Cádiz, España