revisar y evaluar los metaanálisis sobre la tomosíntesis digital para el cribado del cáncer de mama.
Métodosse realizó una revisión sistemática de los estudios de metaanálisis utilizando los términos de búsqueda «Digital breast tomosynthesis for breast cancer screening» en las bases de datos PubMed y Embase. Los metaanálisis finalmente seleccionados se calificaron con la herramienta de evaluación AMSTAR 2.
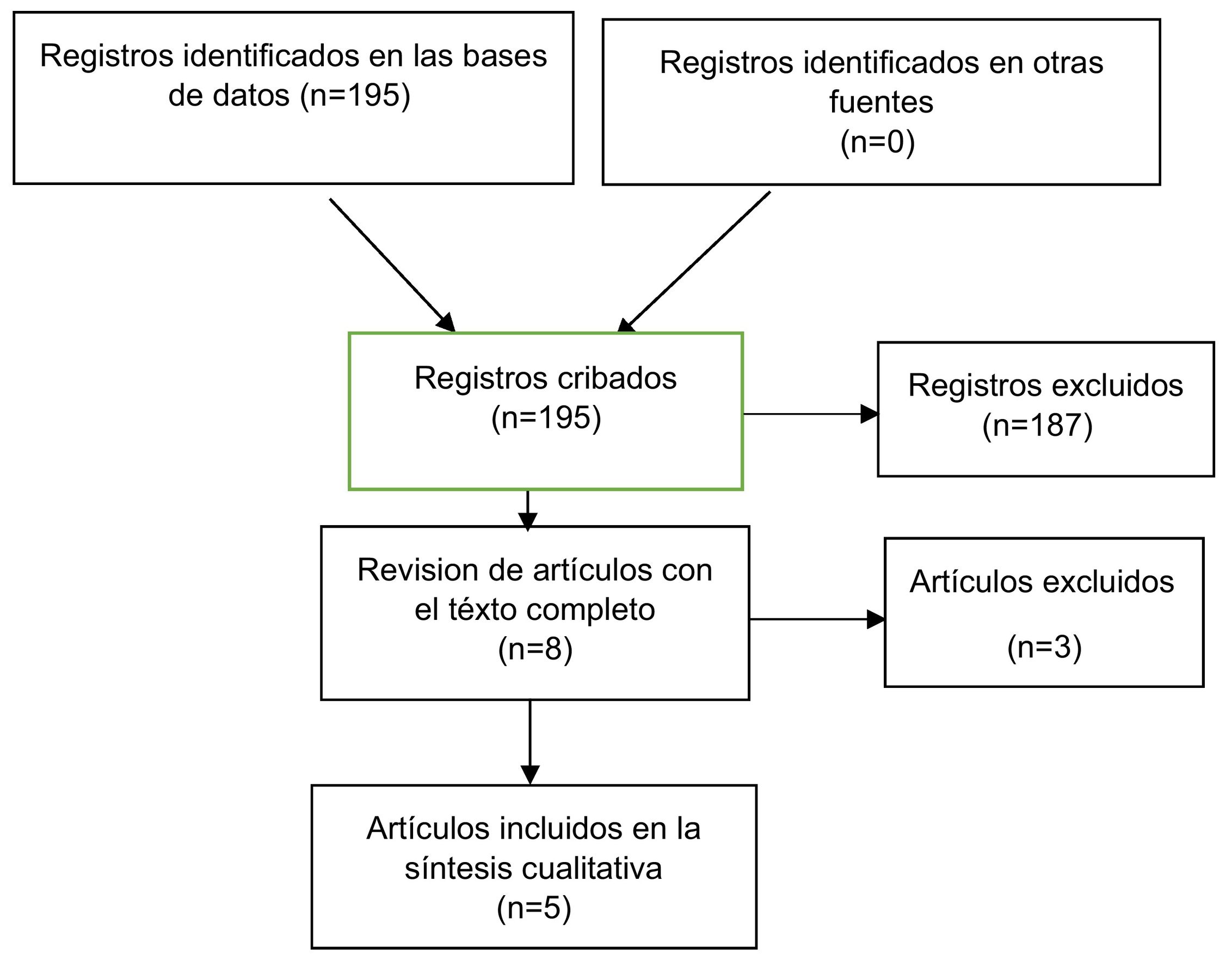
Resultadoslas búsquedas en las bases de datos encontraron 195 artículos de los cuales, después del cribado y la lectura completa de los artículos seleccionados, finalmente se extrajeron 5 para análisis cualitativo. La calificación de los metaanálisis revisadoscon la herramienta de evaluación AMSTAR 2 encontró que la confianza general de sus resultados es críticamente baja.
Conclusioneslos metaanálisis evaluados concluyeron en que hay un aumento en la tasa de detección del cáncer con la inclusión de la tomosíntesis digital en el cribado del cáncer de mama. Sin embargo, este estudio encontró con el uso de la herramienta de evaluación AMSTAR 2, que los resultados de los metaanálisis evaluados, no son confiables en el resumen que hacen de sus estudios.
To review and evaluate meta-analyzes on digital tomosynthesis for breast cancer screening.
MethodsA systematic review of meta-analyzes studies was undertaken using the search terms “Digital breast tomosynthesis for breast cancer screening” in PubMed and Embase databases. The finally selected meta-analyzes were rated with the AMSTAR 2 assessment tool.
ResultsThe database searches found 195 articles of which after screening and full readings of articles selected, five of them were finally extracted for qualitative analysis. The rating of the meta-analyzes reviewed with the AMSTAR 2 assessment tool found the overall confidence of their results is critically low.
ConclusionsThe meta-analyzes evaluated concluded that there is an increase in the cancer detection rate with the inclusion of digital tomosynthesis in breast cancer screening. However, this study found with the use of the AMSTAR 2 evaluation tool that the results of the evaluated meta-analyzes are not reliable in the summary they make of their studies.
El cáncer de mama es la neoplasia maligna que con más frecuencia se diagnostica en las mujeres (2,1 millones de casos nuevos en 2018) y también su principal causa de muerte por cáncer en el mundo (627.000 muertes)1. En el abordaje preventivo de las mujeres con riesgo promedio para cáncer de mama existen varias estrategias, algunas de las cuales tienen que ver con disminuir los factores de riesgo modificables y estimular los factores protectores mediante cambios en los estilos de vida2. Sin embargo, a pesar de que estos cambios resultan útiles en la promoción de la salud, son factores que no se encuentran en la mayoría de los cánceres de mama, por lo que el mayor impacto poblacional se logra con acciones de prevención secundaria mediante el desarrollo de programas de cribado, cuyo objetivo es el detectar la enfermedad en una etapa temprana que permita disponer de tratamientos efectivos para mejorar sus resultados3,4.
La mamografía es la modalidad de cribado más utilizada para la detección del cáncer de mama por su disponibilidad, control de calidad definido, soporte de estudios prospectivos aleatorizados5,6 y la experiencia de su aplicación poblacional. En una revisión independiente de 11 estudios controlados aleatorizados se encontró una reducción de la mortalidad por cáncer de mama de aproximadamente el 20%7. Pero también, se deben reconocer sus limitaciones, tanto en el rendimiento diagnóstico como en la posibilidad de obtener resultados perjudiciales, incluida la detección de cánceres clínicamente insignificantes que no representan una amenaza para la vida (sobrediagnóstico)8. Por lo tanto, se evalúan otras tecnologías que puedan superar estas desventajas. Un recurso tecnológico evaluado es la tomosíntesis digital de la mama. Su aplicación puede superar algunas de las limitaciones de la mamografía en 2 dimensiones (2D), como son los resultados falsamente positivos causados por la superposición del tejido y las interpretaciones falsamente negativas debido a la baja sensibilidad de la mamografía 2D en las mujeres con tejido mamario denso superpuesto9–11. Múltiples estudios muestran que la tomosíntesis digital de mama más la mamografía digital aumentan la tasa de detección del cáncer y pueden reducir la tasa de llamados adicionales (llamado para tomar más exámenes)12–15, especialmente en el caso de lesiones no neoplásicas (rango de 6-67%)16,17 con el consecuente descenso en la ansiedad de la paciente, el costo e irradiación por imágenes adicionales, lo cual la hace atractiva en el cribado del cáncer de mama12. Sin embargo, se debe considerar un balance adecuado de sus ventajas y desventajas. Al respecto, existe una preocupación sobre su capacidad de detección y la caracterización de microcalcificaciones. Estas pueden no percibirse fácilmente en una imagen de corte o ser de difícil interpretación. Otros desafíos incluyen los costos adicionales, el tiempo de interpretación y también existe la preocupación por la dosis de radiación. Pero de otro lado, pueden evitarse biopsias innecesarias en los pacientes con enfermedades benignas16,17.
La tomosíntesis digital de la mama es una técnica de imágenes tridimensional que produce imágenes en múltiples ángulos durante un corto escaneo. En ella, el tubo de rayos X se mueve a través de un ángulo de arco limitado consiguiendo una serie de imágenes que se reconstruyen en una serie de cortes delgados de alta resolución, que se pueden visualizar separadamente o en un modo dinámico18.
Para evaluar la evidencia sobre la tomosíntesis digital en el cribado para cáncer de mama, se han realizado varios metaanálisis. Los que se extrajeron mediante el proceso de revisión sistemática se presentan y califican en este estudio con la herramienta AMSTAR 2. Esta herramienta permite la evaluación crítica de las revisiones sistemáticas que incluyen estudios aleatorizados o no aleatorizados, así como aquellos con ambos diseños en intervenciones sanitarias19 (anexo 1).
MétodosSe realizó una búsqueda de publicaciones utilizando los términos «Digital breast tomosynthesis for breast cancer screening» en las bases de datos PubMed y Embase con el filtro de metaanálisis. El autor y otro revisor examinamos de forma independiente el título y el resumen de las publicaciones identificadas, acordando previamente leer el artículo completo en caso de discrepancia para decidir mutuamente sobre su selección. Los artículos escogidos en este cribado fueron estudiados por el autor con el artículo completo, determinando su relevancia para la revisión, y los que finalmente fueron extraídos, se clasificaron con la herramienta de evaluación AMSTAR 2. Este instrumento considera que todos sus pasos son importantes, pero que 7 de ellos pueden afectar de manera crítica la validez de una revisión y sus conclusiones. Estos ítems corresponden a la existencia de un protocolo registrado antes del comienzo de la revisión, la búsqueda bibliográfica adecuada, la justificación de la exclusión de cada uno de los estudios con esta decisión, el riesgo de sesgo de cada estudio incluido en la revisión, la idoneidad de los métodos del metaanálisis, la consideración del riesgo de sesgo al interpretar los resultados de la revisión y la evaluación de la presencia y el posible impacto del sesgo de la publicación19.
La base de este estudio son metaanálisis publicados que no individualizan a las personas en los grupos de comparación, por lo cual se considera que es una investigación sin riesgo. Este tipo de estudio no precisa la valoración por ningún comité ético.
ResultadosLas búsquedas en las bases de datos encontraron 195 artículos. Todos ellos fueron tamizados, excluyendo 187 por no cumplir con el criterio de metaanálisis sobre el uso de tomosíntesis digital para el cribado del cáncer de mama. Se eligieron 8 publicaciones para la revisión completa por parte del autor, de las cuales finalmente se extrajeron 5 para análisis cualitativo y evaluación con el instrumento AMSTAR 2 (fig. 1).
Las exclusiones decididas después de revisar los textos completos, se debieron a que Alabousi et al.24 combinaron resultados de cribado y diagnóstico; Marinovich et al.9 incluyeron a pacientes con diagnóstico reciente de cáncer de mama; y Lei et al.25 evaluaron el rendimiento diagnóstico de la tomosíntesis digital de mama y la mamografía digital para las lesiones benignas y malignas.
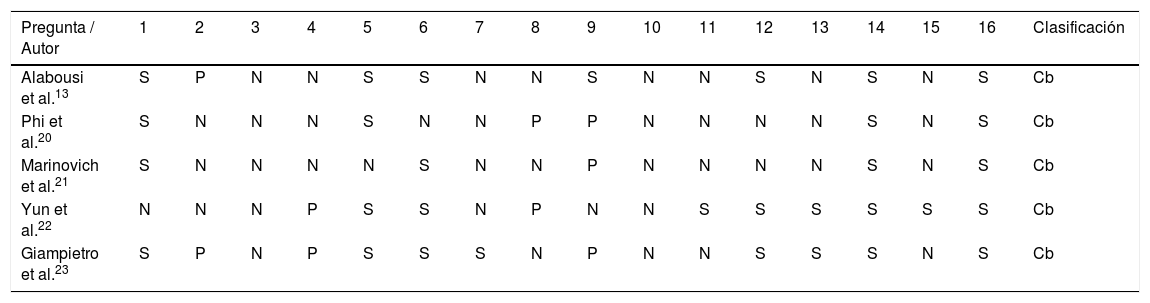
En la tabla 1 se presentan los resultados de los estudios incluidos. La calificación de los ítems en los estudios analizados con la herramienta de evaluación AMSTAR 2 se presentan en la tabla 2.
Resultados en detección de cáncer y llamadas adicionales con el uso en el cribado para cáncer de mama de la tomosíntesis digital comparada con la mamografía; intervalo de confianza del 95%
| Detección de cáncer | Llamadas adicionales | Descripción | |
|---|---|---|---|
| Alabousi et al.13 | 6,36 (5,62–7,14), p < 0,001 | 64,6 (55,5–74,4), p = 0,09 | TDM+MD; tasa x 1.000 |
| Phi et al.20 | RR = 1,33 (1,20–1,47) | RR = 0,72 (0,64–0,80) | TDM±MD |
| Marinovich et al.21 | TAA = 1,6 (1,1-2,0), p < 0,001 | RAC= –2,2% (–3,0 a –1,4) p < 0,001 | TAA= tasa x 1.000 |
| Yun et al.22 | RR = 1,327 (1,168-1,508) | NR | TDM+MD |
| Giampietro et al.23 | RR 1,36 (1,18-1,58) | RR= 1,13 (0,96-1,32) | TDM+MD |
MD= mamografía digital; NR= no reportadas; RAC= reducción absoluta agrupada; RR= riesgo relativo; TAA= tasa de aumento agrupada; TDM= tomografía digital de mama.
Evaluación de cada pregunta en los metaanálisis revisados con el instrumento de evaluación crítica para revisiones AMSTAR 2
| Pregunta / Autor | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | Clasificación |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alabousi et al.13 | S | P | N | N | S | S | N | N | S | N | N | S | N | S | N | S | Cb |
| Phi et al.20 | S | N | N | N | S | N | N | P | P | N | N | N | N | S | N | S | Cb |
| Marinovich et al.21 | S | N | N | N | N | S | N | N | P | N | N | N | N | S | N | S | Cb |
| Yun et al.22 | N | N | N | P | S | S | N | P | N | N | S | S | S | S | S | S | Cb |
| Giampietro et al.23 | S | P | N | P | S | S | S | N | P | N | N | S | S | S | N | S | Cb |
Cb= críticamente bajo; N= no; P= parcialmente sí; S= sí.
En el metaanálisis de Alabousi et al. la tasa de detección de cáncer fue más alta en la tomosíntesis digital de mama y la mamografía digital combinadas (6,36 por 1.000 examinadas, IC del 95% = 5,62 a 7,14, p < 0,001), en comparación con la mamografía digital sola (4,68 por 1.000 examinadas, IC del 95% = 4,28 a 5,11). También fueron mayores, la tasa de detección de cáncer invasivo (4,53 por 1.000 examinadas, IC del 95% = 3,97 a 5,12, p = 0,003 en comparación con la mamografía digital sola (3,42 por 1.000 examinadas, IC del 95% = 3,02 a 3,83) y el valor predictivo positivo (10,0%, IC del 95% = 8,0 a 12,0%, p = 0,004), mientras que no se detectaron diferencias con la tomosíntesis digital sola (7,0%, IC del 95% = 6,0 a 8,0%, p = 0,75) comparada con la mamografía digital sola (7,0%, IC del 95,0% = 5,0 a 8,0%)13.
Phi et al. en un metaanálisis de 11 estudios de cribado, 8 con grupo de comparación; encontraron que la tomosíntesis digital de mama con o sin mamografía digital aumentó la tasa de detección de cáncer en comparación con la mamografía digital sola (en 6 estudios considerados con datos homogéneos, I2 = 0%), (RR: 1,33; IC del 95%: 1,20–1,47). La tasa de llamadas adicionales en los estudios altamente heterogéneos se redujo significativamente con la tomosíntesis digital de mama (RR = 0,72, 95% CI 0,64–0,80)20.
Marinovich et al. compararon la tasa de detección de cáncer y la tasa de llamadas adicionales para la tomosíntesis digital de mama con o sin mamografía digital frente a la mamografía 2D en las pruebas con diseños con y sin apareamiento. La tasa agrupada de aumento en la detección de cáncer con tomosíntesis (cánceres adicionales detectados) fue de 1,6 cánceres por 1.000 examinadas (IC del 95%: 1,1 a 2,0, p < 0,001, I2 = 36,9%), con una tasa menor de llamadas adicionales, estadísticamente significativa, en comparación con la mamografía 2D (reducción absoluta agrupada = –2,2%, IC del 95% = –3,0 a –1,4, p < 0,001, I2 = 98,2%)21.
Yun et al. en 11 estudios de cribado incluidos, evaluaron el beneficio de agregar tomosíntesis digital de mama a la mamografía digital en comparación con la mamografía digital sola para la detección del cáncer de mama, centrándose en las características del cáncer. Los riesgos relativos mostraron una mayor detección de cáncer invasivo con la combinación que con mamografía digital sola (1,327; IC del 95%, 1,168-1,508), estadio T1 (1,388; IC del 95%, 1,137-1,695), ganglios negativos (1,451; IC del 95%, 1,209–1,742), grado histológico (grado I: 1,812, IC del 95%, 1,372–2,393; I2 = 0%; grado II/III, 1,403, IC del 95%, 1,174–1,676; I2 = 0%) y los tipos histológicos de cáncer invasivo (ductal = 1,437, IC del 95%, 1,189–1,737; lobulillar= 1,901, IC del 95%, 1,213–2,979). Sin embargo, la adición de tomosíntesis digital de mama no aumentó la detección de carcinoma in situ (1,198; IC del 95%, 0,942-1,524), estadio ≥ T2 (1,391; IC del 95%, 0,895-2,163) o cáncer con ganglios positivos (1,336; IC del 95%, 0,921-1,938)22.
Giampietro et al. en 1.000 exámenes encontraron que la tomosíntesis digital de mama junto con la mamografía digital aumentaron las tasas de cáncer de mama general e invasivo en comparación con la mamografía digital sola (RR 1,36; IC del 95%: 1,18 a 1,58 y RR 1,51; IC del 95%: 1,27 a 1,79 respectivamente). Sin embargo, no mejoró la tasa de llamadas adicionales, tampoco las tasas de falsos positivos y falsos negativos23.
DiscusiónLas tasas de detección de cáncer fueron más altas tanto estadística como clínicamente con la tomosíntesis digital de mama adicionada a la mamografía digital. También, la tasa de detección de cáncer invasivo y el valor predictivo positivo en comparación con la mamografía digital sola. El uso solamente de la tomosíntesis digital de mama no proporcionó ningún beneficio adicional en la detección del cáncer de mama en comparación con la mamografía digital sola en lo que respecta a las tasas de detección de cáncer, cáncer invasivo, llamadas adicionales y valor predictivo positivo13.
En las mujeres con mamas densas, Phi et al. encontraron que la adición de tomosíntesis digital de mama a la mamografía digital aumentó significativamente la tasa de detección de cáncer en el cribado en comparación con la mamografía digital sola20.
La comparación de la tomosíntesis frente a la mamografía 2D en la detección del cáncer de mama en las mujeres asintomáticas y en la tasa de llamadas adicionales, realizada por Marinovich et al. informó que la tomosíntesis mejora la tasa de detección del cáncer y reduce la tasa de llamadas adicionales; sin embargo, los efectos dependen del entorno del cribado, con una mayor mejora en la tasa de detección de cáncer en los estudios europeos/escandinavos (cribado bianual) y una reducción de llamadas adicionales en los estudios estadounidenses que tienen de base una tasa elevada21.
En la evaluación de las características del cáncer, la adición de la tomosíntesis digital de mama a la mamografía digital permitió la detección de cáncer de mama invasivo temprano que podría haberse pasado por alto con la mamografía digital sola. La detección de cáncer de mama invasivo temprano (estadio T1, N0) es consistente con el beneficio esperado de detectar con precisión lesiones pequeñas y distorsiones de la arquitectura22.
Giampietro et al. reportaron con la tomosíntesis digital de mama tasas aumentadas de cáncer de mama general e invasivo, pero no hay evidencia de calidad al menos moderada que muestre que la tomosíntesis digital de mama comparada con la mamografía digital disminuya las tasas de llamadas adicionales, o las tasas de falsos positivos y falsos negativos23.
Los metaanálisis revisados coinciden en el aumento de la tasa de detección de cáncer cuando se agrega la tomosíntesis a la mamografía digital. También, la tasa de llamadas adicionales tiende a disminuir, aunque este resultado es menos consistente. La disminución de la sensibilidad de la mamografía en las mujeres con mamas densas, condición asociada con un riesgo 1,2-2,1 veces mayor de cáncer de mama en comparación con las mujeres promedio, ha promovido que las prácticas clínicas individuales opten por ofrecer exámenes de detección adicionales26,27. La ventaja encontrada en la tasa de detección de cáncer en estas mujeres, con el uso de la tomosíntesis junto con la mamografía digital, destaca el potencial de este examen como prueba de detección adicional para el seguimiento de mamografías negativas en las mujeres con tejido mamario denso20.
Las valoraciones de la calidad de los metaanálisis evaluados, calificaron la confianza general en los resultados de la revisión como críticamente baja según la herramienta AMSTAR 2. Esto significa que la revisión tiene más de un defecto crítico y no se debe confiar en que proporcione un resumen preciso y completo de los estudios disponibles19. Entre los dominios críticos, los correspondientes a los puntos 9 y 13 del listado de AMSTAR 2, se refieren al riesgo de sesgos, los cuales están presentes en todos los metaanálisis aquí evaluados en diferente magnitud con excepción de los de Alabousi et al.13 para el riesgo de sesgo de los estudios individuales y los de Yun et al.22 y Giampietro et al.23 para la consideración de estos riesgos en el análisis de los resultados de la revisión. A estos ítems que evalúan el riesgo de sesgos se les da prelación en la clasificación, dada la inclusión en las revisiones de estudios no aleatorizados.
Los metaanálisis son componentes importantes de la información científica en la medicina basada en la evidencia28. El número de estas revisiones ha aumentado constantemente, pero no siempre su calidad29. Para este efecto, se han diseñado muchos instrumentos para evaluar los diferentes aspectos de una revisión, AMSTAR 2 permite una evaluación más detallada de las revisiones sistemáticas que incluyen estudios no aleatorizados, que cada vez se incorporan más en estos estudios19.
La evaluación de la calidad de los metaanálisis evaluados con la herramienta AMSTAR 2, calificó la confianza general en los resultados de los metaanálisis como críticamente baja. Esto significa que tienen más de un defecto crítico y no se debe confiar en que proporcionen un resumen preciso y completo de los estudios disponibles19.
Las limitaciones de este estudio se dan por el diseño de la herramienta AMSTAR 2 en la evaluación de la planeación y la realización de las revisiones. Como una nueva herramienta que incluye estudios no aleatorizados en las revisiones sistemáticas, es necesario esperar la retroalimentación de los usuarios del instrumento para considerar la realización de las modificaciones19. Otra limitación es que se espera que AMSTAR 2 tenga un mínimo desacuerdo en la evaluación de los ítems. Sin embargo, la calificación en este estudio fue realizada por un evaluador, por lo que no es posible examinar una posible falta de concordancia en la calificación de cada pregunta19.
La unidad de análisis en los metaanálisis son los estudios originales primarios. En ninguno de los metaanálisis evaluados13,20–23, se menciona alguna preocupación ética sobre sus estudios revisados y tampoco expresan haber requerido o tramitado para el metaanálisis la aprobación por un comité de ética de la investigación clínica en el registro del protocolo (en los que lo hicieron) y el posterior desarrollo de la investigación. Los estudios clasificados con el instrumento AMSTAR 2 en este artículo no evalúan o hacen análisis diferenciales para la población vulnerable o grupos desfavorecidos y tampoco identifican participantes.
ConclusionesHay varios metaanálisis que evalúan el papel de la tomosíntesis digital de mama en el cribado mamario. Comparten entre ellos la inclusión de varias publicaciones, pero el aumento de la tasa de detección de cáncer es un resultado consistente. El uso de la tomosíntesis digital de la mama como prueba de detección adicional después de una mamografía negativa en las mujeres con tejido mamario denso está respaldado en un metaanálisis. La herramienta de evaluación AMSTAR 2 permite evaluar las revisiones sistemáticas que incluyen la frecuente evaluación de estudios no aleatorizados. Este estudio encontró que los resultados de los metaanálisis evaluados con esta herramienta, no son confiables en el resumen que hacen de sus estudios.
Se espera que las revisiones sistemáticas en curso y las futuras que incluyan estudios aleatorizados o no aleatorizados, así como aquellos con ambos diseños en intervenciones sanitarias, tengan en cuenta los parámetros de calidad de AMSTAR 2 con lo cual pueden mejorar la confianza en sus resultados, pero también sería deseable que el conocimiento de este instrumento lograra impactar en la calidad de los artículos primarios.
Consideraciones éticasEs una investigación libre de riesgos. Se trata de una revisión cuya base de evaluación son los estudios publicados; las personas no son evaluadas.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA la Dra. María Claudia Saénz Bohorquez por su colaboración en el cribado de los artículos encontrados en las bases de datos evaluadas.
| 1. ¿Las preguntas de investigación y los criterios de inclusión para la revisión incluyeron los componentes de PICOa?2. ¿El reporte de la revisión contiene una declaración explícita de que los métodos de la revisión fueron establecidos con anterioridad a su realización y justifica cualquier desviación significativa del protocolo?3. ¿Los autores de la revisión explicaron su decisión sobre los diseños de estudio a incluir en la revisión?4. ¿Los autores de la revisión utilizaron una estrategia de búsqueda bibliográfica exhaustiva?5. ¿Los autores de la revisión realizaron la selección de estudios por duplicado?6. ¿Los revisores realizaron la extracción de datos por duplicado?7. ¿Los autores de la revisión proporcionaron una lista de estudios excluidos y justificaron las exclusiones?8. ¿Los autores de la revisión describieron los estudios incluidos con suficiente detalle?9. ¿Los autores de la revisión utilizaron una técnica satisfactoria para evaluar el riesgo de sesgo (RS) en los estudios individuales que se incluyeron en la revisión?10. ¿Los autores de la revisión informaron sobre las fuentes de financiación de los estudios incluidos en la revisión?11. Si se realizó un metaanálisis, ¿los revisores utilizaron métodos apropiados para la combinación estadística de los resultados?12. Si se realizó un metaanálisis, ¿evaluaron los revisores el impacto potencial de RS en los estudios individuales sobre los resultados del metaanálisis u otra síntesis de evidencia?13. ¿Los autores de la revisión tuvieron en cuenta el RS en los estudios individuales al interpretar / discutir los resultados de la revisión?14. ¿Los autores de la revisión proporcionaron una explicación y un análisis satisfactorios de cualquier heterogeneidad observada en los resultados de la revisión?15. Si realizaron una síntesis cuantitativa, ¿los autores de la revisión llevaron a cabo una investigación adecuada del sesgo de publicación (sesgo de estudio pequeño) y discutieron su posible impacto en los resultados de la revisión?16. ¿Los autores de la revisión informaron sobre posibles fuentes de conflicto de intereses, incluida la financiación que recibieron para realizar la revisión? |
aPICO: paciente o problema, intervención, comparación y «outcomes» (resultados). Basado en Shea et al.19