CALIDAD OSEA
La osteoporosis es una enfermedad que afecta a todo el esqueleto produciendo una disminución de la resistencia ósea y un aumento de susceptibilidad a las fracturas1.
Actualmente sabemos que diferentes factores determinan la resistencia ósea. Por una parte, la densidad mineral ósea (DMO) y, por otra, la calidad ósea. En este último término englobamos una serie de factores tales como el grado de remodelado, la mineralización, la microarquitectura y la geometría óseos. Todos ellos, en diferente grado, determinan alguna de las características intrínsecas del tejido que condicionan la calidad final del material óseo.
Así como podemos cuantificar la DMO y, por lo tanto, comparar los casos problema con valores de normalidad, la calidad ósea no la podemos medir tan fácilmente, por lo cual hasta la fecha no disponemos de una herramienta capaz de medirla en la práctica clínica.
Hasta hace 25 años aproximadamente, la radiología convencional era la única manera no invasiva de diagnosticar la osteoporosis. Cuando dispusimos de una nueva herramienta, la densitometría, pudimos medir con mucha más exactitud la cantidad de mineral óseo. Está bien establecido que la densidad ósea se correlaciona bien con el riesgo de fractura2,3 y con la resistencia mecánica de los huesos analizados en condiciones experimentales4,5.
Esta importancia de la densidad ósea llevó a que la Organización Mundial de la Salud (OMS) basara la definición de osteoporosis en valores determinados de aquélla6. A pesar de ello, muchas observaciones señalaban que la cantidad de hueso no era suficiente para explicar el comportamiento del tejido óseo en situaciones especiales como la osteopetrosis. La osteopetrosis es una enfermedad que induce un gran aumento en la densidad ósea a pesar de lo cual se acompaña de fragilidad ósea y fracturas7. De manera similar, tras el uso del flúor en el tratamiento de la osteoporosis8 se observó un marcado aumento de la DMO, pero el material óseo compuesto por cristales de fluorapatita era más frágil e inducía un aumento de fracturas. Por tanto, equiparar masa ósea elevada a hueso sano y baja a hueso osteoporótico no siempre es correcto.
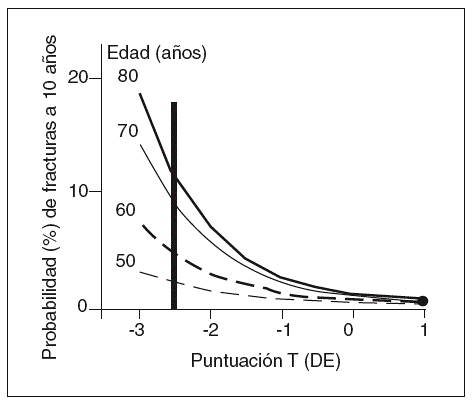
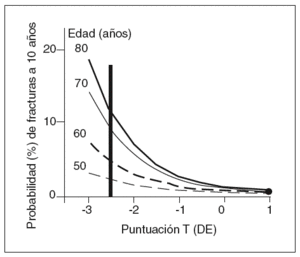
Para diferentes edades, el riesgo de fractura no es el mismo a pesar de que la DMO sea igual, incluso después de ajustar por potenciales factores de confusión2-5. De tal forma que un paciente de 80 años de edad puede tener más del doble de riesgo de fractura que uno de 50 a pesar de tener la misma DMO9 (fig. 1). Esto indica que hay otros factores diferentes de la DMO que están implicados en la resistencia del hueso a la fractura.
Figura 1 La edad y la densidad mineral ósea (DMO) son factores de riesgo de fractura de cadera independientes. Para una misma DMO, las personas de mayor edad tienen un riego de fractura mucho más elevado.
Sabemos también que cuando administramos tratamientos antirreabsortivos, los descensos del riesgo de fractura que se obtienen con estos fármacos se observan mucho antes de cualquier variación sensible en la densidad ósea. A los 6 meses y al año de tratamiento se han comunicado descensos considerables en el riesgo de fractura10-13. De tal manera que el efecto terapéutico se obtiene sin aumentar la densidad ósea de forma perceptible10-13. Un aumento en la densidad ósea de un 2 a un 7% con los diferentes principios activos produce descenso en el riesgo de fractura de un 40-60%. Mediante análisis de estas relaciones se ha concluido que tan sólo entre un 4 y un 20% del descenso en el riesgo de fractura es atribuible al aumento de masa ósea. Además, también es sabido que en la osteoporosis inducida por corticoides el riesgo de fractura es muy superior a la disminución de la DMO observada.
Por lo tanto, hay otros componentes de la estructura del hueso que la densitometría no mide y están directamente implicados en su fragilidad. Los podemos agrupar en factores vinculados a la arquitectura ósea y factores relacionados con la calidad de los materiales que componen el tejido óseo. El proceso que constituye el común denominador de todos estos elementos es el remodelado óseo.
Remodelado óseo
El remodelado óseo es un proceso esencial en la determinación de la calidad ósea, ya que condiciona la arquitectura, la mineralización y la geometría óseas14.
En 1964 Frost sentó las bases conceptuales de la remodelación ósea. El hueso, concebido actualmente como un tejido dinámico, sufre una serie de procesos que se suceden cíclicamente y son de crecimiento, modelado, remodelado y reparación. El remodelado es, en particular, el fenómeno dinámico mediante el cual el tejido óseo es activamente reabsorbido y reemplazado por tejido nuevo durante toda la vida del individuo15. En general, las osteopatías son secundarias a alteraciones en el remodelado.
El remodelado óseo está regulado por factores hormonales y mecánicos y hace posible que el hueso se adapte a las necesidades metabólicas y mecánicas del organismo.
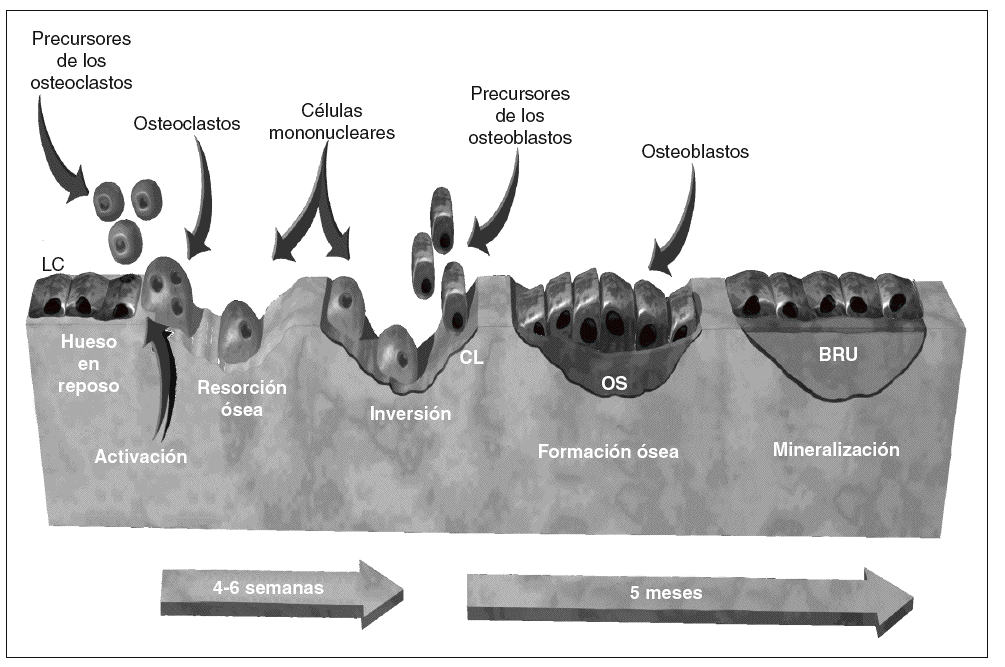
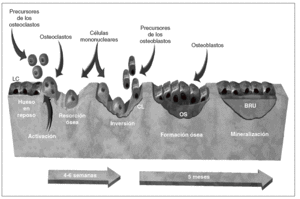
La remodelación se inicia cuando un conjunto de osteoclastos erosiona una cavidad en la superficie ósea. En ausencia de osteoblastos, se establece un intervalo quiescente (fase de inversión). En ese período la superficie irregular de la cavidad se alisa, y se deposita un estrato de sustancia de cemento. Posteriormente, un conjunto de osteoblastos sustituye el hueso recientemente erosionado. El remodelado es un ciclo que se produce en 5 etapas sucesivas15: quiescencia, activación, reabsorción, inversión y formación (fig. 2).
Figura 2 Remodelado óseo normal. BRU: unidad de remodelado óseo; CL: línea de cemento; OS: osteoide.
Quiescencia
En el adulto, la mayor parte de la superficie ósea está inactiva, cubierta por una capa de células de revestimiento aplanadas, provenientes de los osteoblastos. Subyacente a esta capa celular se encuentra un estrato delgado de tejido conectivo no mineralizado, la membrana endóstica. En este estado inactivo se puede observar la superficie ósea hasta que se inicia la fase siguiente.
Activación
Se inicia, en primer término, con el reclutamiento de los osteoclastos y finalmente con un mecanismo para su tropismo y fijación al hueso. Este proceso depende de una serie de variables como edad, sexo, lugar del esqueleto y tipo de hueso. También depende de las necesidades metabólicas y biomecánicas del hueso. En esta fase una serie de estímulos mencionados anteriormente produce la maduración de precursores osteoclásticos16. Las células de revestimiento digieren la membrana endóstica, se contraen y exponen la superficie ósea mineralizada, y permiten la consiguiente liberación de factores quimiotácticos para los osteoclastos.
Reabsorción
Ya en contacto con el hueso los osteoclastos inician la erosión en forma de cavidad. En el hueso trabecular se denomina laguna de Howship y en el hueso cortical, cono penetrante. Con un movimiento oscilante, el osteoclasto es capaz reabsorber una superficie 2 o 3 veces mayor que su área de contacto. Este proceso dura de 2 a 3 semanas y la cavidad puede ser de 50 µm en el hueso trabecular y de 100 µm en el cortical.
Inversión
Es el tiempo que separa el final de la reabsorción y el inicio de la formación para una zona determinada. El acoplamiento de estos dos procesos dura 1-2 semanas. Por una serie de estímulos aparecen los osteoblastos. Al microscopio se observa una laguna de Howship con ausencia de osteoclastos. Se puede identificar unas células mononucleares, posiblemente fagocitos, y otras, posiblemente preosteoblastos, que preparan la superficie para la formación del hueso. En este proceso intervienen los factores locales que asegurarán que los nuevos osteoblastos se agrupen en localización correcta y alineación adecuada16.
Formación
La formación ósea se produce en 2 etapas: la síntesis de matriz y la mineralización. Una vez en contacto con la superficie de cemento, los osteoblastos depositan osteoide, estrato de matriz de hueso, que al microscopio electrónico muestra estar formado por fibrillas de colágeno tipo I que se alinean antes de integrarse al hueso mineralizado. Los osteoblastos producen y depositan osteoide hasta formar un estrato de 10 µm.
Esta nueva matriz inicia su mineralización al cabo de 5-10 días de maduración. La fase de formación dura aproximadamente 3 meses. El período comprendido entre la formación de osteoide y la primera mineralización se denomina tiempo medio de retraso en la mineralización. El frente de mineralización se sitúa entre el osteoide y el hueso mineralizado, y a medida que avanza va dejando matriz ósea mineralizada mediante la formación de cristales de hidroxiapatita (HA). Este proceso controlado activamente por los osteoblastos se denomina mineralización primaria, que una vez concluida continúa, pero a un ritmo mucho menor, en la llamada mineralización secundaria, que dura 3-6 meses. Por tanto el ciclo completo de mineralización dura 4 meses, pero será necesario más tiempo para que el hueso tenga plena madurez.
El remodelado óseo acelerado que se observa típicamente en la posmenopausia destruye las estructuras trabeculares, hasta en casos extremos en que las hace desaparecer por completo. Además, aumenta la porosidad cortical. También induce cavidades de reabsorción en las trabéculas que quedan, lo que las compromete aún mucho más en su capacidad mecánica. Es posible que el rápido efecto antifracturario de los fármacos antirreabsortivos esté muy relacionado con la estabilización precoz de una microarquitectura que se encontraba en situación crítica.
Además el remodelado influye en el grado y la homogeneidad de la mineralización. También el remodelado es el mecanismo básico de reparación del daño por fatiga, lo que indica que una supresión excesiva del remodelado, como ocurre tras la radiación del tejido óseo, o una supresión excesiva farmacológica podrían, teóricamente, aumentar su fragilidad. En la malla de colágeno también actúa como factor de renovación, al reemplazar moléculas viejas más deterioradas por otras jóvenes más competentes mecánicamente. Actualmente hay controversia sobre cuál es el nivel óptimo de remodelado óseo que puede reflejar un estado fisiológico que permita la mejor resistencia ósea17.
La calidad ósea, por lo tanto, tiene importancia en la resistencia mecánica del hueso independientemente de su densidad mineral. Los efectos de los fármacos en la calidad ósea son más importantes que los que tienen en la cantidad. Se intenta, por tanto, buscar fármacos que, más allá de aumentar la densidad, mantengan o mejoren la cantidad de hueso, generando hueso fisiológicamente normal y con mayor resistencia a la fractura, lo que ofrecerá mayor eficacia y seguridad a corto y largo plazo.
Mineralización
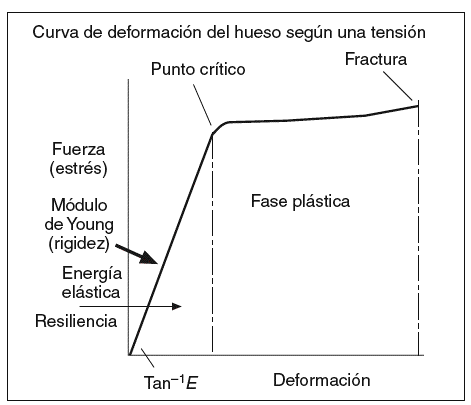
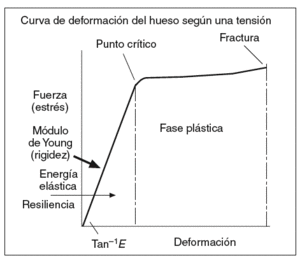
El grado de mineralización es una propiedad que influye en la resistencia ósea a las fracturas18-22. Los cristales de HA y de fosfato amorfo proporcionan al hueso la rigidez y la resistencia a la compresión. Pero el proceso de mineralización puede ser diferente dependiendo del grado de mineralización, que a su vez está determinado por la cantidad, el grado de compactación y la ordenación de los microcristales en torno a las fibras de colágeno. La mineralización del hueso recién formado se produce en un 50-70% durante los primeros 2-3 meses y se denomina mineralización primaria. La mineralización secundaria se produce durante años y completa el depósito mineral en la unidad básica de remodelado. Los excesos de mineralización no implican mayor fortaleza ósea sino, por el contrario, producen un aumento de la rigidez, con la consecuente disminución de la elasticidad y, por tanto, mayor riesgo de fractura como en la osteopetrosis. Por el contrario, una mineralización deficiente también disminuye la resistencia mecánica, como ocurre en la osteomalacia. El grado de mineralización es directamente proporcional a la dureza del tejido óseo (que medimos mediante el módulo de Young) (fig. 3), e inversamente proporcional a su fragilidad. La relación de ésta con la resistencia total del hueso es bifásica, y es peor tanto en grados extremadamente altos como en los extremadamente bajos, en concordancia con las situaciones clínicas arriba descritas. El grado de mineralización se relaciona con la homogeneidad del tejido óseo. Un exceso de homogeneidad actúa como un elemento facilitador de la transmisión de vectores de fuerza que propenden a una más fácil y rápida propagación de líneas de fractura microscópicas o macroscópicas. No se debe confundir estas fracturas microscópicas con las microgrietas que se producen como consecuencia del daño por fatiga22,23. Este fenómeno se produce cuando un material es sometido de forma cíclica a una carga mecánica, como consecuencia de lo cual se produce la fatiga del material, fenómeno ampliamente conocido en la ingeniería. A medida que el hueso envejece, se ve sometido cada vez más a este tipo de estrés que afecta negativamente su resistencia mecánica.
Figura 3 El módulo de Young representa el comportamiento de un material sometido a una fuerza: deformidad elástica, deformidad plástica y fractura.
La composición de la matriz proteínica24-26, colágena y no colágena, según su composición, influye notablemente en la resistencia mecánica ósea. También sabemos que las variantes del gen del colágeno influyen en la resistencia ósea y que el grado de polimerización del colágeno altera su competencia biomecánica en un proceso de envejecimiento paralelo al de otros componentes del tejido óseo.
Los osteocitos a través de la red osteocitaria25 parecen encargados del sistema de respuesta de adaptación a los estímulos mecánicos. Pero, además, detectan las zonas del hueso en que se produce daño por fatiga, donde inician un proceso de remodelado focal que tiende a reemplazar el tejido óseo viejo y deteriorado por hueso nuevo que presenta mayor resistencia mecánica.
Para entender el comportamiento dinámico del hueso debemos analizarlo según 3 niveles estructurales: la macroestructura, la microestructura y la ultraestructura.
Macroestructura: arquitectura ósea-geometría ósea
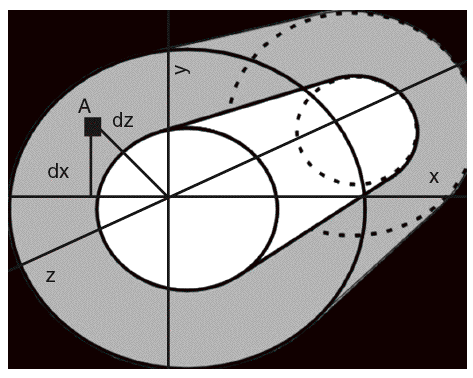
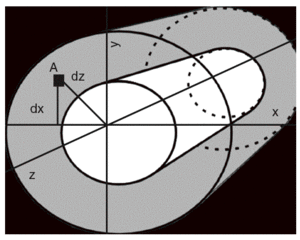
La geometría ósea, que traduce la macroarquitectura, otorga importantes propiedades biomecánicas al hueso. Dependiente del proceso de modelado y remodelado, es uno de los elementos que se pueden modificar para adaptar el hueso a la pérdida mineral asociada al envejecimiento. Explica además una buena parte de las diferencias entre varones y mujeres en el riesgo de fractura, ya que confiere al hueso cortical características diferenciales27. Es sabido que cuanto mayor es el tamaño de un hueso, mayor será su resistencia (por supuesto, hasta un cierto límite). Los huesos largos, de estructura cilíndrica, ofrecen un ejemplo de este principio, gobernado fundamentalmente por los valores del momento de inercia de una sección transversal (MIST) MIST = A * d2 = ¼ (r4 externo r4 interno) (fig. 4). Con exactamente la misma cantidad de hueso, si se dispone en un cilindro de menor diámetro tendrá un menor momento de inercia y una menor resistencia. Por el contrario, si exactamente esta misma cantidad de hueso la disponemos en un cilindro de mayor diámetro, su momento de inercia y resistencia se incrementan. Esta es la explicación de una buena parte de las diferencias de riesgo fracturario entre varones y mujeres, ya que los primeros tienen huesos más voluminosos y, por tanto, de mayor diámetro. Además los huesos cilíndricos sufren una expansión perióstica que mejora su resistencia mecánica. Por este mecanismo se compensa parcialmente el efecto de la pérdida de masa ósea secundaria al envejecimiento28,29.
Figura 4 Efecto de las conexiones transversales. La resistencia al pandeo (doblamiento) aumenta con las conexiones horizontales (trabéculas).
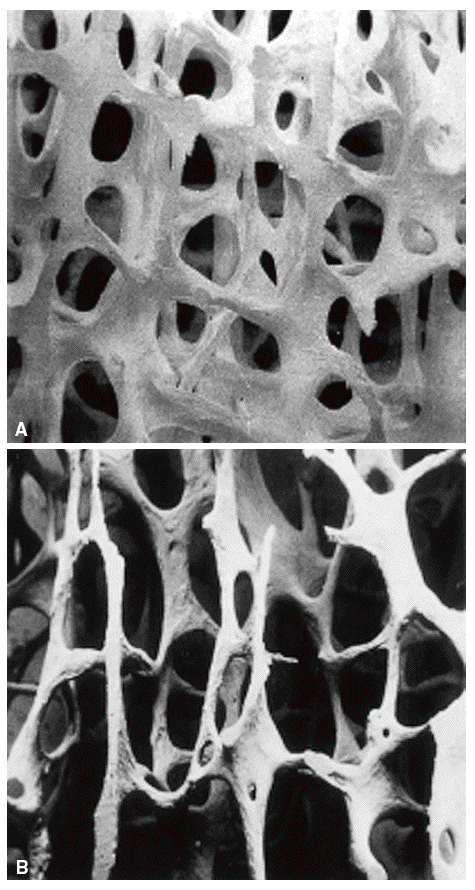
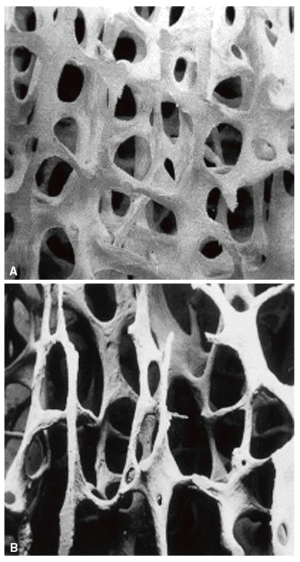
La microarquitectura ósea define la disposición tridimensional de la trama ósea que constituye fundamentalmente el hueso trabecular. Con el desarrollo de la enfermedad, esta trama se deteriora de forma progresiva. Las estructuras trabeculares horizontales se perforan y se convierten en trabéculas lineales (fig. 5) y acaban desapareciendo. Las trabéculas verticales pierden sus conexiones transversales horizontales y, desde un punto de vista estructural, se alargan, adelgazan y a la vez se desconectan, con el resultado final de un hueso trabecular que pierde sensiblemente la resistencia. Progresivamente se producen perforaciones parciales en las trabéculas restantes que actúan como puntos críticos de debilitamiento donde se concentra el estrés mecánico. Así toda la estructura se afecta de manera tal que ante mínimas presiones mecánicas el hueso cede y se fractura14,24.
Figura 5 Imagen tridimensional de alta resolución obtenida por microtomografía computarizada. A: hueso normal; B: osteoporosis.
La ultraestructura describe la composición y la arquitectura a escala molecular. La interconexión entre los materiales orgánicos (el 80% de colágeno tipo I que conforma la matriz celular) y un 20% de matriz de elementos inorgánicos (matriz mineral compuesta por cristales de HA y de fosfato de calcio amorfo) confieren al tejido óseo una parte de sus características biomecánicas. El colágeno proporciona sobre todo la rigidez y la resistencia a la tracción en el sentido longitudinal. Además, el colágeno no sólo aporta sus propiedades elásticas, sino también las plásticas. Por otra parte, los cristales de HA aportan al tejido óseo la resistencia y la rigidez a la compresión.
MARCADORES BIOQUIMICOS DEL REMODELADO OSEO
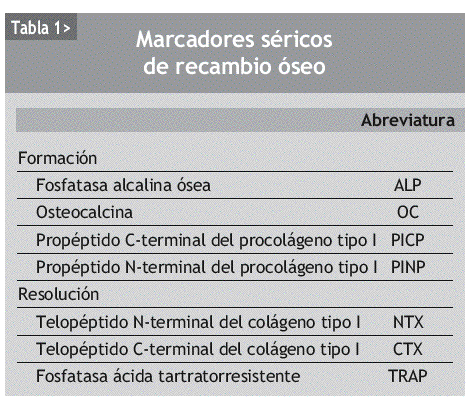
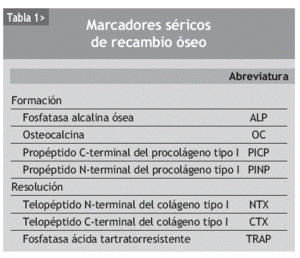
Los marcadores bioquímicos del remodelado óseo son componentes de la matriz ósea o enzimas que son liberados de las células o de la matriz durante el proceso de remodelado y, por tanto, reflejan su dinámica. Clásicamente se han dividido en marcadores de formación y de resorción30 (tabla 1).
Marcadores de formación ósea
Fosfatasa alcalina
Es el marcador de formación ósea más utilizado. Aunque se desconoce su función exacta en el osteoblasto, se sabe que interviene en el proceso de mineralización, y de hecho es sabido que la hipofosfatasia se asocia a una alteración importante de la mineralización ósea.
Como marcador óseo posee una baja sensibilidad diagnóstica, ya que no suele encontrarse elevada en la osteoporosis, a la vez que tiene poca especificidad diagnóstica, ya que la actividad sérica puede reflejar, además de la isoenzima ósea, las isoenzimas procedentes del hígado, el riñón y el intestino.
Fosfatasa alcalina específica del hueso. Se determina en suero, mediante inmunoanálisis con anticuerpos monoclonales. Presenta una importante variabilidad interindividual, pero con variabilidad intraindividual baja y no la influye la dieta. Es una de las isoenzimas de la fosfatasa alcalina, que se diferencia por su composición en carbohidratos. Aproximadamente, la fosfatasa alcalina total circulante procede en un 50% de hueso y en otro 50% de hígado31.
Osteocalcina
Es la proteína no colágena más abundante de la matriz ósea. Es una proteína sintetizada por los osteoblastos maduros, odontoblastos y condrocitos. Se caracteriza por contener tres residuos del aminoácido ligador de calcio, el ácido gammacarboxiglutámico, y se determina por inmunoanálisis. Se considera un marcador sensible y específico de la actividad osteoblástica, si bien en parte puede derivar de la resorción ósea. Sus concentraciones siguen un ritmo circadiano, con los valores más elevados por la mañana, y no las influye la dieta31.
La molécula intacta de osteocalcina se degrada rápidamente in vivo e in vitro, por lo que la osteocalcina circulante constituye un conjunto de fragmentos de diferentes tamaños y antigenicidad; el fragmento N-terminal medio es el que se encuentra en una mayor proporción. Esta proteinólisis puede tener lugar en el mismo osteoblasto, en la sangre o en otros tejidos como el hígado y el riñón, o también in vitro por la acción de proteasas en el tubo. La hemólisis y la lipemia interfieren en el análisis. La concentración de osteocalcina sérica se encuentra incrementada en los pacientes con enfermedades en las que se produce un aumento de la actividad osteoblástica. Como excepción a estas generalizaciones, destacan la osteodistrofia renal, ya que la insuficiencia renal ocasiona la retención de este marcador y de sus fragmentos en el suero, las metástasis óseas y la enfermedad de Paget, en la que no suele observarse un gran incremento de osteocalcina. El hipotiroidismo, el hipoparatiroidismo y el tratamiento con glucocorticoides suelen asociarse con una disminución de la osteocalcina, que es el marcador de elección en los pacientes con afección hepática10.
Propéptidos del procolágeno, amino y carboxiterminales, del colágeno tipo 1
El colágeno tipo 1 se sintetiza en el hueso, pero también se encuentra en otros tejidos como los tejidos blandos, el tejido fibroso del hígado, etc., junto con otros tipos de colágeno, por lo que ningún metabolito derivado del colágeno tipo 1 puede considerarse completamente específico del hueso
PINP-PICP
Los dos marcadores de formación relacionados con el colágeno tipo 1 son los propéptidos aminoterminal (PINP) y carboxiterminal (PICP) del procolágeno tipo 1, que se obtienen por división endoproteinolítica de la molécula de procolágeno y que luego pasan a la sangre.
Debido a que estos propéptidos se liberan durante el proceso de formación de las fibras de colágeno, su determinación se ha relacionado con la formación ósea.
El PICP ha mostrado escasa sensibilidad en pacientes con osteoporosis, mientras el PINP tiene una buena eficiencia diagnóstica en la osteoporosis y en la enfermedad de Paget. La razón de esta discrepancia se desconoce, aunque se ha indicado que podría estar relacionada con diferencias en la liberación de los procolágenos en los tejidos o en su metabolismo. Por tanto el PINP es actualmente el marcador derivado del colágeno con un mayor rendimiento diagnóstico.
Marcadores de resorción ósea30-31
A los marcadores relacionados con los osteoclastos se les denomina marcadores de resorción y la mayoría se determina en la orina. Los principales son:
Enzimas de los osteoclastos
Fosfatasa ácida resistente al tartrato (FART) en suero.
Derivados de la degradación de la fase mineral del hueso
Cociente calcio/creatinina.
Derivados de la degradación del colágeno óseo
Hidroxiprolina.
Piridinolina (Pir) y deoxipiridinolina (Dpir) libres.
Telopéptido carboxiterminal del colágeno 1 con puentes de piridinolina (ICTP) en suero.
Telopéptido aminoterminal del colágeno 1 con puentes de piridinolina (NTX) en suero y en orina.
Telopéptido carboxiterminal de la cadena alfa 1 del colágeno 1 (ß-Cross-Laps, CTX) en suero y en orina.
Hidroxiprolina. Actualmente ha sido reemplazada por otros marcadores más específicos por su falta de especificidad, la necesidad de determinarla en orina de 24 h, y la fuerte influencia del colágeno ingerido en las 24 h previas a la determinación. Es un aminoácido presente en todos los tipos de colágeno, liberado tras su rotura enzimática, y del que se excreta aproximadamente un 10% por orina.
Puentes de piridinolina y desoxipiridinolina. Representan lugares de unión entre las moléculas de colágeno tipo 1. Al metabolizarse el colágeno pueden liberarse puentes de piridinolina o desoxipiridinolina (libres o asociados a péptidos) o formando parte de los telopéptidos aminoterminal (N-terminal) o carboxiterminal (C-terminal) del colágeno. Los puentes de piridinolina son abundantes en diferentes tejidos, y los más específicos del recambio óseo son los puentes de desoxipiridinolina. Pueden medirse por inmunoanálisis directo y tienen la característica de que no les influye la dieta.
Puentes de telopéptidos. Son productos de degradación del colágeno, con puentes procedentes bien de la región amino, bien carboxiterminales. Se determinan en sangre y en orina, y la extracción debe ser siempre en ayunas porque la ingesta modifica sensiblemente los resultados:
Telopéptido aminoterminal del colágeno 1 con puentes de piridinolina (NTX) se determinan en suero y en orina.
Telopéptido carboxiterminal de la cadena alfa 1 del colágeno 1 (ß-Cross-Laps, CTX) en suero y en orina:
Fosfatasa ácida tartratorresistente 5b. Se determina mediante inmunoanálisis en plasma y sus valores no se influyen por la dieta. Es sintetizada y secretada por los osteoclastos durante la resorción activa del hueso.
Marcadores de remodelado óseo. Son predictores independientes del riesgo de fractura en población no tratada. Por otra parte, tienen la capacidad de predecir la respuesta antifracturaria a distintos tratamientos mejor que las variaciones en la DMO.
En resumen, los marcadores bioquímicos de remodelado óseo son útiles para identificar a los pacientes con un elevado recambio óseo (para predecir una rápida pérdida ósea), para valorar la respuesta terapéutica a los agentes antirresortivos tales como los estrógenos y los bisfosfonatos y también el riesgo de fracturas en pacientes ancianos. Por lo tanto, los marcadores tienen capacidad de detectar pacientes con remodelado elevado y podrían ser un índice o factor dentro de la ecuación que defina la calidad ósea, ya que un remodelado elevado se acompaña de perforaciones trabeculares muy numerosas y agresivas, con el consiguiente deterioro de la microarquitectura. Asimismo reflejan el aumento de porosidad y adelgazamiento del hueso cortical que se observa en situaciones de alto remodelado.
Entre lute;n. El origen de la variabilidad puede ser intraindividual y por las variaciones diarias del remodelado (hasta un 20% de CV en una semana). También hay variación interindividual que depende del sexo y la edad y, finalmente, la variación debida a la forma de obtener las muestras y la propia técnica de determinación. Existen modelos matemáticos para mejorar la precisión32,33. En la práctica consideramos que el cambio entre dos valores sucesivos del marcador en el mismo individuo refleja un cambio real y significativo en la actividad de la enfermedad. Una forma de obtener resultados más fiables es determinar dos valores basales y utilizar la media como referencia. Todo ello implica que con la determinación de los marcadores no se puede realizar el diagnóstico de osteoporosis o de enfermedad ósea metabólica.
En la práctica se considera que los más aconsejables para la monitorización del tratamiento son:
1. De los marcadores de formación, la FAO, la osteocalcina34 y el PINP.
2. De los marcadores de resorción, NTX o CTX en orina y CTX sérico para monitorizar el tratamiento con bisfosfonatos, y los mismos marcadores o también la Dpir libre en orina para monitorizar el tratamiento hormonal.
COMO MEDIR LA CALIDAD OSEA
No disponemos en la actualidad de un método para medir la calidad ósea. Sólo tenemos acceso a una serie de herramientas que nos permiten aproximarnos a aspectos parciales y que forman parte de una ecuación que hasta ahora no se ha podido definir. El término calidad ósea hace referencia a las propiedades físicas del hueso que expresan la resistencia a la fractura ante una demanda funcional a la que es sometido24. El hueso es un material muy complejo, ya que no es homogéneo, es anisotrópico, tiene una viscoelasticidad no lineal y capacidad de alterar sus propiedades en respuesta a las cargas, perjudiciales o no, a la que es sometido.
Para determinar la cantidad de masa ósea disponemos de la densitometría y los ultrasonidos, técnicas que no desarrollaremos ya que hacen referencia a la cantidad y no a la calidad ósea.
Para la valoración de la microarquitectura disponemos de la biopsia ósea, la resonancia magnética (RM) y la microtomografía computarizada (µTC) in vivo e in vitro, entre otros métodos. Para la valoración del remodelado disponemos de la histomorfometría en biopsia ósea marcada con tetraciclinas y la tomografía por emisión de positrones (PET).
Histomorfometría ósea. Desde la aparición de este método, que ha revolucionado la comprensión y el estudio del remodelado óseo, se ha podido conocer la dinámica ósea tanto fisiológica como en diferentes afecciones. Es un método invasivo que mediante parámetros estáticos y dinámicos (previo doble marcado con tetraciclinas) permite diagnosticar diferentes enfermedades óseas metabólicas, y se ha descrito patrones patognomónicos. Mediante esta técnica podemos cuantificar el volumen trabecular, el grado de mineralización, el grado de formación o el volumen de osteoide, la profundidad de erosión, la superficie de erosión, etc. Se realiza a partir de una biopsia transilíaca de 8 mm de diámetro y aproximadamente 2 cm de largo, que tras su extracción debe presentar las dos corticales que separan el hueso trabecular para poder realizar una correcta medición. Aunque es una técnica bien tolerada, no deja de ser invasiva y, por lo tanto, muy restringida en la práctica clínica.
Si bien en un principio sólo fue una técnica bidimensional, mediante métodos sofisticados de tomografía computarizada se puede correlacionar con la estructura tridimensional del hueso y determinar la estructura de las trabéculas en el espacio medular35.
Resonancia magnética. Es una técnica no invasiva bien tolerada y que no irradia al paciente. Tras el procesamiento digital de la imagen reconstruye la microarquitectura ósea con una alta resolución y tiene capacidad de discriminar la transformación de las plataformas trabeculares en varillas y su eventual rotura36,37.
Microtomografía computarizada. Se puede realizar in vivo con la limitación de la irradiación que se puede aplicar. A partir de la TC se puede lograr una imagen tridimensional, pero la resolución es limitada (100 µm). Si el estudio se realiza a partir de biopsias óseas, se puede mejorar sensiblemente la resolución al aumentar la irradiación, con lo que se consigue imágenes de hasta 1 µm. Mediante Nanotac se puede obtener imágenes de 0,1 µm38.
Visualización espectroscópica infrarroja por transformada de Fourier. La espectroscopia infrarroja (IR) es un tipo de espectroscopia de vibración (una técnica espectroscópica para analizar las vibraciones moleculares).
Antes, sólo era posible obtener buena información irradiando la molécula con una sola frecuencia de luz IR por vez. Pero actualmente, mediante el algoritmo de la transformada de Fourier, puede irradiarse una molécula con cada frecuencia de luz IR a la vez para obtener un espectro perfecto de forma rápida.
Esta técnica de imagen nos permite obtener datos sobre la cristalización mineral del hueso y la estructura de colágeno del tejido óseo. Mediante ella podemos evaluar las propiedades materiales del hueso en un contexto anatómico (sin necesidad de destruir el hueso).
La técnica se basa en el análisis del espectro de absorción y las mediciones se han calibrado frente a técnicas de medición estándar. La elevada resolución (5-7 µm) permite la evaluación de material que es heterogéneo en su composición y varía cada 10 a 20 µm39.
Medición de la resistencia con estudios biomecánicos
Es obviamente el método más directo de cuantificar la resistencia ósea, aunque no representa exactamente lo que sucede in vivo, ya que se excluye los efectos del tejido muscular y graso que influyen en la resistencia general a la fractura40. Consiste en una serie de mediciones que se realizan directamente en el hueso luego de extraerlo y mide, mediante diferentes técnicas, la resistencia del material cuando se lo somete a una serie de cargas mecánicas.
Test de torsión. El test de torsión se realiza fijando los extremos del hueso a una guía que permite que un extremo rote mientras el otro permanece estacionario. A menos que haya un punto particular débil en el hueso, la rotura ocurrirá cerca del centro y se producirá generalmente una fractura en espiral.
Test de doblamiento en 3 puntos. Para esta técnica, los extremos del hueso se colocan en un soporte con 2 apoyos. La presión se aplica en un tercer punto equidistante entre los puntos de apoyo. Debido a que el hueso se romperá primero en la zona de tensión, la fractura comenzará en la cortical inferior. Es el test de doblamiento más utilizado.
Test de compresión. Es el realizado más frecuentemente en los estudios de resistencia mecánica y permite medir adecuadamente la dureza ósea. Durante los test biomecánicos, la magnitud de la carga usualmente se mide en Newton y se representa en el eje de las y, y la magnitud de la deformación ósea se representan en un eje de abscisas en unidades lineares, como milímetros, o en unidades angulares, como grados. De tal forma se crea una curva de carga-deformación.
Test multiaxial de fatiga. Sometiendo un hueso largo a tensión (estiramiento), compresión y torsión se puede estudiar el comportamiento del hueso y la producción de microfracturas41.
Tomografia por emisión de positrones (PET)
Esta técnica permite analizar el metabolismo óseo en todo el esqueleto. Se utiliza como trazador el 18F y, luego de analizar la distribución dinámica en diferentes compartimentos (óseo, intravascular e intracelular), se obtienen diferentes índices K que ofrecen un mapa del estado regional del remodelado en cualquier territorio del esqueleto. La imagen funcional permite una cuantificación directa del metabolismo en sitios específicos del organismo, incluida la columna lumbar, muy importante desde el punto de vista clínico42-44. Esta técnica ha sido validada comparando los índices histomorfométricos de remodelado, y se ha demostrado que tienen una elevada correlación entre los parámetros cinéticos locales y los parámetros asociados a la actividad osteoblástica tales como el grado de formación ósea y el grado de aposición mineral45.
Análisis fractal a partir de la radiología convencional (análisis textural)
Es una nueva técnica en desarrollo que, a partir de una radiología simple y mediante métodos de análisis textural de la imagen radiográfica digitalizada (el análisis fractal), permite, sin irradiación adicional a la de una radiografía habitual, obtener imágenes de la microarquitectura ósea. Recientes estudios refieren una correlación entre este análisis y calidad ósea46.
En resumen, la calidad ósea define un conjunto de características que influyen en la resistencia ósea: éstas son las propiedades estructurales y materiales del hueso, que a su vez están determinadas por el remodelado óseo. Conocer los factores que determinan la calidad ósea nos permitirá predecir mejor el riesgo de fractura y actuar consecuentemente desde el punto de vista terapéutico.