Special Issue: Lecciones aprendidas del COVID-19
Más datosLa pandemia por SARS-CoV-2, fue un evento sin precedentes en la historia reciente, una crisis en salud pública que puso a prueba a la humanidad como especie; durante esta, destacan las acciones del personal científico, quien con esfuerzos conjuntos identificaron e iniciaron el estudio acucioso sobre su fisiopatología y medios para combatirla. Pero también, se presentaron durante las fases iniciales, y ante la ausencia de evidencia científica, manejos o recomendaciones basadas en la plausibilidad y el deseo de ofrecer una opción terapéutica y/o un manejo compasivo a pacientes con cursos clínicos inexorables. El curso posterior, con trabajos de investigación multicéntricos, demostró la limitación de muchas recomendaciones previas, descartando muchas opciones terapéuticas y confirmando las acciones primordiales para el manejo de esta crisis y dejando unas recomendaciones claras ante futuros brotes, epidemias y/o pandemias: personal de salud debidamente capacitado, recursos disponibles e idóneos, desarrollo de protocolos establecidos a partir de medicina basada en la evidencia y el planteamiento de estrategias gubernamentales en los servicios de salud, para modificar la evolución de la pandemia.
The SARS-CoV-2 pandemic has been an unprecedented event in recent history, a public health crisis, which has tested humanity as a species. The actions of the scientific professionals have stood out during the pandemic, whose joint efforts identified and began the careful study of its pathophysiology and the means to combat it. During the initial phases, and in the absence of scientific evidence, procedures and recommendations were developed based on plausibility and the desire to offer a therapeutic option and compassionate management. The subsequent course, with multicentre research works, demonstrated the limitation of many previous recommendations, ruling out therapeutic options and confirming the essential actions for the management of this crisis, leaving clear recommendations for future outbreaks, epidemics or pandemics: trained healthcare professional, suitable resources, development of protocols based on evidence-based medicine and government strategies in the health services, to change the evolution of the pandemic.
La humanidad ha padecido, que se sepa, 16 pandemias a lo largo de su historia. Es evidente que la capacidad de respuesta ante las mismas ha mejorado y que de cada una se han logrado algunas enseñanzas. Sin embargo, todo indica que, como especie, y como comunidad científica, debimos haber estado mejor preparados para enfrentar el COVID-19. El temor y la ignorancia ante lo nuevo, la intención por hacer algo, el tsunami de las redes sociales y la infodemia con su inmediatez nos llevaron, probablemente, a tomar decisiones inadecuadas olvidando la evidencia disponible en algunos casos y el principio ético de «primero no hacer daño». La presente revisión resume aspectos de la pandemia, el manejo que se le dio a la misma inicialmente, la experiencia científica del abordaje del paciente con COVID-19 así como las intervenciones que cuentan con suficiente evidencia científica decantada en el tiempo para que las tengamos siempre presentes en el paciente crítico y evitar que, ante futuros brotes, epidemias o pandemias, nos dejemos deslumbrar por el canto de sirenas de novedosas hipótesis o rebuscadas teorías.
Ferroplasma acidiphilum, una arqueobacteria que existió hace más de 4.500 millones de años, parece que fue la primera bacteria y nuestro progenitor primigenio1. Por milenios la humanidad padeció infecciones banales pero fatales. En una carta del 24 de abril de 1676 Leeuwenhoek describió la causa de tales infecciones2,3. Pasaron casi 150 años para que Ehrenberg, en 1828, las llamara bacterias4. Cien años después, el viernes 28 de septiembre de 1928, Flemming descubrió la penicilina5. En esa evolución, centenares de hipótesis, manejos absurdos y miles de errores se enterraron en los mismos cementerios donde yacen millones de víctimas.
El 5 de junio de 1981 el CDC detalló cinco casos de una muy rara neumonía6. Un mes después se reportó un exótico tipo de cáncer de piel7. Los primeros casos fueron publicados por el doctor Gottlieb en San Francisco, el 10 de diciembre de 19818. Tiempo después se supo que la primera transmisión a humanos ocurrió en 1920 en Kinshasa9,10 y el primer caso clínico se presentó, realmente, en 1959 en la República Democrática del Congo9,10. A mediados de 1982 fue reconocida como enfermedad y en septiembre de ese año se le dio el nombre de sida11. Al año siguiente se identificó el virus en una ardua batalla entre investigadores del instituto Pasteur y científicos norteamericanos12,13. La primera droga eficaz fue lanzada en 198714, seis años después de la primera descripción.
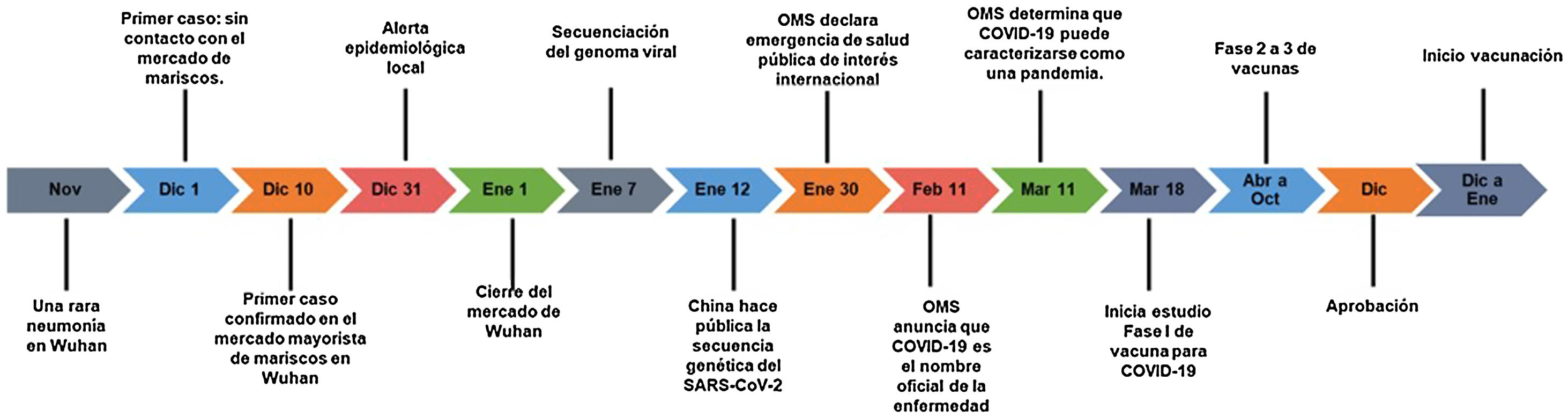
El caso índice o paciente cero no está totalmente claro. Sin embargo, dos estudios, usando análisis filogenético, sugirieron que entre el 6 de octubre y el 11 de diciembre se presentó el ancestro común del SARS-CoV-215,16. El 17 de noviembre un hombre de 55 años presentó un cuadro respiratorio infeccioso agudo en la ciudad de Wuhan. El 1 de diciembre, un paciente de 70 años con alzhéimer presentó un cuadro similar17–20. Entre el 15 y 20 de diciembre aparecieron más casos. Entre el 21 y el 24 de diciembre se realizaron varios lavados broncoalveolares que, días después, confirmaron la etiología del brote. El 27 de diciembre, el doctor Zhang Jixian, en el Hospital Provincial, en Hubei, reportó que la enfermedad era producida por un nuevo coronavirus15–24. De los 59 casos sospechosos iniciales, 41 fueron confirmados por reacción en cadena de polimerasa por transcripción reversa (RT-PCR). De ellos 27(66%) tuvieron contacto con el mercado mayorista de mariscos de Wuhan15,17,18,21,22 (fig. 1). El primer anuncio público se hizo el 31 de diciembre cuando el Comité de Salud Municipal de Wuhan informó a la OMS. El 1 de enero cerraron el mercado y se descartó que la causa fuera SARS, MERS, gripe o gripe aviaria. El 7 de enero los científicos chinos aislaron el virus y realizaron la secuenciación del genoma que estuvo disponible para la OMS el 12 de enero para producir las pruebas de PCR22–25. El 24 de enero un informe de Lancet demostró la transmisión en humanos, recomendó el uso de equipos de protección personal para el personal de salud y planteó la detección del virus por su «potencial pandémico»15. El 30 de enero la OMS lo declaró emergencia de salud pública de interés internacional26 tras registrar 7.818 casos, la mayoría en China y 82 casos en otros 18 países. La figura número 1 muestra la rápida respuesta de la ciencia en medio de esta pandemia comparada con otros retos infecciosos que ha tenido que enfrentar la humanidad.
Las pandemias han afectado a la humanidad durante más de dos milenios. En los últimos 100 años se han declarado 5. La presente es la primera producida por un virus diferente al de la influenza27 (tabla 1).
Las pandemias en el último siglo
| Año | Nombre | Virus | Fallecidos |
|---|---|---|---|
| 1918 | gripe española | Influenza A (H1N1) | 50 millones |
| 1957 | gripe asiática | Influenza A (H2N2) | 1,5 millones |
| 1968 | gripe de Hong Kong | Influenza A (H3N1) | 1 millón |
| 2009 | gripe pandémica | Influenza A (H1N1) | 300.000 |
| 2019-- | COVID-19 | SARS-CoV-2 | Más de 4 millones |
De las pandemias se han aprendido estrategias para combatirlas. En ausencia de tratamiento específico o medidas de prevención directas como una vacuna, se han planteado intervenciones no farmacológicas para limitar su impacto28–32. Así, la detección temprana y masiva, el cierre de escuelas, aislar a personas mayores y el autoaislamiento de individuos sintomáticos reduciría la transmisión y prevendría que la pandemia excediera la capacidad de las UCI disponibles28–32. Situaciones excepcionales, en las cuales la salud se convierte en materia de seguridad pública, requieren medidas de excepción. Medidas que limitaron derechos individuales y colectivos como la libertad de movimiento, la libertad de reunión, el derecho al trabajo y la libre empresa, entre otras. Además, algunos países como China, Corea del Sur, Singapur e Israel usaron vigilancia masiva y una biopolítica intrusiva que les permitió que todo y todos fueran observados, examinados y monitoreados33–35. Preocupa lo que harían algunos con tales datos después de la pandemia36–40. En la práctica, las intervenciones drásticas significaron el secuestro de casi el mundo entero y generaron la quiebra de miles de empresas y millones de desempleados33,34. La economía de muchos países retrocedió varias décadas33–40. La experiencia china demostró que la mortalidad por COVID-19 se asociaba inversamente con la disponibilidad de recursos sanitarios41. En busca de un balance entre economía y salud, tales medidas se implementaron de dos maneras diferentes: eliminación y mitigación. Hoy se sabe que la primera se asoció con menor mortalidad y un menor impacto en la economía42,43.
Por otra parte, las enfermedades no transmisibles generan más de 40 millones de muertes anuales44,45: las enfermedades cardiovasculares (con casi 18 millones), el tabaquismo (7 millones), el consumo excesivo de sal (más de 4 millones), el consumo de alcohol (3,3 millones) la diabetes (1,6 millones) y la vida sedentaria (1,6 millones). Al igual que con la pandemia, sencillas medidas draconianas que nos obligaran a cambiar hábitos de vida como hacer actividad física diariamente, reducir el consumo de sal y azúcar, evitar el alcohol y abolir el cigarrillo podrían ser más costo-efectivas44,45.
En menos de tres meses el COVID-19 se convirtió en pandemia. El tsunami que generó ha desbordado todos los sistemas de salud y confrontado a la comunidad médica con la ignorancia crasa en una enfermedad desconocida. Para enfrentarla, las sociedades científicas han intentado suplir la falta de experiencia y evidencia con guías basadas en recomendaciones de expertos46–51. En los primeros 6 meses de la pandemia se propusieron intervenciones farmacológicas basadas en supuesta plausibilidad biológica (tabla 2). Muchas de ellas se usaron «por compasión» asumiendo que «algo hay que hacer»52–55. Muy seguramente se hicieron más por desesperación olvidando la primera premisa de nuestro código sagrado: no hacer daño.
Posibles intervenciones farmacológicas en COVID-19
| Medicamento | Plausibilidad biológica | Evidencia y/o limitaciones |
|---|---|---|
| Cloroquina-hidroxicloroquina | Antiviral | No beneficios en estudios clínicos |
| Ivermectina | Antiviral | No beneficios en estudios clínicos |
| Plasma convaleciente | Antiviral | No beneficios en estudios clínicos |
| Remdesivir | Antiviral | Perfil de seguridad poco evaluado |
| Colchicina | Efectos antiinflamatorios | No beneficios en estudios clínicos y perfil de seguridad poco evaluado |
| Anticuerpos monoclonales: inhibir IL-6 | Efectos antiinflamatorios | Beneficios en estudios clínicos. Pueden aumentar riesgo de infección, reducido aclaramiento viral.Reduce mortalidad en pacientes hipoxémicos y/o ventilados |
| Corticoides | Posible beneficio en SDRA y sepsis de origen bacteriano | |
| Interferón | Simula respuesta antiviral innata | Reacciones adversas conocidas |
| Moduladores renina-angiotensina-aldosterona | Inhibe o modula unión del virus a receptor ACE-II | Deterioro de hipotensión y función renal |
Por otro lado, se sabe que la mortalidad del COVID-19 en UCI y en ventilación mecánica es muy alta56–65 (tabla 3).
Publicaciones que evalúan mortalidad en UCI y ventilador en COVID-19
| Estudio | Pacientes | Ingresaron UCI | Mortalidad UCI | Mortalidad de los ventilados |
|---|---|---|---|---|
| Wu C. (Wuhan)56 | 201 | 53 (26,4%) | 44(83%) | 65,7% |
| Zhou F. (Wuhan)57 | 191 | 50 (26%) | 72% | 32 en VM. Fallecieron 31(97%) |
| Huang C. (Wuhan)15 | 41 | 13 (32%) | 5 (38,5%) | 100% |
| Yang X. (Wuhan)58 | 710 | 52 | 32 (61,5%) | 37 en VM. Fallecieron 30 (81%) |
| Young BE. (Singapore)59 | 18 | 2 | 0 | 0 |
| Richardson S. (Nueva York)60 | 5.700 | 373 (14,2%) | 291 (78%) | 320 en VM mortalidad 88,1% |
| Cummings MJ. (Nueva York)61 | 1.150 | 257 (22%) | 101 (39%) | 203 (79%) en VM mortalidad 84 (41,3%) |
| Bhatraju PK. (Seatle)62 | 24 | 50% | 71% | |
| Arentz M. (Washington)63 | 21 | 67% | Requirieron VM (71%) falleció 75% | |
| ICNARC (Inglaterra) 64,65 | 2249 | 690 | 346(50,1%) | 388 en VM Fallecieron (83,8%) |
| Grasselli (Italia) 62 | 1.591 | 1591 | Fallecieron (26%) 920 aún estaban en UCI | 1150 (88%) requirieron VM26% fallecieron, pero 920 estaban aún en UCI |
| Zangrillo A. (Milan)66 | 73 | 73 | 17 (23,3%) pero 33(45%) seguían en UCI en ventilador | |
| Auld SC. (Emory)67 | 217 | 217 | 30% | 165 requirieron Ventilador. 35% fallecieron |
| Shi M. (China)68 | 161 | 161 | 31% | 70 requirieron ventilador. Mortalidad 68% |
| PRoVENT-COVID69 | 533 | Mortalidad hospitalaria 42%Mortalidad a 28 días 35% | ||
| Ferrando C.70 | 742 | Mortalidad a 28 días 32% | ||
| REVA network 71 | 4244 | Mortalidad hospitalaria 37%Mortalidad 28 días 30% | ||
| Grasselli G.72 | 301 | Mortalidad 28 días 36% | ||
| Namendys S.73 | 260.859 | Mortalidad hospitalaria 80,9% | ||
| SATICOVID 74 | 1909 | Mortalidad hospitalaria 58%,Mortalidad a 28 días 51% |
En la pandemia los medios de comunicación y las redes sociales traslaparon, en un enroque macabro, verdad y ficción. Se llegó a plantear que el ingreso en UCI, la intubación y el ventilador eran las causas primarias de la alta mortalidad. Por lo tanto, se difundió la idea, incluso en algunos médicos, que evitar la UCI, el tubo y el ventilador salvaría vidas75–79.
La realidad es que la pandemia ha obligado a que un médico atienda decenas de pacientes al tiempo, utilice ventiladores o equipos desconocidos, trabaje con un recurso humano poco entrenado y en áreas con estructura física inadecuada. Los epidemiólogos de campo, son quizá las personas más entrenadas en la atención de este tipo de desastres logísticamente hablando, y muy pocos hospitales, universidades e incluso países cuentan con el número apropiado de ellos; ninguno de nosotros se imaginó vivir algo similar, solo teníamos conocimiento de la capacidad instalada de nuestras instituciones, pero jamás nos dimos a la tarea juiciosa de plantear un escenario similar que nos permitiera pensar en la creación de hospitales flexibles para transformar áreas en verdaderas unidades de atención especializada80,81.
Un punto adicional que hace más difícil el análisis es la variabilidad que hay, de un país a otro y entre una institución y otra, en la frecuencia de intubación y la duración de la ventilación mecánica56–74. Pero esto no es nada nuevo. Algo similar se reportó durante la epidemia de polio de hace 70 años. En esa época la frecuencia de intubación entre Europa y Estados Unidos era muy diferente82,83. Y después de la epidemia de polio y antes de la pandemia ya se veía gran disparidad en los criterios de intubación y la frecuencia de uso de la ventilación mecánica no invasiva e invasiva84,85. Y esto puede depender de variables que muchas veces no aparecen en los estudios como la disponibilidad de recursos (camas de UCI, número de ventiladores) o la diferencia de criterios, más rígidos o flexibles, para decidir la intubación. Otro punto adicional es la edad; antes del COVID se sabía que la edad era un factor que impactaba en la mortalidad de pacientes en ventilación mecánica86. Todo esto debe ser considerado a la hora de interpretar la literatura en esta pandemia y sacar conclusiones.
En general, los estudios con más baja mortalidad: contaron con tiempo suficiente para prepararse; todos los pacientes fueron atendidos por el mismo equipo de trabajo experimentado; tuvieron una adecuada proporción personal/paciente; no hubo escasez ni falta de medicamentos, ventiladores o equipos de diálisis; el cuidado convencional no cambió; no hubo bajas masivas por contagio; el personal de salud no estaba abrumado; y/o la capacidad de la UCI no debió aumentar67,80,81,86.
La conclusión debe ser clara: una UCI es, además de camas y ventiladores, un recurso humano capacitado, un verdadero y valioso equipo de trabajo multidisciplinario, con diversos talentos que trabajan articulados para ofrecer el mejor servicio en las situaciones mas críticas de salud por las que puede atravesar un ser humano; se requiere una visión global e integral para obtener resultados favorables, trabajo arduo a la cabecera del paciente, prácticas basadas en la evidencia, ética profesional y experiencia para tomar las mejores decisiones que beneficien al paciente. Lo que siempre faltó, en los estudios con alta mortalidad, fue más recurso humano capacitado y experimentado67,80,81,86.
Nos ha pasado antes, una novedad nos deslumbra, la empleamos desesperados y luego la evidencia demuestra que era solo canto de sirenas. Y ahora hay una coyuntura adicional, la caja de resonancia de los medios de comunicación y las redes sociales se han convertido en un tsunami llamado infodemia. En la desesperación por encontrar una rápida solución a la pandemia hemos convertido reducidas observaciones o simples comentarios en redes sociales en dogmas clínicos olvidando y descartando múltiples décadas de investigación y ciencia87–92. Con ello no beneficiamos a nuestros pacientes. Probablemente los sometemos a un doble riesgo al usar tratamientos peligrosos sin evidencia suficiente y negarles manejos que han demostrado impactar en sobrevida87–92. Es fundamental que ante la falta de evidencia y experiencia aceptemos las premisas de no maleficencia (evitemos lo que puede hacer daño) y de beneficencia (no dejemos de hacer lo que esta demostrado que hace bien) (tabla 4).
Intervenciones que reducen mortalidad en pacientes ventilados
| Estudio | Pacientes | Intervención | Beneficio |
|---|---|---|---|
| ARMA87 | 861 | Ventilación protectora | Reducción de mortalidad de 40 a 31% (p=0.007), en días libres de ventilación mecánica de 12 a 10 (p=0,007) y días libres de falla orgánica de 15 a 12 (p=0,006) |
| Protocolo de sedación88 | 128 | Protocolo de despertar diario | Duración media de ventilador fue 4,9 días vs. 7,3 (P=0,004), estancia hospitalaria de 6,4 días vs. 9,9 días (P=0,02). |
| ACURASYS 89 | 340 | Relajación neuromuscular en SDRA | Mortalidad a 28 días fue 23,7% (95% CI, 18,1 a 30,5) vs. 33,3% (95% CI, 26,5 a 40,9) con placebo (P=0,05). |
| PROSEVA90 | 466 | Ventilación prona en SDRA | Mortalidad a 90 días 23,6% vs. 41% (P<0,001), con un HR de 0,44 (95% CI, 0,29 a 0,67). |
| Prueba de respiración espontánea91 | 300 | Prueba de respiración espontánea | Tiempo de ventilación mecánica de 4,5 días vs. 6 días (P=0,003). Tiempo de retiro del ventilador de 1 día vs. 3 días (P<0,001). Complicaciones en 20% vs. 41% (P=0,001). Costo total fue menor ($15,740, vs. $20,890; P=0,03); |
| ABC92 | 336 | Protocolo de prueba de despertar y prueba de respiración espontánea | Más días sin ventilador (3,1 días, IC del 95%: 0,7 a 5,6; p=0,02) y fueron dado de alta de UCI antes (9,1 días vs. a 12,9 días; p=0,01) y del hospital antes (14,9 días vs. a 19,2 días; p=0,04). Menos probabilidades de morir (HR 0,68; IC del 95%: 0,50 a 0,92; p=0,01). Número de casos necesario a tratar (NNT=7,4; IC del 95%: 4,2 a 35,5). |
La curiosidad y observación del hombre prehistórico, las juiciosas hipótesis de Galileo, la rigurosa inducción de Bacon, los razonamientos de Newton y el discurso del método de Descartes construyeron las bases del método científico. Este no es más que el camino hacia el conocimiento. La investigación científica pretende generar conocimiento de manera ordenada, metódica, racional y sistemática. Se basa en la observación, generación de hipótesis, la experimentación para lograr corroborar o rebatir la hipótesis93.
Parecería que con el COVID-19 hemos olvidado que la estrategia más segura para nuestro paciente es el largo y difícil camino del método científico. Actuamos como Fausto, ese doctor que despés de toda una vida en busca del conocimiento se desespera, se ofusca y, al reconocerse incapaz de saberlo todo, decide hacer un pacto con el diablo y logra la mediación de Mefistófeles para alcanzar todo el conocimiento entregándole a cambio su alma. Enfrentados al COVID-19, buscamos el camino fácil que nos ofrece el Mefistófeles del SARS-CoV-2 y a cambio le entregamos nuestra única arma, nuestra alma, el método científico. Pero, como clínicos, nuestro deber es darnos cuenta de que no es necesario estar en la antesala de la muerte para, como Goethe, exigir «luz más luz».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Leydis Lora por su colaboración con la infografía.