La hemorragia subaracnoidea aneurismática (HSAa) tiene una alta mortalidad y riesgo elevado de discapacidad entre los sobrevivientes. Ciertos biomarcadores funcionan como predictores de mal pronóstico y muerte en estos pacientes. Sin embargo, en algunos hospitales de México estos reactivos específicos no están disponibles y se busca encontrar bioquímicos accesibles, económicos y reproducibles.
ObjetivoDeterminar si las concentraciones séricas de leucocitos, plaquetas, glucosa, fósforo, potasio y lactato se relacionan con mal pronóstico y mortalidad en pacientes con HSAa.
Material y métodosEstudio observacional, descriptivo, retrospectivo, analítico, realizado de marzo de 2022 a septiembre de 2023 en pacientes que ingresaron a la Unidad de Cuidados Intensivos con HSAa. Mediante un muestreo a conveniencia no probabilístico se registraron los valores de leucocitos, plaquetas, glucosa, fósforo, potasio y lactato al ingreso y 24h subsecuentes. Estos parámetros se correlacionaron con mal pronóstico y mortalidad.
ResultadosDe 84 pacientes registrados, 18 fallecieron (21,4%), 14 presentaron infarto cerebral (16,7%) y 23 secuelas neurológicas (27,4%). El resto (n=29) permaneció sin secuelas neurológicas (34,5%). Los niveles de lactato>1,55mmol/L (AUC 0,698; p=0,005) presentaron significación estadística al ingreso, así como a las 24h con punto de corte>1,25mmol/L (AUC 0,743; p<0,001), seguido de niveles de leucocitos>8,7×10*3 (AUC 0,674; p=0,01) y plaquetas<158×10*3 (AUC 0,657; p=0,02). Ningún biomarcador presentó correlación significativa con pronóstico.
ConclusionesEn pacientes con HSAa se recomiendan los valores de lactato al ingreso y 24h posteriores para predecir mortalidad.
Aneurysmal subarachnoid hemorrhage (aSAH) has a high mortality and elevated risk of disability among survivors. Certain biomarkers function as predictors of poor prognosis and mortality in these patients. However, in most hospitals in Mexico these specific serum biomarkers are not available. The aim is to find accessible, economic and reproducible serum biomarkers.
ObjectiveTo determine whether serum concentrations of leukocytes, platelets, glucose, phosphorus, potassium and lactate are related to poor prognosis and mortality in patients with aSAH.
Material and methodsObservational, descriptive, retrospective, analytical study, conducted from March 2022 to September 2023 in patients admitted to the Intensive Care Unit with aSAH. By means of a non-probabilistic convenience sampling, levels of leukocytes, platelets, glucose, phosphorus, potassium and lactate were obtained at admission and 24h later. These parameters were correlated with poor prognosis and mortality.
ResultsOf 84 patients registered, 18 died (21.4%), 14 presented cerebral infarction (16.7%), 23 neurological sequelae (27.4%). The rest (n=29) remained without neurological sequelae (34.5%). Lactate levels>1.55mmol/L (AUC 0.698; p=0.005) presented statistical significance at admission, as well as at 24h with cutoff point>1.25mmol/L (AUC 0.743; p<0.001), followed by leukocyte levels>8.7×10*3 (AUC 0.674; p=0.01) and platelets<158×10*3 (AUC 0.657; p=0.02). No biomarker presented significant correlation with prognosis.
ConclusionsIn patients with aSAH, lactate values at admission and 24h later are recommended to predict mortality.
La hemorragia subaracnoidea (HSA) es una entidad nosológica que representa el 5% de todos los accidentes cerebrovasculares. Es considerada una urgencia neurológica con alta significación clínica dada su morbimortalidad, llegando a tener un gran impacto en la sociedad debido a su temprana edad de aparición y sobre todo a la discapacidad grave que genera1. Esta condición suele presentarse en su mayoría en mujeres, con un promedio de edad de 52 años2,3.
El origen de la hemorragia se asocia frecuentemente a la rotura de un aneurisma sacular4, donde el 15% muere en el momento de la rotura y el 45% fallece 30 días después1. Fisiopatológicamente, existe una desregulación vascular cerebral, disfunción en la microcirculación, microtrombosis, despolarización cortical y neuroinflamación5,6. Estos mecanismos generan una respuesta inflamatoria local y sistémica que culmina en una lesión celular7.
Este daño se ha estudiado a través de biomarcadores obtenidos por vía sanguínea, líquido cefalorraquídeo, orina, sudor y microdiálisis cerebral, los cuales pueden predecir el riesgo, optimizar el tratamiento y brindar un manejo individualizado posterior a una hemorragia subaracnoidea aneurismática (HSAa)8. Algunos de los biomarcadores ya estudiados son haptoglobina, niveles de IL-1 e IL-6, TNF-α, TNF-β, TNF-κ, oxihemoglobina, CK-BB, subunidades de neurofilamentos NF-H, mitocondrias extracelulares, MMP-9, TRX, NPY, micro-ARN circulante y gen del receptor de R-rianodina 1. Sin embargo, estos son difíciles de determinar en la mayoría de los hospitales ubicados en países en vías de desarrollo5,8.
Se han propuesto otros bioquímicos de bajo costo y reproducibles que también explican la lesión celular neuronal secundaria al proceso inflamatorio. Entre ellos encontramos algunos marcadores de respuesta inflamatoria sistémica, como: niveles de proteína C reactiva, leucocitos, glucosa sérica, niveles de potasio, índice de estrés (nivel de glucosa entre nivel de potasio) y dímero D. Estos biomarcadores representan una línea importante de estudio en procesos infecciosos, aunque su elevación también está presente en procesos inflamatorios de otra índole5,9.
Es necesario destacar que ante un accidente cerebrovascular de tipo hemorrágico, los diferentes mecanismos de lesión celular desencadenan hipoxia y depleción de energía, teniendo por resultado la producción de lactato, con incremento del estrés oxidativo y una respuesta celular metabólica desregulada. Por este motivo, ante una HSAa, el lactato constituye un marcador de lesión celular cerebral cuya elevación traduce una disfunción y/o agotamiento de la respiración aeróbica en ausencia de oxígeno, con deterioro de las funciones celulares dependientes de energía y depleción del ATP, lesión irreversible y muerte celular10,11.
El presente estudio analiza si existe relación entre biomarcadores séricos accesibles, económicos y reproducibles y mal pronóstico y mortalidad en pacientes con HSAa, para el que se tomaron en cuenta los niveles de leucocitos, plaquetas, glucosa, fósforo, potasio y lactato.
Material y métodosDiseñoEstudio observacional, descriptivo, retrospectivo y analítico, realizado en la Unidad de Cuidados Intensivos (UCI) del Instituto Mexicano del Seguro Social, Unidad Médica de Alta Especialidad, Hospital de Especialidades No. 1, Centro Médico Nacional del Bajío en León, Guanajuato, México, del 1 de marzo del 2022 al 30 de septiembre del 2023 en pacientes con diagnóstico de HSAa.
Previa autorización del comité local de ética y de investigación en salud, con número de registro R-2022-1001-068, se realizó un muestreo a conveniencia no probabilístico en el que se incluyeron la totalidad de los pacientes mayores de 18 años que ingresaron a la UCI con diagnóstico de HSAa evidenciada por tomografía computarizada, resonancia magnética y/o angiografía, con una estancia en la UCI de al menos 24h.
Fueron excluidos de este estudio los pacientes con HSA de origen no aneurismático, los pacientes con aneurisma cerebral sin HSA y aquellos que, pese al diagnóstico de HSAa, presentaran enfermedad renal crónica, hepatopatía crónica, neoplasia activa o algún proceso infeccioso documentado microbiológicamente hasta 72h antes del ingreso a UCI. También se eliminaron de este estudio los pacientes trasladados a otra unidad hospitalaria diferente a la nuestra, y aquellos que no contaran con los registros clínicos en el expediente clínico, necesarios para este protocolo de estudio.
MétodoDel expediente clínico se obtuvieron datos demográficos como el nombre del paciente, la fecha de ingreso a la unidad, el diagnóstico previo de hipertensión arterial sistémica y/o diabetes mellitus y el tiempo de inicio del cuadro clínico hasta su ingreso a la terapia intensiva. A los pacientes que ingresaron a terapia intensiva se les solicitaron niveles séricos de leucocitos, plaquetas, glucosa, fósforo, potasio y lactato al ingreso a UCI (M0) y 24h después (M24).
También se buscaron intencionadamente los registros de mal pronóstico y mortalidad, en donde se consideraron como parámetros de mal pronóstico los siguientes elementos: presencia de infarto cerebral documentado por tomografía simple de cráneo, secuela neurológica moderada a severa por escala de Rankin modificada entre 3 y 5, estado vegetativo evidenciado por un electroencefalograma con presencia de ondas polimórficas, ondas delta y theta y/o muerte cerebral confirmada con angiografía, gammagrafía o resonancia magnética de cráneo.
Análisis estadísticoPara el análisis estadístico se utilizó el programa estadístico SPSS® 25. Los datos se describieron mediante el uso de proporciones y porcentajes para las variables cualitativas, mientras que las variables cuantitativas se describieron mediante la media y la desviación estándar. La verificación de la normalidad se realizó mediante la prueba de Kolmogorov-Smirnov. Las variables cuantitativas continuas con distribución normal se presentaron como promedio y desviación estándar.
Para la asociación de la mortalidad y el pronóstico (valorado por la escala de Rankin) se realizó análisis de pruebas cruzadas mediante χ2. Se realizó análisis de correlación mediante la correlación de Pearson, teniendo en cuenta las escalas de valoración de HSAa, los días de estancia, los días de ventilación mecánica invasiva (VMI), la edad y los resultados de laboratorio tomados al ingreso y a las 24h. Para la comparación de variables cuantitativas intragrupo se realizó la prueba t para muestras relacionadas o la prueba de Wilcoxon, según la distribución de los datos.
Se realizaron gráficos de curva ROC y Kaplan-Meier para evaluar el mal pronóstico y la mortalidad con los biomarcadores al ingreso y a las 24h, así como las escalas de valoración para HSAa. Para todos los análisis estadísticos inferenciales se considerarán como significativos valores de p<0,05.
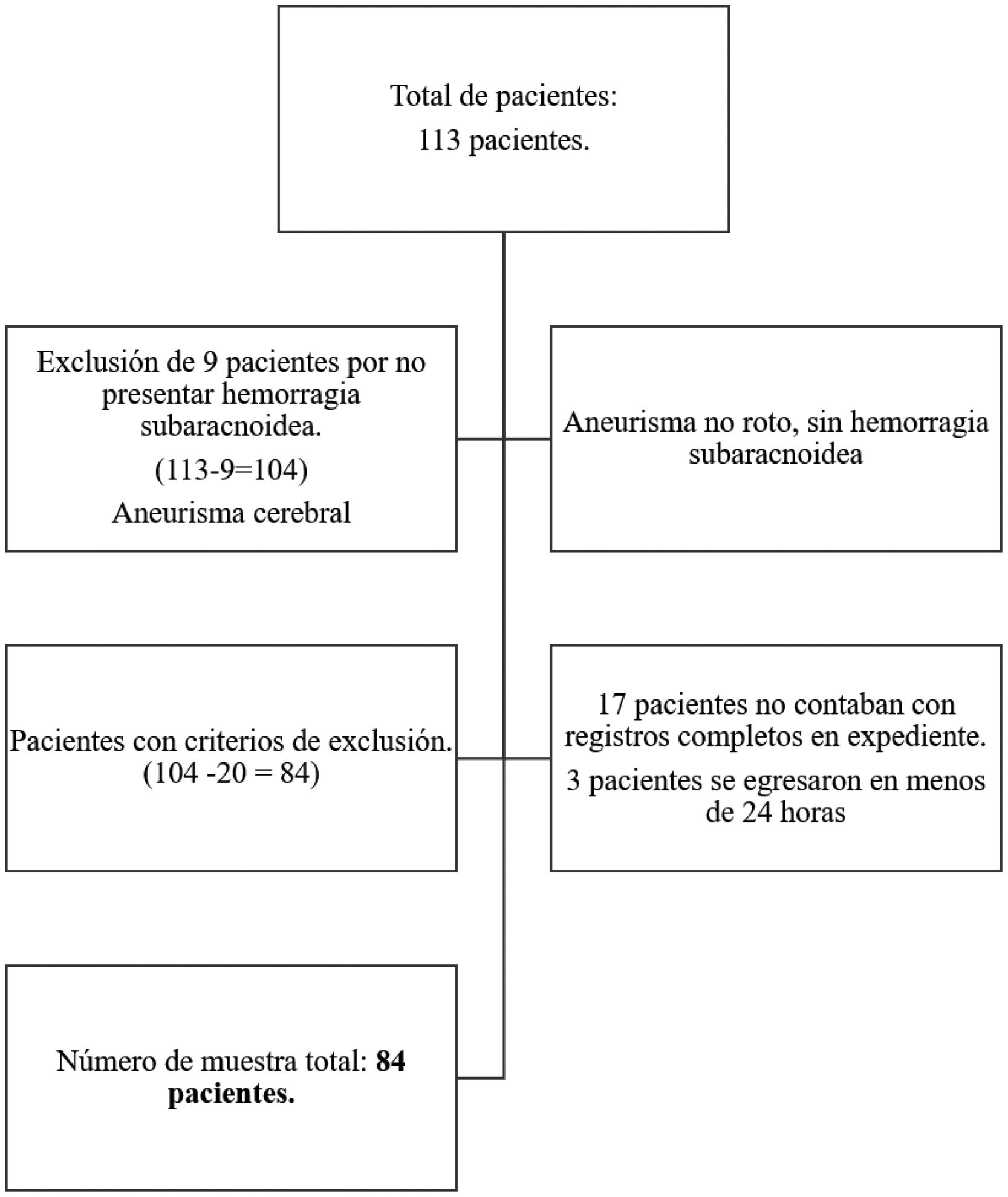
ResultadosDel 1 de marzo del 2022 al 30 de septiembre del 2023, se ingresaron 113 pacientes con diagnóstico de aneurisma cerebral a la terapia intensiva de la Unidad Médica de Alta Especialidad, Hospital de Especialidades No. 1, Centro Médico Nacional del Bajío, León, Guanajuato. Sin embargo, el tamaño total de la muestra se limitó a 84 pacientes, quienes cumplieron los criterios de inclusión especificados (fig. 1).
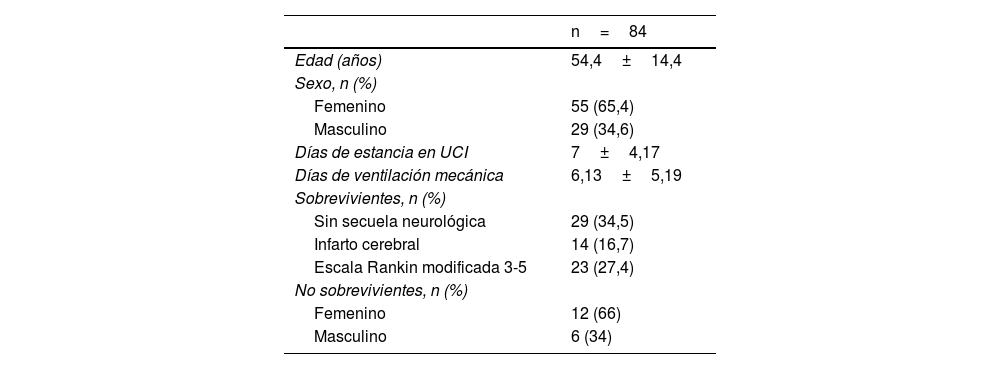
De los 84 pacientes que cumplieron con los criterios de inclusión, 55 fueron mujeres (65,5%) y 29 hombres (34,5%). La edad media fue de 55±14,4 años (tabla 1). Se realizó la prueba de t de Student para comparar la media de edad entre los pacientes sobrevivientes y los no sobrevivientes (p=0,9); 44 pacientes contaban con el diagnóstico previo de hipertensión arterial sistémica (52%) y 14 con diabetes mellitus tipo 2 (16,7%). A su ingreso a la UCI, 50 de ellos tenían apoyo con VMI (59,5%) y 34 estaban con respiración espontánea (40,5%). La estancia en UCI registró una media de 7±4,17 días y los días de VMI fueron 6,13±5,19 (tabla 1).
Características demográficas de la población en estudio
| n=84 | |
|---|---|
| Edad (años) | 54,4±14,4 |
| Sexo, n (%) | |
| Femenino | 55 (65,4) |
| Masculino | 29 (34,6) |
| Días de estancia en UCI | 7±4,17 |
| Días de ventilación mecánica | 6,13±5,19 |
| Sobrevivientes, n (%) | |
| Sin secuela neurológica | 29 (34,5) |
| Infarto cerebral | 14 (16,7) |
| Escala Rankin modificada 3-5 | 23 (27,4) |
| No sobrevivientes, n (%) | |
| Femenino | 12 (66) |
| Masculino | 6 (34) |
Los valores que no están expresados como proporciones se refieren a las medias±desviación estándar.
En la valoración tomográfica de los pacientes incluidos, 51 de ellos cumplieron con características de Fisher modificado iv (60,7%), 23 Fisher modificado iii (27,4%), 9 Fisher modificado ii (10,7%) y un paciente con Fisher modificado i (1,2%). De la escala clínica Hunt y Hess, tenían grado i 12 pacientes (14,3%), grado ii 24 pacientes (28,6%), grado iii 14 pacientes (16,7%), grado iv 21 pacientes (25%) y grado v 13 pacientes (15,5%). Al egreso de la UCI, 29 pacientes no presentaron ninguna secuela neurológica (34,5%) y 18 pacientes murieron (21,4%): 10 de ellos presentaron parada cardiaca (11,9%) y 8 pacientes muerte cerebral (9,5%). En términos de distribución de mortalidad por género, de las 18 defunciones 12 fueron mujeres (78,2%) y 6 hombres (79,3%).
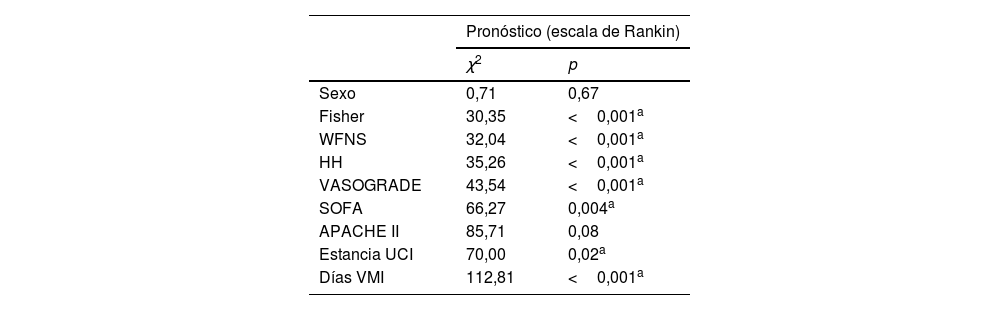
Se asoció la mortalidad con las diferentes escalas de severidad y pronóstico, como la escala Fisher modificada (χ2 8,24, p=0,04), la de la World Federation of Neurosurgical Societies (χ2 13,00, p=0,01) y VASOGRADE (χ2 10,66, p=0,01). En cuanto al resto de las escalas de valoración incluidas, Hunt y Hess, SOFA y APACHE, no se encontró significación estadística. Con respecto a los días de VMI, se obtuvo una p=0,03, estadísticamente significativa (χ2 29,16), mientras que los días de estancia (χ2 11,16, p=0,79) y el género (χ2 0,021, p=0,85) no representaron asociación con mortalidad. Respecto al pronóstico, valorado por la escala de Rankin modificada, todas las escalas de valoración presentaron significación estadística, excepto APACHE II (tabla 2).
Comparación de medias con pronóstico, escalas de valoración y variables demográficas
| Pronóstico (escala de Rankin) | ||
|---|---|---|
| χ2 | p | |
| Sexo | 0,71 | 0,67 |
| Fisher | 30,35 | <0,001a |
| WFNS | 32,04 | <0,001a |
| HH | 35,26 | <0,001a |
| VASOGRADE | 43,54 | <0,001a |
| SOFA | 66,27 | 0,004a |
| APACHE II | 85,71 | 0,08 |
| Estancia UCI | 70,00 | 0,02a |
| Días VMI | 112,81 | <0,001a |
HH: Hunt y Hess; UCI: Unidad de Cuidados Intensivos; VMI: ventilación mecánica invasiva; WFNS: World Federation of Neurosurgical Societies.
En la correlación del pronóstico valorado por la escala de Rankin modificada con las diferentes variables, la edad y los días de VMI, se reportaron con un valor de r<0,5. De las escalas de valoración de la HSAa, todas presentaron una correlación negativa con una p estadísticamente significativa, siendo la escala de VASOGRADE la que presentó mayor correlación (r=−0,599, p<0,001). Del resultado de los biomarcadores, ninguno obtuvo una correlación fuerte ni al ingreso ni a las 24h de ser medido (tabla 3).
Correlación de Pearson. Pronóstico vs. biomarcadores, escalas, edad, días de estancia y ventilación
| Pronóstico (escala de Rankin) | |||||
|---|---|---|---|---|---|
| Edad | r | 0,222 | |||
| p | 0,04a | ||||
| Fisher | r | −0,545 | |||
| p | <0,001a | ||||
| WFNS | r | −0,529 | |||
| p | <0,001a | ||||
| HH | r | −0,456 | |||
| p | <0,001a | ||||
| VASOGRADE | r | −0,599 | |||
| p | <0,001a | ||||
| SOFA | r | −0,473 | |||
| p | <0,001a | ||||
| APACHE II | r | −0,366 | |||
| p | <0,001a | ||||
| Estancia UCI | r | −0,186 | |||
| p | 0,09 | ||||
| Días VMI | r | −0,441 | |||
| p | <0,001a | ||||
| Leucocitos | M0 | r | 0,028 | M24 | −0,397 |
| p | 0,79 | <0,001a | |||
| Plaquetas | M0 | r | −0,119 | M24 | −0,198 |
| p | 0,27 | 0,07 | |||
| Fósforo | M0 | r | −0,007 | M24 | 0,111 |
| p | 0,54 | 0,28 | |||
| Potasio | M0 | r | −0,033 | M24 | 0,008 |
| p | 0,76 | 0,93 | |||
| Lactato | M0 | r | 0,329 | M24 | −0,261 |
| p | 0,01a | 0,01a | |||
HH: Hunt y Hess; M0: valoración al ingreso; M24: valoración a las 24h; UCI: Unidad de Cuidados Intensivos; VMI: ventilación mecánica invasiva; WFNS: World Federation of Neurosurgical Societies.
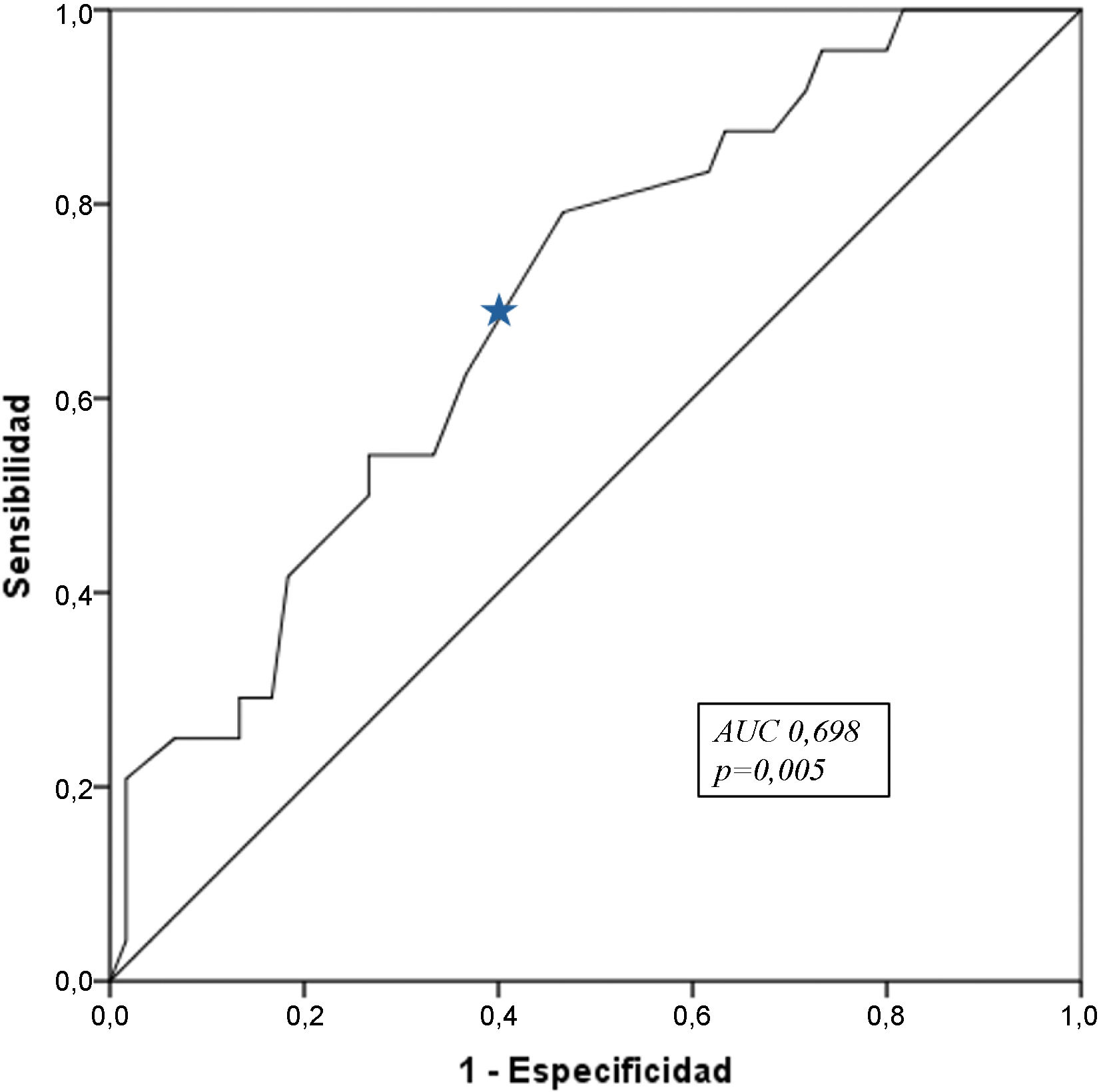
Se realizó un análisis ROC con los biomarcadores séricos al ingreso y a las 24h, para determinar cuál de ellos tenía mayor impacto en la mortalidad. Al ingreso, solo el nivel de lactato presentó significación estadística, con un área bajo la curva (AUC) de 0,698 (p =0,005), una sensibilidad del 95% y una especificidad del 80%, con un índice de Youden de 1,55mmol/L, lo que traduce que un valor superior a este incrementa la mortalidad en esta población de pacientes (fig. 2).
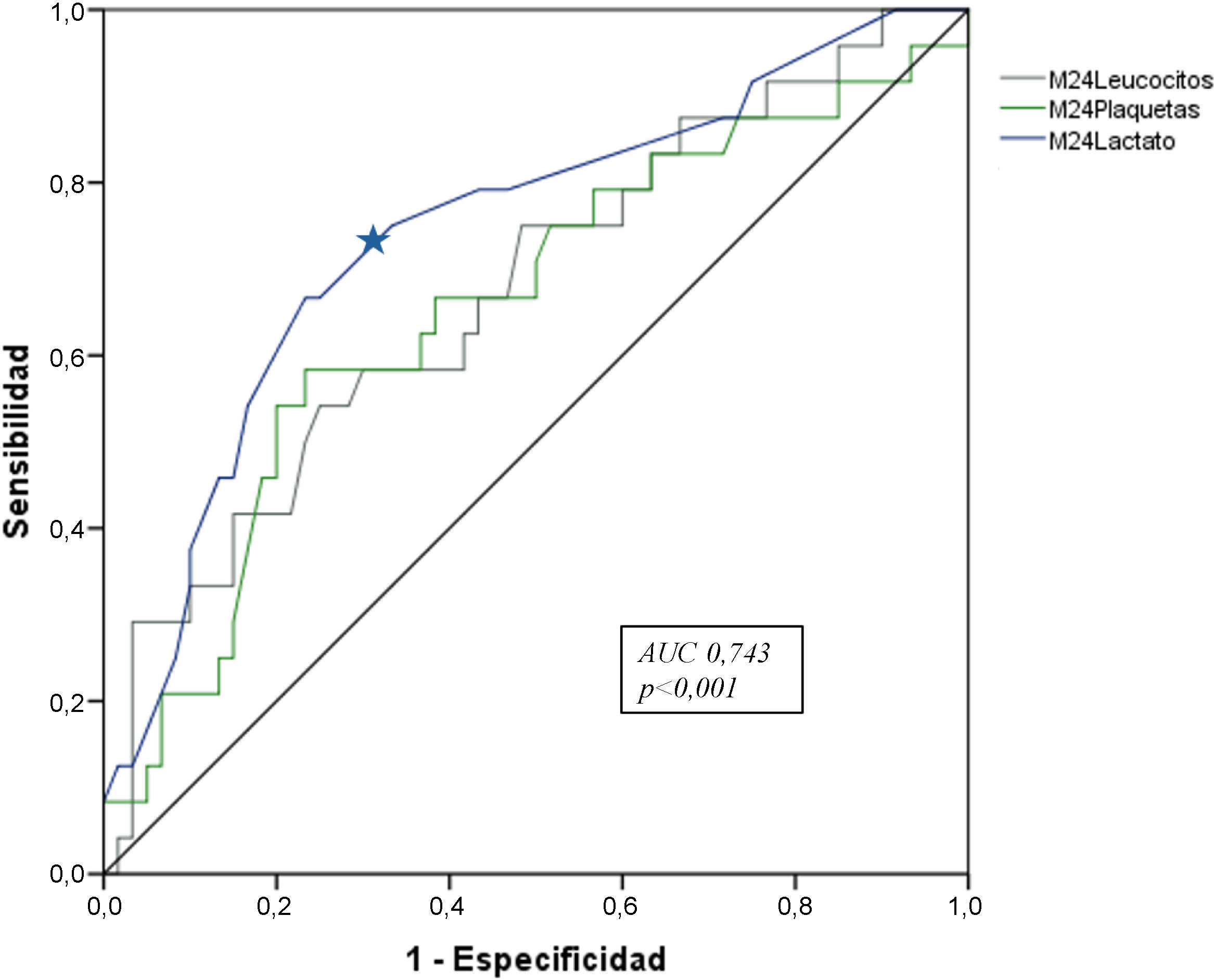
En la comparación del análisis ROC de los niveles séricos de los biomarcadores a las 24h (M24) con la mortalidad, los niveles séricos de lactato presentaron la mejor AUC con significación estadística (AUC 0,743, p<0,001), con una sensibilidad del 91% y una especificidad del 75%, para un valor de corte>1,25mmol/L, seguido del nivel de leucocitos (AUC 0,674, p=0,01) con una sensibilidad del 95% y una especificidad del 88% para un valor de leucocitos>8,7×10*3, y plaquetas (AUC 0,657, p=0,02; sensibilidad 91%, especificidad 86%) con un punto de corte<158×10*3 (fig. 3).
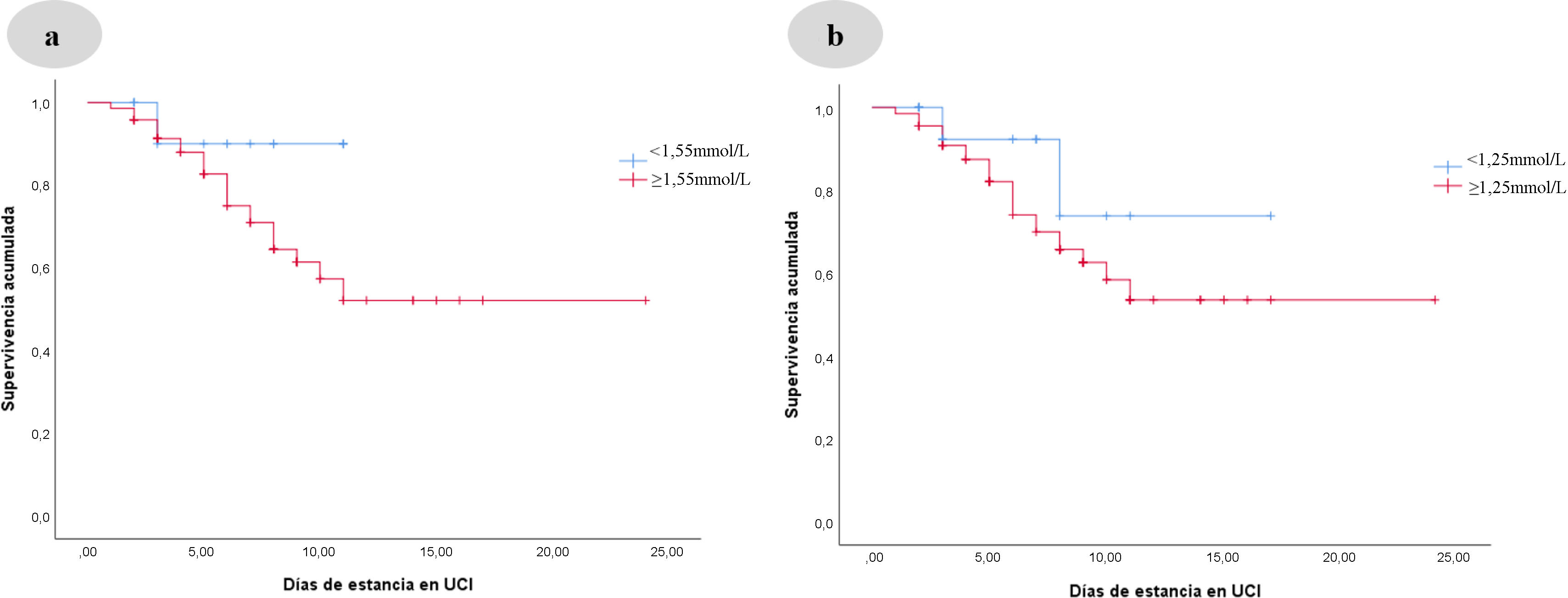
Posteriormente se segmentó la población en aquellos que tuvieron niveles ≥ 1,55 mmol/L de lactato al ingreso y se realizó un análisis de supervivencia en la Unidad de Cuidados Intensivos (días UCI) con curvas Kaplan-Meier; la supervivencia acumulada en el grupo donde con lactato < 1,55 mmol/L no presentó diferencias ni significancia estadística (Log-Rank 2,063, p = 0,151). En el seguimiento a las 24 h se dicotomizó la muestra utilizando el punto de corte de ≥ 1,24 mmol/L en los niveles de lactato. La supervivencia acumulada en aquellos con lactato < 1,25 mmol/L no presentó significancia estadística (Log-Rank 1,087, p = 0,271) (Figuras 4A y 4B). Cabe mencionar que tanto para el ingreso (M0) como para las 24h (M24) los pacientes que presentaron niveles de lactato<1,55mmol/L (M0) y<1,25mmol/L (M24) permanecieron menos días en la UCI, como se aprecia en la figura 4.
Se analizó la relación entre las escalas pronósticas SOFA y APACHE II y la mortalidad en pacientes con HSAa. En la escala SOFA se encontró una media de 5,1±3,5 puntos, siendo>7,5 el punto de corte que predice mortalidad (AUC 0,662, p=0,036), siendo una escala pronóstica adecuada en la población estudiada; para la escala APACHE II, la media fue 11,8±6,8 puntos, con punto de corte de 14,5 puntos para predecir mortalidad (AUC 0,638, p=0,74), por lo que el AUC y la p no fueron significativas.
DiscusiónLa HSAa es una urgencia neurológica con alta discapacidad y mortalidad. Esta entidad nosológica alcanza su punto álgido en adultos de mediana y avanzada edad, especialmente entre los 50 y los 60 años, siendo entre una y 6 veces más frecuente en mujeres que en hombres12. En un estudio realizado en Bélgica por Ndieugnou Djangang et al., en el que se evaluaron un total de 456 pacientes con el diagnóstico de HSAa, se encontró que la media de edad de la población fue de 54 años, compuestos en su mayoría por mujeres (64%)13. Estos datos demográficos se asemejan a los encontrados en el presente estudio, de una unidad de tercer nivel en México, donde la edad media de presentación de esta afección fue 54,4 años, siendo el 65,5% mujeres.
En las últimas 2 décadas, la mortalidad posterior a HSAa ha disminuido, con cifras reportadas de entre un 10 y un 24%14,15, lo cual concuerda con nuestro estudio, donde se reportó una mortalidad del 21,4%. En cuanto a la morbilidad, un metaanálisis reportó que el 55% de los pacientes lograron la independencia después de una HSAa, tras un seguimiento de uno a 12 meses, mientras que el 33% no pueden volver al trabajo o a su nivel anterior de empleo15. Nuestro estudio comprobó el impacto que tiene la HSAa en la sociedad, ya que pese a que la supervivencia alcanzó el 78,6%, más de la mitad de este porcentaje desarrolló algún grado de discapacidad moderada-severa secundaria a secuelas neurológicas derivadas de la isquemia cerebral.
Ante este panorama de fatal desenlace surge la necesidad de investigar de forma sistemática el impacto en la mortalidad y el pronóstico de diversos factores inflamatorios sistémicos en el contexto de la HSAa. Los exámenes paraclínicos de rutina reflejan estados fisiológicos y bioquímicos individuales, son fáciles de obtener en el momento del ingreso y pueden ayudar a evaluar precozmente el riesgo de una evolución complicada, por lo que han revolucionado el diagnóstico y tratamiento de muchas enfermedades, sobre todo en sepsis, ya que pueden medirse potencialmente en sangre y líquido cefalorraquídeo16,17.
La HSA promueve la inflamación tanto a nivel neurológico como a nivel sistémico. En respuesta al estrés, los pacientes experimentan una hiperactivación simpática que puede promover disfunción miocárdica, pulmonar, neurogénica, hiperglucemia e hiperlactatemia17. Estos fenómenos pueden observarse mediante biomarcadores séricos, siendo los más prometedores en pacientes con HSAa el dímero D, el lactato y la proteína C reactiva. Algunos estudios asocian también la presencia de hiperglucemia, trombocitopenia y leucocitosis con riesgo elevado de mala evolución11,17–19.
El lactato y la glucosa están estrechamente relacionados, ya que la glucosa es un precursor directo del lactato. Ante situaciones de estrés, los niveles circulantes de estos 2 metabolitos pueden aumentar16. Se ha descrito que en fases precoces de la HSA, la acumulación de lactato a nivel tisular cerebral (medido por microdiálisis o catéteres de bulbo yugular) se asocia de forma independiente a mortalidad y mala evolución neurológica. Sin embargo, el valor pronóstico de las concentraciones séricas tempranas de lactato en estos pacientes sigue estando mal definido20.
En un estudio retrospectivo realizado por Oh et al., donde se incluyeron 189 pacientes con HSAa, el valor del AUC de lactato sérico para predecir mortalidad en la HSA fue de 0,815 (IC 95%: 0,753-0,868, p<0,001), con un punto de corte de 2,3mmol/L (sensibilidad 87,5%; especificidad 68,5%)21. Esta cifra se puede comparar con lo observado en el presente estudio, donde>2,05mmol/L al ingreso en UCI y>1,25mmol/L 24h después fueron los puntos de corte asociados a mortalidad en HSAa.
Con respecto al uso del lactato como factor de mal pronóstico, se encontró en una revisión sistemática que el punto de corte en los niveles máximos de lactato iniciales asociados a mayor riesgo de infarto cerebral, isquemia cerebral retardada y mala evolución fue de 1,6mmol/L22. Esto también se observa en el estudio realizado por Ndieugnou Djangang et al., donde los pacientes con una evolución desfavorable presentaron niveles diarios de lactato persistentemente más altos durante los primeros 6 días tras el ingreso en la UCI que los pacientes con resultado favorable13. En contraste, en el presente estudio el lactato no fue un predictor útil para establecer mal pronóstico.
Por otra parte, McGirt et al. estudiaron el papel de la glucosa sérica en el desenlace de los pacientes con HSAa, logrando demostrar una asociación entre los niveles altos persistentes de glucosa y 7 veces más riesgo de mal pronóstico en este grupo de pacientes20. Para fines de nuestro estudio, la glucosa no tuvo un papel significativo como predictor de mal pronóstico y mortalidad (p=0,631).
Los niveles de glucosa sérica no solo se han estudiado de manera independiente, sino que se han combinado con bioquímicos como el potasio, el fósforo y la hemoglobina, 2 de los cuales se estudiaron también en el presente estudio. La hiperglucemia, la hipokalemia y la hipofosfatemia son problemas frecuentes en pacientes con HSAa.
Jung et al. estudiaron el cociente de glucosa sérica entre potasio como predictor de mortalidad en pacientes con este diagnóstico, y encontraron que al ingreso el 98,4% de los pacientes tenían hiperglucemia (>99mg/dL), el 26% hipokalemia y solo el 3% hiperkalemia. La glucosa plasmática y el cociente de glucosa entre potasio fueron significativamente mayores en el grupo de pacientes graves que en el de no graves, mismo caso para el grupo de pacientes no supervivientes (p<0,001). Encontraron un punto de corte de 37,8 en el radio de glucosa entre potasio para predecir la mortalidad a 3 meses, con una sensibilidad del 90,2% y una especificidad del 51,2%23. Fujiki et al. también reportaron que el radio glucosa-potasio, la glucosa sérica y el potasio en el momento de la admisión hospitalaria se correlacionaron con peores resultados a 3 meses de la HSAa24.
En un estudio retrospectivo realizado por Zhang et al., en el que estudiaron en 198 pacientes con HSAa el radio de glucosa sérica entre fósforo en el momento de la admisión hospitalaria, encontraron una asociación con mal pronóstico a 3 meses de la HSAa, vasoespasmo e isquemia cerebral retardada25. Además, los pacientes con malos resultados clínicos presentaron radios glucosa-fosfato sérico y glucosa-potasio más elevados que los pacientes que experimentaron buenos resultados clínicos (p<0,05). Hokari et al. también reportaron que la leucocitosis (p=0,003) y el índice glucosa/potasio (p=0,002) en el momento de la admisión hospitalaria funcionaron como predictores de mal pronóstico26.
Nuestro estudio no contempló usar los radios glucosa-potasio y glucosa-fosfato para evaluar pronóstico y mortalidad en pacientes con HSAa, y al tomarlos como factores independientes, los resultados no fueron favorables, con valores de p no significativos (fósforo p=0,506; potasio p=0,306).
Tras una HSAa, se produce una respuesta inflamatoria sistémica en la que intervienen citocinas y otros mediadores inflamatorios, cambios celulares en el parénquima del SNC y células inmunitarias periféricas, contribuyendo al retraso del deterioro neurológico que alcanza su punto máximo a las 24-48h. Se ha documentado que el aumento del recuento periférico de monocitos y de la proporción entre neutrófilos y linfocitos está relacionado con un peor pronóstico27. En el presente estudio no se valoró el impacto del recuento diferencial de leucocitos en el resultado.
Nuestro estudio encontró que los leucocitos funcionaron únicamente como predictores de mortalidad, con un punto de corte mayor de 10,7miles/mL al ingreso y mayor de 8,5miles/mL a las 24h. Sin embargo, los leucocitos no fueron útiles como factor de mal pronóstico, a diferencia de lo planteado por Mahta et al., quienes documentaron que el recuento máximo de leucocitos fue mayor en los pacientes con mal pronóstico (media 17,0miles/mL) que en los pacientes con pronóstico favorable (media 13,5miles/mL)28.
En humanos, la HSAa provoca un aumento de las citocinas/quimiocinas/mediadores de lípidos CXCL, factor activador de plaquetas, factor von Willebrand, así como factores derivados de las plaquetas (tromboxano), todos los cuales intervienen en la activación plaquetaria29. De ahí que se considerara el recuento plaquetario como factor de mal pronóstico y mortalidad. Sin embargo, nuestro estudio no demostró utilidad para el uso de este biomarcador, además de que no se encontraron estudios que hayan demostrado previamente esta asociación.
ConclusionesLa presente investigación exploró la asociación entre biomarcadores séricos accesibles, económicos y reproducibles con la mortalidad y el mal pronóstico en pacientes con HSAa en la UCI. Este estudio demostró la utilidad de los niveles séricos de leucocitos, plaquetas y niveles de lactato para predecir el riesgo de mortalidad temprana al ingreso y en las 24h posteriores. Asimismo, en este grupo de pacientes se recomienda la aplicación de la escala SOFA para predecir mortalidad.
Recomendaciones y limitacionesEntre las limitaciones de este estudio se incluye el tamaño de la muestra, así como el diseño del estudio, ya que es puramente observacional.
FinanciaciónLos autores declaran no haber recibido apoyo de ningún patrocinador ni recursos fuera de los otorgados por la institución médica.
Contribución de los autoresM. N. Gómez: conceptualización, metodología, validación, investigación, software, redacción-revisión y edición, visualización. H. E. Guerrero: conceptualización, metodología, validación, investigación, software, redacción-revisión y edición, visualización. F. J. Perea: investigación, recursos, curación de datos, redacción-borrador original. M. C. Islas: supervisión, visualización. P. L. González: recursos, supervisión. S. P. Nolazco: software, redacción, edición.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.