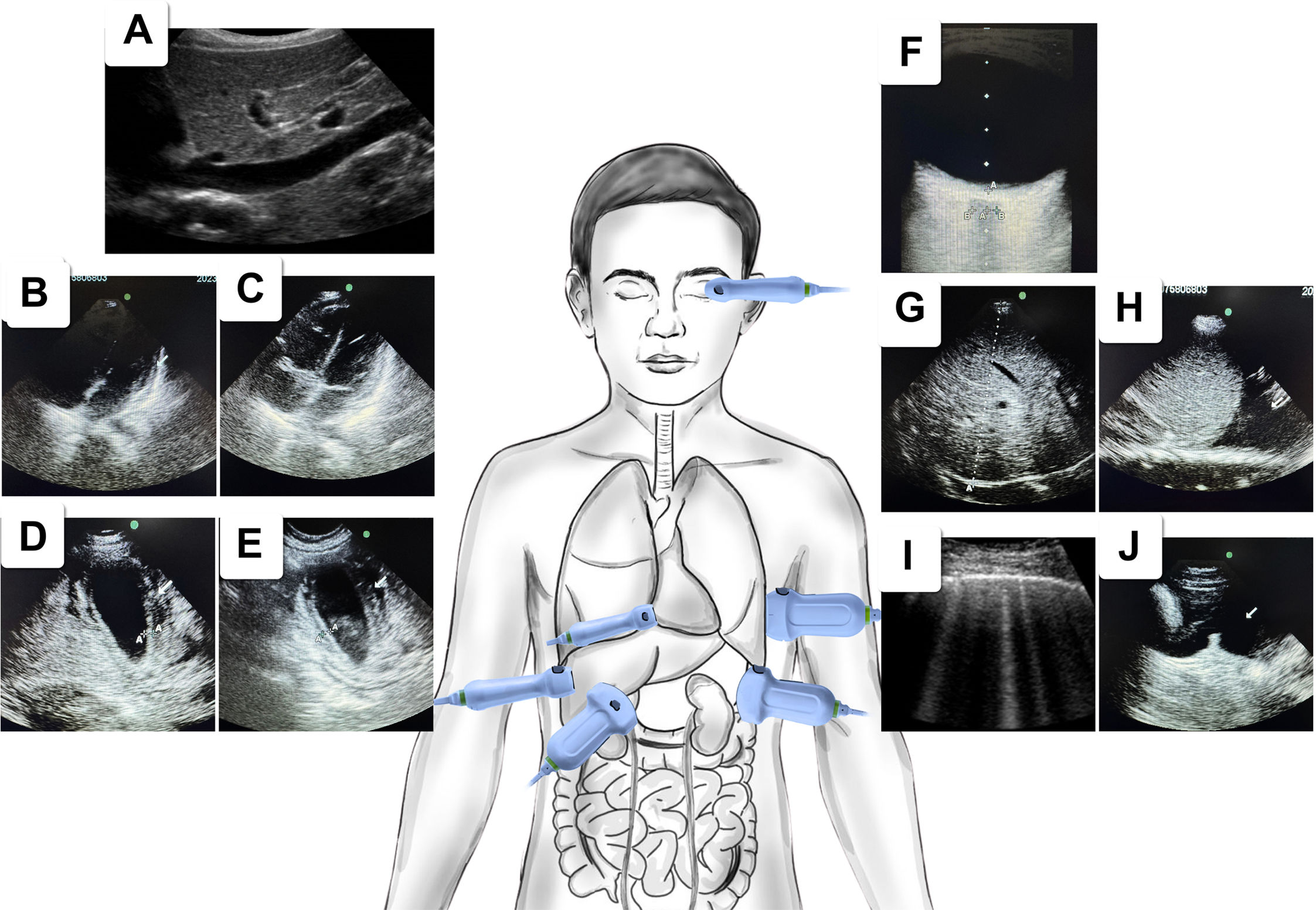
La infección por el virus del dengue (DENV) representa un problema de salud pública, particularmente en países tropicales y subtropicales como Colombia. La fuga vascular es el componente central en la fisiopatología del dengue grave y su evaluación se puede llevar a cabo mediante una ecografía. Esta herramienta no invasiva desempeña un papel crucial en el diagnóstico y la estratificación clínica, facilitando así intervenciones oportunas para prevenir complicaciones. El propósito fundamental de esta revisión consiste en detallar los hallazgos ultrasonográficos principales en pacientes con dengue que presentan signos de alarma, así como en aquellos con dengue grave, centrándose en la aplicación de la estrategia Point-of-Care Ultrasound (POCUS). Entre los hallazgos más comunes reportados en la literatura para pacientes con dengue, se incluyen el engrosamiento de la pared vesicular, derrame pleural, ascitis y derrame pericárdico. La incorporación del entrenamiento POCUS en la práctica clínica del dengue podría reducir tanto la tasa de mortalidad como los costos asociados a la atención de la salud.
Dengue virus infection is a public health problem, especially in tropical and subtropical countries like Colombia. Vascular leakage is the central component in the pathophysiology of severe dengue and can be assessed through ultrasound. As a non-invasive method, it can be used as a tool for both diagnosis and clinical stratification, providing timely management and avoiding complications. The aim of this review is to describe key ultrasonographic points in patients with dengue exhibiting warning signs and severe dengue, with a focus on the application of the Point-of-Care Ultrasound (POCUS) strategy. Among the most common findings reported in the literature for dengue patients are thickening of the vesicular wall, pleural effusion, ascites, and pericardial effusion. The integration of POCUS training into routine clinical practice for dengue has the potential to reduce both mortality rates and healthcare costs.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora