La ototoxicidad se define como el daño, reversible o irreversible, producido sobre el oído interno por diversas sustancias que se denominan ototóxicos y que causan una hipoacusia y/o una alteración del sistema vestibular.
La hipoacusia permanente afecta significativamente a la calidad de vida y es especialmente importante en el caso de niños. Es frecuente la falta o el retraso en su detección, dado que muchas veces progresa de forma poco llamativa hasta que afecta a la comunicación y al desarrollo global. Este impacto puede minimizarse siguiendo una estrategia de monitorización audiológica de la ototoxicidad, que permita su detección y tratamiento precoz. Se recomienda implantar dicha monitorización en los niños que van a ser tratados con cisplatino o aminoglucósidos.
Este documento de revisión y recomendaciones de la CODEPEH se enfoca a la detección precoz, la profilaxis, la otoprotección, el seguimiento y el tratamiento de la ototoxicidad por aminoglucósidos y antineoplásicos derivados del platino en la población pediátrica.
Ototoxicity is defined as the damage, reversible or irreversible, produced in the inner ear by various substances that are called ototoxic and that can cause hearing loss and/or an alteration of the vestibular system.
Permanent hearing loss significantly affects quality of life and is especially important in children. The lack or delay in its detection is frequent, since it often progresses in an inconspicuous manner until it affects communication and overall development. This impact can be minimized by following a strategy of audiological monitoring of ototoxicity, which allows for its early detection and treatment. This document recommends that children who are going to be treated with cisplatin or aminoglycosides be monitored.
This CODEPEH review and recommendation document focuses on the early detection, prophylaxis, otoprotection, monitoring and treatment of ototoxicity caused by aminoglycosides and platinum-based antineoplastics in the paediatric population.
Los medicamentos ototóxicos producen una alteración funcional y/o una degeneración celular de los tejidos del oído interno1.
La hipoacusia permanente por ototoxicidad afecta de forma significativa a la calidad de vida del paciente y es especialmente perjudicial en el caso de los niños, antes y durante la adquisición del lenguaje, porque afecta a su desarrollo psicosocial y a su educación2.
La hipoacusia derivada de los fármacos ototóxicos afecta inicialmente a las altas frecuencias del espectro auditivo. En este estadio, el paciente aún no ha notado ninguna dificultad auditiva. Dado que no se realizan de forma generalizada audiometrías pre- y postratamiento, las cuales son necesarias para evaluar la ototoxicidad, la incidencia real de la misma puede estar siendo subestimada3.
Los síntomas pueden aparecer tras haber finalizado el tratamiento o durante el mismo, y es más frecuente la afectación bilateral4.
Los efectos de la ototoxicidad habitualmente son permanentes. Sin embargo, la ototoxicidad de los diuréticos de asa, de los antibióticos macrólidos y de la quinina normalmente desaparece una vez finalizado el tratamiento. La ototoxicidad de los salicilatos se presenta si existe sobredosificación y remite al cesar la toma del medicamento. En cambio, los derivados del platino (especialmente el cisplatino) y los aminoglucósidos (AG) dañan de forma irreversible el oído interno5,6.
Aunque existen en la actualidad 600 fármacos que tienen un potencial ototóxico4, en este documento de recomendaciones de la Comisión para la Detección Precoz de la Hipoacusia infantil (CODEPEH) se estudiarán los medicamentos ototóxicos más utilizados en pediatría, como son los antibióticos AG y los agentes quimioterápicos derivados de los platinos7.
La ototoxicidad se puede presentar a cualquier edad y, aunque suele estar bien documentada, la magnitud global del problema y su incidencia se desconocen por varios motivos. Entre otros, por la existencia de una variedad de criterios para definirla, por la variabilidad consecuencia de un amplio rango de reacciones a un fármaco en los diferentes grupos étnicos, por la utilización de diferentes protocolos audiológicos para su valoración y, también, debido a la ausencia de derivación a los servicios especializados por ser una complicación que no amenaza a la supervivencia, y que además puede ser reversible8.
La ototoxicidad relacionada con el cisplatino se suele presentar entre el 23 y el 50% en adultos y en el 60% en los niños2,9, pero con gran variabilidad entre los porcentajes registrados (del 1,7% al 90,1%). Sin embargo, ciertos estudios han observado alteraciones en los umbrales audiométricos hasta en el 100% de los pacientes tratados con cisplatino10; mientras que se estima que esto ocurre en el 63% de los que reciben AG y en el 6-7% de los tratados con furosemida11.
Un problema frecuente es el retraso en la detección de la hipoacusia causada por la ototoxicidad, ya que puede ser variable e inconsistente. A menudo progresa de forma indolente hasta que se ponen de manifiesto los importantes problemas de comunicación y de calidad de vida que ocasiona. Pero este impacto puede ser minimizado siguiendo un programa de monitorización audiológica de la ototoxicidad que permita la detección precoz y el tratamiento temprano de la misma8.
El hecho de que los niños que presentan una hipoacusia neurosensorial moderada o severa debida a ototoxicidad muestren un deterioro significativo en su desarrollo global, en la adquisición de la lectura y el análisis matemático a los 5 años12, y que estas secuelas puedan ser evitadas con el oportuno tratamiento audiológico, hace que la atención audiológica cobre gran relevancia desde el inicio del tratamiento ototóxico: si a pesar de todas las medidas preventivas se presentase un daño ototóxico permanente se ha de considerar la rehabilitación auditiva mediante dispositivos como audífonos, implantes o tecnologías y otros productos de apoyo a la audición, combinados con la intervención logopédica necesaria para atender al desarrollo del lenguaje oral y la comunicación13.
El primer aspecto a analizar es que, a pesar de las recomendaciones, la vigilancia de la ototoxicidad infantil es insuficiente. Un 72% de los pacientes considerados de riesgo han sido sometidos a test audiológicos durante el seguimiento y solamente un 43% han sido seguidos con una monitorización audiológica completa antes y después del tratamiento13.
Dado el gran número de medicamentos potencialmente ototóxicos, es poco realista plantearse una monitorización de cada uno de ellos. Sin embargo, la detección precoz de la ototoxicidad, aun antes de que los pacientes la perciban, puede permitir tratamientos tempranos (por ejemplo, buscar alternativas terapéuticas, modificación de dosis y aplicación de sustancias protectoras) y minimizar, o incluso evitar, la progresión de la misma. Así, la monitorización audiológica debe ser un cuidado estándar de los pacientes que van a ser tratados con cisplatino o antibióticos AG, dado que dichos medicamentos pueden inducir una hipoacusia permanente14.
El presente documento de revisión y recomendaciones de la CODEPEH se enfoca a la detección precoz, profilaxis, otoprotección, seguimiento y tratamiento de la ototoxicidad sobre el laberinto anterior por antibióticos AG y antineoplásicos derivados del platino en la población pediátrica.
Fisiopatología de la ototoxicidadHay varias clases terapéuticas implicadas en la ototoxicidad. Las principales son los antibióticos AG, los macrólidos, los salicilatos, los diuréticos de asa, algunos antimitóticos (sales de platino) y la quinina y sus derivados15. Los fármacos ototóxicos representan una de las principales causas de sordera que pueden prevenirse16.
Los ototóxicos alcanzan el oído interno por la stria vascularis al ser transportados por la sangre o pueden difundirse a través de la ventana redonda hacia los tejidos cocleares tras una administración tópica o intratimpánica17,18, donde pueden dañar las células ciliadas internas y externas, las células de soporte, las células del ganglio espiral y el nervio auditivo, aunque el daño de las células ciliadas es el efecto primario de la ototoxicidad.
Los de administración tópica puentean la barrera hematolaberíntica y acceden directamente al oído interno. Esto hace que la administración tópica incremente la concentración en el sitio de administración y aumente su absorción y toxicidad17. La eliminación del fármaco mezclado con los fluidos del oído interno se lleva a cabo por la absorción de las células epiteliales de la stria vascularis y de las células oscuras de la cóclea y vestíbulo para después llevarlo al torrente sanguíneo.
AG: Son un grupo de fármacos ampliamente usados en infecciones graves. Su acción es bactericida, con diversos puntos de acción, como son la alteración de la membrana plasmática, la absorción de fármacos y la unión intracelular a subunidades ribosómicas y otra maquinaria celular19. Aunque pueden producir toxicidad renal y coclear, parece ser que no hay una relación entre la disfunción renal y el grado de pérdida auditiva que se produce20,21. Existe una base genética para la pérdida auditiva inducida por AG debida a mutaciones en el ARNr 12S humano22. Asimismo, hay que tener en cuenta que el aclaramiento de los AG es más lento en el oído interno que en el suero y, por ello, existe una latencia en los efectos ototóxicos de los AG, pudiendo observarse un inicio más tardío de la hipoacusia que se prolonga después de la interrupción del tratamiento. De esta forma, se recomienda monitorizar sus efectos ototóxicos en el paciente hasta al menos 6 meses después. La toxicidad de los AG varía en su predilección por la cóclea o por el vestíbulo. La gentamicina y la estreptomicina son más vestíbulo-tóxicas y la dihidroestreptomicina, la amikacina y la neomicina son fundamentalmente cocleotóxicas. Por potencia ototóxica, en orden decreciente, habría que mencionar: la neomicina, la gentamicina, la kanamicina, la tobramicina, la dihidroestreptomicina, la amikacina y la netilmicina23. La toxicidad coclear produce una pérdida de audición que generalmente comienza en las frecuencias agudas y se explica por la destrucción irreversible de las células ciliadas en el órgano de Corti, predominantemente en el giro basal de la cóclea. En el sistema vestibular, las células ciliadas de tipo i son más sensibles a la toxicidad de los AG que las células ciliadas de tipo ii24. Aunque los mecanismos exactos de la ototoxicidad no se conocen totalmente, se piensa que puede ser multifactorial, induciendo el daño a las células ciliadas sensoriales y no sensoriales por alterar funciones homeostáticas en el oído interno que modulan directamente la función de las mismas. También pueden producirse lesiones en la vía neural, desde la periferia del oído interno a la corteza cerebral, interrumpiendo percepción auditiva y vestibular. Los AG se unen dentro de las células a numerosas proteínas, pudiendo implicar múltiples mecanismos, mediante los cuales estos fármacos pueden inducir la muerte de las células ciliadas25. Se ha demostrado que los AG producen apoptosis activando las caspasas. En estudios en animales e in vitro se ha comprobado que, inhibiendo estas enzimas, se pueden prevenir las lesiones ototóxicas de los AG26. Los AG también pueden producir ototoxicidad si son administrados por vía local, aunque solo se observa si se emplean gotas en pacientes con perforación timpánica15. Un estudio sobre ototoxicidad tópica con gentamicina y neomicina en la otitis media supurativa crónica demostró una alta tasa de afectación coclear y vestibular. Por ello, no se recomienda su utilización en estos procesos27. Solo se recomendaría el uso de AG tópicos ante el fracaso de un tratamiento previo con agentes no ototóxicos, aunque su aplicación no debe prolongarse más de 10 días15.
Quimioterápicos derivados del platino: La ototoxicidad del cisplatino aumenta con el nivel de cada dosis individual, la dosis acumulada de cisplatino, la irradiación craneal simultánea, la exposición al ruido, la administración conjunta de otros fármacos ototóxicos o nefrotóxicos, la discapacidad auditiva preexistente o la insuficiencia renal. A diferencia de los AG, los niños menores de 4 años de edad son los más susceptibles a la pérdida auditiva inducida por cisplatino en comparación con los más mayores. Como numerosos pacientes con cáncer toleraron su terapia de cisplatino programada sin ningún signo de discapacidad auditiva y otros pacientes experimentaron ototoxicidad después de su primera dosis de cisplatino, se fomentó la búsqueda de un marcador genético individual que predijera el riesgo de los pacientes28. El transporte de cisplatino a través de la membrana celular se realiza por medio de transportadores de membrana CTR1. En condiciones fisiológicas el sustrato del CTR1 es el cobre monovalente (Cu+), que es esencial para distintas reacciones enzimáticas29. El cisplatino se liga con los mismos receptores ricos en metionina extracelulares que el Cu+, permitiendo de este modo su entrada en la célula. Además, se ha comprobado que la administración de sulfato de cobre de forma intratimpánica, un inhibidor del CTR1, puede prevenir la hipoacusia causada por el cisplatino30. La ototoxicidad se produce en el núcleo de la célula, y se relaciona con el desencadenamiento por parte del fármaco de una cascada apoptótica31. Los moduladores clave de la apoptosis son una familia de quinasas conocidas como proteinquinasas activadas por mitógenos. Los productos de la vía apoptótica se translocan a las mitocondrias, dando lugar a la liberación del citocromo C, que dispara la apoptosis dependiente de la caspasa32. El cisplatino causa el aumento de los niveles de especies reactivas de oxígeno, que también activan la vía apoptótica antes descrita33. El daño de las células ciliadas de la cóclea es el responsable de la hipoacusia que causa esta ototoxicidad. Las células ciliadas externas de la espira basal de la cóclea son las inicialmente afectadas, lo que es consistente con la observación clínica de que las frecuencias agudas del espectro auditivo son las primeras en alterarse. Si continúa la exposición al cisplatino, el daño progresa a las espiras media y apical y a las células ciliadas internas, con lo que las frecuencias medias, que incluyen las frecuencias conversacionales, se alteran.
Estrategias de monitorización audiológica y seguimientoLas técnicas de monitorización deben ser eficaces, sensibles y específicas para permitir la comparación de los resultados audiológicos durante el curso del tratamiento ototóxico, la detección precoz de cambios en los umbrales auditivos, para posibilitar la toma de decisiones sobre cambios en el tratamiento dirigidos a prevenir el deterioro auditivo, y la indicación de la rehabilitación auditiva más apropiada con el fin de minimizar los efectos negativos de la ototoxicidad. Deben, además, contemplar los principios de detección precoz y tratamiento temprano que rigen en todas las actuaciones en audiología infantil.
La técnica considerada como patrón de referencia para la monitorización audiológica durante un tratamiento con ototóxicos es la audiometría tonal, aunque el uso de pruebas objetivas es imprescindible en aquellos pacientes muy jóvenes o con gran afectación del estado general34.
Los métodos audiológicos recomendados para evaluar la audición de los niños sometidos a tratamientos oncológicos no difieren sustancialmente de los empleados en otras situaciones clínicas. Sin embargo, existen desafíos que hay que conocer y manejar en este contexto. Algunas de estas dificultades se solventan con facilidad modificando las técnicas audiométricas, como puede ser la introducción de actividades creativas que eviten el tedio a un niño que va a ser sometido a pruebas seriadas. Si es posible, se recomienda obtener una audiometría lo más detallada posible (audiometría basal) antes de iniciar el tratamiento para que las futuras audiometrías seriadas puedan focalizarse en las altas frecuencias del espectro, ya que son críticas para determinar la aparición de una hipoacusia. También es importante tener en cuenta que los fármacos quimioterápicos y la radioterapia craneal predisponen a los niños a presentar otitis media serosa de forma crónica, por lo que hay que someterlos con frecuencia a una audiometría por vía ósea.
Todas estas dificultades hacen necesaria la realización en muchos casos de pruebas complementarias objetivas como las otoemisiones acústicas, los potenciales evocados auditivos de tronco cerebral (PEATC) y los potenciales evocados de estado estable34.
Dentro de las otoemisiones acústicas, los productos de distorsión (DPOAE) pueden estudiar frecuencias altas y proporcionan información útil del estatus coclear de los niños tratados con quimioterapia. Experimentan una reducción de su amplitud antes de que se puedan registrar cambios en los umbrales auditivos en la audiometría convencional, con lo que se logra una muy precoz detección de la hipoacusia.
Los potenciales evocados mediante burst o los de estado estable son muy recomendables para conocer la respuesta en el rango de 0,5-4kHz, aunque de manera aislada se considere inadecuada para la monitorización de la ototoxicidad y se recomiende siempre, para una valoración fiable, un abordaje combinado de audiometría conductual, con potenciales evocados y/o DPOAE.
La forma más efectiva para la detección precoz de los signos de ototoxicidad es la monitorización prospectiva de la sensibilidad auditiva. Aunque no se pueda alterar el tratamiento ototóxico en muchas ocasiones (modificación de las dosis o cambio de fármaco), la monitorización ofrece una oportunidad para atender de forma temprana la hipoacusia y evitar las secuelas que conlleva.
Un protocolo completo de monitorización audiológica de la ototoxicidad en la población pediátrica ha de contar con una evaluación basal, previa a recibir el tratamiento, seguida de pruebas audiológicas en el curso del tratamiento (quimioterápicos derivados del platino) y de pruebas audiológicas al finalizar el mismo13.
- •
Evaluación basal. Historia clínica incluyendo información sobre exposición previa a agentes ototóxicos, ruido u otros factores de riesgo. Otoscopia. Timpanometría. Audiometría tonal (aérea y ósea). DPOAE, PEATC y potenciales evocados de estado estable solamente en pacientes que no pueden colaborar en la audiometría tonal.
- •
Evaluación durante el tratamiento. Se recomienda realizar otoscopia, timpanometría y audiometría tonal. Si es posible, se obtendrán DPOAE. En el caso de tratamiento con cisplatino, esta monitorización se programará tras cada ciclo, especialmente cuando se administren 200mg/m2, o si se alcanza una dosis acumulada de 400mg/m2.
- •
Evaluación al finalizar el tratamiento. Se recomienda realizar la evaluación completa como la basal. Los pacientes que recibieron cisplatino serán evaluados tan pronto como sea posible al finalizar los ciclos con visitas de revisión a los 3, 6, 9 y 12 meses tras completar el tratamiento y después anualmente hasta los 10 años.
Asimismo, los pacientes que se sometan de forma añadida a radioterapia craneal deben ser evaluados antes de la misma y después de finalizarla, no considerándose necesario durante el tratamiento.
Una vez que se obtengan los resultados de la evaluación es importante transformarlos en información interpretable por los demás profesionales implicados, de forma que se facilite una comunicación ágil. Para ello, se debe contar con un sistema de clasificación de la gravedad de la hipoacusia causada por un efecto ototóxico, estandarizado y ampliamente aceptado.
En una comparación de 5 escalas de clasificación de la gravedad de la hipoacusia por ototoxicidad (Muenster, International Society of Paediatric Oncology Boston Ototoxicity [SIOP], Brock, Chang y CTCAEv4.03) se demostró que, en general, presentan un buena concordancia entre ellas, y aunque existen diferencias en las definiciones de los resultados funcionales, lo importante no es la escala que se emplee, sino que se monitorice la función auditiva a lo largo de la aplicación de un tratamiento potencialmente ototóxico35.
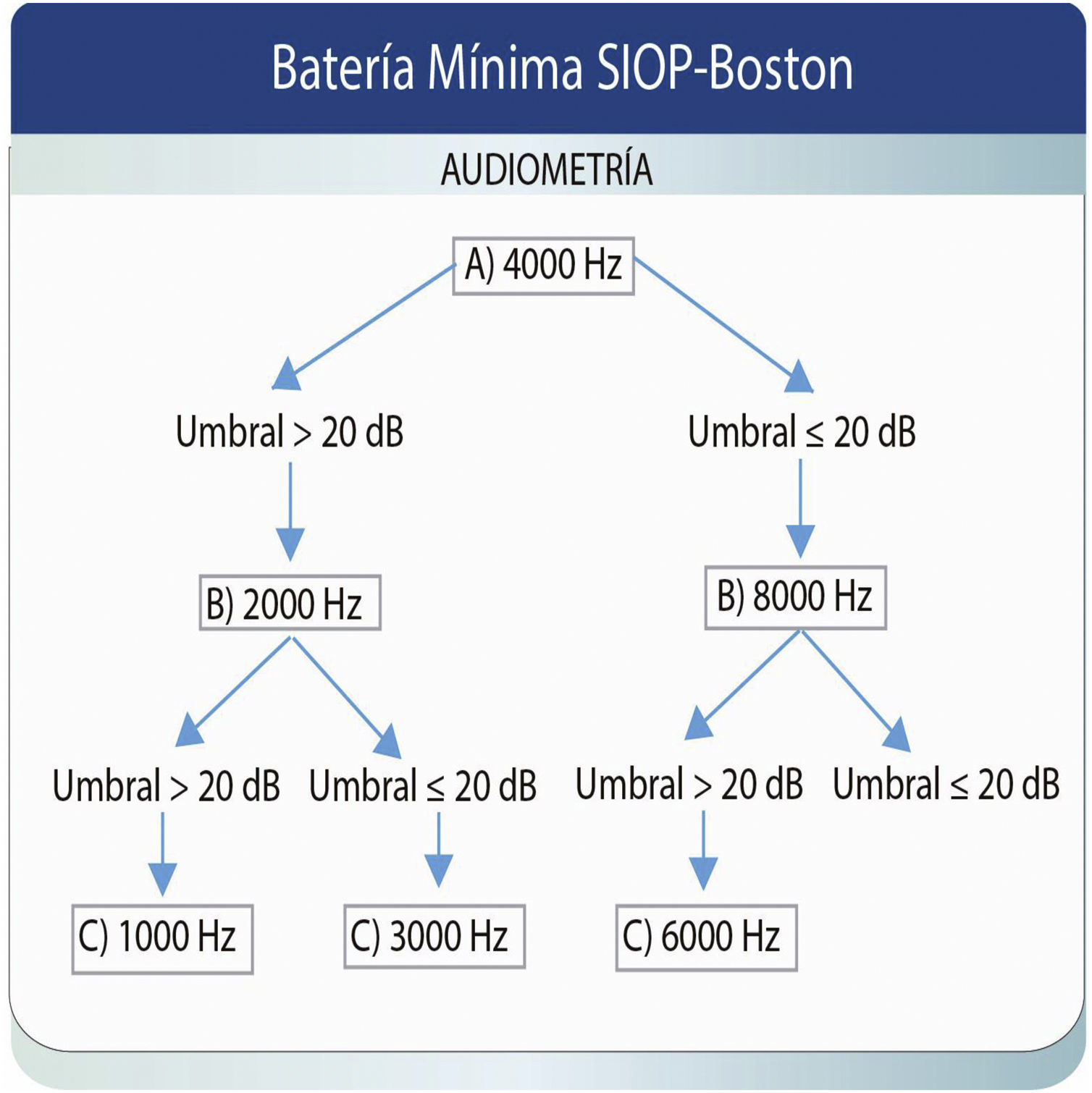
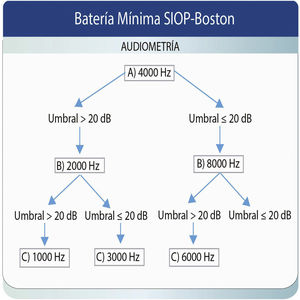
Basándose en los trabajos de Lewis et al.36, y como resultado de un consenso internacional para reportar los resultados audiológicos en ensayos clínicos internacionales para pacientes pediátricos tratados con quimioterápicos derivados del platino, nació la clasificación de la SIOP14. Es una escala de 5 puntos que adopta componentes de otras clasificaciones como la de Brock, CTCAE, Chang y Muenster. Aunque esta última detecta la pérdida auditiva antes en el tiempo y hace una mejor predicción de la necesidad de adaptar audífonos al final del tratamiento, se precisan más estudios para encontrar un sistema de clasificación óptimo, que posea una alta correlación entre el resultado de la clasificación y el resultado funcional, comprensible y de fácil aplicación. La escala SIOP-Boston utiliza solamente 4 categorías, con grados que se corresponden con el resultado funcional, basado en pérdidas significativas de la audibilidad del espectro del habla. Para su creación, los autores combinaron las cualidades de las escalas del Children‘s Hospital Boston, Brock y Chang, creando una escala que se basa en la medida de los umbrales audiológicos absolutos, que es sensible a las pérdidas en las altas frecuencias, a las pérdidas leves, y puede ser fácilmente implementada en la clínica14.
Otros ensayos clínicos oncológicos apoyan el uso internacional de la escala SIOP-Boston para la clasificación de la ototoxicidad infantil. Es, por tanto, recomendable el uso de la misma para la monitorización de la ototoxicidad en los niños ya que permitirá notificar unos resultados consistentes y estandarizados entre las distintas instituciones y representa una oportunidad para la actualización y validación de las clasificaciones de la cocleotoxicidad37. Los recientes avances en el tratamiento del cáncer, la otoprotección y los factores genéticos relacionados con la ototoxicidad apoyan más si cabe esta necesidad34.
Aunque muchas escalas previamente desarrolladas prevén la realización de una evaluación basal, en muchas ocasiones es imposible llevarla a cabo. La escala de gradación de la ototoxicidad SIOP-Boston no precisa esta evaluación basal ya que los criterios de clasificación se basan en umbrales auditivos absolutos. Además, es sensible a pequeños cambios de los mismos en las altas frecuencias, con lo que su valoración es relevante para documentar la reducción en la audibilidad de importantes fonemas del habla. Asimismo, este sistema necesita conocer los umbrales de muy pocas frecuencias para asignar con éxito el grado de afectación de la audición. La escala se muestra en la figura 1 y en la tabla 1 se ilustra el procedimiento de obtención de los umbrales necesarios.
El panel de expertos que desarrolló la escala SIOP-Boston recomendó una batería audiométrica mínima para ayudar al clínico a priorizar el orden de las frecuencias a explorar14. Esta batería mínima no pretende reemplazar a la audiometría diagnóstica completa, sino que reconoce el desafío que supone llevar a cabo una exploración exhaustiva en un niño enfermo. Los grados 0 a 4 se pueden asignar en función de la gravedad de la hipoacusia y ninguno requiere evaluar más de 3 frecuencias38. En España se ha empleado esta clasificación en un estudio de la ototoxicidad por quimioterápicos derivados del platino en una serie de pacientes pediátricos39.
Este planteamiento de vigilancia de la hipoacusia causada por la ototoxicidad también ha de ser aplicado en los casos que reciban cualquier otro fármaco ototóxico, como los AG.
En el caso de los neonatos tratados con ototóxicos la valoración dentro del programa de cribado descartará la existencia de una hipoacusia, y el seguimiento recomendado en el futuro detectará la hipoacusia de desarrollo tardío si acontece40.
En otros contextos, como puede ser el de una enfermedad infecciosa grave en niños fuera del programa de cribado (sepsis, pielonefritis…), en el que haya que emplear AG, ha de realizarse la batería mínima del sistema SIOP-Boston para detectar o clasificar una hipoacusia con el posterior seguimiento o, en su defecto, utilizar técnicas objetivas complementarias, como los PEATC, las otoemisiones acústicas y la audiometría de alta frecuencia.
En casos concretos, cuando no se logre la necesaria colaboración para la audiometría, se pueden emplear los PEATC para documentar la hipoacusia por ototoxicidad. Aunque no validada aún, existe una escala de clasificación de la gravedad de la misma41, que pretende diferenciar los casos leves de los que presentan afectaciones con un impacto funcional significativo y requieren monitorización (tabla 2)42.
Gravedad de la hipoacusia por ototoxicidad
| Grado | Umbral PEA (0,5-4kHz) |
|---|---|
| 1 | Cambio de umbral>10 a<20dB en 4kHz en al menos un oído |
| 2 | Cambio de umbral>20dB en 4kHz en al menos un oído |
| 3 | Cambio de umbral>20dB en 2kHz en al menos un oído |
| 4 | Umbrales absolutos>80dB en 1-4kHz en ambos oídos (no presente en la valoración basal) |
Los DPOAE tienen el potencial de identificar cambios en la función coclear antes de que sea posible observar un deterioro en los umbrales audiométricos, por lo que son eficaces para detectar la ototoxicidad. Sin embargo, tal como sucede con los potenciales evocados, los protocolos de clasificación de la ototoxicidad aún no han validado su uso con el fin de clasificar la hipoacusia, por lo que asignar un grado de gravedad con estos métodos representa en la actualidad un desafío para cualquier protocolo.
La audiometría de alta frecuencia es más sensible que la audiometría convencional para detectar precozmente la ototoxicidad porque el medicamento lesiona la cóclea desde la base hacia el ápex. Sin embargo, los resultados de la audiometría de alta frecuencia precisan tener una basal para comparar con los resultados de las pruebas seriadas. Además, existe un obstáculo pragmático al no poderse contar con este tipo de audiometría en todas las unidades de audiología pediátrica.
Pruebas complementarias para el diagnóstico precozMarcadores serológicos de daño otológico: Actualmente existen líneas de estudio orientadas a descubrir marcadores sanguíneos de daño coclear que anticipen la existencia de lesiones secundarias a la utilización de ototóxicos. Entre ellos destaca la determinación de proteínas, como la prestina, y de microARN (miARN).
La prestina es una proteína específica del oído interno. Se encuentra en la membrana basolateral de las células ciliadas externas, donde desempeña un papel importante en la electromotilidad dependiente de voltaje y la sensibilidad coclear. Se ha demostrado que el daño inducido experimentalmente sobre la prestina conduce a una reducción de la electromotilidad de dichas células y a una disminución de aproximadamente 40-60dB en la sensibilidad coclear. El hallazgo de que la kanamicina suprime la expresión de prestina, antes de su acción dañina sobre las células ciliadas externas, puede explicar la observación clínica de que la ototoxicidad inducida por AG comúnmente comienza con un cambio del umbral de audición y seguida de una pérdida auditiva irreversible en pacientes con tratamiento crónico con AG43.
Tras el daño celular, las proteínas estructurales, como la prestina, se transmiten a la circulación sistémica. Las dosis elevadas de cisplatino y amikacina se asociaron con aumentos en el nivel de prestina sérica y en la puntuación de daño coclear. Estos resultados indican que la prestina es un prometedor indicador precoz de daño coclear44.
Existen hasta 8 proteínas exclusivas del oído interno (otolin-1, otoconina 90/95, prestina, otoancorina, otogelina, α-tectorina, β-tectorina y cocolina). Otras inicialmente encontradas en el oído interno se identificaron posteriormente fuera del mismo (oncomodulina, otospiralina y otoraplina). Todas estas proteínas podrían servir para futuras investigaciones sobre biomarcadores potenciales de enfermedades del oído interno. E incluso, cada una de ellas podría expresar un tipo de daño determinado, como demostró un estudio sobre sordera inducida por el ruido en cuyos hallazgos la prestina aumenta en un intento de compensar la falta de células ciliadas externas y, sin embargo, otolin-1 podría ser un biomarcador circulatorio para daño de otoconias45,46.
Los miARN son potentes moduladores de la expresión génica y están involucrados en casi todos los procesos biológicos primarios, que incluyen proliferación, apoptosis, diferenciación y organogénesis. Los perfiles de miARN parecen ser específicos de la célula. La identificación de un perfil de aumento de miARN en sangre circulante puede ayudar a determinar el diagnóstico, el tipo de lesión y tejido afectado.
Tras el daño ototóxico, la circulación de miR-205 desde la cóclea migra a través de los vasos sanguíneos hacia los órganos y, finalmente, se encuentra en la sangre. En condiciones de pérdida auditiva por medicamentos ototóxicos, se puede usar la detección de miR-205 circulante en la sangre para determinar el alcance de la misma. En un futuro, la lesión del oído interno provocado por ototoxicidad se podría identificar simplemente realizando un análisis de sangre. Se han publicado varios estudios acerca de otros miARN en diferentes modelos de ototoxicidad. Por ejemplo, miR-183 se expresa activamente en la ototoxicidad inducida por kanamicina; aunque se expresa solo alrededor de tejidos lesionados y no en sangre. La vía de señalización de la enfermedad causada por los AG está asociada a radicales reactivas de oxígeno (especies reactivas de oxígeno), y miR-183 puede estar involucrado en este proceso. Se necesitan más estudios acerca de los diferentes miARN47.
Factores de riesgo genético: Entre los factores de riesgo de hipoacusia bien conocidos, existe uno de especial relevancia relacionado con el empleo de AG. Una pequeña proporción de la población infantil con mutaciones en genes del ARNr de las mitocondrias es especialmente sensible al tratamiento con dichos antibióticos (a veces, incluso, tras una sola dosis) y podría presentar hipoacusia secundaria inmediata o posterior a pesar del empleo de dosis correctas y/o del mantenimiento de niveles adecuados. Este grupo podría representar hasta el 10-20% de los pacientes con ototoxicidad inducida por AG48.
El gen MT-RNR1 que codifica la subunidad ribosómica mitocondrial 12S es el responsable de las mutaciones en la pérdida auditiva inducida por AG. Existen varias mutaciones responsables de este efecto. En general, la mutación mitocondrial más frecuente es A1555G, seguida de C1494T49,50, pero la incidencia varía entre las diversas etnias.
La prevalencia de la mutación m.1555A→G en la población infantil en Europa es de 1 cada 520, es decir un 0,19%51. En España, un estudio en Cantabria encontró una prevalencia de la mutación A1555G entre pacientes con antecedentes familiares de hipoacusia de un 25,8% y en un 75% de los pacientes con ototoxicidad coclear y antecedentes familiares de hipoacusia52. Para establecer la sospecha inicial es fundamental una historia familiar materna detallada que puede revelar un antecedente de pérdida auditiva después de la administración de AG53.
Con respecto al cisplatino, los estudios de asociación de genoma completo (GWAS) ofrecen la oportunidad para la investigación a gran escala del papel que desempeña la variación genética en el desarrollo de ototoxicidad. Drögenmöller evidencia el papel de la variante ACYP2rs1872328 en la ototoxicidad por cisplatino en diferentes tipos de cáncer, por lo que podría ser de utilidad54. El estudio de Clemens et al.55 resalta la necesidad de identificar biomarcadores genéticos para el tratamiento individualizado del paciente que está recibiendo cisplatino y confirma 2 potenciales marcadores genéticos: rs1872328 en acilfosfatasa 2 (ACYP2) y rs316019 en el transportador de catión orgánico 2(SLC22A2), aunque aún no hay suficiente evidencia. Futuros estudios de asociación, incluyendo todo el genoma, pueden ayudar a identificar marcadores genéticos adecuados56.
También ciertos estudios han concluido que la aparición del efecto ototóxico de los fármacos que contienen platino está influenciada por la presencia o ausencia de ciertos tipos de enzimas de glutatión-S-transferasa (GST), que son en parte responsables del metabolismo del mismo. Tras analizar los polimorfismos GSTT1, GSTM1 y GSTP1, concluyen que los genotipos GSTM1null y GSTT1null demostraron ser marcadores independientes de ototoxicidad aguda uni- y bilateral, respectivamente. La identificación a priori de este grupo de alto riesgo puede servir como base para una mejor definición de un tratamiento individualizado y el uso dirigido de nuevos fármacos otoprotectores57.
Estrategias y tratamientos preventivosEstrategias preventivas: Minimizar la ototoxicidad de los fármacos sin inhibir su eficacia es un campo de investigación muy activo en la actualidad. Hasta el momento no se ha encontrado una terapia ideal para tratar la ototoxicidad, por lo que la prevención puede ser una estrategia más efectiva que tratar de encontrar un tratamiento58. La principal medida preventiva es observar estrictamente las indicaciones de los medicamentos ototóxicos, evitando su uso cuando no es absolutamente necesario. Además, es recomendable la implantación de protocolos de manejo de la ototoxicidad en el medio hospitalario, dado que actualmente su existencia es minoritaria (algunos estudios amplios muestran que faltan en el 72% de los hospitales de países desarrollados)59. Una medida otoprotectora simple y útil para evitar una mayor lesión por el fármaco sería reducir la dosis del mismo, puesto que dosis menores se asocian con menor efecto ototóxico, aunque esto no siempre es posible.
También se puede intentar variar la pauta de administración, lo cual podría llevar a una farmacodinámica más segura, con una concentración reducida e, incluso, un período libre de fármaco durante el tratamiento, con la consiguiente disminución de la acumulación del mismo en el oído interno. De ahí los cambios en los intervalos de administración de los AG según la edad60. Es recomendable la medición rutinaria de los niveles en plasma para realizar ajustes de dosis. Se ha demostrado en la población pediátrica que el impacto de la gentamicina sobre la audición se puede minimizar programando tratamientos de corta duración, monitorizando los niveles de fármaco y ajustando la dosis48. Los niveles de cisplatino en plasma no se utilizan habitualmente en la práctica clínica, por lo que estas recomendaciones no serían útiles en dicho caso.
Una opción sería el desarrollo y la utilización de variantes de fármacos con menor toxicidad. Por ejemplo, la etimicina es un AG de cuarta generación, que se emplea actualmente en la práctica clínica en China debido a su alta eficacia y que ha demostrado una otonefrotoxicidad mínima, resultado de su menor acumulación en las mitocondrias de las células diana61. Otros AG con menor toxicidad en estudio son la apramicina y la gentamicina C162.
Por otro lado, se investiga acerca de la modificación de los ya existentes para intentar disminuir la incidencia de hipoacusia. Por ejemplo, ciertas modificaciones químicas de la apramicina y la geneticina, consideradas entre los AG menos y más tóxicos respectivamente, reducen el daño celular auditivo63. En el caso de los quimioterápicos derivados del platino se conoce la escala de ototoxicidad de varios compuestos, que pueden llevar a cambiar el tratamiento en situaciones de riesgo otológico (por ejemplo, con carboxiplatino).
Fármacos otoprotectores: Tal como ya se ha mencionado, los mecanismos moleculares de la lesión ototóxica son complejos e involucran múltiples procesos que incluyen la inducción del estrés oxidativo, caracterizado por la producción de especies reactivas de oxígeno y la peroxidación lipídica, la inflamación mediante la activación de factores proinflamatorios y la inducción de vías de señalización dependientes de la p5364.
La introducción de agentes otoprotectores es una opción terapéutica muy interesante, con algunos resultados prometedores, que deriva de la posibilidad de utilizar fármacos con potencial antioxidante u otros mecanismos para prevenir la ototoxicidad de varios compuestos65. Funcionan como un escudo para el oído interno y regulan al alza la maquinaria antioxidante de las mitocondrias. Aunque escasean los estudios de calidad relativos a otoprotección, existen algunas publicaciones que demuestran que es posible utilizar fármacos para prevenir o disminuir la ototoxicidad. Entre estos los más estudiados son:
- -
La N-acetilcisteína (NAC), que tiene varios mecanismos de acción con resultados positivos en tratamientos con AG. En pacientes tratados con cisplatino y en lo relativo a la NAC, existen resultados controvertidos. Por un lado, se ha publicado que con ella se puede prevenir la pérdida de audición de frecuencias altas (8kHz y superior) en varios estudios con tratamiento intratimpánico u oral. Por otro lado, otros estudios no han detectado dicho efecto preventivo ante la hipoacusia inducida por cisplatino. Se necesitan más datos acerca de la dosis óptima de NAC y la vía de administración para proteger contra la ototoxicidad relacionada con el ruido, el cisplatino y los AG. Un enfoque combinado con inhibición de NFAT (nuclear factor of activated T cells) junto con un antioxidante, como la NAC o la L-carnitina, también podría ser útil para el tratamiento y/o prevención de la pérdida auditiva en diversos casos66.
- -
El tiosulfato de sodio, cuyo efecto protector en la pérdida auditiva producida por el cisplatino ha quedado demostrado en diversos ensayos clínicos en niños. De manera similar a la NAC, inactiva y elimina la toxicidad del cisplatino, reduciendo la acción antitumoral. Por ello, se recomienda retrasar su administración (unas 6h tras el cisplatino) para minimizar la interferencia con la acción antitumoral de dicho fármaco67.
- -
La amifostina es otra sustancia que actúa de manera similar al tiosulfato. En la actualidad este compuesto se usa como nefroprotector en tratamientos con cisplatino, pero no hay estudios que hayan confirmado su eficacia en la protección del oído y, por lo tanto, no se utiliza en la práctica clínica67,68.
- -
La D-metionina es un aminoácido que desempeña un papel importante en la resíntesis del glutatión en respuesta a su agotamiento y actúa como antioxidante. En base a los prometedores resultados de reducción de la pérdida auditiva inducida por cisplatino en modelos animales, también se realizó un ensayo clínico en humanos que demostró reducciones en el cambio de umbral para las altas frecuencias60.
Existe una variedad de suplementos nutricionales e, incluso, ingredientes cosméticos para reducir el estrés oxidativo en el oído interno que han demostrado algún efecto otoprotector en animales de experimentación o en humanos. Asimismo, se ha demostrado que varios bloqueantes de los canales del calcio de tipo L y de tipo T reducen tanto la pérdida de células ciliadas externas, como la hipoacusia inducida por el ruido60.
Antiinflamatorios: La inflamación es crucial para la patogenia de la pérdida auditiva neurosensorial adquirida, pero el mecanismo preciso involucrado sigue siendo desconocido. Los esteroides son otoprotectores, pero también pueden disminuir la efectividad antitumoral de medicamentos a base de platino cuando se administran por vía sistémica, y además plantean problemas de seguridad con las dosis prolongadas o crónicas, sobre todo en los niños, por lo que su utilidad es muy limitada69.
El ácido acetilsalicílico (AAS). Un estudio prospectivo, aleatorizado, doble ciego con 195 pacientes, demostró un efecto protector del AAS sobre la ototoxicidad producida por la gentamicina70, aunque se conoce que el AAS en dosis altas es ototóxico. El AAS no ha demostrado ser útil para la otoprotección frente al cisplatino71.
Sin embargo, entre una serie de mediadores inflamatorios, el factor de necrosis tumoral alfa desempeña un papel fundamental en la ototoxicidad del cisplatino. La combinación de interferón gammaγ y factor de necrosis tumoral alfa parece aumentar la citotoxicidad del cisplatino a las células sensoriales cocleares ex vivo, lo que abre todo un camino para utilizar fármacos antifactor de necrosis tumoral y antiinterferón gamma en la prevención del daño coclear.
También las estatinas podrían ser agentes otoprotectores basándose en su efecto antioxidante, así como en sus propiedades antiinflamatorias72.
Los agentes otoprotectores pueden ser administrados por varias vías. La administración sistémica tiene la ventaja de ser una forma común y sencilla, con una farmacocinética fácil de determinar ya que no requiere equipo especializado. Una administración transtimpánica, por otro lado, puede evitar los efectos secundarios sistémicos y potencialmente puede llegar mejor al oído interno; sin embargo, las concentraciones en la perilinfa o la endolinfa pueden ser impredecibles73.
El hidrógeno acuoso y gaseoso (H2) inhalado tiene efectos en la prevención de isquemia en varios modelos de ototoxicidad y nefrotoxicidad, presuntamente reduciendo el estrés oxidativo74,75.
Es importante señalar una serie de cuestiones médicas y éticas sobre la otoprotección en la práctica clínica60. Entre otras, las medidas de otoprotección no deben causar ninguna disminución de la efectividad del fármaco ototóxico en el contexto del tratamiento para el cual se indica. El riesgo de pérdida auditiva inducida por fármacos de un tratamiento farmacológico debe ser lo suficientemente importante como para motivar la administración de otoprotectores y la medida otoprotectora debe ocasionar los mínimos efectos secundarios y tener coste-beneficio razonable.
En conclusión, aunque no sea el principal propósito de esta revisión, se considera importante destacar que se precisa promover estudios para la búsqueda de agentes que pueden reducir el daño auditivo derivado de los compuestos ototóxicos ya que representa un desafío aún abierto, y su resolución permitiría lograr mejoras significativas en la calidad de vida de los pacientes76.
Recomendaciones CODEPEHEs recomendable la implantación de protocolos de manejo de la ototoxicidad en el medio hospitalario, dado que actualmente su existencia es minoritaria (algunos estudios amplios muestran que faltan en el 72% de hospitales de países desarrollados)59.
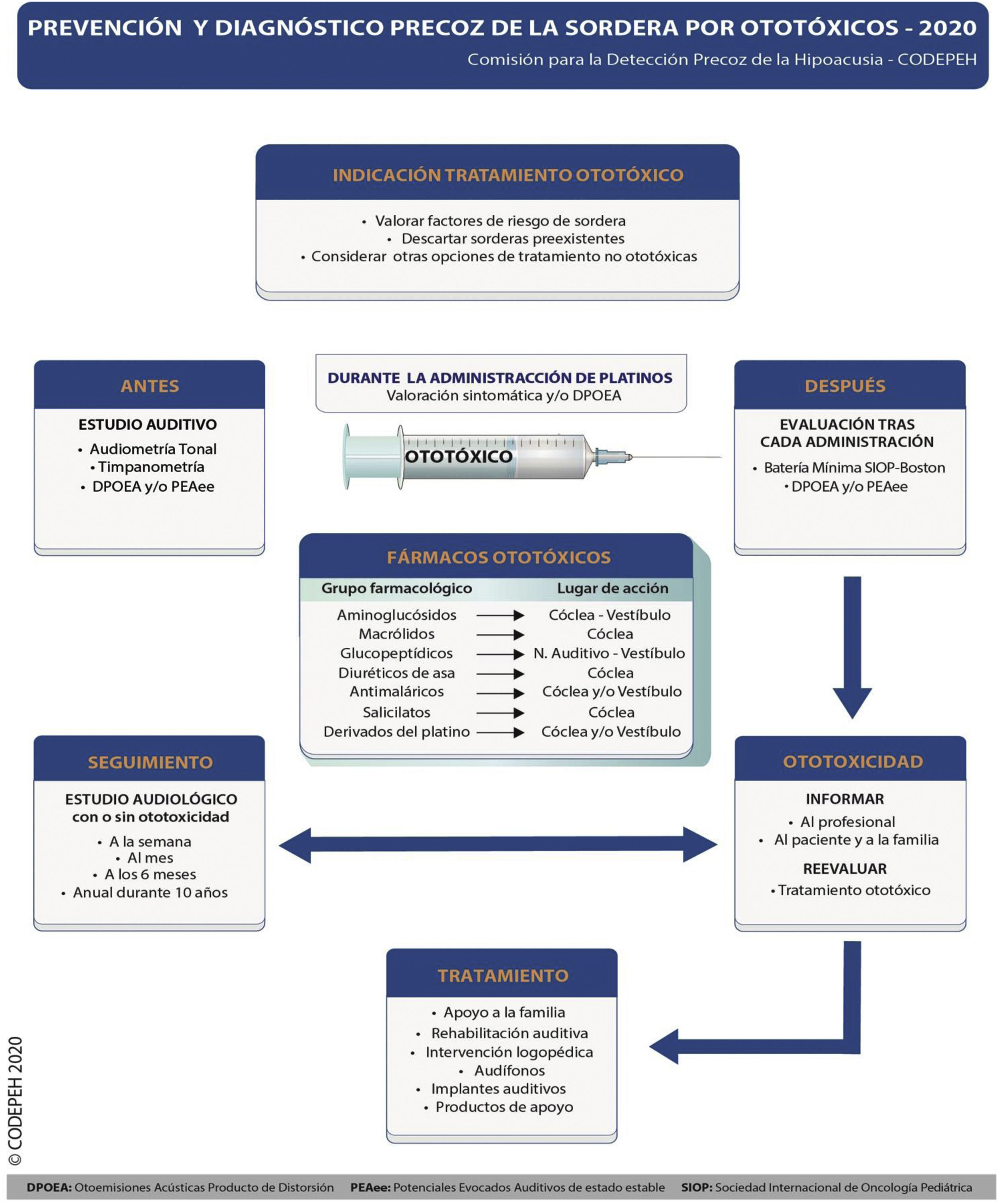
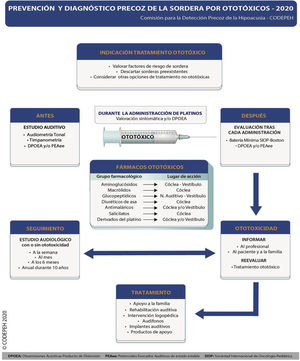
A continuación se presentan las recomendaciones de la CODEPEH relativas a la detección precoz, profilaxis, otoprotección, seguimiento y tratamiento de la ototoxicidad por antibióticos AG y antineoplásicos derivados del platino en la población pediátrica, que se resumen gráficamente en la figura 2.
- 1.
El protocolo de monitorización audiológica completo de la ototoxicidad en la población pediátrica ha de contar con una evaluación basal, previa a recibir el tratamiento, seguida de pruebas audiológicas en el curso del tratamiento (quimioterápicos derivados del platino) y de pruebas audiológicas al finalizar el mismo.
- 2.
La técnica de referencia para la monitorización audiológica durante un tratamiento con ototóxicos es la audiometría tonal, aunque el uso de pruebas objetivas es imprescindible en los pacientes que no son capaces de colaborar en su realización.
- 3.
Aunque existen diversos métodos de clasificación de la ototoxicidad, se demostró que presentan un buena concordancia entre ellos. Lo importante no es la escala que se emplee, sino que se monitorice la función auditiva a lo largo de la aplicación de un tratamiento potencialmente ototóxico. Se recomienda el uso de la escala SIOP-Boston ya que adopta componentes de otras clasificaciones y es sencilla de aplicar.
- 4.
La determinación de marcadores sanguíneos de daño coclear, como las proteínas del oído interno o el miARN, podrían anticipar la existencia de lesiones secundarias a la utilización de ototóxicos.
- 5.
El estudio genético puede ayudar a detectar pacientes de riesgo, como ocurre con las mutaciones del gen MT-RNR1, que son responsables de pérdida auditiva inducida por AG.
- 6.
La principal medida preventiva es cumplir estrictamente las indicaciones de los medicamentos ototóxicos, evitando su uso cuando no es absolutamente necesario.
- 7.
Otras medidas simples y útiles para evitar una mayor lesión por el fármaco son reducir la dosis del mismo, cambiar su posología y/o controlar sus niveles, así como el desarrollo y la utilización de variantes de fármacos con menor toxicidad.
- 8.
Las sustancias otoprotectoras son una opción terapéutica muy interesante que se basa en utilizar fármacos con potencial antioxidante u otros mecanismos que pueden prevenir la ototoxicidad de varios compuestos.
- 9.
Es recomendable informar y orientar al paciente y a su familia sobre la posibilidad de desarrollo de dificultades auditivas tempranas y a largo plazo, que pueden presentarse como consecuencia de haber recibido un tratamiento con ototóxicos, con objeto de que soliciten una evaluación especializada.
- 10.
El seguimiento de todo niño que ha recibido tratamiento ototóxico, independientemente de su estado auditivo, ha de prolongarse durante 10 años. Si se detectara una pérdida auditiva, esta ha de ser abordada de forma temprana con tratamiento audiológico e intervención logopédica.
Los autores declaran no tener ningún conflicto de intereses.
Los trabajos de la CODEPEH se llevan a cabo en el marco de un convenio de colaboración entre el Real Patronato sobre Discapacidad y FIAPAS.