A ressonância magnética multiparamétrica (RM‐mp) da próstata permite detetar, localizar e caracterizar lesões suspeitas de carcinoma da próstata (CaP). Permite ainda dirigir a biópsia prostática, quando efetuada previamente ao diagnóstico, acrescentando à técnica de biópsia actualmente praticada (colheita aleatória de 12 fragmentos) uma maior precisão diagnóstica.
O objetivo deste trabalho consiste em comparar uma técnica de biópsia prostática dirigida (por fusão cognitiva) com a técnica standard aleatória em duplo sextante, determinando qual é mais eficaz no diagnóstico de CaP clinicamente significativo.
Materiais e métodosForam selecionados 30 doentes com idades entre 61‐67 anos, cujo PSA era superior a 4ng/ml (PSA entre 5,6‐19,2). Todos os doentes tinham RM‐mp da próstata com lesões suspeitas de CaP, por critérios morfológicos e funcionais (PI‐RADS 3‐5). No total, foram detetadas 75 lesões suspeitas.
Todas as biópsias foram feitas pelo mesmo urologista (JMP), por via transretal guiada por ecografia, após visualização prévia das imagens de RM. Os disparos foram orientados para a zona da próstata considerada suspeita (fusão cognitiva). Foram colhidos 2 fragmentos por área suspeita. Posteriormente foi efetuada biópsia padrão em duplo sextante a todos os doentes.
ResultadosFoi detetado CaP em 22 doentes. Em 5 doentes, foi detetada doença apenas nos fragmentos dirigidos. A biópsia dirigida detetou mais 17% de CaP quando comparada com a biópsia aleatória, bem como que quase duplicou a taxa de cancro por fragmento.
A taxa global de deteção de CaP foi de 61% para todos os fragmentos colhidos.
Foram colhidos 360 fragmentos de biópsia aleatória, sendo 169 positivos para CaP (47%), com score de Gleason mediano de 6 (3+3) e um envolvimento tumoral médio por cilindro de 25% (5‐85%).Cento e cinco dos 150 fragmentos obtidos por biópsia dirigida foram positivos para CaP (70%). O score de Gleason mediano foi de 7 (3+4), com uma média de envolvimento tumoral por fragmento de 45% (10‐90%).
ConclusãoA RM multiparamétrica permite detetar áreas fortemente suspeitas de CaP possibilitando dirigir a biópsia, aumentando a sua precisão diagnóstica e a deteção de doença clinicamente significativa.
Multiparametric Magnetic Resonance Imaging of the prostate (Mp‐MRI) allows the detection, localization and characterization of suspicious lesions for prostate cancer (PCa). When done prior to the diagnosis it also allows targeting of the biopsy, significantly improving the performance of the standard random prostate biopsy.
Our goal is to compare a targeted biopsy technique (cognitive fusion) with the standard double sextant randomized prostate biopsy, and to determine which has better accuracy in the detection of cinically significant prostate cancer.
Materials and Methods30 patients aged 61‐67 were selected with a PSA greater than 4ng/mL (PSA between 5.6 – 19.2) and with suspicious PCa lesions on Mp‐MRI (Pi‐RADS 3‐5). A total of 75 suspicious lesions were detected.
All biopsies were performed by the same Urologist (JMP), using trans‐rectal ultrasound guidance and after previous visualization of MRI images. Sampling was targeted to the area considered suspicious on MRI, using a Cognitive Fusion Technique, collecting two samples per area. After that, a double‐sextant standard prostate biopsy was also done in all patients. The variables used for statistical analysis were PCa detection rate and amount of cancer per sample.
Results22 patients were diagnosed with PCa. In 5 patients, cancer was only detected on targeted cores. Targeted biopsies diagnosed 17% more PCa when compared to random biopsies, and almost doubled the amount of cancer per sample.
The overall PCa detection rate was 61% for all samples. 360 fragments were collected from standard randomized prostate biopsy, of which 169 were positive for PCa (47%), with a median Gleason score of 6 (3+3). The average amount of cancer per sample was 25% (5%‐85%).
105 of 150 fragments collected by cognitive fusion targeted biopsies were positive for PCa (70%). The median Gleason score was 7(3+4) with a median amount of cancer per sample of 45% (10%‐90%).
ConclusionsMultiparametric prostatic MRI detects areas highly suspicious for PCa, allowing targeted biopsies, which increases diagnostic accuracy and improves the detection of clinically significant PCa.
A biópsia prostática transretal para o diagnóstico de carcinoma da próstata (CaP) é actualmente um dos procedimentos urológicos mais frequentemente realizados no mundo ocidental1.
As principais indicações para a sua realização consistem na presença de PSA (Prostate Specific Antigen) aumentado ou alteração suspeita ao toque retal, associados a outros fatores como a idade, a raça, a velocidade do aumento do PSA ou a presença de outras comorbilidades2.
A técnica de biópsia mais frequentemente realizada e aceite como atual método de referência é a biópsia prostática em duplo sextante guiada por ecografia transretal3. Trata‐se de uma técnica de biópsia aleatória a locais prédefinidos, com colheita de 10‐12 fragmentos, sendo dependente do executante.
As principais limitações desta técnica incluem a elevada taxa de falsos negativos, principalmente de tumores clinicamente significantes (segundo os critérios de Epstein), a estratificação de risco imprecisa e a possível deteção de tumores pequenos, de baixo risco, clinicamente insignificantes. Esta incerteza diagnóstica pode levar à repetição da biópsia, ao atraso no diagnóstico ou ao sobretratamento2.
Apesar da biópsia prostática ser tipicamente bem tolerada2, é um procedimento invasivo e que se pode associar à ocorrência de complicações tais como hemorragia, infeções, sintomas urinários baixos (LUTS), retenção urinária, disfunção erétil ou mesmo morte4,5. Um estudo demonstrou ainda uma associação entre o número de fragmentos colhidos e a intensidade de hemorragia, com casos de hematúria abundante mesmo em doentes não anticoagulados6.
O CaP caracteriza‐se ainda por ser um tumor heterogéneo e multifocal em 67‐87% dos casos7–9. No caso da multifocalidade, a lesão tumoral dominante, ou lesão index, define‐se como a lesão tumoral com maior score de Gleason ou de maior volume, se o Gleason for o mesmo em diversas lesões. A lesão index tem especial importância, pois pensa‐se que seja a responsável pela progressão do CaP10. Assim, a sua caracterização histológica é fundamental para uma correta decisão trapêutica. A biópsia prostática aleatória associa‐se a erros de amostragem que a tornam num método impreciso para a correta caracterização da lesão index, nomeadamente na sua localização, volume e score de Gleason11.
A ressonância magnética (RM) apresenta elevada resolução espacial e de contraste tecidular, permitindo uma melhor visualização da próstata e de alterações patológicas da mesma, em comparação com a ecografia prostática transretal. Recentemente têm‐se vindo a desenvolver sequências funcionais de RM que permitem obter informações fisiológicas sobre os tecidos. A associação mais frequentemente utilizada para o estudo da próstata, designada de ressonância magnética multiparamétrica (RM‐mp), associa sequências morfológicas ponderadas em T1 e T2 com pelo menos 2 sequências funcionais, tais como a técnica de difusão (DWI), o realce dinâmico após injeção de contraste (DCE) e a espetroscopia (MRSI)12.
A RM‐mp tem‐se vindo a assumir como uma ferramenta importante para a deteção de CaP, apresentando uma boa correlação entre as lesões por si identificadas com a localização tumoral nas peças de prostatectomia radical13.
Foi ainda descrita uma correlação entre o grau de suspeição radiológica nas imagens de RM‐mp e o grau de risco tumoral segundo a estratificação de D’Amico, permitindo uma melhor identificação da lesão index14,15.
A capacidade de detetar e delinear lesões fortemente sugestivas de CaP nas imagens de RM‐mp levou ao desenvolvimento de novas técnicas de biópsia prostática dirigidas: biópsia guiada por fusão visual ou cognitiva, biópsia guiada por RM e biópsia guiada por fusão entre as imagens da RM e imagens em tempo real obtidas por ecografia prostática transretal (RM/TRUS)16.
A técnica de fusão cognitiva envolve a visualização prévia das imagens de RM‐mp com identificação das lesões suspeitas, tentando‐se, posteriormente, através de ecografia transretal, estimar o local onde se encontrarão essas lesões e biopsá‐las. Para melhor localizar as lesões deve recorrer‐se a pontos de referência anatómicos que possam ser visíveis na RM e na ecografia, tais como quistos, calcificações, nódulos de HBP, etc. Pode também ser necessário realizar medições das lesões à uretra, às vesiculas seminais ou ao contorno prostático de modo a melhor identificar o local a biopsar17. Esta técnica é extremamente dependente do executante e da sua experiência em interpretar as imagens de RM‐mp e na sua capacidade de as transpor para a ecografia.
A biópsia prostática realizada diretamente no aparelho (túnel) de RM consiste na realização da biópsia durante a aquisição das imagens de RM. Trata‐se de uma técnica dispendiosa e que ocupa o aparelho de ressonância durante muito tempo, prejudicando a realização de outros exames18.
A biópsia prostática por fusão de imagem RM/TRUS consiste na aquisição prévia da RM‐mp, com identificação e marcação das lesões, bem como de todo o contorno prostático. Este mapeamento é depois carregado em software específico que o sobrepõe à ecografia prostática transretal, permitindo localizar em tempo real o local suspeito e previamente marcado para a realização da biópsia. Este é o método mais facilmente reprodutível e com maior popularidade, que, no entanto acarreta custos iniciais para a aquisição do equipamento19.
Este estudo tem como objectivo comparar a taxa de deteção tumoral entre a biópsia aleatória e a biópsia dirigida, utilizando uma técnica de fusão cognitiva.
Materiais e métodosForam seleccionados 30 doentes com indicação para a realização de biópsia prostática, por aumento do PSA (>4 ng/mL).
A estes doentes foi realizada ressonância magnética multiparamétrica (RM‐mp) da próstata utilizando um aparelho de 1,5T. O protocolo utilizado inclui um estudo morfológico pélvico ponderado em T1, particularmente útil na deteção de metástases ósseas, gânglios suspeitos e de hemorragia parenquimatosa condicionada por biópsias anteriores. As sequências T1 não permitem distinguir a anatomia zonal da glândula e, consequentemente, detetar lesões tumorais; contudo, são ainda benéficas na avaliação do contorno capsular e da integridade do feixe vasculonervoso. Para a próstata, são utilizadas sequências de alta resolução com cortes axiais, coronais e sagitais, ponderadas em T2, que permitem distinguir a anatomia zonal e detetar os focos tumorais, tipicamente hipointensos. São também utilizadas como estudos funcionais sequências axiais de difusão (DWI) com factores b de 50, 800, 1.000 e 1.200s/mm2 e sequências dinâmicas 3D Vibe ponderadas em T1 com saturação de gordura (DCE), após administração endovenosa de gadolíneo, em bolus, com dose de 0,2mmol/kg de peso.
Todas as imagens foram avaliadas por radiologistas com experiência em RM‐mp e discutidas posteriormente com urologistas para a identificação e demarcação das lesões suspeitas, bem como de possíveis pontos de referência.
No total, foram detetadas 75 lesões suspeitas de CaP, segundo os critérios da Sociedade Europeia de Radiologia Urogenital (Pi‐RADS 3‐5)1, em 30 doentes, que constituíram a amostra do estudo.
Todos os doentes foram submetidos a biópsia prostática ecodirigida por via trans‐retal, sob bloqueio anestésico periprostático (10mL de lidocaína a 1%).
Para as biópsias dirigidas foram carregadas as imagens da RM num monitor existente junto ao ecógrafo, de forma a identificar as lesões consideradas suspeitas. Sempre que possível, utilizaram‐se pontos de referência a nível da RM, tais como a presença de imagens quísticas, nódulos de HBP, a uretra e o contorno prostático, bem como a distância a cada uma delas. Posteriormente tentou‐se encontrar uma correlação com a imagem obtida através de ecografia transretal. Foram biopsadas as áreas ecográficas que corresponderiam às zona suspeitas da RM, através de uma técnica de fusão visual, ou cognitiva, com colheita de 2 fragmentos por área suspeita, de acordo com esquemas efetuados por outros autores22.
Para as biópsias aleatórias, utilizou‐se um esquema em duplo sextante com colheita de 2 fragmentos nas regiões do ápex, zona média e base, bilateralmente, originando um total de 6 regiões abrangidas.
As biópsias dirigidas foram efetuadas antes das biópsias aleatórias de forma a evitar possíveis alterações dos pontos de referência causadas pelo trajeto da agulha.
Ambas as biópsias foram efetuadas pelo mesmo operador (JMP). Dependendo do número de lesões por doente, obteve‐se um mínimo de 7 frascos para análise, 6 correspondendo aos fragmentos obtidos por biópsia aleatória e os restantes à biópsia dirigida.
Estatisticamente, comparou‐se a taxa de deteção tumoral entre as 2 técnicas de biópsia utilizando o teste exato de McNemar. Foi ainda comparado o score de Gleason entre as 2 técnicas nos doentes com ambas as biópsias positivas. Considerou‐se como estatisticamente significativo um valor de p<0,05.
Avaliou‐se também a percentagem de tecido tumoral por fragmento em ambas as biópsias.
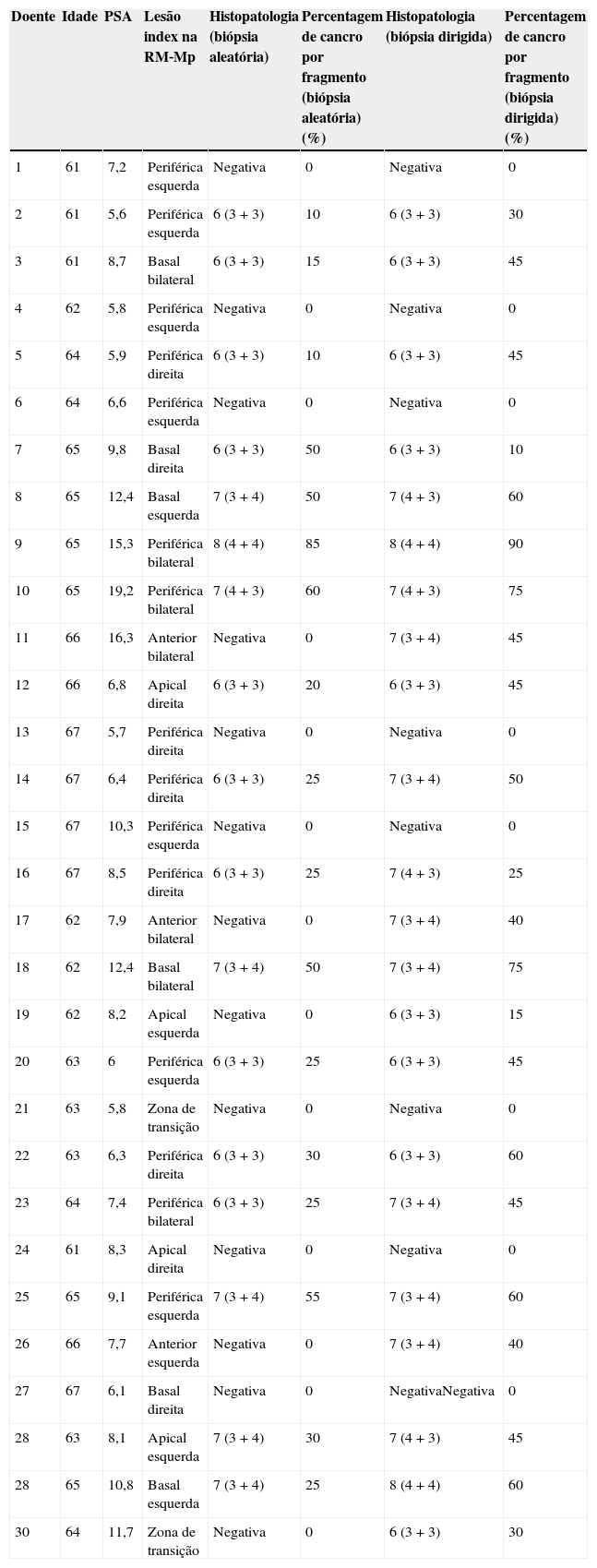
ResultadosOs 30 doentes selecionados tinham idade mediana de 64 anos (61‐67). O valor mediano do PSA era 8ng/mL (5,6‐19,2) (tabela 1).
| Doente | Idade | PSA | Lesão index na RM‐Mp | Histopatologia (biópsia aleatória) | Percentagem de cancro por fragmento (biópsia aleatória) (%) | Histopatologia (biópsia dirigida) | Percentagem de cancro por fragmento (biópsia dirigida) (%) |
|---|---|---|---|---|---|---|---|
| 1 | 61 | 7,2 | Periférica esquerda | Negativa | 0 | Negativa | 0 |
| 2 | 61 | 5,6 | Periférica esquerda | 6 (3+3) | 10 | 6 (3+3) | 30 |
| 3 | 61 | 8,7 | Basal bilateral | 6 (3+3) | 15 | 6 (3+3) | 45 |
| 4 | 62 | 5,8 | Periférica esquerda | Negativa | 0 | Negativa | 0 |
| 5 | 64 | 5,9 | Periférica direita | 6 (3+3) | 10 | 6 (3+3) | 45 |
| 6 | 64 | 6,6 | Periférica esquerda | Negativa | 0 | Negativa | 0 |
| 7 | 65 | 9,8 | Basal direita | 6 (3+3) | 50 | 6 (3+3) | 10 |
| 8 | 65 | 12,4 | Basal esquerda | 7 (3+4) | 50 | 7 (4+3) | 60 |
| 9 | 65 | 15,3 | Periférica bilateral | 8 (4+4) | 85 | 8 (4+4) | 90 |
| 10 | 65 | 19,2 | Periférica bilateral | 7 (4+3) | 60 | 7 (4+3) | 75 |
| 11 | 66 | 16,3 | Anterior bilateral | Negativa | 0 | 7 (3+4) | 45 |
| 12 | 66 | 6,8 | Apical direita | 6 (3+3) | 20 | 6 (3+3) | 45 |
| 13 | 67 | 5,7 | Periférica direita | Negativa | 0 | Negativa | 0 |
| 14 | 67 | 6,4 | Periférica direita | 6 (3+3) | 25 | 7 (3+4) | 50 |
| 15 | 67 | 10,3 | Periférica esquerda | Negativa | 0 | Negativa | 0 |
| 16 | 67 | 8,5 | Periférica direita | 6 (3+3) | 25 | 7 (4+3) | 25 |
| 17 | 62 | 7,9 | Anterior bilateral | Negativa | 0 | 7 (3+4) | 40 |
| 18 | 62 | 12,4 | Basal bilateral | 7 (3+4) | 50 | 7 (3+4) | 75 |
| 19 | 62 | 8,2 | Apical esquerda | Negativa | 0 | 6 (3+3) | 15 |
| 20 | 63 | 6 | Periférica esquerda | 6 (3+3) | 25 | 6 (3+3) | 45 |
| 21 | 63 | 5,8 | Zona de transição | Negativa | 0 | Negativa | 0 |
| 22 | 63 | 6,3 | Periférica direita | 6 (3+3) | 30 | 6 (3+3) | 60 |
| 23 | 64 | 7,4 | Periférica bilateral | 6 (3+3) | 25 | 7 (3+4) | 45 |
| 24 | 61 | 8,3 | Apical direita | Negativa | 0 | Negativa | 0 |
| 25 | 65 | 9,1 | Periférica esquerda | 7 (3+4) | 55 | 7 (3+4) | 60 |
| 26 | 66 | 7,7 | Anterior esquerda | Negativa | 0 | 7 (3+4) | 40 |
| 27 | 67 | 6,1 | Basal direita | Negativa | 0 | NegativaNegativa | 0 |
| 28 | 63 | 8,1 | Apical esquerda | 7 (3+4) | 30 | 7 (4+3) | 45 |
| 28 | 65 | 10,8 | Basal esquerda | 7 (3+4) | 25 | 8 (4+4) | 60 |
| 30 | 64 | 11,7 | Zona de transição | Negativa | 0 | 6 (3+3) | 30 |
Foi detetada a presença de CaP em 22 doentes, o que se traduz numa taxa global de deteção de CaP de 73%. Tendo em conta que todos os doentes a quem foi detetado CaP apresentaram resultados positivos nos fragmentos dirigidos, esta é também a taxa de deteção de CaP por biópsia de fusão cognitiva. Apenas 17 doentes apresentaram CaP nos fragmentos de biópsia aleatória, traduzindo‐se numa taxa de deteção tumoral por esta técnica de 56%.
Em 5 casos detetou‐se a presença de cancro apenas nos fragmentos resultantes de biópsia dirigida, resultando num acréscimo de deteção de CaP de 17% quando comparado com a biópsia aleatória (p=0,06).
Em nenhum doente com biópsia de fusão negativa foi documentada a presença de tumor por biópsia aleatória.
Dos 360 fragmentos recolhidos por biópsia aleatória, 169 eram positivos para cancro (47%), com um valor mediano de tecido neoplásico por fragmento de 25% (5‐85%). O score de Gleason mais frequentemente encontrado nestes fragmentos foi de 6 (3+3).
As biópsias dirigidas originaram um total de 150 fragmentos, dos quais 105 continham CaP (70%) numa extensão mediana de 45% por fragmento (10‐90%). Verificou‐se ainda uma alteração ao padrão de Gleason mais frequente, sendo neste caso de 7 (3+4) (p=0,08).
A taxa de biopsias positivas quando dirigidas por fusão (70%) foi claramente superior à taxa de biopsias positivas da técnica standard (aleatórias) (47%).
DiscussãoO potencial da RM‐mp prébiópsia tem sido extensamente documentado em diversos estudos16,19,20, tendo inclusivamente sido elaboradas guidelines para a sua correta realização e interpretação pela Sociedade Europeia de Radiologia Urogenital1.
Os benefícios da biópsia prostática dirigida, guiada por RM‐mp, encontram‐se descritos em diversos estudos, no entanto, a sua validação ainda se encontra em curso21–23.
Em teoria, uma localização precisa apenas de lesões de CaP clinicamente significativas antes da biópsia poderia superar as limitações importantes associadas à biópsia aleatória. A colheita dirigida de fragmentos de zonas fortemente suspeitas levaria a uma redução dos falsos negativos e de casos de CaP insignificantes melhorando a precisão diagnóstica e a estratificação de risco.
Relativamente ao método de biópsia dirigida, não se encontra ainda comprovada a superioridade de um método em relação a outro. Todos têm as suas vantagens e desvantagens. O que se sabe é que, independentemente do método escolhido, a biópsia dirigida apresenta maior eficácia que a biópsia aleatória convencional20,24.
Neste trabalho procurou‐se comparar a eficácia da biópsia prostática dirigida por cognição com a biópsia aleatória em doentes com suspeita clínica de CaP e sem nunca terem realizado previamente biópsia prostática. Para tal foi fundamental a realização prévia de RM‐mp. Trata‐se de uma abordagem ainda pouco habitual. Habitualmente a RM é realizada após diagnóstico estabelecido de CaP para estadiamento, ou em doentes com biópsias prostáticas prévias negativas, mas com persistente suspeita clinica de CaP. No entanto, vários autores defendem a realização de RM‐mp prébiópsia25–32.
A taxa global de deteção de cancro por biópsia prostática no nosso estudo é de 73%, bastante acima do encontrado na maioria dos estudos internacionais. Pensamos que este facto esteja relacionado com a seleção dos doentes na nossa amostra, pois só incluímos doentes que, além do aumento do PSA, apresentavam imagens fortemente sugestivas de CaP na RM‐mp.
No nosso estudo, apesar da biópsia de fusão ter originado maior taxa de deteção de CaP, quando comparada com a biópsia aleatória, tal facto não evidenciou diferença estatisticamente significativa (p=0,06).
No entanto, a taxa de fragmentos positivos quando dirigidos por cognição é muito superior (70%) à taxa de fragmentos positivos na biopsia aleatória (47%). Por outras palavras o número de fragmentos necessários para obter um fragmento positivo foi muito superior na biópsia aleatória.
Quanto à deteção de CaP clinicamente significativo33, os nossos resultados são concordantes com a maioria dos estudos. Em 6 doentes (27%) ocorreu um aumento no score de Gleason com a biópsia dirigida, e em nenhum doente a biópsia dirigida identificou Gleason score inferior ao detetado por biopsia aleatória. No entanto, na nossa amostra, esta variação também não foi estatisticamente significativa (p=0,08)
Cinco doentes (17%) apresentaram resultados negativos na biópsia convencional e positivos nos fragmentos dirigidos, 2 dos quais com score de Gleason de 7 (3+4). Apesar do baixo número de casos limitar esta conclusão, constatou‐se que a maioria destes doentes tinham lesões localizadas em topografia anterior e no ápex, áreas eventualmente menos abrangidas pela biópsia aleatória, aspetos que poderão ser melhor abordados num estudo de maior dimensão. No entanto, também foram detetados focos tumorais periféricos não apanhados pela biópsia tradicional.
Na grande maioria dos doentes com resultados positivos nas 2 técnicas registou‐se ainda um aumento na fração de cancro por fragmento, um dos critérios de Epstein para a distinção entre tumores clinicamente significativos dos não significativos33.
O nosso estudo apresenta algumas limitações. Apesar de se tratar de um estudo prospetivo, ele é não randomizado uma vez que todos os doentes são submetidos às 2 técnicas. A amostra em si é reduzida, levando a uma menor potência dos resultados, nomeadamente na análise estatística. No entanto, os nossos resultados vão de encontro aos encontrados nos estudos recentes.
ConclusãoEste estudo demonstrou uma superioridade da biópsia guiada por fusão visual com RM‐mp da próstata em relação à biópsia standard não só no que diz respeito à taxa de deteção tumoral global (73% vs. 56%), mas também na deteção de tumores clinicamente significativos, ao aumentar o score de Gleason e a percentagem tumoral por fragmento. Apesar de não se ter verificado diferença estatisticamente significativa, pensamos que tal facto se deve ao reduzido tamanho da amostra, sugerindo que se continuem a incluir doentes para se poderem consolidar os resultados.
A técnica de fusão usada tem algumas desvantagens. É necessária experiência a interpretar as imagens de RM‐mp e é extremamente dependente de quem realiza a biópsia. No entanto, é uma técnica barata, que não necessita de equipamento adicional e que pode ser rapidamente implementada em qualquer centro.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.