A disfunção erétil (DE) apresenta‐se como uma das complicações mais comuns da diabetes, sendo o stresse oxidativo uma característica relevante da DE diabética. Eventos deletérios induzidos pelo stresse oxidativo levam a relevantes alterações celulares e tecidulares alvos do dano oxidativo. No entanto, permanecem por clarificar os efeitos nocivos de mecanismos oxidativos no tecido peniano com a progressão da diabetes. Desta forma, pretendeu‐se avaliar a condição do stresse oxidativo a nível sistémico e peniano numa fase precoce e estabelecida da diabetes.
Materiais e métodosRatos machos Wistar foram divididos em grupos de: 2 e 8 semanas de diabetes tipo 1 induzida por streptozotocina e os respetivos controlos emparelhados pela idade. O stresse oxidativo sistémico foi avaliado pela quantificação de peróxido de hidrogénio (H2O2) na urina e pelo rácio glutationa reduzida/oxidada (GSH/GSSG) no plasma. Localmente, em tecido peniano, a condição de stresse oxidativo foi analisada através da produção de H2O2 e avaliação da nitração proteica pela deteção de 3‐nitrotirosina (3‐NT). 3‐NT foi quantificado por western blotting e por imunohistoquímica identificouse a sua localização celular no tecido cavernoso dos animais em estudo.
ResultadosA avaliação sistémica do stresse oxidativo revelou um aumento significativo dos níveis de H2O2 urinário e uma diminuição significativa do rácio GSH/GSSG circulante nos animais com uma diabetes avançada. No tecido cavernoso, o incremento significativo da produção de H2O2 verificou‐se também nos animais com 8 semanas de diabetes. Relativamente à formação de 3‐NT, os dados obtidos revelaram um aumento significativo no tecido cavernoso em animais com uma diabetes tardia e uma localização predominante deste marcador oxidativo na musculatura lisa cavernosa.
ConclusõesOs resultados indicam um efeito nocivo sistémico e cavernoso induzido pelo stresse oxidativo, proeminente num estadio avançado da diabetes. Sugere‐se que o aumento das modificações oxidativas nas proteínas do pénis poderá ser responsável por promover desregulações estruturais/funcionais nos mecanismos celulares/moleculares, contribuindo para o desenvolvimento e progressão da DE associada à diabetes.
Erectile dysfunction (ED) is one of the most common complications of diabetes, being oxidative stress an important feature of diabetic ED. Deleterious events induced by oxidative stress lead to crucial cellular and tissue alterations targeted by oxidative lesions. However, the noxious effects of oxidative stress mechanisms in penile tissue with the progression of diabetes, remains unclear. We intended to evaluate systemic and penile oxidative stress in an early and late stage of diabetes.
Material and methodsMale Wistar rats were divided in groups: 2 and 8‐weeks of streptozotocin‐induced type 1 diabetes, and age‐matched controls. Systemic oxidative stress was evaluated in urine by hydrogen peroxide (H2O2) quantification and in plasma by reduced/oxidized glutathione (GSH/GSSG) ratio. Penile oxidative status was assessed by H2O2 production and by the evaluation of protein nitration through the detection of 3‐nitrotyrosine (3‐NT). 3‐NT was quantified by Western blotting analysis and immunohistochemistry allowed to identify its cavernosal cellular location.
ResultsSystemic evaluation revealed a significant increase in urinary H2O2 levels in both diabetic groups. A significant decrease of circulating GSH/GSSG ratio was observed in animals with late stage diabetes. In cavernosal tissue, H2O2 production was significantly increased at 8‐weeks diabetes. Regarding 3‐NT cavernosal formation, data revealed a significant increment in advanced diabetes and a predominant location in cavernosal smooth muscle cells.
ConclusionsWe observed that systemic and cavernosal noxious effects induced by oxidative stress are predominant in advanced diabetes. Increased penile protein oxidative modifications in late‐staged diabetes may be responsible for structural/functional deregulations in cellular/molecular systems, contributing to the development of diabeticassociated ED.
A disfunção erétil (DE) é uma das complicações mais comuns da diabetes, sendo uma patologia com grande prevalência a nível mundial e com um importante impacto negativo na qualidade de vida dos homens diabéticos e das suas parceiras1. Os diabéticos apresentam um risco, aproximadamente 3 vezes maior de desenvolver DE, comparativamente a indivíduos não diabéticos (29% vs 9,6%). Nos doentes diabéticos, a DE manifesta‐se numa idade precoce, aumentando com a duração da diabetes2,3. Os fatores subjacentes à DE associada à diabetes são multifatoriais, envolvendo particularmente neuropatia e disfunção das células endoteliais (CE), devido a desarranjos metabólicos induzidos pela condição de hiperglicemia4. Encontra‐se reportado que a concentração elevada de glicose crónica está associada à geração de espécies reativas de oxigénio (ERO) e nitrogénio (ERN)5. Estas desregulações podem causar uma dimi‐nuição na biodisponibilidade do óxido nítrico (NO) endotelial e neuronal, levando à disfunção vascular e alterações nos mecanismos de vasorelaxamento no corpo cavernoso (CC) diabético6,7. A geração excessiva de ERO está também associada a uma diminuição dos mecanismos compensatórios antioxidantes, resultando num desequilíbrio entre agentes próe anti‐oxidantes culminando numa condição reconhecida por stresse oxidativo8. Este desequilíbrio leva a alterações cruciais de alvos celulares vulneráveis ao dano oxidativo, nomeadamente proteínas, lípidos e ADN9,10. Estas lesões oxidativas nas biomoléculas podem culminar na degeneração cavernosa da função e estrutura celular8. Várias evidências apontam para uma irrefutável ligação entre o stresse oxidativo e os mecanismos patofisiológicos da DE diabética, particularmente na redução da biodisponibilidade do NO e consequente disfunção endotelial. No entanto, permanecem por clarificar quais os mecanismos redox com maior relevância na promoção de alterações celulares no CC, que poderão por sua vez contribuir para o desenvolvimento e progressão da DE diabética. Até ao momento, a maioria dos estudos de investigação básica que avaliam as EROs em tecido peniano diabético focam‐se particularmente na produção do ião superóxido (O2 –) e na sua relevância na DE diabética7. No entanto, nunca foi avaliada no CC diabético uma outra importante ERO, o peróxido de hidrogénio (H2O2). Esta molécula é um potente agente oxidante, que se difunde facilmente através das membranas e do citosol, potencialmente causando danos oxidativos na maioria dos componentes celulares11. Em particular, modificações oxidativas em proteínas, como a nitração, podem contribuir para a alteração da homeostasia celular e tecidular. A nitração de proteínas define‐se como um processo químico em que ocorre a introdução preferencial de grupos nitrito (‐NO2) em certos aminoácidos, incluindo as tirosinas. De facto, a nitração de resíduos de tirosina, resultando em 3‐nitrotirosina (3‐NT), representa uma modificação póstranslacional oxidativa, levando a alterações cruciais na estrutura e função das proteínas12. Alguns estudos reportaram o aumento sistémico e tecidular dos níveis de 3‐NT na diabetes13,14. No entanto, a formação de 3‐NT nunca foi avaliada no contexto da progressão da DE diabética. O objetivo deste estudo prende‐se com a caracterização da condição redox sistémica e peniana numa fase inicial e tardia da diabetes. Desta forma pretende‐se esclarecer as modificações oxidativas que ocorrem com a progressão da diabetes e que podem contribuir para a degeneração de mecanismos moleculares e celulares, essenciais à homeostasia tecidular e à função erétil.
Material e métodosAnimal modeloAs experiências e manipulação animal foram conduzidas de acordo com as diretrizes éticas da Direção Geral de Alimentação e Veterinária (DGAV) portuguesa na diretiva de 24 de Novembro de 1986 (86/609/EEC), com a recomendação de 18 de Junho de 2007 proposta pelo Concelho das Comunidades Europeias. O estudo incluiu 40 ratos macho da estirpe Wistar (280‐350 g; Charles River Laboratories, Barcelona, Espanha) que foram mantidos em 12 horas de ciclos de luz/escuro com livre acesso a ração e a água. Os ratos foram divididos aleatoriamente em dois grupos: grupo diabético (n = 20) e grupo controlo emparelhado pela idade (n = 20). Ao grupo diabético induziu‐se diabetes tipo 1 por injeção intraperitoneal de 50 mg/Kg de streptozotocina (STZ; Sigma‐Aldrich, Sintra, Portugal), dissolvida em tampão citrato 0,1 M a pH 4,5 e o grupo controlo foi injetado com veículo. Efetuou‐se a confirmação da diabetes por monitorização da glicemia (Accu‐Check, Roche Diagnostics, Mannheim, Alemanha), sendo considerados diabéticos os animais que apresentavam níveis de glicose sanguínea superiores a 250 mg/dL. De forma a avaliar alterações de stresse oxidativo numa fase inicial e avançada da diabetes, o grupo de ratos diabéticos foi posteriormente dividido em dois: grupo diabético com 2 e 8 semanas de diabetes (n = 10 por grupo) e respetivos controlos emparelhados pela idade (n = 10 por grupo). Após as 2 e 8 semanas de duração de diabetes, recolheu‐colheu‐se urina de 24 h em gaiolas metabólicas, sacrificaram‐se os animais aos quais se retirou o sangue e se removeram os pénis. O tecido peniano foi pesado e utilizado para medição da libertação de H2O2. O restante tecido foi armazenado a –80°C para posterior extração de proteína ou inclusão em parafina.
Quantificação dos níveis de H2O2A medição da produção de H2O2 na urina efetuou‐se com o kit Amplex®Red Hydrogen Peroxide Assay, segundo o protocolo fornecido pelo fabricante. As amostras de urina foram diluídas com a solução tampão de reação do referido kit (1:50 para os animais diabéticos e 1:10 para os animais controlos). Procedeu‐se à avaliação da intensidade de fluorescência num leitor de multiplacas (Spectramax Gemini XS, Molecular Devices, Sunnyvale, CA, USA). Os valores de produção de H2O2 foram representados em nmol de H2O2 por mg de creatinina. O mesmo protocolo foi utilizado para a análise da libertação de H2O2 em tecido peniano, após a incuação de fragmentos de tecido cavernoso num banho com tampão Krebes‐Hepes (NaCl 118,0 mM, KCl 4,5 mM, CaCl2 2,5 mM, MgCl 1,20 mM, K HPO 1,2 mM, NaHCO3 25,0 mM, Na‐HEPES 25,0, Glucose 5,0 mM; pH 7,4), durante 90 minutos a 37°C. Os valores de H2O2 nas amostras de CC foram expressos em pmol por mg de tecido.
Determinação do rácio glutationa reduzida/oxidadaO rácio glutationa reduzida/oxidada (GSH/GSSG) nas amostras de sangue dos animais em estudo foi avaliado por cromatografia, de acordo com as instruções do fabricante (HPLC; Hight Performance Liquid Chromatography; Immundiagnostik, Benshein KIt, Germany) usando o sistema Shimadzu LC (Shimadzu Corporation, Kyoto, Japan), equipado com a bomba LC 20AD e o desgaseificador DGU‐20A5 e, um detetor de fluorescência (FLD) RF‐10AXL. A separação foi efetuada numa coluna Luna (C18, tamanho da partícula 5μm, 4,60 × 150 mm, Phenomenex, Torrance, California, USA), à temperatura ambiente (20 ± 1°C). O volume injetado foi de 20μL e, para controlo e processamento de dados utilizou‐se o LCsolution software version 2.1 (Shimadzu Corporation, Kyoto, Japan). As condições cromatográficas foram as recomendadas pelo manual do referido kit. A intensidade de fluorescência foi mediada pelo seguinte par de comprimentos de onda de excitação/emissão: 385/515 nm, para a deteção com FLD, a taxa de fluxo de 1,0 mL min–1 e por fim os cromatogramas foram registados.
Avaliação da expressão de 3‐NT por western blottingEfetuou‐se a extração e quantificação de proteínas penianas segundo o protocolo previamente descrito15. 8 mg de proteína total de tecido cavernoso foram separadas através de uma eletroforese num gel de 10% de poliacrilamida‐dodecil sulfato de sódio. Após a transferência das proteínas para uma membrana de nitrocelulose, procedeu‐se à incubação da membrana durante a noite com o anticorpo policlonal de coelho anti‐3‐NT (1:1000; Cat.#AB5411, Upstate, Millipore, Temecula, CA, USA) e posteriormente com o respetivo anticorpo secundário conjugado com peroxidase (1:2000; Santa Cruz Biotechnology, CA, USA). A deteção de 3‐NT foi efetuada por quimioluminiscência com um kit de ECL (Amersham Biosciences, Buckinghamshire, UK). A membrana foi incubada com uma solução de NaOH 0.1M de forma a remover as ligações anticorpo‐antigénio e novamente incubada com o anticorpo de coelho actina na humana (1:3000; Abcam, Cambridge, UK), tal como descrito anteriormente. Alterações na expressão de 3‐NT foram quantificadas por densitometria (Vision Works LS Software; UVP Inc, Upland, CA, USA) e os resultados expressos como intensidade média relativa e normalizados por comparação com a β‐actina.
Deteção de 3‐NT por imunohistoquímicaO perfil de expressão celular de 3‐NT em tecido cavernoso foi avaliado por imunohistoquímica, usando o método estreptavidina‐biotina‐peroxidase16. Os tecidos foram incubados durante a noite com o anticorpo primário policlonal de coelho anti‐3‐NT (1:50; Cat.#AB5411, Upstate, Millipore, Temecula, CA, USA) e de seguida, com o respetivo anticorpo secundário biotinilado (diluição de 1:150; Santa Cruz Biotechnology, Santa Cruz, CA, EUA). Por fim adicionou‐se o complexo avidina‐biotina (VECTASTAIN® Elite ABC Kit, Vector Laboratories, Burlingame, CA, EUA). Os controlos negativos foram obtidos através da omissão do anticorpo primário. A reação antigénio‐anticorpo foi revelada utilizando o cromogénio 3,3‐diaminobenzidina (DAB; Substrate Kit, Abcam) e os tecidos contrastados com hematoxilina. A observação das reações foi efetuada no microscópio de luz Olympus AH3‐RFCA (Olympus Imaging, Hamburg, Alemanha) e as imagens foram capturadas utilizando a câmara fotográfica digital Olympus C35AD‐4 (Olympus Imaging, Hamburg, Alemanha).
Análise estatísticaA avaliação estatística foi realizada pelo software GraphPad Prism (GraphPad Software version 5.0, San Diego, CA, USA). Os dados foram expressos como média ± desvio padrão. Alterações significativas entre grupos para a produção de H2O2 e rácio GSH/GSSG, foram calculadas pelo Student's t‐test. Para o western blotting, a análise estatística foi efetuada com o One‐way Analysis of Variance (ANOVA), seguida pelo teste de Bonferroni, considerando um valor p < 0,05 estatisticamente significativo.
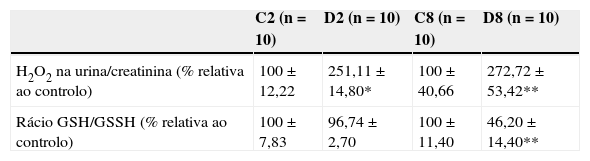
ResultadosAvaliação sistémica do stresse oxidativo em animais diabéticos e não diabéticosPara analisar se numa condição de diabetes inicial e estabelecida, ocorrem alterações no estado redox sistémico, procedeu‐se à quantificação na urina dos níveis de produção de H2O2 dos animais em estudo. Os resultados revelaram um aumento significativo de H2O2 nas amostras de urina de animais com 2 e 8 semanas, comparativamente com os respetivos controlos emparelhados pela idade. Os valores obtidos foram de 100 ± 12,22% nos controlos de 2 semanas versus 251,11 ± 14,80% nos diabéticos de 2 semanas (p < 0,0001) e de 100 ± 40,66% no grupo controlo de 8 semanas versus 272,72 ± 53,42% nos diabéticos de 8 semanas (p < 0,05) (tabela 1). Relativamente ao rácio plasmático de glutationa reduzida/oxidada, não se verificaram alterações significativas na fase inicial da diabetes (100 ± 7,83% nos controlos versus 96,74 ± 2,70% nos diabéticos) (tabela 1). Contudo, às 8 semanas de diabetes observou‐se um decréscimo significativo de GSH/GSSG, em comparação com os respetivos controlos, com valores de 46,20 ± 14,40% e de 100 ± 11,40% (p < 0,05), respetivamente (tabela 1). Estes resultados revelam um aumento dos níveis sistémicos de H2O2 e uma diminuição do rácio GSH/GSSG, com a progressão da diabetes, indicando um desequilíbrio na condição redox sistémica a favor da promoção de danos oxidativos. Analisaram‐se seguidamente a nível local, em tecido cavernoso diabético, se marcadores oxidativos específicos estariam também aumentados com o desenvolvimento da doença.
Avaliação sistémica dos níveis de H2O2 libertados na urina e do rácio GSH/GSSH no plasma dos animais com uma diabetes inicial e estabelecida e, respetivos controlos
| C2 (n = 10) | D2 (n = 10) | C8 (n = 10) | D8 (n = 10) | |
|---|---|---|---|---|
| H2O2 na urina/creatinina (% relativa ao controlo) | 100 ± 12,22 | 251,11 ± 14,80* | 100 ± 40,66 | 272,72 ± 53,42** |
| Rácio GSH/GSSH (% relativa ao controlo) | 100 ± 7,83 | 96,74 ± 2,70 | 100 ± 11,40 | 46,20 ± 14,40** |
C2: grupo controlo para as 2 semanas de diabetes; D2: grupo diabético de 2 semanas; C8: grupo controlo para as 8 semanas de diabetes; D8: grupo diabético de 8 semanas.
Dados expressos como valores médios ± SE.
* p < 0,0001 animais diabéticos comparados com os controlos emparelhados pela idade.
** p < 0,05 animais diabéticos comparados com os respectivos controlos.
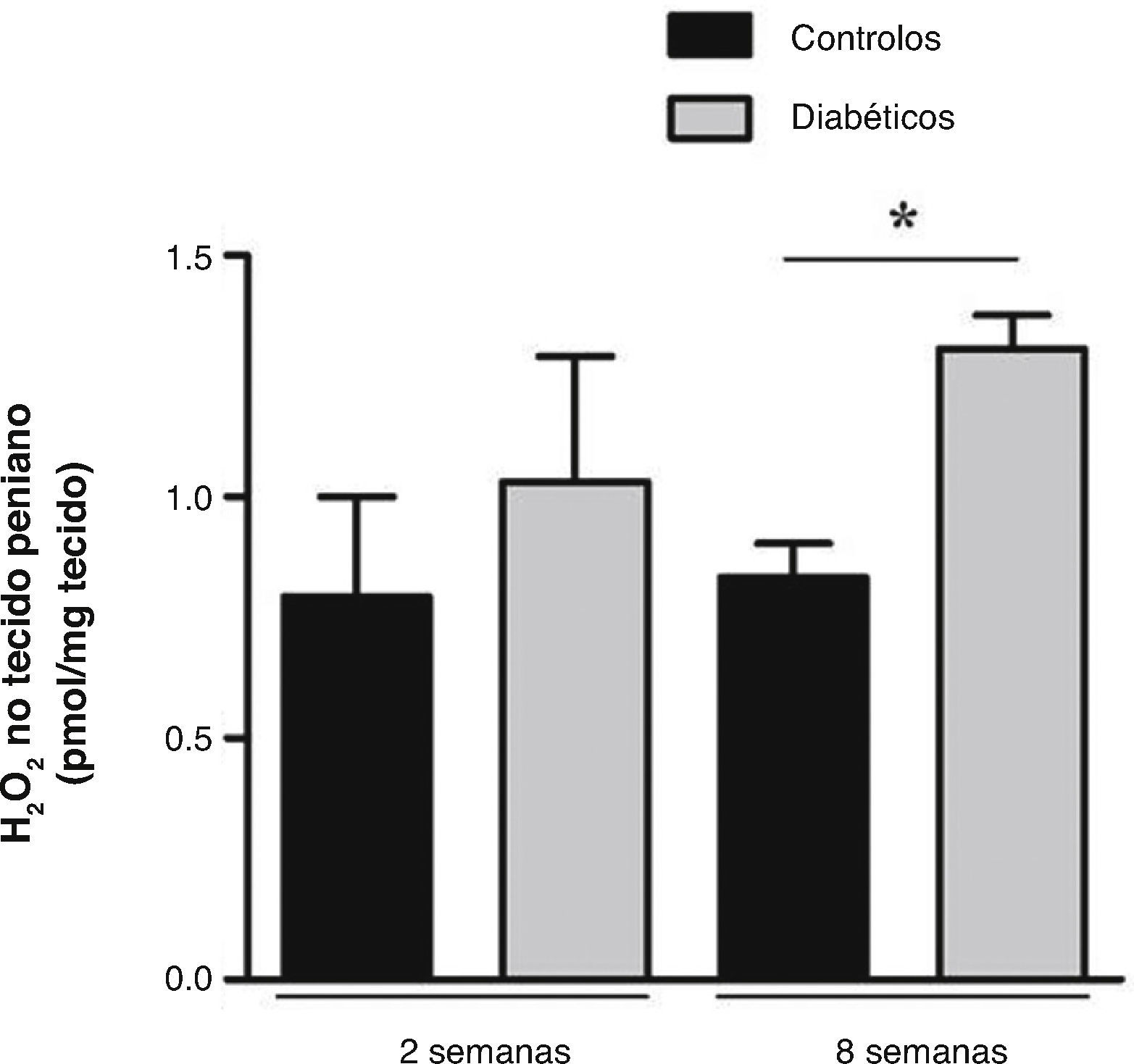
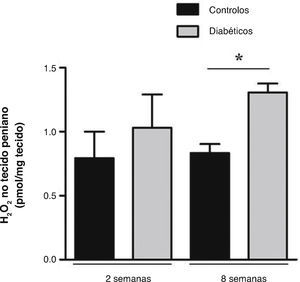
Níveis de H2O2 foram avaliados em fragmentos de tecido peniano com 2 e 8 semanas de diabetes e respetivos controlos. Os resultados revelaram um aumento não significativo na produção de H2O2 numa fase inicial da diabetes, em que os controlos apresentavam valores de 0,79 ± 0,21 pmol/mg e os diabéticos de 1,03 ± 0,26 pmol/mg (fig. 1). Um incremento de H2O2 foi também observado às 8 semanas de diabetes (1,31 ± 0,07 pmol/mg), sendo estatisticamente significativo (p < 0,05) quando comparado com o grupo controlo (0,83 ± 0,07 pmol/mg) (fig. 1). Corroborando os resultados obtidos a nível sistémico, estes resultados sugerem um aumento de stresse oxidativo no pénis diabético numa fase mais tardia da patologia. De modo a verificar se a acumulação excessiva de pró‐oxidantes leva a danos oxidativos em proteínas cavernosas, avaliámos seguidamente uma relevante alteração oxidativa, a nitração proteica.
Medição local da produção de H2O2 no tecido peniano dos ratos diabéticos de 2 e 8 semanas e respetivos controlos emparelhados pela idade. Os resultados revelaram que a libertação de H2O2 no tecido peniano de 2 semanas de diabetes não se alterou, quando comparado com os controlos; e demonstraram um aumento significativo para os níveis de H2O2 penino na fase estabelecida da diabetes relativamente aos respetivos controlos. Dados expressos como valores médios ± SE. * p < 0,05.
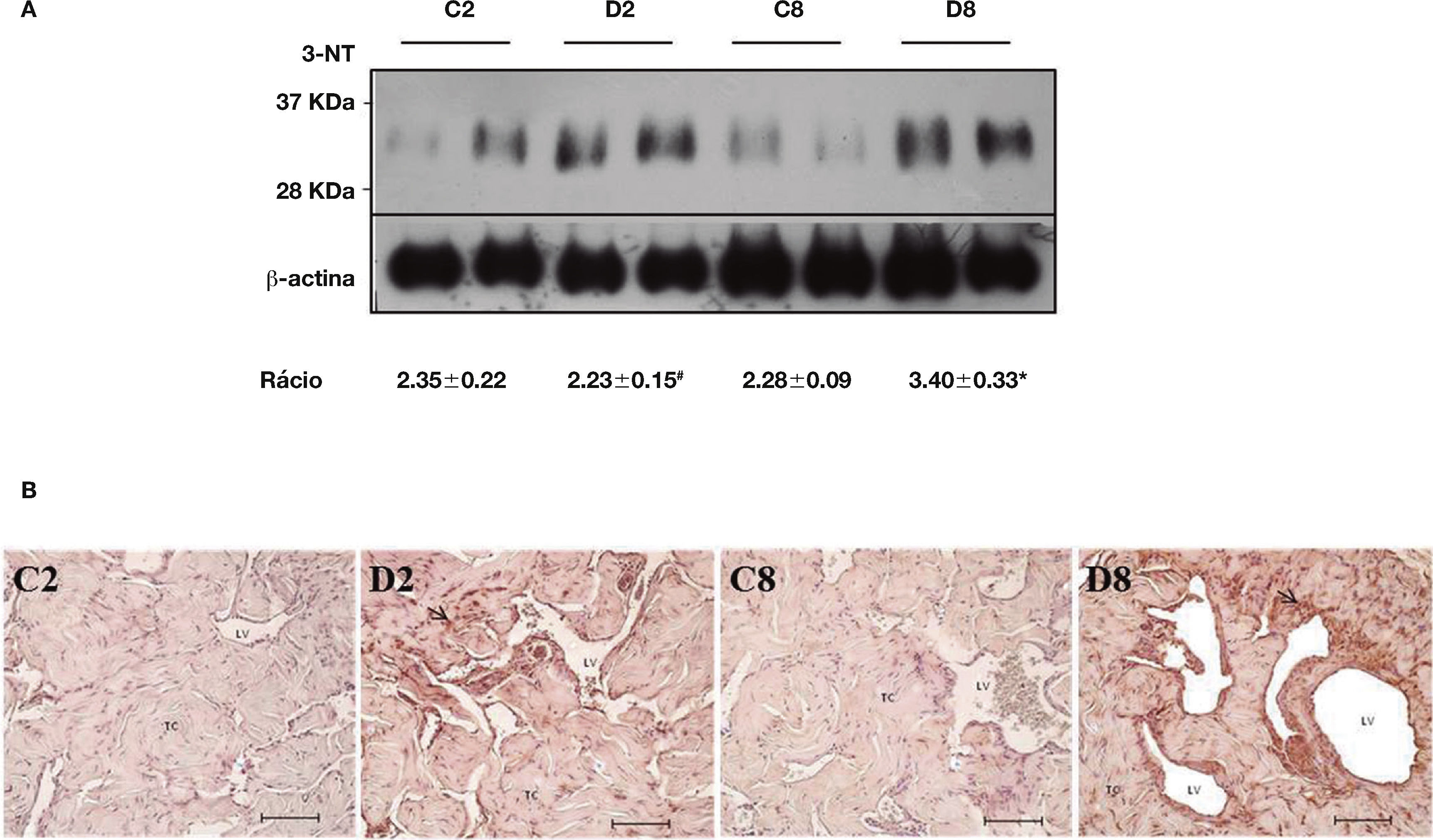
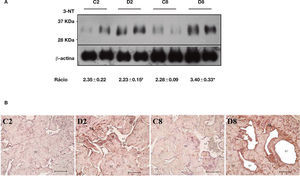
De forma a investigar possíveis danos de stresse oxidativo em proteínas do tecido cavernoso diabético, procedeu‐se à deteção de um estável marcador de lesão oxidativa proteica, a 3‐NT. Para tal, quantificou‐se a expressão de 3‐NT por western blotting e avaliou‐se o perfil tecidular desta alteração proteica por imunohistoquímica, em CC diabético e não diabético. Por western blotting foram identificadas várias bandas de diversos pesos moleculares para a formação de produtos de nitração de tirosina. A banda representada na figura 2A refere‐se a proteínas de baixo peso molecular cujas alterações observadas foram as mais relevantes. Relativamente às 2 semanas de diabetes, a expressão de 3‐NT não se encontra alterada significativamente, quando se comparam os animais diabéticos com os respetivos controlos. O aumento estatisticamente significativo (p < 0,01) da expressão da 3‐NT é observado no CC dos diabéticos de 8 semanas (3,40 ± 0,33), comparativamente com o grupo controlo (2,28 ± 0,09). O mesmo se verifica quando se compara o grupo diabético de 2 com o de 8 semanas, verificando‐se um incremento significativo de 3‐NT numa diabetes estabelecida relativamente a uma fase inicial da patologia (2,23 ± 0,15 e 3,40 ± 0,33, respetivamente; p < 0,05) (fig. 2A). Quanto ao perfil celular de 3‐NT, as imagens de imunohistoquímica revelaram que os resíduos de nitração se encontram predominantemente em células musculares lisas (CMLs), sendo também visualizados no endotélio e nos fibroblastos trabeculares de CC diabético, com um evidente aumento de expressão na fase tardia da patologia (fig. 2B). Estes resultados reforçam a ideia de que modificações oxidativas em proteínas cavernosas ocorrem particularmente numa diabetes estabelecida, podendo promover desregulações estruturais/funcionais em mecanismos moleculares/celulares essenciais para uma função erétil normal.
Quantificação da expressão da 3‐NT por western blotting (A) e avaliação do seu padrão de expressão por imunohistoquímica (B) no tecido peniano dos grupos de animais diabéticos e não diabéticos. Os resultados obtidos revelaram um aumento significativo dos níveis de lesão oxidativa nas proteínas do tecido peniano dos animais numa fase estabelecida da diabetes em comparação com o respetivo grupo controlo e com o grupo de animais de 2 semanas de diabetes. Quantificação por densitometria e intensidade média relativa por comparação com a intensidade da expressão da proteína β‐actina. Dados expressos em intensidade média relativa ± SE. * p < 0,05; #p < 0,01. O perfil de expressão da 3‐NT, avaliado por imunohistoquímica, demonstrou um padrão de expressão para 3‐NT perivascular na musculatura lisa e trabelucar. C2: grupo controlo para as 2 semanas de diabetes; D2: grupo diabético de 2 semanas; C8: grupo controlo para as 8 semanas de diabetes; D8: grupo diabético de 8 semanas. LV: Lúmen Vascular; TC: Trabéculas Cavernosas. Setas (marcação positiva para a 3‐nitrotirosina). Escala: 100μm.
Os diabéticos apresentam um risco três vezes maior de desenvolver DE em relação a indivíduos não diabéticos3,17. Sabe‐se que a condição de hiperglicemia é responsável por induzir muitos dos efeitos patofisiológicos característicos da diabetes, nomeadamente produtos finais de glicação avançada (AGEs), ERO e ERN, levando a deficiências na síntese e biodisponibilidade de NO. Estas desregulações moleculares podem afetar a estrutura celular do CC, induzindo por sua vez alterações deletérias nos mecanismos de vasorelaxamento5‐7. De facto, surgem cada vez mais evidências que reforçam o papel central do stresse oxidativo na etiologia da DE diabética9,10,18,19. No entanto, os estudos de investigação básica centraram‐se particularmente na avaliação da produção de ERO e no efeito da administração de antioxidantes numa fase específica de desenvolvimento da diabetes7,9,10,18,19. Deste modo, o presente trabalho caracterizou a condição redox sistémica e peniana em animais diabéticos, num estadio inicial (2 semanas) e avançado (8 semanas) da patologia. Para tal, quantificou‐se sistemicamente a produção de H2O2 na urina e analisou‐se um importante mecanismo celular de defesa antioxidante, com a medição do rácio GSH/GSSG no plasma. Os resultados revelaram um aumento significativo dos níveis de H2O2 em ambos os grupos de animais diabéticos de 2 e 8 semanas. O H2O2 é caracterizado por ser uma potente molécula pró‐oxidante difusora, relativamente estável em solução aquosa o que permite a sua medição de forma fácil e direta. Esta molécula tem uma natureza dupla no ambiente celular, a baixas concentrações tem um papel fisiológico na sinalização celular e a altas concentrações induz stresse oxidativo e contribui para o dano oxidativo das células. O H2O2 atua particularmente de forma indireta, servindo de fonte para a produção de outros radicais de oxigénio que lesam ADN, lípidos e proteínas11. De facto, foi reportado que a medição de H2O2 urinário pode ser um valioso biomarcador na deteção do aumento sistémico do stresse oxidativo associado a condições patológicas, incluindo a diabetes20. Em concordância com os resultados do presente estudo, foi anteriormente demonstrado um aumento dos níveis de H2O2 urinário em ratos diabéticos induzidos com STZ às 4 e às 8 semanas após indução da patologia21. Desta forma, sabe‐se que a diabetes induz alterações patofisiológicas significativas com a progressão da doença, sendo expectável um incremento do stresse oxidativo numa fase tardia da diabetes. Contudo, o aumento dos valores de H2O2 urinário por nós observado às 2 semanas de diabetes, indica que a produção desta ERO pode apresentar‐se como um evento oxidativo que ocorre numa fase inicial da diabetes. Seguidamente foi analizado o rácio GSH/GSSG plasmático em ambas fases da diabetes. Este é o produto de um sistema endógeno antioxidante que consiste em enzimas com capacidade de controlar os níveis de radicais livres, oxidando GSH a GSSG e de novo a GSH22. A GSH apresenta um papel central como antioxidante e é o produto da ação da glutationa redutase sobre GSSG. Por esse motivo, o rácio entre GSH e GSSG no plasma apresenta‐se como um importante indicador sistémico do estado redox celular. Os resultados apresentados revelam uma redução significativa do rácio GSH/GSSH no plasma dos animais diabéticos de 8 semanas quando comparados com o grupo normoglicémico, sugerindo um défice deste sistema antioxidante e um aumento do stresse oxidativo sistémico com a progressão da doença. De facto, estes dados corroboram estudos experimentais anteriores que demonstraram uma diminuição do rácio GSH/GSSG plasmático num modelo experimental de diabetes23. De acordo com os resultados do nosso trabalho, este sistema enzimático antioxidante parece estar alterado como consequência de uma diabetes prolongada, exacerbando desta forma o stresse oxidativo sistémico. Após a caracterização da condição redox sistémica, procedeu‐se à avaliação local do stresse oxidativo cavernoso, através da medição da produção de H2O2 e da formação de 3‐NT. Apesar de dados previamente publicados revelarem um aumento dos níveis de H2O2 em tecidos diabéticos24,25, até ao momento nunca se tinha procedido à sua avaliação no CC diabético com a progressão da doença. Assim sendo, os nossos resultados mostraram pela primeira vez um aumento tendencial da libertação cavernosa de H2O2 às 2 semanas de diabetes, sendo este incremento estatisticamente significativo apenas na fase estabelecida da patologia. Uma vez que o H2O2 é uma molécula lipossolúvel, parece razoável inferir que numa fase inicial da diabetes já são observados incrementos significativos desta ERO na urina, enquanto no pénis, esta alteração torna‐se proeminente apenas num estadio avançado da doença. Como mencionado previamente, a estrutura e função dos tecidos são também afetados por danos oxidativos proteicos induzidos por EROs12. De facto, proteínas modificadas por resíduos de 3‐NT são suscetíveis a alterações na estrutura, função, atividade enzimática e ativação de vias de sinalização12,26. Devido ao seu importante papel e ao facto da modificação proteica 3‐NT nunca ter sido avaliada em tecido peniano no contexto de progressão da diabetes, neste estudo, quantificou‐se e caracterizou‐se a expressão de 3‐NT cavernosa. Os dados obtidos revelaram um aumento significativo da expressão de 3‐NT em proteínas de diferentes pesos moleculares no tecido erétil diabético de 8 semanas quando comparado com os respetivos controlos e com os animais numa fase inicial da diabetes. Corroborando os nossos resultados, estudos prévios por técnicas de imunohistoquímica reportaram um incremento de 3‐NT peniano, numa única fase após indução da diabetes27‐29. Adicionalmente, por imunohistoquímica, os nossos resultados revelaram uma proeminente expressão de 3‐NT nas CMLs, nos fibroblastos trabeculares e alguma marcação a rodear os sinusoides do CC diabético. Este padrão de expressão de 3‐NT está de acordo com o descrito em estudos anteriores, indicando que a formação de 3‐NT pode afetar diversos componentes celulares, promovendo degeneração funcional dos tecidos. Consistentemente com os dados obtidos para H2O2, detetaram‐se lesões oxidativas nas proteínas de forma proeminente numa fase estabelecida da diabetes, possivelmente como consequência de uma hiperglicemia sustentada e de modificações moleculares induzidas pelo stresse oxidativo. Em resumo, os nossos resultados mostram um aumento sistémico e peniano da condição oxidativa com a progressão diabetes. Destacase ainda o incremento da libertação cavernosa de H2O2 e aumento de lesões oxidativas nas proteínas penianas, modificações que poderão prejudicar a função molecular/celular do tecido peniano e do processo de vasorelaxamento, contribuindo desta forma para a progressão da DE diabética.
ConclusõesOs resultados obtidos no presente trabalho demonstraram que os efeitos prejudiciais do stresse oxidativo são mais proeminentes na fase avançada da diabetes. Registou‐se um desequilíbrio sistémico dos mecanismos do stresse oxidativo com um aumento da produção de H2O2 e dano do sistema antioxidante endógeno GSH/GSSG. Localmente, no tecido peniano diabético observou‐se um aumento assinalável de marcadores oxidativos, nomeadamente de H2O2 e um incremento de modificações proteicas através da formação de 3‐NT, que poderão ser responsáveis por promover alterações estruturais/funcionais nos mecanismos celulares/moleculares essenciais no processo erétil. Por conseguinte, o aumento do stresse oxidativo cavernoso na progressão da DE diabética reforça a importância de terapêuticas antioxidantes preventivas.
FinanciamentoTrabalho financiado pelo Prémio JABA RECORDATI Urologia 2010, Associação Portuguesa de Urologia.
Responsabilidades éticasProteção de pessoas e animais. Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados. Os autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.