O carcinoma da bexiga é uma das neoplasias mais comuns do aparelho urinário, estando associado e elevada morbilidade e obrigando os doentes a um longo follow‐up recorrendo a métodos invasivos, como a cistoscopia.
O diagnóstico e estadiamento iniciais são dependentes da análise histopatológica de fragmentos recolhidos por biópsia ou ressecção transuretral da lesão vesical. No entanto, a taxa de subestadiamento é elevada, tornando necessárias novas cirurgias de re‐estadiamento.
Com os avanços recentes nas técnicas de ressonância magnética, nomeadamente com a utilização da difusão, tornou‐se possível aumentar a taxa de detecção de lesões suspeitas bem como avaliar a sua extensão e infiltração nas várias camadas da parede vesical, melhorando a acuidade do estadiamento. É ainda possivel detectar precocemente alterações sugestivas de recidiva ou mesmo progressão tumoral.
Com este trabalho, os autores pretendem fazer uma revisão da literatura existente sobre o papel da ressonância magnética em doentes com tumores vesicais, nomeadamente no seu diagnóstico, estadiamento e follow‐up, como complemento às técnicas actuais existentes.
Bladder cancer is one of the most common malignancies of the urinary tract. It is associated with significant morbidity and long‐term follow‐up using invasive procedures, like cystoscopy.
The initial diagnosis and staging are dependent on the histopathologic analysis of resected or biopsed samples. However, it is associated with significant under‐staging, often requiring multiple re‐staging procedures.
With the recent advances in Magnetic Resonance Imaging techniques, namely Diffusion Weighted images, it has become possible to improve the detection rate of suspicious lesions and their extension to the deep layers of the bladder wall, therefore improving staging. It is also possible to detect recurrent tumours during follow‐up and even to predict the progression rate.
With this work, the authors intend to review the current literature regarding the role of Magnetic Resonance imaging in the detection, staging and follow‐up of bladder cancer patients.
O carcinoma da bexiga é 7.a neoplasia mais frequente a nível mundial, em ambos os sexos, e constitui uma causa major de morbilidade e mortalidade1.
Segundo os dados da Organização Mundial de Saúde, a taxa de incidência estimada na Europa é de 14,4 por 100.000 habitantes e em Portugal de 17,8 por 100.000, com uma mortalidade associada de 4,5 por 100.0002.
Em >90% dos casos este tumor afeta pessoas com mais de 55 anos, contudo, também pode ocorrer em idades mais jovens3.
De entre os fatores de risco associados aos tumores de bexiga destacam‐se o tabagismo e a exposição ocupacional a agentes carcinogénicos uroteliais4,5 (nomeadamente aminas aromáticas e hidrocarbonetos aromáticos policíclicos utilizados na indústrias química)6. Outras exposições ambientais que se podem associar com o cancro de bexiga incluem infeções urinárias crónicas7, exposição a ciclofosfamida8 e radioterapia9. Recentemente, foi também documentado um aumento de incidência em homens com neoplasia da próstata tratados com radioterapia10.
A maioria dos tumores (>90%) tem origem no epitélio de transição urotelial11, seguindo‐se em ordem de frequência o carcinoma pavimento‐celular e o adenocarcinoma que ocorrem em cerca de 5 e 1% dos casos, respetivamente12,13. No caso particular das zonas onde a schistosomíase é endémica, até 75% dos casos podem ser de carcinomas pavimento‐celulares14. Também pode ocorrer metastização de outros tumores para a bexiga, nomeadamente carcinomas primários do cólon, útero, ovários e próstata, bem como nos linfomas.
A sintomatologia associada ao carcinoma da bexiga é bastante inespecífica, incluindo hematúria indolor, sintomas irritativos vesicais ou dor pélvica. Frequentemente, os tumores vesicais são assintomáticos.
A extensão local do tumor, a existência de metastização ganglionar ou à distância, o tipo histológico e grau tumoral são fatores determinantes para a decisão terapêutica e prognóstico15. Assim, o estadiamento inicial preciso é imperativo, sendo o sistema de estadiamento universalmente aceite o sistema TNM16.
De acordo com existência ou não de invasão da camada muscular, os tumores são subdivididos em 2 grupos com implicações terapêuticas distintas: tumores não músculo‐invasivos (NMI) (Ta, Tis e T1), representando 75% dos casos à data do diagnóstico, e tumores músculo‐invasivos (MI) (≥T2)17.
De acordo com os dados disponíveis, cerca de 70% dos tumores NMI recidivam após tratamento, encontrando‐se muitos destes casos associados a resseções tumorais incompletas18. Assim, várias tentativas de aumentar a acuidade no diagnóstico do cancro da bexiga têm vindo a ser estudadas.
ObjetivosDescrever, de forma sistematizada, as aplicações atuais da ressonância magnética (RM) associada ou não a estudos funcionais em doentes com suspeita clínica ou diagnóstico de tumor vesical.
Aquisição de evidênciaRealizou‐se uma revisão não sistematizada da literatura recorrendo à base de dados da PubMed, com os termos principais «Bladder Cancer», «NMIBC», «Non‐Muscle Invasive Bladder Cancer», «Magnetic Resonance Imaging», «MRI», «Diffusion Weighted MRI». De todos os artigos apresentados, selecionaram‐se aqueles escritos em língua inglesa, originais ou de revisão, publicados até 2014 que mais se adequavam ao tema.
Síntese de evidênciaDiagnóstico e estadiamento convencionalAs técnicas de imagem convencionais como a urografia endovenosa, a ecografia e a tomografia computorizada (TC) podem sugerir o diagnóstico de tumor da bexiga no caso de lesões exofíticas19.
Por sua vez, a citologia urinária tem elevada sensibilidade no diagnóstico de tumores de alto grau, embora seja reconhecido o elevado número de falsos negativos em casos de tumores de baixo grau. Neste sentido, vários marcadores urinários têm sido apontados como potenciais testes diagnósticos, contudo, nenhum provou ter valor diagnóstico suficiente para figurar nas guidelines urológicas internacionais19.
O diagnóstico definitivo de carcinoma da bexiga consiste na visualização da lesão e sua análise histopatológica20.
A cistoscopia permanece o exame gold standard para o diagnóstico inicial e deteção de recidiva tumoral, uma vez que através da introdução de um cistoscópio, por via transuretral, é possível a visualização direta de toda a mucosa vesical.
Apesar de ser um exame invasivo, a cistoscopia pode ser efetuada em regime de ambulatório, apenas com anestésico tópico figura 1.
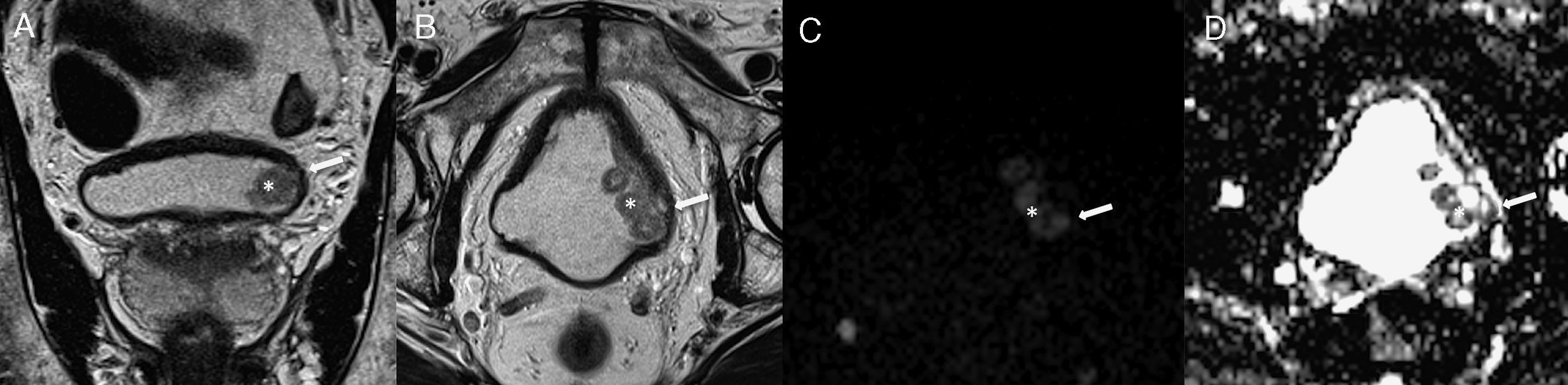
Exemplo de um tumor vesical localizado na parede lateral esquerda (*).
A‐ T2 coronal
B‐ T2 axial
C‐ DWI (b1200)
D‐ mapa ADC
Nas sequências T2 observamos tumor vegetante, de sinal intermédio implantado na parede lateral esquerda da bexiga, que infiltra profundamente a parede vesical, condicionando descontinuidade focal da linha de hipossinal característica da muscularis própria, traduzindo tumor músculo‐invasivo. Estes achados são corroborados pelo estudo funcional de difusão, documentando‐se tumor com hipersinal em DWI e hipossinal no mapa ADC (setas).
A taxa global de deteção tumoral com cistoscopia é de aproximadamente 79%, sendo menor no caso particular dos carcinomas in situ (CIS) (50%)21. Recentemente surgiram novas ferramentas com o objetivo de melhorar a taxa de deteção tumoral por cistoscopia, quer recorrendo a fenómenos de fluorescência através da photodynamic diagnosis (PPD) quer através da variação do comprimento de onda da luz emitida na narrow band imaging (NBI)22. Estas técnicas são particularmente importantes na deteção de pequenas lesões papilares e de CIS23.
A cistoscopia deve assim ser realizada em todos os doentes com suspeita de tumor vesical. No entanto, se existir suspeição de tumor vesical por outros métodos de imagem, poderá ser evitada uma cistoscopia diagnóstica, devendo ser programada ressecção transuretral (RTU‐V), de modo a permitir um diagnóstico histológico19.
Diagnóstico e estadiamento por ressonância magnéticaEm doentes com suspeita clínica de tumor vesical por hematúria franca a diferenciação entre lesões benignas e malignas da bexiga poderia evitar a necessidade de procedimentos diagnósticos invasivos, se excluídos tumores do aparelho urinário alto.
Neste sentido e desde a sua introdução em 1983, a RM pélvica tem sido indicada como uma técnica fiável para o estadiamento e diagnóstico dos tumores vesicais. A sua capacidade multiplanar, que permite uma adequada visualização de toda a parede vesical, em particular das áreas da cúpula vesical e da região do trígono, bem como das estruturas adjacentes (como a próstata e vesículas seminais), associada à sua elevada resolução de contraste tecidular, tornam esta técnica a uma ferramenta muito útil no diagnóstico de lesões vesicais, com uma precisão diagnóstica superior à da TC15.
Contudo, o estadiamento preciso dos tumores vesicais com técnicas de imagem é difícil dada a reduzida espessura da parede vesical, o que condiciona dificuldades na distinção entre tumores com invasão muscular superficial (pT2a) e profunda; e entre invasão muscular profunda e extensão mínima para a gordura perivesical (pT3a)24.
Por outro lado há que ter presentes as contraindicações para estudo RM: presença de implantes/próteses metálicas, pacemakers ou claustrofobia, entre outros.
Protocolos de ressonância magnética convencionaisAtualmente, o estadiamento imagiológico do cancro da bexiga é geralmente realizado utilizando combinação de sequências anatómicas ponderadas em T2 e estudo após administração de gadolínio.
A RM com estudo dinâmico após administração de contraste consiste numa técnica funcional que fornece informação acerca da microvasculatura dos tecidos. Este facto assume uma importância preponderante no diagnóstico do cancro da bexiga, uma vez que o crescimento tumoral se associa diretamente com a angiogénese tumoral. Por sua vez, a densidade microvascular relaciona‐se diretamente com o grau tumoral e capacidade de metastização25.
Classicamente as lesões tumorais captam mais contraste que os tecidos saudáveis adjacentes, permitindo assim identificar lesões malignas. Contudo, no estudo dinâmico além da avaliação visual do grau de captação lesional é possível ainda derivar alguns parâmetros semiquantitativos a partir de uma curva de intensidade de sinal/tempo que refletem as alterações de sinal ao longo do tempo, isto é, de forma simplificada a rapidez com que o contraste é captado (taxa de wash‐in) ou libertado dos tecidos (taxa de wash‐out).
Na maioria dos estudos publicados a acuidade diagnóstica da RM com contraste variou entre 52‐93%26,27.
No entanto, o sobre‐estadiamento dos tumores confinados à bexiga parece ser uma desvantagem da RM convencional uma vez que as sequências ponderadas em T2 não permitem diferenciar as várias camadas da parede da bexiga15.
Há ainda que considerar que a administração endovenosa de produtos de contraste à base de gadolínio está contraindicada em doentes com insuficiência renal. Para superar estas limitações, vários trabalhos recentes têm investigado o uso das sequências de difusão (diffusion weighted imaging ‐ DWI) no diagnóstico dos tumores da bexiga28.
Estudos de difusão (diffusion weighted imaging)As técnicas de difusão na RM são técnicas não invasivas, que refletem os movimentos Brownianos das moléculas de água nos tecidos e não requerem administração de contraste endovenoso ou exposição à radiação ionizante.
A DWI foi aplicada pela primeira vez no cérebro, onde se tornou o gold standard para o diagnóstico de AVC agudo, uma vez que as mudanças microestruturais observadas na DWI precedem as alterações anatómicas detetadas nas sequências morfológicas convencionais29,30. A sua aplicação a nível extracraniano é mais complexa devido aos artefactos de movimento fisiológicos (respiração, batimentos cardíacos e peristalse intestinal)31. Contudo, com as melhorias técnicas progressivas, incluindo sequências cada vez mais rápidas, a aplicação da DWI tem sido alargada à deteção/caracterização tumoral em vários órgãos31,32.
As lesões malignas, pela elevada celularidade, desorganização arquitetural e redução do espaço extracelular que as caracterizam têm maior restrição à movimentação livre das moléculas de água, o que se traduz por sinal elevado nas sequências de difusão. A partir de aquisições com diferentes gradientes de difusão, isto é, diferentes valores de b, é possível quantificar a restrição a nível tecidular e a elaboração de mapas de coeficiente de difusão aparente (ADC). As lesões tumorais tipicamente apresentam baixo sinal nos mapas ADC33. Contrariamente, as lesões benignas são menos restritivas ao movimento das moléculas de água pelo que não apresentam hipersinal nas sequências de difusão (dificultando a sua identificação nas sequências com valores de b elevados). Nos mapas ADC, pelo contrário, têm sinal elevado/moderado.
A DWI tem assim sido considerada útil para deteção e estadiamento tumoral, com uma precisão diagnóstica que ronda 94% e uma precisão de estadiamento entre 63‐96%34–39. A superioridade da DWI em relação às sequências convencionais verifica‐se sobretudo nos tumores confinados à bexiga15.
Como desvantagem da DWI há, no entanto, que considerar a impossibilidade de visualização do lúmen uretral, contrariamente à cistoscopia convencional40.
Estadiamento ganglionarA presença de adenopatias pélvicas é um fator de prognóstico major e decisivo para o planeamento terapêutico dos tumores vesicais41,42.
O estadiamento ganglionar é geralmente baseado em critérios dimensionais, considerando‐se um limiar de 8‐10mm de menor eixo para considerar adenopatias patológicas nas técnicas de imagem43. Contudo, em cerca de 25% dos doentes tratados cirurgicamente, que apresentavam gânglios pélvicos normodimensionados nos estudos imagiológicos pré‐operatórios, verificou‐se a presença de metastização ganglionar. Por outro lado, os gânglios reativos/inflamatórios podem encontrar‐se aumentados mimetizando adenopatias patológicas44,45.
A DWI terá uma capacidade potencial em discriminar os gânglios benignos dos malignos, uma vez que se espera que nos segundos exista restrição aos movimentos das moléculas de água devido à elevada celularidade, resultando em baixos valores de ADC. Contudo, os estudos nesta área ainda são limitados e com resultados discrepantes28.
Follow‐upA elevada frequência de recidiva local e possibilidade de progressão dos tumores vesicais denota a importância da vigilância apertada em doentes com tumores NMI.
Existem várias estratégias de follow‐up, contudo, de forma mais comum os doentes são reavaliados a cada 3 meses nos 2 primeiros anos após diagnóstico, seguindo‐se vigilância bianual durante mais 2‐3 anos e anual a partir desse período46.
O follow‐up inclui avaliação clínica, citologia urinária e cistoscopia.
Para follow‐up, a sensibilidade da cistoscopia ronda 94%, contudo, no caso específico dos CIS permanece na ordem dos 60%47.
Apesar da vigilância da recidiva se basear historicamente na cistoscopia, este procedimento tem desvantagens: trata‐se de um procedimento invasivo, com elevado custo e que pode associar‐se a complicações como perfuração vesical ou urosépsis48.
A possibilidade de se recorrer a um método radiológico que consiga diferenciar de forma consistente entre alterações benignas pós‐terapêuticas e recidiva/persistência tumoral permitiria evitar a necessidade de cistoscopia invasiva. A RM parece ser uma técnica com potencial para colmatar esta necessidade.
Há, no entanto, que ter presente que a realização de RTU‐V prévia prejudica a precisão diagnóstica dos estudos RM posteriores pela presença de fenómenos inflamatórios28. Por outro lado, as alterações fibróticas e a inflamação decorrente quer da quimioterapia intravesical quer da RTU‐V são difíceis de distinguir de recidiva nas sequências morfológicas convencionais de RM, uma vez que se manifestam ambas apenas por espessamento parietal vesical49.
No que respeita à DWI, um estudo recente publicado demostrou a utilidade desta técnica no follow‐up de doentes com tumores vesicais superficiais após RTU‐V, revelando uma elevada fiabilidade da DWI na distinção entre alterações inflamatórias pós RTU‐V e recidiva/tumor residual com resultados que são mesmo semelhantes aos da cistoscopia convencional40.
Outras vantagens apontadas a esta técnica são a ausência de radiação ionizante, da necessidade de administração de contraste endovenoso e o facto de acrescer apenas alguns minutos ao protocolo do estudo RM convencional.
Novos desenvolvimentosRecentemente, a RM funcional (estudo dinâmico e DWI) tem sido apontada como possível método de avaliação da agressividade tumoral: a taxa de wash‐out do contraste tende a ser mais elevada nos tumores de baixo grau, uma vez que nas lesões mais agressivas a microarquitectura tumoral (com maior celularidade) e neoangiogénese mais complexa poderão justificar um maior atraso na excreção do contraste relativamente a lesões menos agressivas. Por outro lado, o valor de ADC pode também refletir a agressividade tumoral, com valores de ADC significativamente inferiores para lesões mais agressivas (devido à maior celularidade e consequente maior restrição à movimentação das moléculas de água) comparativamente aos tumores de baixo grau34,50–52.
Contudo, continua a existir uma sobreposição substancial nos valores de ADC entre os tumores de alto e de baixo grau, o que limita de alguma forma a utilidade potencial da DWI neste campo28.
Ainda no caso da DWI, um estudo recente demonstrou existir uma relação entre valores de ADC mais baixos e uma maior expressão de Ki‐67 (um marcador de proliferação celular reconhecidamente associado ao cancro da bexiga)53.
Por outro lado, o papel da DWI na previsão da resposta à terapêutica tem vindo também a ser estudado, nomeadamente no que respeita à eventual sensibilidade aos esquemas de quimioradioterapia dos tumores MI: lesões com valores de ADC mais baixos são mais suscetíveis a ter uma resposta favorável54. A especificidade e precisão calculadas para a DWI (92 e 80%, respetivamente) para prever resposta completa são significativamente superiores em comparação com as sequências morfológicas T2 (45 e 44%, respetivamente) e DCE (18 e 33%, respetivamente)55. Se estes dados vierem a ser confirmados por mais estudos a DWI poderá funcionar como um biomarcador na resposta ao tratamento, eventualmente, permitindo a otimização terapêutica individual.
ConclusõesOs tumores da bexiga são comuns e acarretam elevada morbilidade associada. Estão também associados a custos elevados e esquemas de follow‐up prolongados e invasivos para o doente, com realização frequente de cistoscopia.
Atualmente, as técnicas de imagem funcionais por RM têm um papel estabelecido no diagnóstico e seguimento de doentes oncológicos. Em particular a DWI tem sido considerada uma ferramenta extremamente útil na deteção, estadiamento, determinação do grau histológico, avaliação da resposta ao tratamento e deteção de recidiva dos tumores vesicais. É ainda uma técnica não invasiva e que não necessita de administração de contraste endovenoso, alargando assim o espectro de doentes que dela podem beneficiar.
No entanto, o número de equipamentos de RM disponíveis no país não se encontra dimensionado para estudos frequentes de follow‐up, pelo que o seu acesso se encontra ainda limitado.
No futuro, com o desenvolvimento da técnica e tendo em conta as suas vantagens, talvez possamos assistir a uma maior implantação da mesma.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.