A terapêutica intravesical com bacilo de Calmette-Guérin é uma opção válida no tratamento dos tumores uroteliais não músculo invasivos da bexiga, existindo já vários estudos publicados sobre os resultados obtidos. O objectivo deste trabalho é o de rever e compilar a informação disponível sobre esta temática.
MétodosFoi realizada uma revisão na base de dados da PubMed com os termos principais “intravesical BCG”, “NMIBC” e “Non-Muscle Invasive Bladder Cancer”, sendo selecionados artigos de revisão e originais em Português e Inglês. Foram apresentados os resultados em conjunto com a discussão por motivos estruturais.
Resultados e discussãoA evidência científica favorece a utilização do BCG intravesical nos tumores de risco intermédio e alto pelo seu impacto no risco de recorrência e possivelmente no de progressão. Esta terapêutica implica uma vigilância dos efeitos secundários possíveis tanto a nível local como sistémico. A sua detecção determina uma correcta atitude terapêutica e cumprimento dos esquemas recomendados.
ConclusãoA utilização de BCG intravesical é uma modalidade terapêutica com evidência clara nos tumores não músculo invasivos da bexiga. No entanto, mais estudos são necessários para esclarecer qual o melhor esquema de utilização e o seu mecanismo de acção.
The use of intravesical Bacillus Calmette-Guérin is a valid option in the treatment of non-muscle invasive bladder tumors, making it the main subject of a lot of publications. The aim of the present study is to review and consolidate the data available about this subject.
MethodsA review of the data available was made on PubMed with the keywords: “intravesical BCG” and “non-muscle invasive bladder cancer”. Original and review articles written in English or Portuguese were selected. We present the discussion alongside the results for structural purposes.
Results and discussionScientific evidence strongly advises in favor of BCG use on intermediate and high risk tumors, due to its impact on the recurrence and possibly on the progression rates. It is important to be watchful for possible local and systemic side effects, that when detected call for a rightful therapeutically decision alongside the recommended schemes.
ConclusionThe use of intravesical BCG with therapeutically purposes has strong evidence on the non-muscle invasive bladder tumors. More studies are needed in order to better understand the best administration scheme and its mechanism of action.
O desenvolvimento de uma estirpe de Micobacterium bovis atenuada, denominada Bacilo de Calmette-Guérin / BCG (em homenagem aos seus produtores), veio revolucionar o mundo da imunoterapia. Desenvolvida no início do século XX como arma contra a Tuberculose, o BCG só mais tarde iria fazer a sua incursão no mundo da Urologia sob a forma de instilações intravesicais, após os primeiros resultados publicados por Morales em 19771. Rapidamente o BCG se tornou uma arma terapêutica com um lugar muito próprio no tratamento do carcinoma da bexiga, associando-se a uma diminuição da recorrência, e possibilidade de progressão, após a resseção transuretral da neoplasia vesical, demonstrando taxas de resposta completa de 55-65%2.
O mecanismo de acção ainda não se encontra totalmente esclarecido, no entanto, muito já se descortinou sobre o modo como o BCG actua no carcinoma da bexiga. Sabe-se que a instilação de BCG, de modo subcutâneo ou intravesical, desencadeia uma cascata imunológica, com activação do sistema reticulo endotelial. O bacilo é absorvido pelas células uroteliais tanto neoplásicas como saudáveis, sabendo-se que as células pouco diferenciadas captam o bacilo com maior intensidade e são mais sensíveis à resposta por ele desencadeada3. Esta ligação do bacilo às células uroteliais é mediada por fibronectinas, através da ligação de receptores da membrana bacilar (FAP-“fibronectin attachemnt protein”) à forma extracelular insolúvel da fibronectina4. O complexo FAP-fibronectina adere às integrinas na superfície celular urotelial, promovendo a sua entrada para o meio intracelular e o inicio da resposta imunitária5. A apresentação dos antigénios bacilares pelas células epiteliais é mediada pelo complexo de histocompatibilidade classe II, induzindo uma resposta celular Th1 (linfócitos T helper tipo1)6. Existe a activação de uma resposta inflamatória exuberante com libertação de múltiplas citocinas e formação de granulomas, resultado principalmente da resposta celular mediada pelos linfócitos T7. Sabe-se que um predomínio de activação das células Th1, com libertação de interleucinas 1, 2, 6, 8, 10 e 12, e TNF-alfa (Factor de Necrose Tumoral Alfa), está corelacionada com uma melhor resposta à terapêutica com BCG2,8,9.
Actualmente a utilização do BCG está recomendada em todas as orientações internacionais. A Associação Europeia de Urologia defende a utilização do BCG nos tumores não músculo invasivo da bexiga de alto risco e no carcinomas in situ (CIS), e a possibilidade de utilização nos tumores de risco intermédio10. Do mesmo modo, a Associação Americana de Urologia defende a utilização do BCG no CIS e apenas refere o benefício na diminuição da taxa de recorrência dos tumores não músculo invasivos11. De notar que as últimas actualização destas orientações têm 6 anos de diferença entre si.
Assim, o objectivo deste trabalho é o de compilar, por um lado a informação disponível sobre a utilização do BCG intravesical no tratamento dos tumores não músculo invasivos da bexiga, e por outro dos efeitos secundários possíveis, assim como das atitudes terapêuticas a ter na sua presença.
Material e métodosUma revisão da literatura foi feita na base de dados da Pub-Med com os termos principais “Intravesical BCG”, “NMIBC” e “Non-Muscle Invasive Bladder Cancer”. Dos 87 artigos obtidos foram selecionados os artigos originais e de revisão mais adequados ao tema, publicados até 2013, assim como as suas referências bibliográficas.
Resultados e discussãoUtilização do bacilo de Calmette-Guérin intravesicalO BCG para tratamento do carcinoma da bexiga é actualmente utilizado na forma de instilação intravesical. O seu desenvolvimento inicial baseou-se na cultura repetida em meios seleccionados até obter colónias sem potencial virulento. Estas colónias desenvolvidas no Instituto Pasteur foram distribuidas pelo mundo inteiro para prosseguir com a produção contínua e massiva da vacina. A partir dos anos 60, com a liofilização das diferentes linhagens de culturas foi possível continuar a sua produção de forma mais estável, com consequente preservação de património genético diferente em cada série de culturas. Desta forma, várias estirpes existem, habitualmente designadas a partir do seu local de origem, com estudos genéticos a demonstrar a sua estrutura particular12. Apesar de alguns estudos in vitro demonstrarem diferenças na resposta imunológica e potencial anti oncogénico para as diferentes estirpes, ainda nenhum estudo demonstrou diferença na eficácia in vivo13,14.
Modo de administraçãoEsta terapêutica é apresentada na forma de pó liofilizado para instilação intravesical diluido em soro fisiológico. As contra indicações absolutas clássicas para a administração são a presença de hematúria macroscópica, cateterização traumática, Infecção urinária sintomática, história pessoal de sépsis por BCG, e resseção transuretral da bexiga (RTUV) recente (2 semanas após RTU V) (grau de recomendação C)10.
Para uma correcta administração é aconselhada restrição hídrica ligeira de modo a diminuir o volume intravesical e a facilitar a permanência do produto após a instilação. A observação de uma amostra de urina do dia deverá ser realizada de modo a excluir hematúria. Alguns centros têm como rotina a pesquisa de microhematúria em doentes transplantados ou sob imunossupressão, no entanto já existem estudos que demonstram que não há aumento do risco de efeitos secundários com o BCG nesta subpopulação, apesar de alguma perda de eficácia15.
A bexiga deverá ser esvaziada previamente á instilação. A cateterização deverá ser o menos traumática possível de modo a evitar a hematúria traumática, e com a menor quantidade possível de lubrificante. A lidocaína deverá ser evitada pelo seu efeito deletério nas colónias. A alternância de decúbitos é desnecessária no caso de uma correcta administração do fármaco. O doente deverá manter a instilação durante 2 horas, após as quais poderá ser feita a eliminação vesical.
Está recomendado que o BCG seja administrado pelo menos duas semanas após a RTU-V, já que é necessário existir uma reepitelização da bexiga para permitir o seu efeito e diminuir os efeitos secundários16. O esquema de indução adoptado por Morales ainda hoje se mantém (exceptuando a administração subcutânea concomitante) com óptimos resultados, consistindo em instilações semanais durante 6 semanas, seguidas de 6 semanas sem terapêutica. Uma avaliação endoscópica deverá ser realizada nesta altura.
Existem vários esquemas de manutenção da administração do BCG, sendo este um dos tópicos que limita mais a interpretação dos resultados de vários estudos e a sua comparação. No entanto, o esquema mais amplamente divulgado é o de Lamm17 com três administrações semanais aos 3, 6, 12, 18, 24 meses. Deverá ser sempre feita reavaliação endoscópica antes de cada ciclo de tratamento.
Eficácia e resultados provadosDesde 1977 vários trabalhos foram desenvolvidos para testar a eficácia do uso BCG no tratamento dos tumores da bexiga. Desde os primeiros resultados publicados por Morales, que demonstraram uma incidência 12 vezes menor de recidivas no grupo tratado com BCG18, vários estudos já vieram comprovar a eficácia do bacilo. Diversas metanálises já demonstraram que a utilização de BCG como terapêutica adjuvante à ressecção transuretral da bexiga (RTU-V) obtém resultados superiores19,20, com diminuições de 47% quando comparado com o tratamento cirúrgico isolado21. No entanto, a utilização de BCG intravesical acarreta efeitos secundários, levando a um intenso debate sobre quais os doentes que têm maior benefício com esta opção terapêutica.
Assumindo o score de risco de progressão e recorrência publicado pela EORTC (European Organization for Research and Treatment of Cancer)22, os tumores com baixo risco de recorrência não parecem beneficiar de terapêutica adjuvante com BCG, já que o benefício não supera os possíveis efeitos secundários que podem advir da sua utilização. Assim, a questão que se coloca é se existe outra opção terapêutica poupadora de bexiga mais eficaz ou adequada nos tumores de risco intermédio e alto.
As outras opções disponíveis poupadoras de orgão no carcinoma da bexiga são os diferentes fármacos de quimioterapia intravesical. Assim, vários estudos foram realizados com o objectivo de comparar estas duas opções terapêuticas. Ambas são eficazes a atingir uma diminuição no risco de recorrência, existindo ainda alguma controvérsia na comparação destes dois fármacos, no entanto a balança tende a favorecer o BCG.
Taxa de recidivaA superioridade da utilização do BCG intravesical na taxa de recidiva dos tumores uroteliais da bexiga em comparação com a quimioterapia, nomeadamente com a Mitomicina C, já foi demonstrada em vários estudos23–25. Numa metanálise extensa publicada em 2003, Böhle et al demonstraram que a utlização de mais de 12 instilações de BCG era superior ao uso de Mitomicina C na diminuição das recidivas em todos os tumores não musculo invasivos26. No entanto, e devido ao facto do risco de efeitos secundários aumentar com o uso do esquema de manutenção, o benifício só supera o risco nos tumores de risco intermédio e alto27.
Taxa de progressãoO grande benefício associado ao uso do BCG intravesical é o seu potencial na diminuição do risco de progressão de doença. Vários estudos já foram conduzidos de modo a determinar esta eficácia, no entanto a grande variabilidade na metodologia e as grandes diferenças nos grupos de doentes escolhidos, tornam ainda difícil retirar conclusões definitivas sobre esta temática.
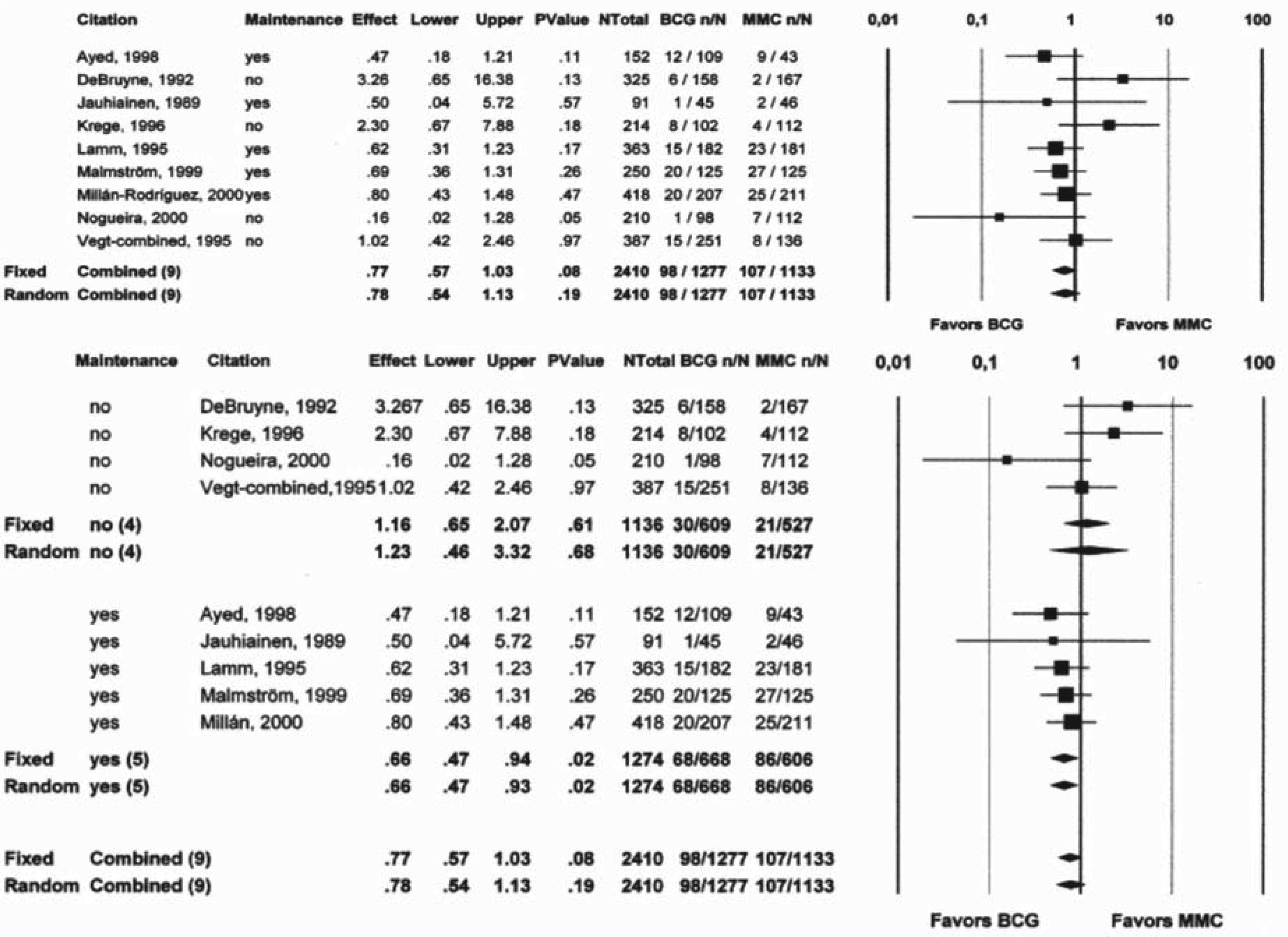
Uma conclusão que já foi comprovada por vários estudos é a de que é necessário realizar o esquema de manutenção para obter uma diminuição na taxa de progressão de doença28,29. Uma meta análise de 2004 (fig. 1) confirma esta conclusão ao demonstrar que o efeito na diminuição do risco de progressão só é evidente com o uso de esquema de manutenção nos tumores da bexiga, quando comparado com o uso de quimioterapia com Mitomicina C30. De notar que o número de doentes nesta meta análise não permitiu estratificar por grau histológico, sendo este um factor importante no risco de progressão do tumor.
Efeito do esquema de manutenção de BCG versus Mitomicina C (Böhle et al30).
Mais recentemente um estudo com uma população de 89 doentes com um follow up de 17 anos onde foi feita a comparação do uso de BCG versus Mitomicina C intravesical demonstrou uma tendência fraca a favorecer o BCG como mais eficaz na diminuição da taxa de progressão23.
Carcinoma in situO uso de BCG intravesical é recomendado no tratamento desta entidade histológica do carcinoma urotelial da bexiga. De facto, a taxa de resposta demonstrada em vários estudos é relativamente constante, com valores na ordem dos 70%31. Morales foi o primeiro a demonstrar estes efeitos, com taxas de resposta de 71% com o esquema de indução32. Mais recentemente já se demonstrou que o efeito usando o esquema de manutenção é prolongado no tempo, com taxas de resposta aos 6 meses pós esquema de manutenção de 84%29. Quando comparado com o uso de Mitomicina intravesical, o uso de BCG em esquema de manutenção obtém resultados superiores33.
Efeitos secundáriosUm dos pontos mais criticados na terapêutica intravesical com BCG é a sua toxicidade. De facto, alguns autores alegam taxas de apenas 18% de cumprimento terapêutico devido ao aparecimento de efeitos secundários, levando a uma fraca adesão terapêutica29. No entanto, estudos mais recentes já revelam taxas de não cumprimento da terapêutica devido a efeitos secundários, inferiores a 10%34. Esta grande diferença no cumprimento terapêutico mostra, por um lado, que existe ainda muita heterogeneidade na utilização deste fármaco entre os diferentes centros médicos, e por outro que poderão haver outros factores que influenciam o cumprimento terapêutico (aparecimento de recidiva, intercorrências, etc.).
A etiopatogenia da toxicidade do BCG ainda não é totalmente conhecida, havendo duas grandes teorias: a da reacção de hipersensibilidade e a de infecção localizada/sistémica. Na verdade, é provável que ambos os fenómenos ocorram, já que existem casos relatados de infecção à distância, com isolamento do agente, favorecendo a segunda teoria, assim como casos sem isolamento de bacilo e com boa resposta a corticoterapia35 favorecendo a primeira.
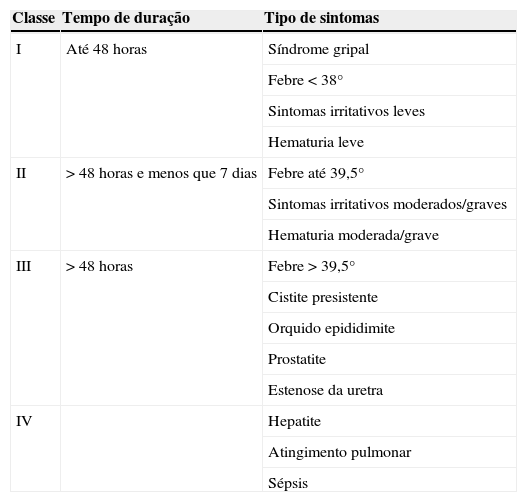
As queixas mais comuns são as queixas irritativas urinárias, nomeadamente disúria e poliaquiuria (71%), e febre (25%)36, sendo a grande maioria das vezes auto limitadas às primeiras 24–48 horas. Por outro lado a incidência de efeitos secundários graves chega aos 5% nas maiores séries de doentes. Para facilitar a estratificação dos efeitos secundários, foi proposta uma tabela com 4 graus de severidade37 (tabela 1).
Classes de efeitos secundários da terapia intravesical com BCG (adapatado de Scarneciu et al37)
| Classe | Tempo de duração | Tipo de sintomas |
|---|---|---|
| I | Até 48 horas | Síndrome gripal |
| Febre < 38° | ||
| Sintomas irritativos leves | ||
| Hematuria leve | ||
| II | > 48 horas e menos que 7 dias | Febre até 39,5° |
| Sintomas irritativos moderados/graves | ||
| Hematuria moderada/grave | ||
| III | > 48 horas | Febre > 39,5° |
| Cistite presistente | ||
| Orquido epididimite | ||
| Prostatite | ||
| Estenose da uretra | ||
| IV | Hepatite | |
| Atingimento pulmonar | ||
| Sépsis |
A grande maioria dos doentes apresenta queixas irritativas auto limitadas após a instilação. Cerca de 20% dos doentes desenvolvem uma infecção do aparelho urinário durante a terapêutica38. O aumento da temperatura corporal até 38,5 °C é frequente. A abordagem recomendada para os sintomas leves (grau I) é a vigilância com terapêutica sintomática se necessário (analgésicos/anti inflamatórios não esteroides/anticolinérgicos). A recomendação para a abordagem de doentes com efeitos do tipo grau II implica a observação clínica e uma abordagem mais agressiva: avaliação analítica, colheita de urocultura, realização de radiografia do tórax, e início de terapia com anti bacilares (sendo aconselhada a discussão do caso com especialistas em Infecciologia). O regime aconselhado é a administração de Isoniazida e Rifampicina até melhoria clinica ou isolamento de agente com TSA na urocultura. De notar que febre muito elevada e/ou sintomas sistémicos, levando a um alto grau de suspeita de infecção sistémica, implicam o inicio de terapêutica anti bacilar precoce e de longa duração39. Os quadros que se enquadram num perfil Grau IV implicam terapia antibacilar tripla e poderão necessitar de medidas mais interventivas.
Apesar de raras, estão descritas infecções locais do aparelho genito urinário, com extensão renal40, prostática41, atingimento das vesiculas seminais, testículos42 e pénis43. Muitas vezes o seu aparecimento é insidioso, podendo surgir anos após as instilações. Terá que se ter um alto grau de suspeição clínica e implicam sempre a utilização de terapêuticas anti bacilares ao longo de vários meses.
Um estudo publicado em 2005 44, com uma amostra pequena de homens jovens com carcinoma urotelial tratado com BCG estudou os efeitos na espermatogénese, concluindo que existia uma diferença significativa no espermograma após a terapêutica. Os autores hipotetizaram mesmo um efeito gonadotoxico directo do bacilo, deixando a sugestão de uma escolha por parte do doente para realizar conservação de esperma previamente a iniciar o tratamento.
Efeitos sistémicosA disseminação à distância do bacilo é rara, sendo a complicação mais mortal a sépsis por este agente. Não existem muitos casos descritos desta complicação séria, no entanto é comum o início da sintomatologia pouco tempo após a instilação, acreditando-se que surja devido a uma libertação de citocinas em grande escala para a corrente sanguíena. A abordagem deverá ser como em qualquer caso de sépsis, com instituição de medidas rápidas para o choque séptico e monitorização intensiva.
Estão também descritas disseminações para o tecido hepático (hepatite granulomatosa), pulmonar (correspondendo a menos de 1% dos casos), óssea, e articular. A hepatite granulomatosa é uma entidade que surge com a apresentação típica de hepatite (icterícia, febre e anorexia), no contexto do tratamento com BCG, podendo ser acompanhada de hematúria ou Insuficiência renal45. No caso da disseminação pulmonar pode ocorrer com padrão miliar ou intersticial, sendo comum a associação com sépsis46. A disseminação óssea é uma entidade muito rara, e os casos descritos restringem-se a envolvimento da coluna vertebral, com queixas de dor e compromisso funcional47 O atingimento da medula óssea pode levar a citopenias.
Lamn descreveu o aparecimento de queixas articulares em 0,5-1% dos casos. Mais recentemente uma revisão de casos clínicos reuniu 47 casos de complicações reumatológicas com o uso de BCG intravesical48, tendo todos em comum o aparecimento de artralgia. O mecanismo de acção ainda é desconhecido, mas postula-se um efeito auto imune despoletado pelo bacilo. O tratamento inicia-se com a aplicação de anti inflamatórios não esteróides, corticoterapia e anti bacilares no caso de artrite séptica.
Como diminuir efeitos secundáriosO leque de efeitos secundários associados ao BCG é considerável e contém algumas complicações sérias e potencialmente fatais. Assim, vários estudos foram feitos no sentido de tentar compreender e desenvolver métodos para diminuir a incidência destes efeitos mantendo a mesma eficácia terapêutica.
O uso concomitante em cada instilação de isoniazida, apesar de ter algum sentido teórico, já se mostrou ineficaz24. No entanto, recentemente um estudo multicêntrico, randomizado e prospectivo demonstrou a eficácia na diminuição dos efeitos secundários tipo I e II com o uso concomitante de ofloxacina em ciclos curtos aquando cada instilação intravesical49, estando já sugerida a sua utilização.
A decisão de qual a dose de um fármaco a utilizar tem em consideração a dose mínima necessária para obtenção do melhor resultado terapêutico com o mínimo de efeitos secundários. Assim, Martinez-Pinero et al postularam que um terço da dose habitual de BCG seria a dose minima eficaz com menor incidência de efeitos secundários50. No entanto, um estudo de grandes dimensões veio contrariar esta ideia, demonstrando que um terço da dose habitual não diminui a incidência de efeitos secundários, com consequente perda de efeito terapêutico51.
Em doentes que demonstrem uma tolerância baixa às instilações podem ser tentadas medidas simples como o aumento do período de tempo entre as administrações ou diminiuição da dose administrada, tendo sempre em conta uma possível diminuição da eficácia52.
ConclusãoA utilização de BCG veio revolucionar o tratamento dos carcinomas uroteliais da bexiga, ocupando agora um lugar de destaque nas opções terapêuticas preservadoras de órgão. A sua utilização deve ter sempre em consideração o benefício na redução da taxa de recidiva e progressão, assim como os possíveis efeitos secundários, reservando-se como opção nos carcinomas de risco intermédio e alto risco. Ainda assim, estudos são necessários para compreender quais os tumores que benificam efectivamente mais da imunoterapia e o porquê da melhor resposta.
Conflito de interessesOs autores declaram não haver conflito de interesses.