FUNDAMENTOS DE LA REACTIVIDAD CRUZADA
El concepto Reactividad cruzada (RC) se refiere a la presencia de manifestaciones clínicas alérgicas como consecuencia de la existencia de una reactividad frente a una fuente proteica específica, sin que haya mediado una exposición previa a la misma1,2.
Por otra parte el término Co-reconocimiento describiría a su vez la reactividad IgE como consecuencia de la coexposición a un variado número de fuentes alergénicas que comparten moléculas homólogas, sin que sea posible la identificación inequívoca de la fuente sensibilizante1,2.
En general, la RC depende básicamente de tres factores1:
1. La respuesta inmune del organismo.
2. El tipo y la intensidad de la exposición.
3. La naturaleza del alergeno. En este sentido, uno de los principales factores de la RC es la configuración estructural de las proteínas responsables. Así, por lo general es necesaria una similitud secuencial superior al 70 % entre las proteínas responsables de la RC procedentes de diferentes fuentes alergénicas3. Diferentes proteínas y carbohidratos han sido identificados como potenciales "panalergenos" y, en consecuencia, como posibles responsables de reacciones de RC1:
Proteínas relacionadas con la Patogénesis (PRP). Son proteínas producidas por las plantas como respuesta a estímulos tales como infecciones, sequía, inundaciones, agresiones, congelación, etc. La cantidad producida de ciertas PRP está en relación directa con su resistencia a situaciones de stress, por lo que estas plantas suelen ser más utilizadas en agricultura, lo que puede favorecer una mayor posibilidad de sensibilización alérgica a estas proteínas4,5.
Enzimas:
* Proteasas.
* Enzimas glicolíticas (p. ej., Enolasas).
* Supeóxido dismutasas.
* Enzimas carbohidratos (Glucanasas, Quitinasas, Hialuronidasas, Lactoalbúmina, etc.).
* Esterasas (Fosfolipasas).
Proteínas de Transporte (Proteínas de Transporte de Lípidos [PTL], Caseína y Lactoglobulina).
Inhibidores de las proteasas (Ovomucoide y Ovoalbúmina).
Proteínas reguladoras (Profilinas).
Proteínas estructurales (Tropomisosina, Parvalbúmina).
Proteínas de almacenamiento (albúminas y globulinas).
El Banco de Datos del Sub-comité de Nomenclatura Alergénica de la Unión Internacional de Sociedades de Inmunológica tiene registradas hasta el momento más de 400 alergenos y más de 200 isoformas de los mismos6. La mayor parte de los estos alergenos puede ser agrupada en una serie de familias de proteínas, que, independientemente de la fuente de la que procedan, comparten una notable similitud estructural. Así por ejemplo, las Profilinas, Tropomiosinas, Parvalbúminas, etc. tienen una gran similitud estructural sea cual sea la fuente de la que procedan, lo que explicaría los fenómenos de RC entre fuentes alergénicas de muy distinto origen.
MODELOS NATURALES DE RC
La práctica clínica proporciona interesantes modelos naturales que permiten el estudio de los fenómenos de RC. Algunos de los más comunes son:
Síndrome Ave-Huevo. Algunos pacientes con sintomatología respiratoria (asma y/o rinoconjuntivitis) causada por la inhalación de antígenos de ave (plumas, excrementos), exhiben concomitantemente manifestaciones digestivas y/o cutáneas derivadas de la ingestión de huevo, fundamentalmente yema. Diferentes estudios revelan la identidad estructural entre la Alfa-Livetina (presente en la yema de huevo) y la albúmina de pollo (Gal d 5), lo que explicaría de manera consistente el origen de este síndrome de RC7-11.
Síndromes Pólenes-Frutas. La mayoría de las reacciones alérgicas frente a frutas, frutos secos y vegetales se asocian con sensibilización a pólenes12-15. Han sido descritos varios síndromes de asociación entre sensibilización a pólenes diversos y frutas:
* Polen de Abedul-frutas/vegetales diversos (manzana, pera, cereza, melocotón, albaricoque, ciruela, kiwi, frutos secos, apio, zanahoria, soja, patata)16.
* Polen de Gramíneas y frutas (manzana, tomate, melocotón, cacahuetes)17.
* Polen de Artemisia y vegetales (zanahoria, apio, especies)14.
* Polen de Ambrosia y plátano, sandía18.
* Polen de Plátano y frutas (avellana, melocotón, manzana, melón, cacahuetes, etc.)19.
* Polen de Olivo y frutas (melocotón, pera, kiwi, melón, frutos secos)20.
La mayor parte de las reacciones producidas como consecuencia de la ingestión de los alimentos implicados son síndromes de Alergia Oral leves, aunque en algunos casos pueden producirse reacciones anafilácticas graves21,22. Existen por otra parte considerables diferencias entre diversas zonas geográficas, probablemente en relación con diferentes hábitos alimenticios23-29. Así, comparado con los países del norte de Europa, en los países del área mediterránea:
Son más frecuentes las reacciones tipo I a frutas, frutos secos y vegetales.
Las reacciones frente a alimentos vegetales suelen ser más graves.
El alimento que con más frecuencia produce alergia es el melocotón.
En general, y específicamente en el caso de la reactividad entre el alergeno mayor del polen de abedúl (Bet v1) y sus homólogos presentes en frutas, la reactividad IgE es altamente dependiente de la estructura terciaria de la proteína, es decir de epitopos conformacionales, mientras que péptidos aislados raramente muestran reactividad IgE30,31.
Síndrome Latex-Frutas. El Síndrome Látex-Frutas constituye una entidad clínica que se describe entre el 30 y el 80 % de los pacientes adultos alérgicos a Látex, que reaccionan a su vez de manera clínicamente relevante frente a la ingestión de frutas tales como el plátano, la castaña, el aguacate y otras frutas tropicales (papaya, maracuyá, kiwi, etc.)32. Sin embargo, esta relación raramente se produce entre niños con espina bífida (EB) alérgicos a látex. En una serie de 35 niños con EB con sensibilización demostrada frente a látex (20 de ellos con alergia clínicamente relevante), ninguno de ellos presentó sintomatología relacionada con la ingesta de los mencionados frutos, y tan sólo dos de ellos tuvieron Tests cutáneos y/o CAP® positivo frente a castaña33. La razón de esta discrepancia estribaría en el diferente patrón de sensibilización. Se comparó una muestra de 20 sueros de niños con EB con otra de sueros de pacientes adultos, todos ellos sensibilizados a látex, utilizando para ello anticuerpos monoclonales frente a diferentes alergenos de látex. Así, mientras que apenas el 4 % de los adultos estaban sensibilizados al factor de elongación del látex (Hev b 1), ello ocurría en el 65 % de los niños con espina bífida. Asimismo, los adultos mostraban una sensibilización mayoritaria a Hev b 5 (Proteína acídica) y Hev b 6 (Proheveína, heveína) (35 % y 65 % respectivamente), que en los niños con EB era del 58 % y 50 % respectivamente34. Así pues, este distinto patrón de sensibilización condicionaría el patrón de respuesta clínica y, previsiblemente las diferencias en los patrones de RC frente a frutas.
Síndrome Acaros/Gamba/Caracol/Cucaracha. Los ácaros del polvo constituyen uno de los alergenos inhalantes más prevalentes como factores causales de patología alérgica respiratoria (Asma y Rinitis). Diferentes estudios in vivo e in vitro han analizado la existencia de RC entre alergenos de ácaros y otros invertebrados poco relacionados taxonómicamente como insectos, moluscos y crustáceos35. Hasta el momento han sido identificados más de una docena de alergenos de ácaros6,35. Así, estudios utilizando métodos inmunoquímicos muestran que alergenos de caracoles, crustáceos, cucarachas y quironómidos, exhiben una RC con alergenos de ácaros del polvo. Dicho reconocimiento mutuo parece estar basado en la existencia de Tropomiosina. Esta es una proteína presente en el músculo de dichos invertebrados, que posee secuencias muy similares de aminoácidos entre las Tropomiosinas de estas especies animales2,36.
IMPLICACIONES CLINICAS DE LOS FENOMENOS DE RC
Alguna de las anteriores observaciones supone ya la existencia de importantes implicaciones clínicas.
1. La existencia de RC es causa frecuente de reacciones inesperadas, en ocasiones graves. Los fenómenos de RC son expresión de la complejidad de las reacciones alérgicas, e ilustran la necesidad de profundizar en el conocimiento de los mecanismos íntimos de las reacciones alérgicas y de la estructura y composición de las sustancias responsables de dichas reacciones.
2. Algunos estudios demuestran que cuando pacientes con alergia a pólenes y frutas son tratados con Inmunoterapia frente al/los polen/es responsable/s, presentan concomitantemente una mejoría de la sintomatología relacionada con la ingestión de las frutas implicadas37.
3. La existencia de diferentes patrones de sensibilización entre grupos de pacientes alérgicos a una misma fuente alergénica, indica la necesidad de identificar dichos patrones con el fin de poder establecer las pautas adecuadas. Por ejemplo, las diferencias detectadas entre pacientes adultos y niños con espina bífida alérgicos a látex, condiciona la actitud terapéutica a seguir. Así, la inclusión en extractos para Inmunoterapia de los alergenos relevantes en la sensibilización individual de cada paciente condicionará su eficacia; al mismo tiempo, la no estandarización de alergenos relevantes en un extracto para Inmunoterapia pudiera ser causa de reacciones adversas. Asimismo, está por determinar la posibilidad de que la Inmunoterapia con Látex pudiera mejorar de manera concomitante la reactividad frente a frutas en pacientes afectos del Síndrome Látex-Frutas.
4. Por el contrario, en otros síndromes, como el de Acaros/Gamba/Caracol/Cucaracha no está suficientemente aclarado si la Inmunoterapia frente a ácaros puede mejorar la alergia simultánea a otros invertebrados, puede empeorarla, o incluso puede ser causa del desarrollo de la citada alergia a invertebrados. En todo caso, ello ilustra la conveniencia de estandarizar en los extractos alergénicos para diagnóstico y tratamiento los alergenos considerados como menores, pero que podrían tener importantes implicaciones en desarrollo de estos síndromes de RC38-41.
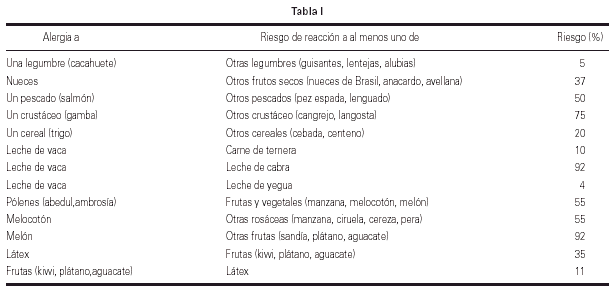
5. La RC entre alergenos de diferentes especies implica que el médico deba ser consciente de la posibilidad de reacciones cruzadas entre diferentes alergenos, particularmente alimentos. En este sentido a partir de datos obtenidos en estudios epidemiológicos y estudios utilizando tests de provocación, Sicherer publicó una tabla en la que se especifica de manera aproximada la probabilidad de que un paciente tenga una reacción adversa frente a alimentos cuando sea simultáneamente alérgico a otros alergenos (alimentarios o no)42 (tabla I).
6. Finalmente, es conocido que muchos de los alimentos ingeridos en la actualidad, sobre todo vegetales, tienen un origen transgénico, con el fin de mejorar su resistencia a plagas, sus cualidades nutritivas, etc. Así, por ejemplo, un estudio reciente demuestra que soja transgénica a la que se insertó un gen productor de Albúmina 2s rica en metionina procedente de la nuez de Brasil, puede mostrar reactividad IgE mediada por parte de suero de pacientes alérgicos a la nuez de Brasil43. Así, algunas de las reacciones insospechadas frente a algunos alimentos, podrían ser debidas al contenido en proteínas originarias de otros alimentos, y expresadas tras manipulación mediante ingeniería genética. El conocimiento de estos hechos resulta crucial para una adecuada identificación de las causas de las reacciones alérgicas.