INTRODUCCION
La sensibilización al epitelio de gato en nuestra Región Canaria es muy frecuente porque este animal es una mascota que se encuentra en muchos domicilios y en complejos turísticos.
El estudio Alergológica 92 (1) mostró que el 19,2 % de los pacientes con asma extrínseca estaban sensibilizados a epitelios, con un porcentaje mayor de convivencia con gatos (18,1 %) que en el resto del Estado (11,9 %).
En otro estudio epidemiológico basado en la sensibilización cutánea, se comprobó que el 21,4 % de las madres de niños atópicos estaban más sensibilizadas al epitelio de gato que las madres de niños no atópicos (1,9 %) (2).
El gato produce alergia con más frecuencia y de forma más grave que otras especies de mamíferos. Los estudios de prevalencia reportan del 5-10 % de reacciones cutáneas en población general y del 15-30 % en población alérgica (3-5). Ohman et al (6) consideran que al menos el 2 % de la población es alérgica a proteínas derivadas del gato doméstico y que aproximadamente un tercio de estos individuos viven en casa en donde tienen un gato (7). El epitelio de gato y otros alergenos menores del gato son muy comunes y están presentes en el polvo de la mayoría de las casas, incluso en las que nunca ha vivido un gato (8). El 20 % aproximadamente de las casas sin gatos tienen entre 1 y 8 mg del Feld 1 por gramo de polvo (9).
A pesar de que el tratamiento de elección en alergia al gato es evitar cualquier contacto con el animal, no siempre es factible debido a conflictos emocionales en la familia y/o a la dificultad de vivir en una casa tan aislada en la cual los alergenos del gato estén completamente ausentes.
Muchos pacientes asmáticos extrínsecos sensibilizados a los ácaros del polvo doméstico, sometidos a inmunoterapia subcutánea convencional, no evolucionan lo favorablemente deseado, por la coexistencia de una sensibilización al epitelio de gato, con o sin la presencia del gato.
La inmunoterapia subcutánea con epitelio de gato a dosis de mantenimiento de 13,2 mg, ha presentado reacciones adversas en el 1,9 % de los casos (10).
La inmunoterapia sublingual ha demostrado claramente su efectividad en reducir la sintomatología y consumo de medicamentos.
El motivo del presente trabajo es estudiar la eficacia clínica de la inmunoterapia sublingual con epitelio de gato en pacientes monosensibilizados con rinitis perenne alérgica y/o asma bronquial.
MATERIAL Y MÉTODOS
Diseño
Se trata de un estudio a doble ciego controlado con placebo. El análisis estadístico se ha llevado a cabo mediante el test de Wilcoxon para comparación intragrupo y el test de Mann-Whitney para el estudio comparativo intergrupo. Se consideran el test estadístico comparativo significativo cuando la p < 0,05.
Pacientes
Se han seleccionado 40 pacientes con los siguientes criterios de inclusión:
1. Clínica de rinitis perenne y/o asma bronquial extrínseca.
2. Monosensibilizados al epitelio de gato.
3. Provocación nasal positiva al epitelio de gato.
4. Contacto o no con gato o correlación alergénica con el contacto con el mismo.
5. No medicación que modifique el resultado de las pruebas in vivo o in vitro.
6. No haber recibido inmunoterapia previamente.
El intervalo de tiempo transcurrido desde el inicio de los síntomas hasta el inicio de la vacuna sublingual fue, por término medio, de un año.
Los criterios de exclusión fueron los siguientes:
1. Pacientes polisensibilizados.
2. Haber recibido inmunoterapia con anterioridad.
3. Dudas acerca de la posibilidad de colaborar correctamente.
Tratamiento
El grupo activo de 20 pacientes recibía la inmunoterapia sublingual (TOL) CBF-Leti constituida por el alergeno mayoritario del gato Feld 1. Compuesta por 5 frascos, siendo el de la máxima concentración el F6 a 1 HEP equivalente/ml, F5 0,02; F4 0,04; F3 0,008; F2 0,0016; y F1 0,00032. El extracto alergénico acuoso estaba preparado con suero salino glicerinado al 50 y fenol al 0,4 %. Dosis única diaria, antes del desayuno, manteniendo el extracto debajo de la lengua durante 3 min. El grupo placebo estuvo integrado por 20 pacientes que reunieron los mismos criterios de inclusión que el grupo activo, recibiendo glicerina fenolada, en solución salina. Siguieron la misma pauta y dosis que el grupo activo. El extracto está valorado en unidades TOL (1/2.500 TOL producen in vitro el mismo grado de inhibición a la unión con la IgE que el producido por 1 HEP).
La duración del tratamiento para ambos grupos fue de 1 año.
Control de los pacientes y puntuación de los síntomas
Los pacientes anotaron cotidianamente los siguientes síntomas: estornudos, rinorrea, obstrucción nasal, tos, disnea, sibilancias. Se evaluaron de 0-3 intensidad: 0, no síntomas; 1, intensidad media; 2, moderada; 3, grave. Cada paciente registraba diariamente las necesidades de la medicación sintomática. En cada visita, mensual se evaluaba la eficacia del tratamiento de la siguiente manera: muy bien, síntomas nasales esporádicos; bien, síntomas nasales semanales con consumo de medicación sintomática; sin cambios, síntomas nasales diarios, uso habitual de medicación sintomática y aparición de broncospasmo; mal, situación anterior con episodios de broncospasmo que requieren asistencia en servicio de urgencias.
Pruebas cutáneas
Se utilizaron los extractos diagnósticos de CBF-Leti con la batería estándar de neumoalergenos y con epitelio de gato. Utilizando las concentraciones 10, 50 y 100 unidades HEP para este último. El método y valoración del tamaño de la pápula se efectuó mediante papulometría computarizada según trabajo previo realizado por nosotros (11). Se hicieron pruebas de especificidad en 20 sujetos sanos y 20 polisensibilizados.
Provocación nasal
Para ello se utilizaron 3 concentraciones del extracto de epitelio de gato: 0,1, 1 y 10 HEP. Se consideró la prueba positiva si el paciente presentaba síntomas a los 20 min de su aplicación nasal: estornudos, prurito, rinorrea y obstrucción nasal. Como control se usó solución fisiológica clorurada (12).
Parámetros in vitro
La determinación de IgE específica, IgG4 alergeno específica y proteína catiónica del eosinófilo se valoraron antes y al año del comienzo de la Inmunoterapia, utilizando los kits comerciales de Pharmacia Ab, Uppsala Sweden, con el método CAP-FEIA.
RESULTADOS
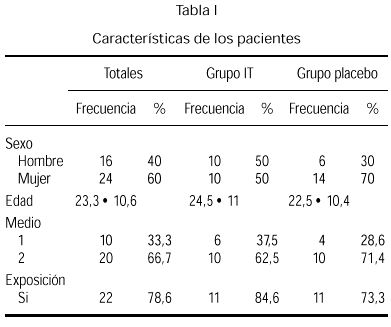
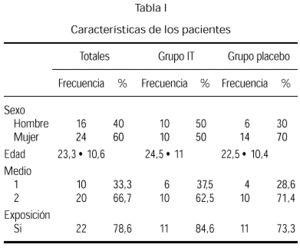
En la tabla I se describen las características de los pacientes cuya edad media fue de 23,3 con un predominio del sexo femenino y con una exposición al gato directa o indirecta, es decir, refiriendo sintomatología tras la exposición en un 78,6 %.
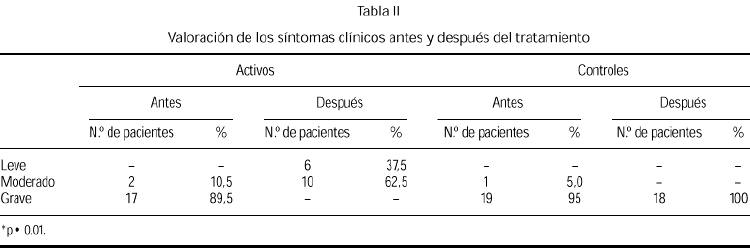
En la tabla II viene la valoración de síntomas clínicos y pudiéndose ver que después de 1 año de tratamiento con la inmunoterapia sublingual, los pacientes del grupo activo habían mejorado, con una significación estadística de p < 0,01, con respecto a los del grupo control que recibieron placebo.
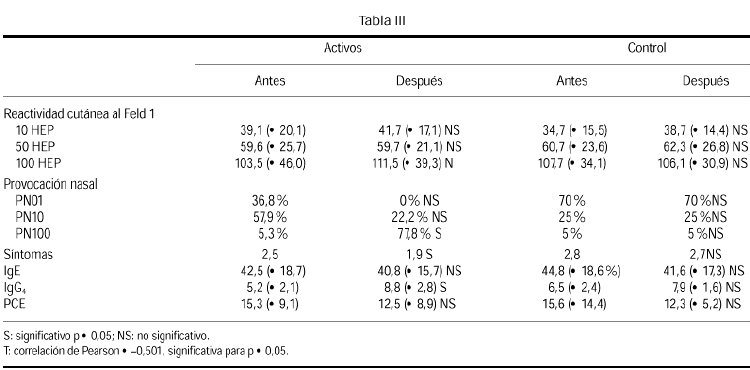
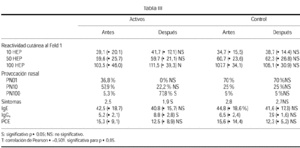
En relación con la reactividad cutánea para el epitelio de gato a distintas concentraciones (10, 50 y 100 HEP) no se encontraron diferencias significativas en el grupo activo para las distintas concentraciones, después del año de inmunoterapia (tabla III).
En relación con la provocación nasal hay una diferencia estadísticamente significativa en la utilización de una concentración mayor en un 77,8 % en el grupo activo después de 1 año de tratamiento. Es decir, el 77,8 % de los pacientes necesitaron una concentración mayor, lo que no ocurría en una situación pre que era del 5,3 %. Si comparamos con el grupo control, las provocaciones no se modifican. En relación con los síntomas clínicos, se encontró una diferencia significativa en el grupo activo, pasando de 2,5 a 1,9, siendo estas cifras la media de los 20 pacientes en situación pre y postratamiento. No se observaron diferencias en el grupo control.
En relación con la determinación de IgE específica antes y tras 1 año de tratamiento, no se encontraron diferencias significativas en ninguno de los dos grupos. Lo mismo ocurre con la proteína catiónica del eosinófilo (PCE), con diferencia entre ambos tiempos muy similar para ambos grupos, de 15,3 al 12,5.
En cambio, la IgG4 específica aumenta en el grupo activo después del año de inmunoterapia sublingual, pasando de 5,2 a 8,8 con una diferencia estadísticamente significativa con respecto al grupo control. Este aumento se correlaciona muy bien con la mejoría clínica de los pacientes (tabla III).
DISCUSION
La sensibilización clínica frente al epitelio de gato en nuestro medio constituye un problema importante dada la exposición voluntaria e involuntaria al gato.
Se comporta como un neumoalergeno que actúa dentro y fuera de casa, esto explica la evolución que presentan algunos pacientes con asma bronquial y rinitis perenne extrínseca, sensibilizados a los ácaros del polvo de casa, que también están al epitelio de gato y no mejoran lo que debieran, tras la inmunoterapia subcutánea convencional después de 1 año de tratamiento. Basándonos en trabajos previos, utilizando inmunoterapia sublingual con polen de olivo en un estudio control placebo 66 niños con asma, rinitis y conjuntivitis estacional, después de 2 estaciones los autores encuentran una mejoría clínica y buena tolerancia al extracto sublingual (13). Estos resultados son superponibles a los de otros autores (14-21) que han utilizado pólenes y controles con placebo.
En relación con la utilización del epitelio de gato, el único estudio con placebo que hemos encontrado es el de Nelson (22) en el que no encuentra mayor efectividad que el grupo placebo en 20 pacientes con rinoconjuntivitis. La explicación puede ser que el tiempo de inmunoterapia ha sido muy corto, de 105 días, a diferencia de nuestro trabajo de un año de tratamiento.
Existe dificultad para comparar los resultados debido a la gran variabilidad del otros trabajos que difieren en la duración del tratamiento, la cantidad del extracto administrado, el número y características de los pacientes y el alergeno usado. Sin embargo, la mayoría de los resultados muestran una evidente mejoría clínica y una conclusión a favor de su seguridad (15, 20). La dosis acumulativa después del año de tratamiento con nuestro extracto fue de 3,6 mg de Feld 1, siendo la cantidad de alergeno de 10 ng/gota. El líneas generales la mayoría de los autores no se ponen de acuerdo sobre la utilización de dosis máximas en intervalos cortos o dosis mínimas con mayor tiempo de duración (10-14).
En nuestro estudio no hemos encontrado cambios en la PCE, en la IgE específica, y en la reactividad cutánea, a diferencia de otros autores (13). Quizás el tiempo de duración del estudio pueda influir en este sentido ya que esos estudios se han seguido 2 años consecutivos aunque con diferente alergeno. La mejoría clínica de nuestros pacientes se correlaciona con el aumento de la IgG4 después de 1 año de inmunoterapia, resultados que concuerdan con la mayoría de los trabajos reseñados (10, 12-16).
En relación con el mecanismo de acción de la inmunoterapia sublingual sabemos que las funciones inmunobiológicas de la mucosa orofaríngea no son conocidas y, en consecuencia, se desconocen los acontecimientos resultantes de la estimulación con antígenos ambientales. Cabría pensar en dos posibles mecanismos, el primero la inducción de tolerancia oral: la ingesta de antígenos puede inducir una supresión de la respuesta inmune frente a estos antígenos, incluso con ausencia de células T supresoras. Estudios realizados en modelos experimentales (ratones y ratas) han revelado que la respuesta inmune frente alergeno inhalado, acarrea una activación preferencial de los mecanismos supresores mediados por células T. En este proceso de inducción de tolerancia no contribuye el alergeno que ha sido tragado, sino que la generación inicial de estos linfocitos T supresores tiene lugar en los nódulos linfáticos cervicales que drenan la cavidad oronasal. Esto sugiere que la mucosa oronasal y/o faríngea representa el lugar adecuado para la inducción de tolerancia inmunológica.
Otro mecanismo de acción sería la desensibilización de los basófilos, habiéndose demostrado in vitro que las dosis bajas de antígeno pueden producir una falta de respuesta prolongada de los basófilos a la subsiguiente provocación de dosis óptimas.
De todo lo expuesto se puede concluir que en nuestro medio y en nuestros pacientes la inmunoterapia sublingual al extracto de gato es clínicamente efectiva al cabo de 1 año, que no se modifican la IgE, la PCE ni la respuesta cutánea y que la mejoría clínica se correlaciona con el aumento de la IgG4. Hay que destacar la buena tolerancia en los 20 pacientes, excepto en un caso que se presentó urticaria generalizada y prurito lingual. Por último, la inmunoterapia sublingual con extracto de epitelio de gato es un tratamiento complementario de aquellos pacientes que están polisensibilizados a ácaros y gato con poca mejoría clínica con la inmunoterapia subcutánea convencional.